100% encontró este documento útil (1 voto)
255 vistas17 páginasDiagrama de Fases
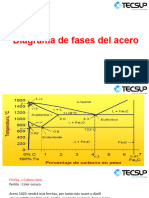
Un diagrama de fase es un mapa que los metalurgistas usan para fabricar aleaciones y realizar tratamientos térmicos. Muestra las fases presentes en un sistema de materiales a diferentes temperaturas, presiones y composiciones. El diagrama hierro-carbono es importante para la fabricación de aceros y fundiciones, e incluye fases como ferrita, austenita y cementita. La regla de fases de Gibbs relaciona la microestructura con variables de estado como la temperatura y presión.
Cargado por
OSCO NEYRA LEIBNIZDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (1 voto)
255 vistas17 páginasDiagrama de Fases
Un diagrama de fase es un mapa que los metalurgistas usan para fabricar aleaciones y realizar tratamientos térmicos. Muestra las fases presentes en un sistema de materiales a diferentes temperaturas, presiones y composiciones. El diagrama hierro-carbono es importante para la fabricación de aceros y fundiciones, e incluye fases como ferrita, austenita y cementita. La regla de fases de Gibbs relaciona la microestructura con variables de estado como la temperatura y presión.
Cargado por
OSCO NEYRA LEIBNIZDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd