Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cultivo Primario Neuronas Ratón
Cargado por
LuciaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cultivo Primario Neuronas Ratón
Cargado por
LuciaCopyright:
Formatos disponibles
Laboratorio L8
CULTIVO PRIMARIO DE NEURONAS DE RATÓN
Lo primero que se hace es elegir el cruce de interés. En mi caso, uso la colonia de
ratones WT/KO NCLX del Dr. Antonio Martinez, y escojo cruces entre ratones de
igual genotio (WTxWT o KOxKO) para asegurar una descendencia uniforme. Una
vez que se pone el cruce, puede pasar hasta una semana de registro del tapó n. Es
mejor escoger hembras no muy mayores, ya que aunque se vayan a sacrificar,
cuando má s joven má s probabilidad de embarazo y de má s fetos. Todo esto va por
correos a Iliana (Iliana.mir@uam.es) con copia a Toñ o
(amartinezruiz@salud.madrid.org).
Una vez fechado el tapó n en la hembra, el cultivo se hará en el día 19 de gestació n
(E19).
PREPARACIÓN MEDIO DE CULTIVO PRIMARIO DE NEURONAS DE RATÓN:
A partir de medio neurobasal (GIBCO 21103, 500 mL), se le añ ade:
- 5 mL de L-glutamina (SIGMA G6392)
- 2.5 mL de Penicilina/Estreptomicina (GIBCO)
L-Glutamina: viene en un vial en polvo y hay que diluirlo en 10 mL de Neurobasal
(sin nada, de la botella directamente). Para reconstituirlo, se echan los 10 mL de
medio en un falcon de 50 mL y con una jeringuilla se pasan al bote. Se necesita una
aguja que atraviese el tapó n. Este proceso es bastante complejo y engorroso. Hay
que disolverlo muy bien, porque cuesta mucho, usar vortex. Luego añ adir 5 mL al
medio y guardar los otros 5 mL en el congelador. (Cultivos L8, 2º cajó n de Cris).
Antibió ticos: son los mismos que para el medio de cultivo de SH-SY5Y, está n en el
congelador de cultivos, 2º cajó n Cris.
Mientras se está preparando el medio SIEMPRE hay que tener el mechero
encendido y FLAMEAR TODO.
DÍA 0: TRATAMIENTO DE LAS PLACAS
Para que las neuronas puedan pegarse se debe poner poli-D-lisina en los pocillos
(también se pegan con poli-L-lisina). Con una pipeta Pasteur se dejan caer 2-3
gotas (dependiendo del tamañ o del pocillo de la placa que se vaya a utilizar). Se
precinta con parafilm y se dejan en la nevera hasta el día siguiente.
En el caso de hacer inmunohistoquímica, se colocan cubres en los pocillos de una
p24. Antes de ser colocados, cada cubre se flamea para aumentar su esterilidad.
Después se cubre bien todo con poli-D-lisina con atenció n ya que estos cristales
tienden a flotar.
Lucía Viejo de Navas
Laboratorio L8
Si por alguna razó n no se puede preparar todo esto el día de antes, ese mismo día
se sigue el mismo procedimiento pero, en vez de meterlo en la nevera, se deja 30
min en el incubador.
DÍA 1: SIEMBRA
Primero se saca la placa de la nevera y se limpia la poli-D-lisina que sobre. En la
campana, se unas un envoltorio de una placa y se vuelca allí la poli-D-lisina que no
se ha pegado. Después, con una pipeta se lava 3 veces con agua destilada llenando
los pocillos hasta la mitad. Se seca bien con el aspitador y se pone en el ultravioleta
al menos 30 min o hasta que se vuelva del animalario.
Antes de ir al animalario preparar un falcon de 15 mL con 2 mL de medio
neurobasal para disgregar los trozos de cerebro y los falcons necesarios para
sembrar. Dejarlos en el bañ o para que estén calientes.
En el animalario se pide la hembra preñ ada y se sube al laboratorio para realizar
todo el protocolo aquí. En el laboratorio tenemos todo lo el material para hacer la
extracció n (tijeras, pinzas…)
La hembra se mata por dislocació n cervical de forma rá pida y comienza la
extracció n de los fetos. Se hace un corte vertical en la tripa de la ratona con las
tijeras abriendo la capa de piel de forma que se accede a la capa muscular. Se
realiza el corte de esta capa por la línea alba (de color blanco) levantando en forma
de tienda de campañ a toda la musculatura al cortar para evitar dañ ar a los fetos o
partes del sistema digestivo. Después con las pinzas se sacan todas las placentas
con los fetos asegurando que no quede dentro ninguno, suele haber en torno a 5-7
crías. Se abren una por una las placentas, se saca el feto y se corta la cabeza con las
tijeras en un corte rá pido y preciso. Las cabezas se meten en el Falcon de 50.
Una vez extraídas las cabezas, la ratona se envuelve en un guante y me mete en el
congelador hasta que volvamos a bajar al animalario.
Se prepara una placa petri con hielo dentro y sobre ella se coloca las cabezas (de
una en una). Se llega esta el cerebro sujetando la cabeza con unas pinzas finas y
usando otras para retirar la piel, el crá neo y las meninges. Después se cortan dos
pequeñ as rodajas correspondientes a la corteza cerebral. Los trozos se dejan en
medio neurobasal hasta que se extraen todas las cortezas.
Dentro de campana, con una pipeta Pasteur al Falcon de 15 con 2 mL de
neurobasal con cuidado de llevar el menor medio ‘no estéril’ posible. Con otra
pipeta pasteur, en la que se pone una punta amarilla, se pasan los trozos por ella 5
veces para comenzar a disgregarlos. Si son muy grandes y no entran por la punta,
cogerlos con la pipeta y luego poner la punta. Se cuenta solamente las veces que
pasa por la pipeta TODO el tejido. Después, pasar se pone una punta blanca sobre
Lucía Viejo de Navas
Laboratorio L8
la amarilla y se disgrega 10 veces. Cuando está todo bien homogeneizado, se
cuentan las células en una cá mara Neubaguer.
En un eppendorf 10 uL de azul de tripano y 10 uL de células. Pasar 10 uL y ponerlo
en la cá mara de Neubaguer. Se recuentan los 4 cuadrantes y se hace la media. A
continuació n se multiplica por 2 para quitar la dilució n del tripano y para saber
cuá ntas células hay por mL se multiplica por 104.
Por ú ltimo, se ponen los uL correspondientes a cada placa que se quiera sembrar
en los falcons con medio que inicialmente se han preparado y se añ ade B27 (factor
que promueve le crecimiento exclusivo de neuronas). Por cada 10 mL de medio se
añ aden 200 uL de B27.
En el caso de siembra para inmunohistoquímica (IH), los cá lculos de medio con
células se hacen en 200 uL. Se añ ade en forma de gota con cuidado esa cantidad
con células sobre el cubre para que la mayoría de las células queden pegadas en la
zona de interés. Con cuidado de no romper las gotas, se deja 30 min en el
incubardor y después se completa el medio con 500 uL/poc. Todos los medios
suplementados con B27.
Placa Células/pocillo uL/pocillo neurobasal
IH-
30.000 200 + 500
p24
p48 40.000 200
p96 30.000 200
Se siembran las placas que se requieran y se meten en el incubador. NO se pueden
sacar del incubador hasta el día de uso ya que son extremadamente sensibles a los
cambios de temperatura y concentraciones de gases.
Lucía Viejo de Navas
También podría gustarte
- Adopta un conejo. Cómo cuidar en casa de una bolita peludaDe EverandAdopta un conejo. Cómo cuidar en casa de una bolita peludaAún no hay calificaciones
- Protocolo de CongelaciónDocumento4 páginasProtocolo de CongelaciónaccesoriosdeiratiAún no hay calificaciones
- Cultivo primario de neuronas hipocampalesDocumento6 páginasCultivo primario de neuronas hipocampalesSergio Nicolas Rodriquez ValeroAún no hay calificaciones
- Protocolo de CultivoDocumento3 páginasProtocolo de CultivoglodovichiAún no hay calificaciones
- Cuaderno de Prácticas 2 Evaluación PDFDocumento10 páginasCuaderno de Prácticas 2 Evaluación PDFdesireeAún no hay calificaciones
- PROTOCOLOs Cultivo CelularDocumento6 páginasPROTOCOLOs Cultivo CelularÁngela Lorena Jiménez PérezAún no hay calificaciones
- Protocolo de Conservacion y Congelacion de SemenDocumento3 páginasProtocolo de Conservacion y Congelacion de SemenHAYVER LEONARDO LOPEZ CARRILLOAún no hay calificaciones
- Curso Cultivos UAM 2008 PDFDocumento69 páginasCurso Cultivos UAM 2008 PDFxlichun23Aún no hay calificaciones
- protocoloDocumento4 páginasprotocoloJeniffer ChaAún no hay calificaciones
- Métodos InformesDocumento3 páginasMétodos InformesAdriana MarcelaAún no hay calificaciones
- Practico IIIDocumento8 páginasPractico IIIRosalía PattyAún no hay calificaciones
- Informe de Laboratorio para Microbiologia AmbientalDocumento22 páginasInforme de Laboratorio para Microbiologia AmbientalCarlosDavidCelySaenzAún no hay calificaciones
- Determinación de Células Formadoras de AnticuerposDocumento5 páginasDeterminación de Células Formadoras de AnticuerposAngy MarquezAún no hay calificaciones
- 4.inseminacion Artificial en CerdosDocumento4 páginas4.inseminacion Artificial en CerdosLuis RengifoAún no hay calificaciones
- PRÁCTICA N°1Documento7 páginasPRÁCTICA N°1PabloIsoardiAún no hay calificaciones
- Preparacion MatrigelDocumento1 páginaPreparacion MatrigelEliud Florentino MolinaAún no hay calificaciones
- Preparacion MatrigelDocumento1 páginaPreparacion MatrigelEliud Florentino MolinaAún no hay calificaciones
- INTRODUCCIÓNDocumento3 páginasINTRODUCCIÓNBianca Inoñan RamirezAún no hay calificaciones
- Final ReproducciónDocumento22 páginasFinal ReproducciónDaniel GuevaraAún no hay calificaciones
- Conservación de E. coli y Streptomyces sp mediante criopreservaciónDocumento2 páginasConservación de E. coli y Streptomyces sp mediante criopreservaciónJavier ClarosAún no hay calificaciones
- Gi 11 Práctica Cultivo de LinfocitosDocumento4 páginasGi 11 Práctica Cultivo de Linfocitosluis david carmona dueñasAún no hay calificaciones
- Protocolo de La Inseminación PorcinaDocumento11 páginasProtocolo de La Inseminación PorcinaSinedselaromAún no hay calificaciones
- TuberculosisDocumento8 páginasTuberculosisJULIO CHÁVEZAún no hay calificaciones
- Método para producir hongo entomopatógenoDocumento7 páginasMétodo para producir hongo entomopatógenoPaco EstévezAún no hay calificaciones
- Manual de Cultivo 3.4Documento15 páginasManual de Cultivo 3.4Marta CanalesAún no hay calificaciones
- Cuaderno PrácticasDocumento43 páginasCuaderno PrácticasNerea Lazaro GarciaAún no hay calificaciones
- PRACTICAS MICRO 5 de MollyDocumento5 páginasPRACTICAS MICRO 5 de MollyNoe NoseAún no hay calificaciones
- Inseminacion ArtificialDocumento4 páginasInseminacion ArtificialFernanda Dominique TobarAún no hay calificaciones
- Proyecto Drosophila MelanogasterDocumento14 páginasProyecto Drosophila MelanogasterJose Luis FernandezAún no hay calificaciones
- Rabia EquinosDocumento3 páginasRabia Equinoselvisescorpio95Aún no hay calificaciones
- Producción de Galleria Mellonella y de Nematodos en Visita IniaDocumento12 páginasProducción de Galleria Mellonella y de Nematodos en Visita IniamanuelAún no hay calificaciones
- Reporte de Practica IDENTIFICA HONGOS FILAMENTOSOS EN MEDIO DE CULTIVODocumento12 páginasReporte de Practica IDENTIFICA HONGOS FILAMENTOSOS EN MEDIO DE CULTIVOcesarAún no hay calificaciones
- PracDocumento7 páginasPracLuz Angelica Leyva SantillanoAún no hay calificaciones
- Ratón DisecciónDocumento5 páginasRatón DisecciónFhanny D CastanedaAún no hay calificaciones
- Diseño Experimental Práctica 3Documento11 páginasDiseño Experimental Práctica 3LindaAún no hay calificaciones
- Práctico Preparación QuimiocompetentesDocumento2 páginasPráctico Preparación QuimiocompetentesNICOLAS IGNACIO VALENZUELA SAYESAún no hay calificaciones
- Metodología de Cultivo de SetasDocumento4 páginasMetodología de Cultivo de SetasJorge Valencia VargasAún no hay calificaciones
- Protocolo para la obtención de cromosomas de animales y vegetalesDocumento8 páginasProtocolo para la obtención de cromosomas de animales y vegetalesKarina PacaraAún no hay calificaciones
- PRÃ CTICA 3 Extraccion ADN SangreDocumento3 páginasPRÃ CTICA 3 Extraccion ADN SangreSuelen NunesAún no hay calificaciones
- Práctica 5Documento8 páginasPráctica 5minrocasAún no hay calificaciones
- Crianza Masiva de CrisopasDocumento3 páginasCrianza Masiva de CrisopasFlavio Lagos GutierrezAún no hay calificaciones
- 2 Practica Celula Animal Epitelio Bucal-Cilios FlagelosDocumento32 páginas2 Practica Celula Animal Epitelio Bucal-Cilios FlagelosRosa Flor Huaroc ArhuisAún no hay calificaciones
- Cultivo y congelación de células F3IIDocumento4 páginasCultivo y congelación de células F3IIgabrielaAún no hay calificaciones
- Métodos y Técnicas de Aislamiento y SelecciónDocumento9 páginasMétodos y Técnicas de Aislamiento y SelecciónjoaquinAún no hay calificaciones
- Practica Tecnicas de SiembraDocumento3 páginasPractica Tecnicas de SiembraGenesisAún no hay calificaciones
- Aislamiento y Cultivo de Celulas Primarias Del Intestino de RataDocumento10 páginasAislamiento y Cultivo de Celulas Primarias Del Intestino de Ratadvabe618Aún no hay calificaciones
- CRISOPASDocumento4 páginasCRISOPASPercy Ricardo Santos GomezAún no hay calificaciones
- Recuperación de Insectos BenefgicosDocumento8 páginasRecuperación de Insectos BenefgicosAntonio Ulloa TorresAún no hay calificaciones
- Explotación de CodornicesDocumento14 páginasExplotación de CodornicesVélez Cano FelipeAún no hay calificaciones
- Guia Fungi ProDocumento16 páginasGuia Fungi ProNano GallardoAún no hay calificaciones
- Manual Kit Fungi Pro XLDocumento16 páginasManual Kit Fungi Pro XLrodrigo esteban hernandez ramirezAún no hay calificaciones
- Método para La Cuenta de Mohos y Levaduras en AlimentosDocumento4 páginasMétodo para La Cuenta de Mohos y Levaduras en AlimentosJosé Larragaña OsunaAún no hay calificaciones
- Aislamiento de PsicrofilosDocumento3 páginasAislamiento de PsicrofilosThalia M. FernandezAún no hay calificaciones
- Informe Electivo N°7Documento13 páginasInforme Electivo N°7CM VnessAún no hay calificaciones
- Proceso de Cría Del TrichogrammaDocumento7 páginasProceso de Cría Del TrichogrammaDavid Randy Ballesteros MedellinAún no hay calificaciones
- Microbiologia Tecnicas de SiembraDocumento21 páginasMicrobiologia Tecnicas de SiembraGonzalo ZumbaAún no hay calificaciones
- Protocolo DiatomeasDocumento9 páginasProtocolo DiatomeassaulblancoAún no hay calificaciones
- Diagrama de Flujo Practica 1 EFECTO DE LA TEMPERATURA SOBRE LA GERMINACIÓNDocumento2 páginasDiagrama de Flujo Practica 1 EFECTO DE LA TEMPERATURA SOBRE LA GERMINACIÓNEdmundo CoronaAún no hay calificaciones
- Cría de los caracoles. Las especies más comunes, la reproducción, la puesta en marcha de un criadero, uso y comercializaciónDe EverandCría de los caracoles. Las especies más comunes, la reproducción, la puesta en marcha de un criadero, uso y comercializaciónAún no hay calificaciones
- Acute Coronary Syndromes Con Elevacion STDocumento79 páginasAcute Coronary Syndromes Con Elevacion STCarlos alvarezAún no hay calificaciones
- Alcohol Gel 70% Limpia Manos EficazmenteDocumento2 páginasAlcohol Gel 70% Limpia Manos EficazmenteLeslie Ramos VelaAún no hay calificaciones
- Decalogo Sobre Abordaje Terapeutico de La Crisis Familiar e Individual en Un Proceso de DueloDocumento5 páginasDecalogo Sobre Abordaje Terapeutico de La Crisis Familiar e Individual en Un Proceso de DueloVanesaAún no hay calificaciones
- Resultado Idime CovidDocumento1 páginaResultado Idime Covidangelica ramirezAún no hay calificaciones
- Calendario Academico Ac 2022 1 v3Documento2 páginasCalendario Academico Ac 2022 1 v3Sam BloqueadaAún no hay calificaciones
- Evidencia 3. Intoxicacion Por EtasDocumento4 páginasEvidencia 3. Intoxicacion Por EtasSantidash GamesAún no hay calificaciones
- Joseangel Casas 11 Deilis Ivonne Pacheco SanzDocumento10 páginasJoseangel Casas 11 Deilis Ivonne Pacheco SanzLidia GilAún no hay calificaciones
- PRL Guía Buenas PrácticasDocumento44 páginasPRL Guía Buenas Prácticaskandelaria7Aún no hay calificaciones
- T Ucsg Pre Med Odon 53 PDFDocumento154 páginasT Ucsg Pre Med Odon 53 PDFYAMEL ROA SANCHEZAún no hay calificaciones
- Lista de Verificación para Las Inspecciones de Seguridad en La ConstrucciónDocumento12 páginasLista de Verificación para Las Inspecciones de Seguridad en La ConstrucciónMiguel RamosAún no hay calificaciones
- Organización de Las Naciones Unidas - Wikipedia, La Enciclopedia LibreDocumento177 páginasOrganización de Las Naciones Unidas - Wikipedia, La Enciclopedia Libreaaronortega.xdAún no hay calificaciones
- Lactante masculino de 3 meses con crecimiento y desarrollo normalDocumento10 páginasLactante masculino de 3 meses con crecimiento y desarrollo normalAngel OzunaAún no hay calificaciones
- Responsabilidad Penal Del Psicópata.Documento39 páginasResponsabilidad Penal Del Psicópata.Yair TorresAún no hay calificaciones
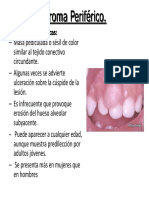
- Fibroma PeriféricoDocumento8 páginasFibroma PeriféricoJuanPérezAún no hay calificaciones
- Infancia Herida - Christian OrtizDocumento22 páginasInfancia Herida - Christian OrtizArielAún no hay calificaciones
- Enfermedades y Tumores Benignos Del Útero PDFDocumento25 páginasEnfermedades y Tumores Benignos Del Útero PDFArgellia ZamariOoAún no hay calificaciones
- Taller #3 Técnicas de Modificación de ConductaDocumento7 páginasTaller #3 Técnicas de Modificación de ConductaPaola SierraAún no hay calificaciones
- Resumen - Parte 2 Viernes - FonoestomatologíaDocumento38 páginasResumen - Parte 2 Viernes - FonoestomatologíaMariana Herrera Lopardo100% (1)
- Solicitud Interdicción ProvisionalDocumento1 páginaSolicitud Interdicción ProvisionalhaideeAún no hay calificaciones
- FT-SST-029 Formato Manual de Funciones Del CargoDocumento8 páginasFT-SST-029 Formato Manual de Funciones Del CargoAndrea SilvaAún no hay calificaciones
- Tarea Unica de Estudio de Casos SPYH 1Documento4 páginasTarea Unica de Estudio de Casos SPYH 1Cristian SilvaAún no hay calificaciones
- Taller 1 Conceptos de La Norma BRC V08Documento2 páginasTaller 1 Conceptos de La Norma BRC V08kimichiroAún no hay calificaciones
- Frenilectomía Labial Superior-KikinDocumento7 páginasFrenilectomía Labial Superior-KikinJoshua Diaz QuiquijanaAún no hay calificaciones
- Resultados Otis Sencillo y GammaDocumento4 páginasResultados Otis Sencillo y GammaAbigail Rojas BernaAún no hay calificaciones
- Caratulas SJB MedicinaDocumento1 páginaCaratulas SJB MedicinaCarlos K FloresAún no hay calificaciones
- 2 Parcial Famaco II - Novas e Antigas-1Documento128 páginas2 Parcial Famaco II - Novas e Antigas-1Gleycy Subtil75% (4)
- Implicancia de La Procreación Asistida en El Libro de Personas Del Código CivilDocumento41 páginasImplicancia de La Procreación Asistida en El Libro de Personas Del Código CivilGary GomeroAún no hay calificaciones
- Comentarios Al Yel Que Regulan La Suspensión Perfecta de Labores en El Contexto de La Pandemia Por COVID-19Documento13 páginasComentarios Al Yel Que Regulan La Suspensión Perfecta de Labores en El Contexto de La Pandemia Por COVID-19Estudio Arbizu GamarraAún no hay calificaciones
- Taller y Gattist de Dermatitis de Contacto OcupacionalDocumento19 páginasTaller y Gattist de Dermatitis de Contacto OcupacionalYina PachecoAún no hay calificaciones
- Composición corporal: Guía de 40 pasos para una vida saludableDocumento9 páginasComposición corporal: Guía de 40 pasos para una vida saludableruth sanchezAún no hay calificaciones