Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Pre2 TERMO II
Cargado por
ivan Gonzalez0 calificaciones0% encontró este documento útil (0 votos)
15 vistas3 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
15 vistas3 páginasPre2 TERMO II
Cargado por
ivan GonzalezCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
TERMODINÁMICA ll
VOLUMEN MOLAR PARCIAL
GONZÁLEZ PEDRAZA JOSÉ IVÁN
15/09/2021 Miércoles 15:00 – 17:00
SANDRA BERENICE ARAUJO DÍAZ
VOLUMEN MOLAR PARCIAL
OBJETIVO
Determinar volúmenes molares parciales del agua y del cloruro de sodio a diferentes
concentraciones, a partir de densidades medidas con un picnómetro.
GUÍA DE ESTUDIOS
1. Defina volumen molar parcial.
Se puede considerar de varias formas, como el incremento del volumen obtenido por la adición
de una pequeña cantidad de un componente inicial a la mezcla, manteniendo constantes
la temperatura, presión y el número de moles de los otros componentes, divido por el número de
moles del componente inicial.
2. Mencione tres ejemplos de propiedades molares parciales.
Volumen molar parcial, entalpia molar parcial, energía de Gibbs molar parcial.
3. ¿Qué diferencia existe entre una propiedad extensiva y una intensiva?
Las propiedades extensivas dependen de la masa, mientras que las propiedades intensivas son
independientes de ella.
4. ¿Cómo se puede obtener el volumen molar parcial?
Método de la pendiente: Para medir el volumen molar parcial de un componente “y”, se preparan
disoluciones con el mismo número de moles del disolvente “x”, pero variando el número de
moles del componente “y” trabajando a presión y temperatura constantes. Una tangente de la
curva del volumen total contra concentración representa el volumen parcial molar.
5. ¿Cómo se puede obtener experimentalmente el volumen de un picnómetro?
Pesando el picnómetro seco y luego lleno de agua, se resta la masa del picnómetro con agua
menos la del picnómetro vacío, el resultado es la masa de agua que al multiplicarla por la
densidad que le corresponde a la temperatura a la que estaba se obtiene el volumen del agua
que es el volumen que puede contener el picnómetro.
6. ¿Qué diferencia existe entre molalidad (𝑚) y molaridad (𝑀)?
La molaridad (M), o concentración molar, es el número de moles de soluto por cada litro de
disolución. La molalidad (m) es el número de moles de soluto que contiene un kilogramo de
disolvente. La molalidad de una solución dada no varía con la temperatura, porque las masas no
varían con está.
7. Mencione tres tipos de concentración de las disoluciones que sean independientes de
la temperatura y explique las razones.
Fracción molal, porcentaje peso-peso, molalidad, ya que estas propiedades dependen de la
cantidad de masa únicamente, no varían con la temperatura, sin embargo, las concentraciones
que contienen volumen sí dependen de la presión y temperatura.
8. Investigar las características CRETIB de los residuos que se generan en la práctica, así
como el tratamiento que se les dará a estos.
La acetona es peligrosa por su inflamabilidad, aún diluido con agua, dejarlo evaporar en una
campana extractora de gases. No tirar al drenaje, pues pueden alcanzarse niveles explosivos.
Para la solución de NaCl, guardar en frascos y evaporar el agua.
BIBLIOGRAFÍA
1. Laboratorio de Termodinámica II, FCQ. (2021). “Practica #2. Volumen Molar
Parcial”. Manual de Laboratorio Termodinámica I. (pp. 6-8) San Luis Potosí:
UASLP.
2. Cengel, Y. A., & Boles, M. A. (2012). Termodinámica (7ma ed.). Nueva York:
McGraw-Hill.
3. Anthony F. Fucaloro. Partial Molar Volums from Refractive Index Measurements.
Journal of Chimical Education Vol. 79 No. 7 julio 200. P.p 867.
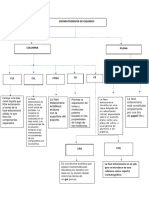
INICIO
Pesar el picnómetro vacío y seco. Anotar el
peso como
1 Wo
Llenar con agua, secar perfectamente el
Anotar el peso el peso
exterior y volver a pesar. como Wa y medir la
2 temperatura del agua.
Vaciar el picnómetro, enjuagarlo
con acetona y secarlo con
3 aire con el compresor.
Llenar y pesar el picnómetro con la Anotar el
solución de NaCl 0.2 M . peso como
4 Ws.
Enjuagar el picnómetro con agua Anotar los
destilada y seguido de acetona y pasos de
secarlo con el aire del compresor. cada una.
5
Recolectar los residuos en un
contenedor rotulado.
6
FIN
También podría gustarte
- Volumen Molar ParcialDocumento3 páginasVolumen Molar ParcialIsa UrbinaAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Pre2 JimenaReyes 342928Documento5 páginasPre2 JimenaReyes 342928Jimena ReyesAún no hay calificaciones
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Pre 2 Termo II Marcela AndradeDocumento4 páginasPre 2 Termo II Marcela AndradeMarcela AndradeAún no hay calificaciones
- Pre 2Documento4 páginasPre 2Joaly MorenoAún no hay calificaciones
- Pre 2 Labo Termo IIDocumento3 páginasPre 2 Labo Termo IIJoaly MorenoAún no hay calificaciones
- Termodinamica CuestionarioDocumento5 páginasTermodinamica CuestionarioMario JosafatAún no hay calificaciones
- Pre2 TermodinamicaII 327639 LoredoZamarripaDocumento6 páginasPre2 TermodinamicaII 327639 LoredoZamarripadaniel loredoAún no hay calificaciones
- Pre2 - Cynthia Torres - 292522Documento4 páginasPre2 - Cynthia Torres - 292522Cynthia Jazmin Torres AlmendarezAún no hay calificaciones
- Manual Fisicoquimica II-Noe - Observaciones RoxDocumento22 páginasManual Fisicoquimica II-Noe - Observaciones RoxBene AdictoAún no hay calificaciones
- Practicas FisicaDocumento14 páginasPracticas Fisica822852Aún no hay calificaciones
- Informe de Calibracion Volumetrico JuntoDocumento4 páginasInforme de Calibracion Volumetrico JuntoFelipe CantorAún no hay calificaciones
- Reporte de Práctica Masa y DensidadDocumento9 páginasReporte de Práctica Masa y DensidadLucero Paloma Ortiz LopezAún no hay calificaciones
- Informe MFF 01Documento11 páginasInforme MFF 01KENYI HUILLCAMISA PANOAún no hay calificaciones
- Pre2-Temodinamica 2Documento4 páginasPre2-Temodinamica 2Fanny UrestiAún no hay calificaciones
- Pre2 - Daniela Rodriguez324519Documento6 páginasPre2 - Daniela Rodriguez324519Alejandra RodriguezAún no hay calificaciones
- LAB1Documento7 páginasLAB1kevin mendieta vegaAún no hay calificaciones
- PradoRuizPr4 J9Documento6 páginasPradoRuizPr4 J9Moises Prado RuizAún no hay calificaciones
- Práctica 1Documento8 páginasPráctica 1nievesAún no hay calificaciones
- Densidad de Líquidos.Documento4 páginasDensidad de Líquidos.Carlos Cristian Ferrufino GuzmánAún no hay calificaciones
- 2 Lab. Masa, Volumen y DesindadDocumento6 páginas2 Lab. Masa, Volumen y DesindadManuela RozoAún no hay calificaciones
- Pre2 - Yatzhiry Alviso330891Documento5 páginasPre2 - Yatzhiry Alviso330891Yatzhiry Alviso100% (1)
- Informe Lab DeyaniraDocumento38 páginasInforme Lab DeyaniraJose AntonioAún no hay calificaciones
- Analisis Organoleptico Del AguaDocumento5 páginasAnalisis Organoleptico Del AguaDanielito ChamakitoAún no hay calificaciones
- Cahuana Vargas Rodrigo Laboratorio 3Documento18 páginasCahuana Vargas Rodrigo Laboratorio 3Rodrigo Ccahuana Vargas100% (1)
- PRACTICA #6 Densidades-1Documento2 páginasPRACTICA #6 Densidades-1gerson alarconAún no hay calificaciones
- Pre3 Termodinámica LLDocumento5 páginasPre3 Termodinámica LLluisa GonzálezAún no hay calificaciones
- Práctica N. 2 PROPIEDADES FISICAS DE LA MATERIADocumento6 páginasPráctica N. 2 PROPIEDADES FISICAS DE LA MATERIALau Villa PeñaAún no hay calificaciones
- Practica de Laboratorio de Quimica4Documento7 páginasPractica de Laboratorio de Quimica4Ernesto Andre Lobo HdzAún no hay calificaciones
- Informe de Laboratorio de Quimica # 6Documento7 páginasInforme de Laboratorio de Quimica # 6DavidFer DuraznoAún no hay calificaciones
- Laboratorio de Equilibrio FisicoquimicoDocumento16 páginasLaboratorio de Equilibrio FisicoquimicoMa BaAún no hay calificaciones
- Metodo de La Picnometria en Los Analisis de AlimentosDocumento3 páginasMetodo de La Picnometria en Los Analisis de AlimentosSusan TBAún no hay calificaciones
- Año de La Lucha Contra La Corrupción e ImpunidadDocumento20 páginasAño de La Lucha Contra La Corrupción e Impunidadtarazona alejandro stefany fiorellaAún no hay calificaciones
- Guialabfisicoquimica AlimentosDocumento16 páginasGuialabfisicoquimica AlimentosVictoria Gonzalez BarraAún no hay calificaciones
- Informe 4 Viscosidad y DensidadDocumento14 páginasInforme 4 Viscosidad y DensidadMiguel Angelo Miranda JAún no hay calificaciones
- 2prevolumen Molar ParcialDocumento3 páginas2prevolumen Molar ParcialFrancisco Lara GallardoAún no hay calificaciones
- TerminadoDocumento36 páginasTerminadoSergio Daniel HdzAún no hay calificaciones
- Determ Densidad PicnometroDocumento4 páginasDeterm Densidad PicnometroR Carlos AlvarezAún no hay calificaciones
- Informe de Propiedades Coligativas PDFDocumento16 páginasInforme de Propiedades Coligativas PDFAlex MalizaAún no hay calificaciones
- Guia de Lab, Temario ExamenDocumento14 páginasGuia de Lab, Temario ExamenAiled González SánchezAún no hay calificaciones
- Densidadinforme de FicoDocumento30 páginasDensidadinforme de FicoAdrianQuispeAún no hay calificaciones
- Informe de QuímicaDocumento4 páginasInforme de QuímicaANDREA BELEN CORTIJO SEGURAAún no hay calificaciones
- Guia de Práctica #03Documento5 páginasGuia de Práctica #03Pamela MonteroAún no hay calificaciones
- Informe de Densidad Practica 2Documento23 páginasInforme de Densidad Practica 2Anthony GutierrezAún no hay calificaciones
- Practica 1. Propiedades Fisicas en AlimentosDocumento5 páginasPractica 1. Propiedades Fisicas en AlimentosLIZAún no hay calificaciones
- Guía #1 - Preparación de PulpasDocumento6 páginasGuía #1 - Preparación de PulpasDaniel100% (1)
- L B Volumenes Molares ParcialesDocumento7 páginasL B Volumenes Molares Parcialesfabrycio chAún no hay calificaciones
- Unidades Quimicas de ConcentracionDocumento3 páginasUnidades Quimicas de ConcentracionFabio Leonardo Baron HernandezAún no hay calificaciones
- Córdova ReyesPre4Mi9 11Documento6 páginasCórdova ReyesPre4Mi9 11Paola CórdovaAún no hay calificaciones
- Densidad de Los FluidosDocumento8 páginasDensidad de Los FluidosLuis FrancoAún no hay calificaciones
- Guía N°2 Propiedades ColigativasDocumento8 páginasGuía N°2 Propiedades ColigativasBRIGITH STHEFANIA BENITES GARCIAAún no hay calificaciones
- Informe 1 - EcologiaDocumento10 páginasInforme 1 - EcologiaSANDRA NICOL MARQUINA ORBEGOZOAún no hay calificaciones
- LTP 6Documento67 páginasLTP 6Strokes LemusAún no hay calificaciones
- Informe 1 - Volumen Molar Parcial-Grupo 3Documento34 páginasInforme 1 - Volumen Molar Parcial-Grupo 3Nahomy Malasquez PeñaAún no hay calificaciones
- Laboratorion 02.Documento6 páginasLaboratorion 02.Jimena Joaquin RiveraAún no hay calificaciones
- Practica Numero 2 - (2012-2) PDFDocumento5 páginasPractica Numero 2 - (2012-2) PDFRoberto Bocanegra FelixAún no hay calificaciones
- Densidad de Sólidos y LíquidosDocumento11 páginasDensidad de Sólidos y LíquidosCristhian Mendoza YucraAún no hay calificaciones
- Pre Reporte 3Documento4 páginasPre Reporte 3Oreana González GonzálezAún no hay calificaciones
- Fundamento de Cromatografía de Líquidos GPJIDocumento11 páginasFundamento de Cromatografía de Líquidos GPJIivan GonzalezAún no hay calificaciones
- Practica 10. DeterminacionDocumento6 páginasPractica 10. Determinacionivan GonzalezAún no hay calificaciones
- Probabilidad Clásica FinalDocumento9 páginasProbabilidad Clásica Finalivan GonzalezAún no hay calificaciones
- Dieta Macros Jesus GallegoDocumento28 páginasDieta Macros Jesus GallegoJhonny Gabriel TorrezAún no hay calificaciones
- Pre1 TERMO IIDocumento4 páginasPre1 TERMO IIivan GonzalezAún no hay calificaciones
- Espectroscopía de Fluorescencia Atómica y MolécularDocumento5 páginasEspectroscopía de Fluorescencia Atómica y Molécularivan GonzalezAún no hay calificaciones
- Cromatografía de Gases L GPJIDocumento7 páginasCromatografía de Gases L GPJIivan GonzalezAún no hay calificaciones
- Cromatografía de Gases L GPJIDocumento7 páginasCromatografía de Gases L GPJIivan GonzalezAún no hay calificaciones
- Practica-De-Tensión-Superficial ZavaDocumento10 páginasPractica-De-Tensión-Superficial ZavaCristian ZavaletaAún no hay calificaciones
- Sintesis de CloruroDocumento4 páginasSintesis de CloruroKelly ArrietaAún no hay calificaciones
- Solucionario Fisica Quimica UNI 2016 IIDocumento20 páginasSolucionario Fisica Quimica UNI 2016 IINohelia Fer GavAún no hay calificaciones
- Unidadad 4.1 Equilibrio QuímicoDocumento26 páginasUnidadad 4.1 Equilibrio QuímicoChristopher Guevara Che100% (1)
- A Instructor Said Vargas Laboratorio 2 CDocumento7 páginasA Instructor Said Vargas Laboratorio 2 CBy CadizAún no hay calificaciones
- Conceptos Basicos U3Documento5 páginasConceptos Basicos U3Daniela FernandezAún no hay calificaciones
- Cuestionario 7 BioquimicaDocumento2 páginasCuestionario 7 Bioquimicasantigo0504Aún no hay calificaciones
- Practica N 5 Dilatacion LinealDocumento18 páginasPractica N 5 Dilatacion LinealRamiro Q Llusco0% (1)
- Que Es El ÁtomoDocumento3 páginasQue Es El ÁtomoDulce María Hernández serranoAún no hay calificaciones
- Fenómenos de Transporte y Transferencia - Farid Chejne PDFDocumento214 páginasFenómenos de Transporte y Transferencia - Farid Chejne PDFdacardonarAún no hay calificaciones
- Estructura Cristalina FCCDocumento8 páginasEstructura Cristalina FCCJunior Marquinho Delgado SieteAún no hay calificaciones
- Texto 2Documento15 páginasTexto 2Diego Masias0% (1)
- Anteproyecto de Examen de Tercero de BachillerDocumento8 páginasAnteproyecto de Examen de Tercero de BachillerAurelina Diaz AmadorAún no hay calificaciones
- Incompatibilidad Química y Estabilidad Térmica Del Baclofeno Por Análisis TérmicoDocumento7 páginasIncompatibilidad Química y Estabilidad Térmica Del Baclofeno Por Análisis TérmicoLAIX ISSELLA SANTIAGO RODRIGUEZAún no hay calificaciones
- Preguntas Capitulo 2.Documento3 páginasPreguntas Capitulo 2.oscar cano0% (1)
- VISCOSIDADDocumento3 páginasVISCOSIDADDeysi Danae Toledo LeonAún no hay calificaciones
- Viscosidad Rev6 PDFDocumento6 páginasViscosidad Rev6 PDFVicente SosaAún no hay calificaciones
- Problem A RioDocumento8 páginasProblem A RioMarleny Garcia LucasAún no hay calificaciones
- Cuestionario 2 Lab QMC-100Documento5 páginasCuestionario 2 Lab QMC-100carlosAún no hay calificaciones
- TEMA 01 Bio PDFDocumento17 páginasTEMA 01 Bio PDFaudaAún no hay calificaciones
- 1.4. Teoría Atómica y Teoría CuánticaDocumento6 páginas1.4. Teoría Atómica y Teoría CuánticaHumberto Javier Guirao MartinezAún no hay calificaciones
- CuestionarioDocumento13 páginasCuestionarioRodrigo Dalence100% (1)
- EDTADocumento10 páginasEDTAAlmendra Ramos BartoloAún no hay calificaciones
- Práctica Sobre Técnicas Básicas de LaboratorioDocumento14 páginasPráctica Sobre Técnicas Básicas de LaboratorioAndres Eduardo MartinezAún no hay calificaciones
- FT - DecylDocumento2 páginasFT - DecylLEIDIPAOLAAún no hay calificaciones
- Métodos de Análisis PotenciometricosDocumento36 páginasMétodos de Análisis PotenciometricosGu Fa EnAún no hay calificaciones
- Endulzamiento REDOXDocumento5 páginasEndulzamiento REDOXLANZcuberAún no hay calificaciones
- Evaluacion 1 TermodinamicaDocumento8 páginasEvaluacion 1 Termodinamicawillinton238967% (3)
- Sustancia Simple, Pura y ComprensibleDocumento49 páginasSustancia Simple, Pura y ComprensibleEmanuel MoschenAún no hay calificaciones
- Practica 1-Lab Org IIDocumento16 páginasPractica 1-Lab Org IICarina AlvarezAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (201)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- La causa raiz de los accidentes: Historias de accidentes en la industriaDe EverandLa causa raiz de los accidentes: Historias de accidentes en la industriaCalificación: 5 de 5 estrellas5/5 (1)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDe EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Manual técnico para la interpretación de análisis de suelos y fertilización de cultivosDe EverandManual técnico para la interpretación de análisis de suelos y fertilización de cultivosCalificación: 4 de 5 estrellas4/5 (1)