Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Piedra Caliza
Cargado por
marena loorDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Piedra Caliza
Cargado por
marena loorCopyright:
Formatos disponibles
NOMBRE: MARENA LOOR
CURSO: IAG303-1
FECHA: 19/11/2018
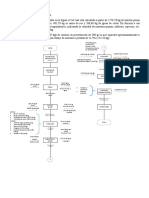
El cloruro de calcio es un sal muy usada en las bebidas de hidratación, se puede obtener esta sal al hacer reaccionar con el carbonato de calcio con ácido clorhidrico. Una planta productora de esta sal
utiliza una tonelada de piedra caliza al 65% de pureza en carbonato de calcio, si el acido clorhidrico usado es de 30% de pureza y 1.15g/ml de densidad, Hallar la composición de la solución de salida. Si
el proceso se realiza en una hora, y el rendimiento de la reacción es del 80%.
228.8 Kg
BASE = 1 HORA
REACTIVOS PRODUCTOS
REACCION IGUALADA 1 CaCO3 2 HCl → 1 CaCl2 1 CO2 1 H2O Kg/kmol
PESO MOLECULAR 100 + 36.5 111 + 44 + 18 Kg
CANTIDAD 100 73 111 44 18 Kg
PIEDRA CALIZA COMPROBACIÓN 173 173 Kg
80%
1000 kg ENTRA 650 475 0 0 1107 Kg
65% Pureza REACCIONA 520 + 380 577 + 228.8 + 93.6 Kg
650 Kg de CaCO3 QUEDA 130 94.9 577 228.8 1200.8 Kg
SOLUCION DE SALIDA
ÁCIDO CLORHIDRICO
30% Pureza CaCl2 577.2 Kg 29%
1.15 Kg/l H2O 1200.76667 Kg 60%
475 Kg Acido Puro HCl 94.9 Kg 5%
1582 Kg Acido 30% CaCO3 130 Kg 6%
1107 Kg Agua TOTAL 2002.9 Kg 100%
1375.4 Litros de Acido 30%
También podría gustarte
- Balance de Materia YogurDocumento1 páginaBalance de Materia YogurEdgar C Medina100% (1)
- Informe Laboratorio 06Documento16 páginasInforme Laboratorio 06Dario Rosales tapiaAún no hay calificaciones
- Balance de Masa ComacsaDocumento13 páginasBalance de Masa ComacsabetsyAún no hay calificaciones
- Balance de Materia en El Molino 1Documento5 páginasBalance de Materia en El Molino 1Mónica Porras RojasAún no hay calificaciones
- Practica 1 Balance de Materia I PDFDocumento10 páginasPractica 1 Balance de Materia I PDFJosé Luis Gomez0% (3)
- Piedra CalizaDocumento1 páginaPiedra Calizamarena loorAún no hay calificaciones
- Acido AdipicoDocumento2 páginasAcido Adipicomarena loorAún no hay calificaciones
- 6 Balance MasasDocumento4 páginas6 Balance MasasMatias GuardiaAún no hay calificaciones
- Excel de Trabajo de Investigacion OptimizacionDocumento17 páginasExcel de Trabajo de Investigacion OptimizacionmiguelAún no hay calificaciones
- 1 Presentación Paso 4Documento42 páginas1 Presentación Paso 4Juan OrtegaAún no hay calificaciones
- Acido Adipico y Acetato de PropiloDocumento2 páginasAcido Adipico y Acetato de Propilomarena loorAún no hay calificaciones
- Bm-Dulce de Leche-Meyra RVDocumento4 páginasBm-Dulce de Leche-Meyra RVLuis Artica MallquiAún no hay calificaciones
- DiMENSIÓN AMBIENTALDocumento15 páginasDiMENSIÓN AMBIENTALanapauibarraochoa99Aún no hay calificaciones
- SOLUCION Casos de BalanceDocumento6 páginasSOLUCION Casos de BalanceLuis Angel ChiloAún no hay calificaciones
- Linea de Producción de AtúnDocumento2 páginasLinea de Producción de AtúnAlvaroAún no hay calificaciones
- FLUJOGRAMAs de Diseño de PlantaDocumento5 páginasFLUJOGRAMAs de Diseño de Plantayanesi clavo fernandezAún no hay calificaciones
- CUESTIONARIO Pqi 6Documento12 páginasCUESTIONARIO Pqi 6James Junior Rojas SanchezAún no hay calificaciones
- Taller#1Documento2 páginasTaller#1María José BarreraAún no hay calificaciones
- Linea de Producción de AtúnDocumento2 páginasLinea de Producción de AtúnAlvaroAún no hay calificaciones
- BALANCE EN SEMI-CONTINUO HARINA PULMA Y SANGRE HaarslevDocumento1 páginaBALANCE EN SEMI-CONTINUO HARINA PULMA Y SANGRE HaarslevVivi De QuevedoAún no hay calificaciones
- Balance para AlmibarDocumento8 páginasBalance para AlmibarKAKAWAún no hay calificaciones
- Adición de Cal Al Convertidor LDDocumento9 páginasAdición de Cal Al Convertidor LDMoises Delgado BarbozaAún no hay calificaciones
- Determinacion de La Humedad Del Concentrado MagneticoDocumento4 páginasDeterminacion de La Humedad Del Concentrado Magneticojoseph ayma cutiAún no hay calificaciones
- Balance de Materia de QUESO SUIZODocumento7 páginasBalance de Materia de QUESO SUIZOJulio Tirado100% (1)
- Determinación de Nitrógeno Por El Métdo KjeldahlDocumento8 páginasDeterminación de Nitrógeno Por El Métdo KjeldahlNatalia Valentina Toledo AguilarAún no hay calificaciones
- Ejercicios Balance de Materia y EnergiaDocumento5 páginasEjercicios Balance de Materia y Energiarudy ramos100% (1)
- Balance de Materia CerealesDocumento10 páginasBalance de Materia CerealesErika TrujilloAún no hay calificaciones
- Flujograma Conserva de FrejolDocumento1 páginaFlujograma Conserva de FrejolPathy JiménezAún no hay calificaciones
- Diagrama de FlujoDocumento4 páginasDiagrama de FlujoAnghela Ortiz FloresAún no hay calificaciones
- Determinación Tamaño PlantaDocumento6 páginasDeterminación Tamaño Plantaalexanderpascal326Aún no hay calificaciones
- H3PO4Documento3 páginasH3PO4marena loorAún no hay calificaciones
- Inventario Barras ProcesosDocumento5 páginasInventario Barras ProcesosSaraAún no hay calificaciones
- Balance de Masa FINALDocumento2 páginasBalance de Masa FINALgonzalo vallejosAún no hay calificaciones
- Balance de MateriaDocumento3 páginasBalance de MateriakatyamaritzasanchezperezAún no hay calificaciones
- S01 EjerciciO - GRUPALDocumento4 páginasS01 EjerciciO - GRUPALLlano Ychpas LuciaAún no hay calificaciones
- Taller Balance de MasasDocumento4 páginasTaller Balance de MasasMiriam Posada Villa100% (1)
- Documento PDFDocumento6 páginasDocumento PDFCristhian DelgadoAún no hay calificaciones
- AsdfDocumento2 páginasAsdfMARIA JESUS SUAREZ TACOAún no hay calificaciones
- Cálculos Pepinillos en SalmueraDocumento4 páginasCálculos Pepinillos en SalmueraHeidy Montes GalarzaAún no hay calificaciones
- Balance de Materia Elaboración de Grated de AnchovetaDocumento3 páginasBalance de Materia Elaboración de Grated de AnchovetaROSA ROJAS GUEVARAAún no hay calificaciones
- Balance de Materia Elaboración de Grated de AnchovetaDocumento3 páginasBalance de Materia Elaboración de Grated de AnchovetaROSA ROJAS GUEVARAAún no hay calificaciones
- Mfid VinoDocumento8 páginasMfid Vinocezc menAún no hay calificaciones
- VIACHA IP40 H-21 Aditivo 1,2%Documento4 páginasVIACHA IP40 H-21 Aditivo 1,2%Lucio Villanueva100% (1)
- Viacha Ip40 H-21Documento3 páginasViacha Ip40 H-21Lucio Villanueva100% (1)
- Recepcion de Alcachofas FinalDocumento7 páginasRecepcion de Alcachofas FinalFiorelaGasparSaenzAún no hay calificaciones
- Diagrama de FlujoDocumento1 páginaDiagrama de FlujoCinthia GraceAún no hay calificaciones
- Balance de Materia...Documento7 páginasBalance de Materia...Cristhian Alejandro Cruz MegoAún no hay calificaciones
- Scharfeen Berger Chocolate Maker - VGDocumento3 páginasScharfeen Berger Chocolate Maker - VGpaocvl892Aún no hay calificaciones
- Desarrollo de Segundo Examen Parcial - Burga LizDocumento2 páginasDesarrollo de Segundo Examen Parcial - Burga LizFlor Caro100% (1)
- Practico Balance de MasaDocumento3 páginasPractico Balance de Masaaylin condoriAún no hay calificaciones
- Termo Informe ArequipeDocumento10 páginasTermo Informe ArequipeEduard PintoAún no hay calificaciones
- Taller 1. Variables de Proceso-Balance de Masa y Energía - 16-02-21Documento10 páginasTaller 1. Variables de Proceso-Balance de Masa y Energía - 16-02-21Vanesa CañonAún no hay calificaciones
- Biologiaejrciios PorcentajesDocumento4 páginasBiologiaejrciios PorcentajesIsrael Marco RamirezAún no hay calificaciones
- Balance de MasaDocumento1 páginaBalance de MasaChristian CarreraAún no hay calificaciones
- CASO PRACTICO 5 - Balance de Energía TriclorometanoDocumento3 páginasCASO PRACTICO 5 - Balance de Energía TriclorometanoFernandox PachecoAún no hay calificaciones
- Queso Tipo QuesilloDocumento8 páginasQueso Tipo Quesillogutierrezr514Aún no hay calificaciones
- PDFDocumento10 páginasPDFJames AaronAún no hay calificaciones
- Farmacotecia TallerDocumento15 páginasFarmacotecia TallerJoe RiveraAún no hay calificaciones
- Balance Sin Reaccion 2Documento14 páginasBalance Sin Reaccion 2Juan Luis ViañaAún no hay calificaciones
- Ebmop U1 A1 EnmrDocumento6 páginasEbmop U1 A1 EnmrEnrique Martinez Rodriguez100% (1)
- Cronograma 2023 Control de Plagas PDFDocumento1 páginaCronograma 2023 Control de Plagas PDFmarena loorAún no hay calificaciones
- Nivel Reclamos Proveedor Ingreso de Quejas EneroDocumento6 páginasNivel Reclamos Proveedor Ingreso de Quejas Eneromarena loorAún no hay calificaciones
- Inventario de Panaderia, Reproceso y JabasDocumento7 páginasInventario de Panaderia, Reproceso y Jabasmarena loorAún no hay calificaciones
- Flujograma y APCC Manjar de LecheDocumento17 páginasFlujograma y APCC Manjar de Lechemarena loorAún no hay calificaciones
- Calculo de Porcentaje de Vida UtilDocumento2 páginasCalculo de Porcentaje de Vida Utilmarena loorAún no hay calificaciones
- Calculos de Calibraciones MensualDocumento3 páginasCalculos de Calibraciones Mensualmarena loorAún no hay calificaciones
- AIB International Food Safety Maturity Assessment-SPDocumento1 páginaAIB International Food Safety Maturity Assessment-SPmarena loorAún no hay calificaciones
- Bpm-P-038-Camara de LeudoDocumento1 páginaBpm-P-038-Camara de Leudomarena loorAún no hay calificaciones
- Bpm-P-040-Selladora Al VacioDocumento1 páginaBpm-P-040-Selladora Al Vaciomarena loorAún no hay calificaciones
- BPM P 044 Laminadora de PastaDocumento1 páginaBPM P 044 Laminadora de Pastamarena loorAún no hay calificaciones
- Ficha Técnica Lavador 100Documento1 páginaFicha Técnica Lavador 100marena loorAún no hay calificaciones
- AlergenosDocumento5 páginasAlergenosmarena loorAún no hay calificaciones
- Bpm-P-042-Amasadora GrandeDocumento1 páginaBpm-P-042-Amasadora Grandemarena loorAún no hay calificaciones
- BPM P 039 PlanchaDocumento1 páginaBPM P 039 Planchamarena loorAún no hay calificaciones
- Bpm-P-038-Cuartos FriosDocumento1 páginaBpm-P-038-Cuartos Friosmarena loorAún no hay calificaciones
- MSDS Lavador 100Documento5 páginasMSDS Lavador 100marena loorAún no hay calificaciones
- Bpm-P-035-Selladora A PedalDocumento1 páginaBpm-P-035-Selladora A Pedalmarena loorAún no hay calificaciones
- BPM P 037 CremerasDocumento1 páginaBPM P 037 Cremerasmarena loor100% (1)
- Bpm-P-036-Horno PlantaDocumento1 páginaBpm-P-036-Horno Plantamarena loorAún no hay calificaciones
- Planta BPMDocumento6 páginasPlanta BPMmarena loorAún no hay calificaciones
- Calculo de EspaciosDocumento17 páginasCalculo de Espaciosmarena loorAún no hay calificaciones
- Clase 8s5 SLP - RELACIÓN DE ACTIVIDADESDocumento43 páginasClase 8s5 SLP - RELACIÓN DE ACTIVIDADESmarena loorAún no hay calificaciones
- MainDocumento64 páginasMainGloria HernándezAún no hay calificaciones
- Lista de VerificaciónDocumento17 páginasLista de VerificaciónJohnSteel01Aún no hay calificaciones
- Examen PHOTOSHOP BÁSICODocumento3 páginasExamen PHOTOSHOP BÁSICOMiguelon CespedesAún no hay calificaciones
- Informe Corto Máq. de Los Ángeles (Enunciado) (Autoguardado)Documento4 páginasInforme Corto Máq. de Los Ángeles (Enunciado) (Autoguardado)MelanieAlfonsoAún no hay calificaciones
- Tarea 2Documento9 páginasTarea 2Fredy TumiñaAún no hay calificaciones
- Laboratorio 8.2Documento9 páginasLaboratorio 8.2Ines RomeroAún no hay calificaciones
- Problemas VariadosDocumento3 páginasProblemas VariadosEdith PacoriAún no hay calificaciones
- Planteamiento de La HipótesisDocumento8 páginasPlanteamiento de La HipótesisBertha Suarez HidalgoAún no hay calificaciones
- 15 Minutos LibroDocumento57 páginas15 Minutos LibroMarina GiménezAún no hay calificaciones
- Mic Iberia FuncionamientodiagnosisDocumento107 páginasMic Iberia FuncionamientodiagnosisHassan Tutunge50% (2)
- Ejercicios de Capacidad y VolumenDocumento10 páginasEjercicios de Capacidad y VolumenAna Alvarez CarabotAún no hay calificaciones
- Actividades A Realizar en La Practica Del Tema Genetica Mendeliana Monohibrida y DihibridaDocumento13 páginasActividades A Realizar en La Practica Del Tema Genetica Mendeliana Monohibrida y DihibridaAlvaro Armando Muñoz OrtizAún no hay calificaciones
- Guía de Laboratorio No. 2 - Parte I Sent. Alternativas - 2021Documento22 páginasGuía de Laboratorio No. 2 - Parte I Sent. Alternativas - 2021Israel GóndolaAún no hay calificaciones
- Quimica Basic (Agosto 2022) Soluciones IDocumento4 páginasQuimica Basic (Agosto 2022) Soluciones IFêlîx LôzânôAún no hay calificaciones
- Trabajo y Energia IVDocumento6 páginasTrabajo y Energia IVrebeca nievesAún no hay calificaciones
- Proyecto BioplasticoDocumento18 páginasProyecto BioplasticoHELEN MANZANOAún no hay calificaciones
- 166-Texto Del Artículo-164-1-10-20120726Documento8 páginas166-Texto Del Artículo-164-1-10-20120726Juan RodríguezAún no hay calificaciones
- Círculo de Viena y La Crítica de FeyerabendDocumento5 páginasCírculo de Viena y La Crítica de FeyerabendLuis132312Aún no hay calificaciones
- Calculadora, Computadora y FuturoDocumento6 páginasCalculadora, Computadora y FuturoJennifer Catalina Villatoro Gil67% (3)
- PRACTICA1Documento44 páginasPRACTICA1Roberto Enrique Barahona Coello Barahona CoelloAún no hay calificaciones
- Informe Construccion Comando de Policia - Esmad 2019Documento22 páginasInforme Construccion Comando de Policia - Esmad 2019Humberto OrtegaAún no hay calificaciones
- La Ley de Elasticidad de HookeDocumento3 páginasLa Ley de Elasticidad de HookeAbel C. CardichAún no hay calificaciones
- Formulas TrigonometricasDocumento1 páginaFormulas TrigonometricasJorge Perez DzulAún no hay calificaciones
- Parámetros de HumidificaciónDocumento13 páginasParámetros de HumidificaciónBrayanHernandezRosasAún no hay calificaciones
- Momento de Inercia de Cuerpos RígidosDocumento10 páginasMomento de Inercia de Cuerpos RígidosLucho AriasAún no hay calificaciones
- Examen Mensual de Razonamiento MatematicoDocumento8 páginasExamen Mensual de Razonamiento Matematicogianina chavez reyesAún no hay calificaciones
- Filosofos GriegosDocumento9 páginasFilosofos GriegosJhon CabreraAún no hay calificaciones
- Informe Topografico - Canales QuicachaDocumento12 páginasInforme Topografico - Canales QuicachaTOPROYECCIONAún no hay calificaciones
- 5 - Programación Imperativa - Variables y Procedimientos - ¿Y El Program - Sé ProgramarDocumento2 páginas5 - Programación Imperativa - Variables y Procedimientos - ¿Y El Program - Sé ProgramarMaria Jose Egea MussiAún no hay calificaciones