Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Acetanilida
Acetanilida
Cargado por
LiLiana NiñoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Acetanilida
Acetanilida
Cargado por
LiLiana NiñoCopyright:
Formatos disponibles
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
INVESTIGACIÓN PREVIA: PRÁCTICA 5
Acetanilida.
El grupo carbonilo, abreviado frecuentemente como –CO2H o –COOH, es uno de los grupos
funcionales más comunes en la Química y la Bioquímica. Los ácidos carboxílicos no sólo
son importantes por sí mismos, sino que el grupo carboxilo es el grupo base de una gran
familia de compuestos relacionados llamados compuestos acilo o derivados de ácidos
carboxílicos.
Objetivos
Una amina puede ser tratada con un anhídrido de acido para formar una amida
efectuar la acetilación del grupo amino como reacción de protección
Los compuestos que se clasifican como derivados de ácidos carboxílicos son aquellos que
contienen grupos funcionales que se convierten en ácidos carboxílicos por una hidrólisis
ácida o básica; es decir, son compuestos en los que el grupo acilo se ha enlazado con un
átomo o sustituyente electronegativo (que puede actuar como grupo saliente en una reacción
de sustitución).
Los derivados más importantes de los ácidos carboxílicos son los ésteres, las amidas y los
nitrilos. Los halogenuros y anhídridos de ácido también están comprendidos en este grupo,
aunque con frecuencia los consideramos como formas activadas de los ácidos, más que
como compuestos diferentes.
1. Principales derivados de ácidos carboxílicos
Grupo funcional Estructura Grupo funcional Estructura
Halogenuros de Tioéster
ácido
Anhídrido de ácido Fosfato de acilo
Ëster Nitrilo
Amida Nota: Aunque los nitrilos carecen del grupo carbonilo
de los ácidos carboxílicos se clasifican como
derivados de los ácidos debido a que se hidrolizan
para formar ácidos carboxílicos y pueden sintetizarse
por la deshidratación de amidas.
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
Los derivados de ácido difieren mucho en sus reactividades hacia la sustitución nucleofílica
del ácido. La reactividad de los derivados de ácido hacia el ataque nufleofílico depende de
sus estructuras individuales y de la naturaleza del nucleófilo atacante. Desde un punto de
vista electrónico, los derivados de ácido fuertemente polarizados reaccionan con más
facilidad que los menos polares.
En general, el orden de reactividad es el siguiente:
Una consecuencia importante del orden de reactividad observado es que usualmente es
posible transformar un derivado de ácido más reactivo en otro menos reactivo; en reacciones
que implican la SN del acilo por el mecanismo de adición-eliminación se generan buenos
rendimientos.
Conversión de halogenuros de ácido en anhídridos
La reacción de sustitución nucleofílica en el grupo acilo de un cloruro de ácido con un anión
carboxilato da un anhídrido de ácido. Los anhídridos simétricos y asimétricos pueden prepararse de
esta manera.
Conversión de los halogenuros de ácido en ésteres: Alcohólisis
Los cloruros de ácido reaccionan con los alcoholes para producir ésteres en un proceso análogo a su
reacción con agua para producir ácidos. Como sucede con la hidrólisis, las reacciones de alcohólisis
se realizan por lo general en presencia de piridina o de NaOH para que reaccionen con el HCl
formado.
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
Conversión de halogenuros de ácido en amidas: Aminólisis
Los cloruros de ácido reaccionan rápidamente con amoniaco y aminas para dar amidas. Pueden
utilizarse aminas monosustituidas y disustituidas, pero no aminas trisustituidas (R3N).
Conversión de anhídridos de ácido en ésteres
Una anhídrido reacciona con un alcohol para formar un éster, observe que una de las dos unidades
de ácido del anhídrido se elimina cómo el grupo saliente.
Conversión de los anhídridos de ácido en amidas
Los anhídridos reaccionan con rapidez con el amoniaco y con las aminas. La reacción de un
anhídrido con amoniaco forma una amida primaria, la reacción de un anhídrido con una amina
primaria forma una amida secundaria y con una amina secundaria forma una amida terciaria.
Conversión de los ésteres en amidas: Aminólisis
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
Los ésteres reaccionan con amoniaco y aminas para producir amida. Sin embargo, la reacción no se
utiliza con frecuencia debido a que por lo general es más fácil comenzar con un cloruro de ácido
Justificación de la técnica experimental
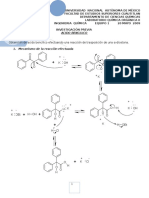
La primera reacción consiste en la adición de la anilina, la cual actúa como un nucleófilo,
sobre el átomo de carbono del grupo carbonilo del anhídrido acético, para que, a través de la
formación de un enlace C-N, se obtenga el intermediario.
Dentro de la estructura del intermediario, el átomo de carbono de lo que era el grupo
carbonilo de anhídrido acético cambió de una hibridación sp2 a una sp3. Para regenerar la
hibridación original del grupo carbonilo, en la que se minimiza el impedimento estérico, debe
ocurrir una reacción de eliminación, en la que se rompe heterolíticamente un enlace C-O la
acetanilida, mezclado con acetato de anilinio.
Debido a que el precipitado es una mezcla de compuestos, se recristaliza para purificar.
Mecanismo de reacción
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
H2O
Otras formas de obtención de la acetanilida:
1) Adicionar 100 ml de H2O destilada en un Matraz Erlenmeyer de 250 ml.
2) Pipetear 4,5 ml de HCl y colocarlos en el matraz con el agua.
3) Añadir 5 ml de anilina y colocar en el matraz con la solución, agitar hasta lograr toda la
disolución de la anilina.
4) Filtrar por gravedad para limpiar la muestra.
5) Añadir 6,5 ml de anhídrido acético, a la solución filtrada, agitar por un momento y
luego dejar reposar por un par de minutos (10 min.).
6) Calentar la solución en baño María.
7) Preparar el equipo para enfriar la muestra, colocar en un vaso de precipitado de 500
ml con hielo el matraz y dejarlo hasta que precipite la muestra.
8) Filtrar el precipitado y lavar con agua destilada helada (3 lavados de 25 ml).
9) Filtrar nuevamente la muestra al vacío para obtener el producto puro.
Calculo del rendimiento experimental
1.06 𝑔 𝑎𝑛𝑖𝑙𝑖𝑛𝑎 1 𝑚𝑜𝑙 𝑎𝑛𝑖𝑖𝑙𝑖𝑛𝑎
𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝐴𝑛𝑖𝑙𝑖𝑛𝑎 = (0.6 𝑚𝐿 𝑎𝑛𝑖𝑙𝑖𝑛𝑎) ( 1𝑚𝐿 𝑎𝑛𝑖𝑙𝑖𝑛𝑎
) ( 93.1 𝑔 𝑎𝑛𝑖𝑙𝑖𝑛𝑎 )= 0.0068 moles
1 𝑚𝑜𝑙 𝑎𝑐𝑡𝑎𝑛𝑖𝑙𝑖𝑑𝑎 135.17 𝑔 𝑎𝑐𝑒𝑡𝑎𝑛𝑖𝑙𝑖𝑑𝑎
𝑔𝑟𝑎𝑚𝑜𝑠 𝑑𝑒 𝑎𝑐𝑒𝑡𝑎𝑛𝑖𝑙𝑖𝑑𝑎 = (0.0068 𝑚𝑜𝑙 𝑎𝑛𝑖𝑙𝑖𝑛𝑎 )( )( )= 0.4595 g
2 𝑚𝑜𝑙 𝑎𝑛𝑖𝑙𝑖𝑛𝑎 1𝑚𝑜𝑙 𝑎𝑐𝑒𝑡𝑎𝑛𝑖𝑙𝑖𝑑𝑎
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
Diagrama de flujo 1.0: Metodología experimental de obtención de Acetanilida
UNAM–FES Cuautitlán Campo I. Carrera: BQD. Asignatura: Química Orgánica II. Equipo No. 5.
“Previo Práctica 5. Acetanilida” Grupo: 2251. Periodo 2020 – 2.
Integrantes: Cohetero Olivares Laura Nayeli, Cortés López Alex Rodrigo, Niño Orozco José Javier Fecha de entrega: 03/03/2012.
Tabla 1.0 – Propiedades Físicas y Toxicológicas de los reactivos y productos.
ESTRUCTURA O
PROPIEDADES
REACTIVO FÓRMULA PROPIEDADES FISICAS NFPA
TOXICOLOGICAS
QUÍMICA
Estado físico, color y olor: Liquido
incoloro de olor penetrante
Punto de ebullición: 184°C
Rata oral LD50: 250 mg /
Punto de fusión: -6°C
kg
Densidad relativa (agua = 1):
1,02
Conejo piel LD50: 820
Anilina Solubilidad en agua, g/100 ml a
mg/kg
20°C: 3,4
Presión de vapor, Pa a 20°C: Salud:3
Ratones inhalación LC50 Inflamabilidad:2
40
175 ppm por 7 horas. Reactividad:0
Densidad relativa de vapor (aire =
1): 3,2
C6H5NH2
Solubre en agua
Estado físico, color y olor: Liquido
incoloro con olor a vinagre
Oral (LD-50) 1780 mg/Kg
Punto de ebullición: 139°C
(rata)
Punto de fusión: -73°C
Anhidrido Dermal (LD-50) 4000
Densidad relativa (agua = 1): 1,08
acetico mg/Kg (conejo)
Solubilidad en agua: reacciona
Inhalativa (LC-50/4h) Salud:3
(CH3CO)2O Presión de vapor, kPa a 20°C: 0,5
1000 ppm/4h (rata) Inflamabilidad:2
Densidad relativa de vapor (aire =
1): 3,5 Reactividad:0
Estado físico, color y olor:
solidonblanco inodoro
Punto de fusión 114,3 ° C
Punto de ebullición 304 ° C
pH 6-7 Oral (LD-50) 800 mg / kg
Acetanilida
Densidad relativa de vapor (rata).
(aire=1) 4,65
Salud:2
CH3CONHC6H Densidad relativa (agua=1) 1,219 Inflamabilidad:1
5 Solubilidad en agua 1g/185 mL de Reactividad:0
agua
REFERENCIAS
Smith, L. & Cristol, L. (1975). Química Orgánica. Barcelona: Reverté.
Macy, R. (1992). Química Orgánica Simplificada. Barcelona: Reverté.
Solomons, T. (2007) Química Orgánica. México: Limusa.
Wade, L. (2011) Química Orgánica. Volumen 2. 7a. ed México: Pearson. pp. 980-1002
McMurry, J. (2008) Química Orgánica 7a. ed México: Cencage. pp. 680-707
También podría gustarte
- Pastorela Fiesta en El CieloDocumento11 páginasPastorela Fiesta en El CieloLiLiana Niño67% (6)
- Carácter Social de La MoralDocumento3 páginasCarácter Social de La MoralEstefa Sandoval71% (7)
- Manejo Integrado Del Cultivo de Pitahaya en EcuadorDocumento41 páginasManejo Integrado Del Cultivo de Pitahaya en EcuadorFernanda Romero Blacio67% (3)
- Reporte Practica 3Documento5 páginasReporte Practica 3Daniel OlveraAún no hay calificaciones
- Reporte FurfuralDocumento9 páginasReporte FurfuralMary FallAún no hay calificaciones
- p1 Obtencion Del Epoxido de MenadionaDocumento6 páginasp1 Obtencion Del Epoxido de MenadionadanielAún no hay calificaciones
- Extracción de Glucógeno en Hígado de RatónDocumento8 páginasExtracción de Glucógeno en Hígado de RatónJulio GLAún no hay calificaciones
- Guia de Campo de Algunas Especies de Anf PDFDocumento140 páginasGuia de Campo de Algunas Especies de Anf PDFLuisAlbertoHigueraAún no hay calificaciones
- Practica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaDocumento2 páginasPractica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaJackCrack1221Aún no hay calificaciones
- Reporte MenadionaDocumento5 páginasReporte MenadionaRodary Dymarcuz100% (6)
- Bioorganica EncbDocumento2 páginasBioorganica EncbCassie Flores0% (1)
- DibenzalacetonaDocumento7 páginasDibenzalacetonaCarlos Santiago100% (1)
- p10 0 PDFDocumento4 páginasp10 0 PDFmonmo100% (2)
- Sintesis de La AcetanilidaDocumento6 páginasSintesis de La AcetanilidaBetzaBa2633% (3)
- BenzoínaDocumento13 páginasBenzoínadany_289Aún no hay calificaciones
- Previo Práctica 3 2-NitrotiofenoDocumento25 páginasPrevio Práctica 3 2-NitrotiofenoJonathan JacomeAún no hay calificaciones
- Previo Ácido FenoxiacéticoDocumento6 páginasPrevio Ácido FenoxiacéticoJosh Tapia Muciño100% (1)
- AcetanilidaDocumento7 páginasAcetanilidaLiLiana Niño100% (1)
- PREVIO6 PnitroanilinaDocumento7 páginasPREVIO6 PnitroanilinaLiLiana Niño100% (1)
- Previo HidantoínasDocumento9 páginasPrevio HidantoínasUriel RamosAún no hay calificaciones
- Qoiii Rep 01 MenadionaDocumento2 páginasQoiii Rep 01 MenadionaFrancisco QuirozAún no hay calificaciones
- Esterificación de Fischer Practica 10Documento4 páginasEsterificación de Fischer Practica 10Carlos Daniel Sarabia CienfuegosAún no hay calificaciones
- Previo 6 Sintesis de Hantzsch para PiridinasDocumento3 páginasPrevio 6 Sintesis de Hantzsch para PiridinasJulio Cesar Venegas Muñoz50% (2)
- Reporte 5 PirazolonasDocumento4 páginasReporte 5 PirazolonasAnonymous enA4SSAún no hay calificaciones
- Previo 2 NitrotiofenoDocumento4 páginasPrevio 2 NitrotiofenoAngelicaBaezAún no hay calificaciones
- Reacción de Claisen SchmidtDocumento3 páginasReacción de Claisen SchmidtKimberly TorresAún no hay calificaciones
- Ácido PícricoDocumento2 páginasÁcido PícricoViiry Salazar75% (4)
- Reporte 2Documento6 páginasReporte 2GabrielVazquezOlvera100% (1)
- Práctica 9 - BenciloDocumento4 páginasPráctica 9 - BenciloBrigitteMoran0% (1)
- Previo 4 Q O III PirrolDocumento4 páginasPrevio 4 Q O III PirrolAngel ZurielAún no hay calificaciones
- Previo BenciloDocumento6 páginasPrevio BenciloHeber Daniel Andrade Rivera100% (1)
- Reporte 1 Difenil CarbinolDocumento4 páginasReporte 1 Difenil Carbinolgancho2010Aún no hay calificaciones
- Reporte DibenzalacetonaDocumento2 páginasReporte DibenzalacetonaluisAún no hay calificaciones
- Previo 10 Acido BencilicoDocumento5 páginasPrevio 10 Acido BencilicospellfloresAún no hay calificaciones
- Practica 2Documento4 páginasPractica 2IvanAún no hay calificaciones
- Dibenzalacetona PracticaDocumento4 páginasDibenzalacetona PracticaBrayan Efrain Orozco SoteloAún no hay calificaciones
- (REPORTE) Práctica #2 Síntesis de DibenzalacetonaDocumento3 páginas(REPORTE) Práctica #2 Síntesis de DibenzalacetonaVanesa Cx SlumberAún no hay calificaciones
- Sintesis de AcetanilidaDocumento5 páginasSintesis de AcetanilidaKaláshnikov MalkavianAún no hay calificaciones
- Obtención Del Furfural y Reacción de CannizzaroDocumento5 páginasObtención Del Furfural y Reacción de CannizzaroYeraldim LopezAún no hay calificaciones
- Practica 12 y Ensayos para Proteinas y AminoacidosDocumento2 páginasPractica 12 y Ensayos para Proteinas y AminoacidosElCaballero Modesto0% (1)
- NitrotiofenoDocumento3 páginasNitrotiofenoGaby RodriguezAún no hay calificaciones
- Practica 8Documento6 páginasPractica 8Rob HBAún no hay calificaciones
- Practica 11Documento3 páginasPractica 11Kimberly TorresAún no hay calificaciones
- Práctica No. 1 Síntesis de Furfural-Suárez Martínez Jeisel Aurora PDFDocumento11 páginasPráctica No. 1 Síntesis de Furfural-Suárez Martínez Jeisel Aurora PDFjeiselllaAún no hay calificaciones
- Bioorganica 3Documento5 páginasBioorganica 3Denisse CoortAún no hay calificaciones
- Previo 5 Q.O IIIDocumento2 páginasPrevio 5 Q.O IIIMichell Maximiliano Santillan HerrejonAún no hay calificaciones
- Cuestionario Previo 16 BenciloDocumento5 páginasCuestionario Previo 16 BenciloDavid AquinoAún no hay calificaciones
- Previo 10Documento6 páginasPrevio 10Carlos CastilloAún no hay calificaciones
- Previo - Obtención Del Ácido PicricoDocumento15 páginasPrevio - Obtención Del Ácido PicricoDisco17Aún no hay calificaciones
- Previo 2-NitrotiofenoDocumento5 páginasPrevio 2-NitrotiofenoEdgar Armando100% (5)
- Previo 7 Bioquimica .1Documento7 páginasPrevio 7 Bioquimica .1MisaelAún no hay calificaciones
- Previo-2-Fenil-Indol Autor: Patricio A. M.Documento7 páginasPrevio-2-Fenil-Indol Autor: Patricio A. M.Patricio ArreolaAún no hay calificaciones
- Condensación de Knoevenagel QuimicaDocumento8 páginasCondensación de Knoevenagel QuimicaFernanda Garcia HernandezAún no hay calificaciones
- Practica 1 Sintesis de Acido Picrico y Tincion PDFDocumento4 páginasPractica 1 Sintesis de Acido Picrico y Tincion PDFalejandroAún no hay calificaciones
- AzocompuestosDocumento11 páginasAzocompuestosIsabel Centeno100% (1)
- Bencilo ReporteDocumento2 páginasBencilo ReporteDavid Ramirez50% (2)
- BenciloDocumento3 páginasBenciloLily LeroAún no hay calificaciones
- Investigacion Previa BenciloDocumento2 páginasInvestigacion Previa BenciloEve TenorioAún no hay calificaciones
- 2 Síntesis de Alcohol Bencílico y Ácido BenzoicoDocumento3 páginas2 Síntesis de Alcohol Bencílico y Ácido BenzoicoBren CooperAún no hay calificaciones
- 2 Nitro TiofenoDocumento7 páginas2 Nitro TiofenoAngel HernándezAún no hay calificaciones
- DIBENZALACETONADocumento7 páginasDIBENZALACETONACrash TinocoAún no hay calificaciones
- Sintesis de para NitroanilinaDocumento3 páginasSintesis de para Nitroanilinakory_sc100% (5)
- Previo BenciloDocumento6 páginasPrevio BenciloPepe AngelesAún no hay calificaciones
- Informe Lab Biomoleculas.Documento13 páginasInforme Lab Biomoleculas.Anggy KathyuskaAún no hay calificaciones
- Reporte 1. Equipo 6Documento9 páginasReporte 1. Equipo 6LiLiana NiñoAún no hay calificaciones
- Cuadernillo Aparatos y Sistemas-Profa KempisDocumento21 páginasCuadernillo Aparatos y Sistemas-Profa KempisLiLiana NiñoAún no hay calificaciones
- Cte 1 Oct 22-23Documento39 páginasCte 1 Oct 22-23LiLiana NiñoAún no hay calificaciones
- Semana2 PLANIFICACIÓN 6°Documento7 páginasSemana2 PLANIFICACIÓN 6°LiLiana NiñoAún no hay calificaciones
- Niño Orozco Jose Javier Sistema de Secreción III Attaching and Effacing 1651Documento20 páginasNiño Orozco Jose Javier Sistema de Secreción III Attaching and Effacing 1651LiLiana NiñoAún no hay calificaciones
- Exposicion Equipo1 Citotox Solventes 1002Documento16 páginasExposicion Equipo1 Citotox Solventes 1002LiLiana NiñoAún no hay calificaciones
- 1-5 de Marzo 1° C LiliDocumento12 páginas1-5 de Marzo 1° C LiliLiLiana NiñoAún no hay calificaciones
- 14 - 18 de Junio 1° C LILIDocumento11 páginas14 - 18 de Junio 1° C LILILiLiana NiñoAún no hay calificaciones
- Rep4 HPLC Eq3 2501Documento8 páginasRep4 HPLC Eq3 2501LiLiana NiñoAún no hay calificaciones
- Infografía - SistemaInmune - 1652Documento1 páginaInfografía - SistemaInmune - 1652LiLiana NiñoAún no hay calificaciones
- Obtención Halogenuros de AlquiloDocumento6 páginasObtención Halogenuros de AlquiloLiLiana NiñoAún no hay calificaciones
- Rally EvaluaciónDocumento5 páginasRally EvaluaciónLiLiana NiñoAún no hay calificaciones
- Formato Tareas Evaluativas (Primaria) )Documento6 páginasFormato Tareas Evaluativas (Primaria) )LiLiana NiñoAún no hay calificaciones
- DifenilcarbinolDocumento5 páginasDifenilcarbinolLiLiana NiñoAún no hay calificaciones
- TDAH Estrategias para MatematicasDocumento8 páginasTDAH Estrategias para MatematicasLiLiana NiñoAún no hay calificaciones
- Rotafolio - Módulo 7 Cuidado en El Uso de Maquinas y HerramientasDocumento8 páginasRotafolio - Módulo 7 Cuidado en El Uso de Maquinas y HerramientasYessica danielaAún no hay calificaciones
- Cardiopatia IsquemicaDocumento45 páginasCardiopatia IsquemicaFran Burga BecerraAún no hay calificaciones
- Guion Sobre La Responsabilidad Del AuditorDocumento10 páginasGuion Sobre La Responsabilidad Del Auditorseguridadtrabajo PabonAún no hay calificaciones
- Fregadero - Instalacion PDFDocumento2 páginasFregadero - Instalacion PDFCarlosAún no hay calificaciones
- Infografia Sexualidad AdolescenteDocumento1 páginaInfografia Sexualidad AdolescenteRaquel YddAún no hay calificaciones
- El Comercio VenezolanoDocumento3 páginasEl Comercio VenezolanoKeylingAún no hay calificaciones
- Biologia PreguntasDocumento7 páginasBiologia PreguntasMaria KleroAún no hay calificaciones
- (Opa LRVV) Igss - 1948 2014Documento182 páginas(Opa LRVV) Igss - 1948 2014claudiaAún no hay calificaciones
- Crianza y Comercialización de Cerdos PPT - Ultimo - LUCERO HUAMANI SALAZARDocumento27 páginasCrianza y Comercialización de Cerdos PPT - Ultimo - LUCERO HUAMANI SALAZARLucerito Huamani Salazar100% (1)
- Libreta M 3 VERONICADocumento15 páginasLibreta M 3 VERONICAGilberto Fabián Rivera ReyesAún no hay calificaciones
- Semana 10Documento8 páginasSemana 10FabricioVillamarinAún no hay calificaciones
- Termografía: Un Aliado Eficaz en La Detección de Fallas IndustrialesDocumento1 páginaTermografía: Un Aliado Eficaz en La Detección de Fallas Industrialesjuan marquezAún no hay calificaciones
- Megaciudades y Contaminacion AtmosfericaDocumento54 páginasMegaciudades y Contaminacion AtmosfericaFrancisco RodríguezAún no hay calificaciones
- Actividad Radio de Matemática-S8-2do 27-05-2020Documento4 páginasActividad Radio de Matemática-S8-2do 27-05-2020Heber CusiAún no hay calificaciones
- Pdfs Del Modulo 4Documento172 páginasPdfs Del Modulo 4Laura FernandezAún no hay calificaciones
- Moniliophthora RoreriDocumento22 páginasMoniliophthora RoreriRina Panihuara LeivaAún no hay calificaciones
- Monogv 5. Derrames Pleurales InfecciososDocumento25 páginasMonogv 5. Derrames Pleurales Infecciososdavid diazAún no hay calificaciones
- 12.trabajos en CalienteDocumento20 páginas12.trabajos en CalienteDavid Diaz CapitanAún no hay calificaciones
- COLEDOCOLITIASISDocumento4 páginasCOLEDOCOLITIASISIngrid del valleAún no hay calificaciones
- Caso Clinico CoquelucheDocumento8 páginasCaso Clinico CoquelucheBlanca De GonzalezAún no hay calificaciones
- Estadistica para Los NegociosDocumento29 páginasEstadistica para Los NegociosAndres Manuel LopezAún no hay calificaciones
- Conflictos LaboralesDocumento3 páginasConflictos LaboralesImpresiones RapidasAún no hay calificaciones
- Ciclo Joule en Turbina A Gas 1Documento3 páginasCiclo Joule en Turbina A Gas 1Belen HaroAún no hay calificaciones
- Algas Verdes TerminadoDocumento7 páginasAlgas Verdes TerminadoEdison T MoyoAún no hay calificaciones
- 53-Pancreatitia AgudaDocumento12 páginas53-Pancreatitia AgudaGuilherme LeeiteAún no hay calificaciones
- K - L - Guía Práctica #04Documento7 páginasK - L - Guía Práctica #04Leslie SanchezAún no hay calificaciones
- Anuario Institucional IECS Argentina - 2017 (Castellano)Documento52 páginasAnuario Institucional IECS Argentina - 2017 (Castellano)Instituto de Efectividad Clínica y SanitariaAún no hay calificaciones