0% encontró este documento útil (0 votos)
746 vistas7 páginas2 Nitro Tiofeno
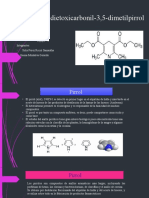
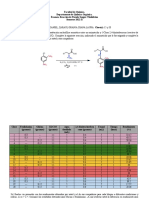
Este documento describe un experimento de laboratorio para estudiantes de farmacia en la Universidad Nacional Autónoma de México. El objetivo es ejemplificar reacciones de sustitución electrofílica aromática en sistemas heterocíclicos como el tiofeno. El experimento involucra la nitración del tiofeno para producir 2-nitrotiofeno. Se discuten las propiedades químicas y aplicaciones medicinales potenciales de los compuestos derivados del tiofeno.
Cargado por
Angel HernándezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
746 vistas7 páginas2 Nitro Tiofeno
Este documento describe un experimento de laboratorio para estudiantes de farmacia en la Universidad Nacional Autónoma de México. El objetivo es ejemplificar reacciones de sustitución electrofílica aromática en sistemas heterocíclicos como el tiofeno. El experimento involucra la nitración del tiofeno para producir 2-nitrotiofeno. Se discuten las propiedades químicas y aplicaciones medicinales potenciales de los compuestos derivados del tiofeno.
Cargado por
Angel HernándezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd