Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Eficiencia de inmovilización de β amilasa en Celite
Eficiencia de inmovilización de β amilasa en Celite
Cargado por
Jhoana Falcon0 calificaciones0% encontró este documento útil (0 votos)
4 vistas2 páginasTítulo original
Eficiencia de inmovilización de β amilasa en Celite.docx
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
4 vistas2 páginasEficiencia de inmovilización de β amilasa en Celite
Eficiencia de inmovilización de β amilasa en Celite
Cargado por
Jhoana FalconCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
Eficiencia de inmovilización de β amilasa en Celite-545
• El presente estudio implica la inmovilización directa de β-amilasa parcialmente
purificada de I. batata en un soporte económico, Celite-545. Por lo tanto, el costo de la
purificación enzimática se minimiza. Celite-545 es una tierra de diatomeas inorgánica
mecánicamente estable, no tóxica y no biodegradable que se ha utilizado ampliamente
para inmovilizar diversas enzimas y proteínas. La unión de la β amilasa al soporte se
vio significativamente afectada por el cambio en el pH. La enzima se adsorbió al
máximo a un pH de 6.0 y retuvo 244 U de la actividad de la β-amilasa g-1 de Celite-545
con 83% de actividades preservadas (Tabla 1). En la literatura, para la β-amilasa
inmovilizada, se dan varios valores para las capacidades de unión y las actividades
preservadas. Por ejemplo, cuando se logró la inmovilización de la β-amilasa de batata
en perlas de quitosano y soporte basado en esferón, las actividades preservadas se
informaron como 59% y 76%, respectivamente. Además, se observó un 49% de
eficiencia inmovilizada al inmovilizar la β-amilasa de cebada en el polímero de
poliacrilamida.
http://www.chemik.com.mx/descargas/Triptico_Celite.pdf
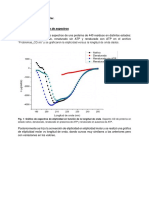
Análisis espectroscopía infrarroja de transformada de Fourier FT-IR
Los espectros FT-IR de Celite-545 y Celite-545 adsorbido β-amilasa se utilizan para investigar la
interacción entre la enzima y el soporte (Fig. 1).
• El pico de intensidad principal a 1079.63 cm-1 se debe a la vibración de estiramiento
asimétrica de Si-O-Si de Celite-545.
• La banda a 791.57 cm-1 se atribuye al estiramiento simétrico de la estructura del anillo
de tetraedros (SiO) 4 .
• La vibración de H2O causada por los enlaces de hidrógeno de la proteína con los
grupos de silanol se presenta en 1639.48 cm-1.
• Además, el pico a 3362.70 cm-1 debido al estiramiento de C-H indicó fuertes
interacciones de enzima con Celite-545.
• El pico de intensidad de la vibración de estiramiento de Si-O-Si a 1079.63 cm-1 se
redujo a 1074.20 cm-1 cuando la enzima se adsorbió a la superficie de soporte.
Análisis AFM Fuerza atómica microscópica
• La visualización de la topografía de la superficie del soporte y la enzima adsorbida con
AFM reveló una cantidad significativa de moléculas de enzima inmovilizadas en el
soporte (Fig. 2). Los grupos funcionales existentes en la superficie Celite-545 también
se verificaron mediante espectroscopía FT-IR. Utilizamos la distancia de pico a valle en
estas imágenes como un indicador de la rugosidad de la superficie. La superficie de
soporte, antes de la inmovilización de la β-amilasa, era lisa (Fig. 2a), en comparación
con las superficies inmovilizadas con enzimas. Es evidente que a medida que avanza la
inmovilización aumenta la rugosidad de la superficie de soporte, lo que podría verse
por el aumento del valor de pico a valle (Fig. 2b). La rugosidad de la superficie de la
muestra es una característica importante y debe jugar un papel importante en la
actividad enzimática. Esta observación es consistente con las de informes anteriores.
También podría gustarte
- Prac 5 Fierro CuantiDocumento3 páginasPrac 5 Fierro Cuantioswaldo hernandez100% (1)
- Ciclo de La UreaDocumento13 páginasCiclo de La UreaJefferson Córdoba0% (1)
- Amilasa PDFDocumento4 páginasAmilasa PDFXimenaAún no hay calificaciones
- Inta Maiz GuanoDocumento7 páginasInta Maiz GuanoFavio ReAún no hay calificaciones
- Método de PurificaciónDocumento3 páginasMétodo de PurificaciónRicardo Alvarado RodríguezAún no hay calificaciones
- Clase Práctica No.10 Cap. I. Proteinas-2Documento4 páginasClase Práctica No.10 Cap. I. Proteinas-2Aiden PalafoxAún no hay calificaciones
- Documents - MX Cinetica Enzimatica Ejercicios ResueltosDocumento26 páginasDocuments - MX Cinetica Enzimatica Ejercicios ResueltosSebastian Rubat100% (1)
- Documento para SuscripciónDocumento348 páginasDocumento para SuscripciónSamy Alexis Rodriguez AAún no hay calificaciones
- TALODURADocumento15 páginasTALODURAAriel LopezAún no hay calificaciones
- Laboratorio FavinasDocumento5 páginasLaboratorio FavinasNicole Bernard100% (1)
- Informe Práctica 3 BioquímicaDocumento7 páginasInforme Práctica 3 BioquímicaJUAN DANIEL RUELAS HUAMANAún no hay calificaciones
- Estructura de Proteínas y EnzimasDocumento7 páginasEstructura de Proteínas y Enzimascbaracatt1Aún no hay calificaciones
- 26-Metabolismo Proteico en RumiantesDocumento6 páginas26-Metabolismo Proteico en RumiantesSthla PerezAún no hay calificaciones
- ALEACIONES Al-Si-Cu-Fe - RELACIÓN ENTRE EL ESPACIADO DE BRAZOS DENDRÍTICOS Y EL TAMAÑO DE LA FASE INTERMETÁLICA β−Al5FeSiDocumento7 páginasALEACIONES Al-Si-Cu-Fe - RELACIÓN ENTRE EL ESPACIADO DE BRAZOS DENDRÍTICOS Y EL TAMAÑO DE LA FASE INTERMETÁLICA β−Al5FeSijesus00158Aún no hay calificaciones
- Reporte Fed-BatchDocumento12 páginasReporte Fed-Batchalejandro dcdcAún no hay calificaciones
- 4000 Control Del Proceso Flotación Rev00Documento70 páginas4000 Control Del Proceso Flotación Rev00Rene Ccolque HuillcaAún no hay calificaciones
- Actividad UreasicaDocumento2 páginasActividad UreasicaStefany Cadena BaronAún no hay calificaciones
- Tema 10 Metabolismo Del NitrogenoDocumento6 páginasTema 10 Metabolismo Del Nitrogenofabricio85mgzAún no hay calificaciones
- Propiedades y Aplicaciones de Las Enzimas Alpha Amylase-Hidrolisis AlmidonDocumento12 páginasPropiedades y Aplicaciones de Las Enzimas Alpha Amylase-Hidrolisis AlmidonANGIE ARLETTE HIDALGO APAZAAún no hay calificaciones
- Practicas 1 y 2 Quimica AnaliticaDocumento6 páginasPracticas 1 y 2 Quimica AnaliticaJorge RamirezAún no hay calificaciones
- Guia 4-Enzimas ResueltaDocumento4 páginasGuia 4-Enzimas ResueltaRocioAún no hay calificaciones
- TPA #2 EnzimasDocumento14 páginasTPA #2 Enzimassantiago jofreAún no hay calificaciones
- Ejercicios EnzimoDocumento10 páginasEjercicios EnzimoJenny S-boomAún no hay calificaciones
- Cinética EnzimáticaDocumento17 páginasCinética EnzimáticaGianny SRAún no hay calificaciones
- Reporte Práctica 3 ProteínasDocumento8 páginasReporte Práctica 3 ProteínasLyn XajilAún no hay calificaciones
- Actvidad Unidad VIDocumento10 páginasActvidad Unidad VIYair CasarrubiasAún no hay calificaciones
- Cinetica LactasaDocumento122 páginasCinetica LactasaalvarezriAún no hay calificaciones
- Taller 7b Proteínas 2022 ResoluciónDocumento6 páginasTaller 7b Proteínas 2022 Resoluciónjuanita mendezAún no hay calificaciones
- Examen FinalDocumento14 páginasExamen FinalFrank Raul GomezAún no hay calificaciones
- Informe de EnzimasDocumento8 páginasInforme de EnzimasJorge RosalesAún no hay calificaciones
- Informe 10. CBHE Y EOJE. 3IV1Documento4 páginasInforme 10. CBHE Y EOJE. 3IV1Horus Emanuel Castillo BrionesAún no hay calificaciones
- CINETICA ENZIMATICA 2013 EnzimologiaDocumento38 páginasCINETICA ENZIMATICA 2013 EnzimologiaJosé Luis Yareta YaretaAún no hay calificaciones
- Práctica II TransiciónAlcalinaCitcDocumento3 páginasPráctica II TransiciónAlcalinaCitcPablo Espejo HijanoAún no hay calificaciones
- Clase Tema 5a BiocatalisisDocumento86 páginasClase Tema 5a BiocatalisisArianaRiosAún no hay calificaciones
- Pba de Carga EjemploDocumento4 páginasPba de Carga EjemploAlejandro GarcíaAún no hay calificaciones
- Dicroismo Circular2018Documento8 páginasDicroismo Circular2018Ariel Pinto MarchantAún no hay calificaciones
- Actividad de La Enzima CatalasaDocumento2 páginasActividad de La Enzima CatalasaNick Renzo Barzola YauceAún no hay calificaciones
- Proyecto Procesos Microbiologicos.Documento31 páginasProyecto Procesos Microbiologicos.Juan Sebastian Orozco GomezAún no hay calificaciones
- Informe 4 Actividad EnzimaticaDocumento8 páginasInforme 4 Actividad EnzimaticaAnniee FelizAún no hay calificaciones
- Produccion Furfural Cascarilla ArrozDocumento3 páginasProduccion Furfural Cascarilla ArrozHenry MezaJavAún no hay calificaciones
- Lipasas PapeleriaDocumento5 páginasLipasas PapeleriaAntonio Marques GutierrezAún no hay calificaciones
- Regulación Genética en El Operón Lac Corregido 1Documento4 páginasRegulación Genética en El Operón Lac Corregido 1Miguel RivasAún no hay calificaciones
- Cuestionario Sección 5Documento3 páginasCuestionario Sección 5Angela HernandezAún no hay calificaciones
- Cinetica Enzimatica Ejercicios ResueltosDocumento30 páginasCinetica Enzimatica Ejercicios ResueltosAndres Suarez100% (1)
- Coloquio 5Documento13 páginasColoquio 5Alex AlustizaAún no hay calificaciones
- Actividad 2 BioquimicaDocumento4 páginasActividad 2 BioquimicaMelissa MarulandaAún no hay calificaciones
- Problemas Aqf Tema7 Inhibicion 19may13Documento4 páginasProblemas Aqf Tema7 Inhibicion 19may13Juan Gabriel FernándezAún no hay calificaciones
- Plantilla Informes Laboratorio de Bioquímica 2022-1SDocumento19 páginasPlantilla Informes Laboratorio de Bioquímica 2022-1SMafe LopezAún no hay calificaciones
- Experimento 8 Lisozima 06-04Documento20 páginasExperimento 8 Lisozima 06-04rominagriseldaAún no hay calificaciones
- Tema 3 EnzimasDocumento8 páginasTema 3 EnzimasPercy Julio Sanchez VasquezAún no hay calificaciones
- Enzimología Tema 3Documento31 páginasEnzimología Tema 3pabloAún no hay calificaciones
- Estudio de ReferenciaDocumento7 páginasEstudio de ReferenciaGerson OrtegaAún no hay calificaciones
- Cuestiones 4Documento5 páginasCuestiones 4Polet BarrionuevoAún no hay calificaciones
- Práctico de Bioquímica 1. Purificación de Lisozima Por Cromatografía de Intercambio IónicoDocumento10 páginasPráctico de Bioquímica 1. Purificación de Lisozima Por Cromatografía de Intercambio IónicoAlejo MuñizAún no hay calificaciones
- Reporte2 Eq1Documento6 páginasReporte2 Eq1Natalie MoreAún no hay calificaciones
- Informe de Producto Quitina Completo (Autoguardado)Documento6 páginasInforme de Producto Quitina Completo (Autoguardado)Daniel Jahdai Bejerano100% (1)
- Practica 03 - Proteinas IiDocumento8 páginasPractica 03 - Proteinas IiXio Xio HuaytaAún no hay calificaciones
- Lab Cultivo LevadurasDocumento15 páginasLab Cultivo LevadurasLeydi Vanessa GBAún no hay calificaciones
- ELECTRICIDADDocumento2 páginasELECTRICIDADfernandoAún no hay calificaciones
- Actiidad Proteolitica de FicinaDocumento3 páginasActiidad Proteolitica de FicinaYaot GuerreroAún no hay calificaciones
- Ensayo Metabolitos MarinosDocumento2 páginasEnsayo Metabolitos MarinosJhoana FalconAún no hay calificaciones
- La Bolsa de Valores de QuitoDocumento8 páginasLa Bolsa de Valores de QuitoJhoana FalconAún no hay calificaciones
- Acrilamida en Papas FritasDocumento6 páginasAcrilamida en Papas FritasJhoana FalconAún no hay calificaciones
- Curso Escalado1Documento30 páginasCurso Escalado1Jhoana FalconAún no hay calificaciones
- RetrotransposonesDocumento7 páginasRetrotransposonesJhoana FalconAún no hay calificaciones
- Biol Fertilizante Orgánico FinalDocumento39 páginasBiol Fertilizante Orgánico FinalJhoana FalconAún no hay calificaciones
- Practica de Laboratorio Del HemocitometroDocumento8 páginasPractica de Laboratorio Del HemocitometroJhoana FalconAún no hay calificaciones
- Pruebas de Esterilización InformeDocumento3 páginasPruebas de Esterilización InformeJhoana FalconAún no hay calificaciones
- Hibridaciones Luis CigarroaDocumento5 páginasHibridaciones Luis CigarroaMega DroidAún no hay calificaciones
- Sistema TernarioDocumento6 páginasSistema TernarioBelen OrtizAún no hay calificaciones
- Coguanor Ngo 29 014 h8 1a Revisión - Aguas DqoDocumento28 páginasCoguanor Ngo 29 014 h8 1a Revisión - Aguas Dqomarilis111Aún no hay calificaciones
- Dosis Del Hipoclorito de Sodio Utilizado para DesinfectarDocumento1 páginaDosis Del Hipoclorito de Sodio Utilizado para DesinfectarJAIME ANDRES MEJIA GALINDOAún no hay calificaciones
- Experiencia de EduardDocumento2 páginasExperiencia de EduardkontoonyAún no hay calificaciones
- 5 LípidosDocumento24 páginas5 LípidosAriel LeivaAún no hay calificaciones
- Familia Del HierroDocumento9 páginasFamilia Del HierroRosa Sotelo HernándezAún no hay calificaciones
- La Etapa de Flotación y Su EquipoDocumento2 páginasLa Etapa de Flotación y Su Equiporoy iñigoAún no hay calificaciones
- Act 7Documento11 páginasAct 7cristian lopezAún no hay calificaciones
- Segundo Informe de LaboratorioDocumento32 páginasSegundo Informe de LaboratorioJose Luis Gomez Huamani100% (3)
- Informe LaboratorioDocumento12 páginasInforme Laboratoriosarah chavesAún no hay calificaciones
- El AceroDocumento12 páginasEl AceroGola ZooAún no hay calificaciones
- Jabon LiquidoDocumento15 páginasJabon LiquidoEdwinCalderonMora100% (3)
- Primer Examen Parcial-6Documento6 páginasPrimer Examen Parcial-6Ernesto Moises Garnica TrejoAún no hay calificaciones
- QO3 BenciloDocumento4 páginasQO3 BenciloEdrian Bernal Edrian BernalAún no hay calificaciones
- Bronc EsDocumento10 páginasBronc EsÁlvaro_cayetanoAún no hay calificaciones
- Caterpillar 3500Documento32 páginasCaterpillar 3500Steve da RiviaAún no hay calificaciones
- Tipos de Gases ContaminantesDocumento3 páginasTipos de Gases Contaminantescristian cuaspaAún no hay calificaciones
- Aglomerantes 2 - Resumen 4 EdsonDocumento3 páginasAglomerantes 2 - Resumen 4 EdsonJuan Pablo Chavarria CabanillasAún no hay calificaciones
- Proceso de Fabricación Del CementoDocumento4 páginasProceso de Fabricación Del CementoJose MoroccoCallohuancaAún no hay calificaciones
- ACIDO MuriaticoDocumento6 páginasACIDO MuriaticoAlejandro Polo VasquezAún no hay calificaciones
- P1Documento8 páginasP1Gabriel AltamiranoAún no hay calificaciones
- Curso Basico GLP - GNVDocumento83 páginasCurso Basico GLP - GNVmcajahuancaAún no hay calificaciones
- Cuestionario 1 Ciclo 3Documento20 páginasCuestionario 1 Ciclo 3JIMMY FERNANDO RIOFRIO POGOAún no hay calificaciones
- 5857 CrucigramaDocumento5 páginas5857 CrucigramaIrvin Guatemala SolisAún no hay calificaciones
- EXPEDIENTE PTAPotableDocumento31 páginasEXPEDIENTE PTAPotableskullkAún no hay calificaciones
- PDF Analisis de Fosforo Soluble CompressDocumento4 páginasPDF Analisis de Fosforo Soluble CompressAlejandro Rodriguez ZentenoAún no hay calificaciones
- Pruebas de Acceso A La Universidad para Alumnos de Bachillerato Logse (Plan 2002) Septiembre 2007 QuímicaDocumento2 páginasPruebas de Acceso A La Universidad para Alumnos de Bachillerato Logse (Plan 2002) Septiembre 2007 QuímicaalfonsocerezoAún no hay calificaciones
- Bioqui A Inf3Documento15 páginasBioqui A Inf3Cevallos WilmerAún no hay calificaciones