Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Equilibrio de Fases
Cargado por
JudithDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Equilibrio de Fases
Cargado por
JudithCopyright:
Formatos disponibles
Diagrama de fase
Ir a la navegaciónIr a la búsqueda
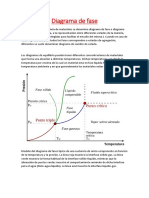
Modelo del diagrama de fases típico de una sustancia de único componente en función de la
temperatura y la presión. La línea roja muestra la interfase sólido-gas. La línea verde muestra la forma
habitual de la interfase sólido-líquido, mientras que la alineación de puntos verdes muestra el
comportamiento anómalo de dicha interfase para el agua (hielo-agua líquida). La línea azul muestra la
interfase líquido-gas.
En termodinámica y ciencia de materiales se denomina diagrama de fase o diagrama de
estados de la materia, a la representación entre diferentes estados de la materia, en función
de variables elegidas para facilitar el estudio del mismo.1 Cuando en una de estas
representaciones todas las fases corresponden a estados de agregación ,diferentes se suele
denominar diagrama de cambio de estado.
Los diagramas de equilibrio pueden tener diferentes concentraciones de materiales que forma
una aleación a distintas temperaturas. Dichas temperaturas van desde la temperatura por
encima de la cual un material está en fase líquida hasta la temperatura ambiente y en que
generalmente los materiales están en estado sólido.
Índice
1Diferentes diagramas de equilibrio
2Diagrama de fase de una sustancia pura
3Diagrama de fase binario
4Relación entre las propiedades y el diagrama de fases en una aleación
5Véase también
6Referencias
7Enlaces externos
Diferentes diagramas de equilibrio[editar]
Estos son todos aquellos a los que los diagramas de equilibrio mas sencillos son los de
presión-temperatura esta es una sustancia pura, como puede ser el del agua. En el eje de
ordenadas se coloca la presión y en el de abscisas la temperatura. Generalmente, para una
presión y temperatura dadas, el cuerpo presenta una única fase excepto en las siguientes
zonas:
Punto triple: En este punto del diagrama coexisten los estados sólido, líquido y gaseoso.
Estos puntos tienen cierto interés, ya que representan un invariante y por lo tanto se
pueden utilizar para calibrar termómetros.
Dos metales (A, B) a temperaturas superiores a sus respectivos puntos de fusión (TA, TB) se
encuentran en estado líquido pudiéndose disolver y conformar así una fase única líquida. Esto
quiere decir que no podemos establecer diferencias de comportamiento u observación entre
las distintas partes del líquido y que los metales en las proporciones mezcladas tienen la
propiedad de miscibilidad. Si la mezcla líquida, XA + XB, la sometemos a un proceso de
solidificación, mediante enfriamiento, llegamos a obtener el producto que se denomina
aleación de los metales A y B.
Es conocido que las aleaciones mejoran las características de los metales puros. Realmente
debería decirse que introducen variables que diferencian el comportamiento de los metales
puros que las componen, porque en algunas circunstancias pueden perjudicar sus
propiedades. Obviamente, conformar una aleación es uno de los medios más primitivos que la
ingeniería ha dispuesto para actuar sobre las propiedades de los metales puros, incluso
históricamente la aleación es predecesora como lo justifica el bronce, Edad del bronce
En ciencia de materiales se utilizan ampliamente los diagramas de fase binarios, mientras que
en termodinámica se emplean sobre todo los diagramas de fase de una sustancia pura.
Diagrama de fase de una sustancia pura[editar]
Existen diferentes diagramas según los materiales, sean totalmente solubles en estado sólido
y líquido, o sea miscibles, o que sean insolubles. También pueden darse casos particulares.
Uno de los diagramas de equilibrio más clásico es el de los aceros que tiene particularidades,
donde afecta claramente la concentración y las diferentes cristalizaciones que pueden darse
en el hierro en estado sólido y a diferentes temperaturas.
Pares (presión, temperatura) de transición de fase entre:
Dos fases sólidas: Cambio alotrópico
Entre una fase sólida y una fase líquida: fusión - solidificación
Entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación
inversa)
Entre una fase líquida y una fase vapor: vaporización - condensación (o licuefacción)
Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto
llamado punto crítico (La densidad del líquido y vapor son iguales). Más allá de este punto, la
materia se presenta como un fluido supercrítico que tiene propiedades tanto de los líquidos
como de los gases. Modificando la presión y temperatura en valores alrededor del punto crítico
se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas
para obtener café descafeinado.
Es preciso anotar que, en el diagrama P-T del agua, la línea que separa los estados líquido y
sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que
aumentando la presión el hielo se funde, y también que la fase sólida tiene menor densidad
que la fase líquida.
Diagrama de fase binario[editar]
Cuando aparecen varias sustancias, la representación de los cambios de fase puede ser más
compleja. Un caso particular, el más sencillo, corresponde a los diagramas de fase binarios.
Ahora las variables a tener en cuenta son la temperatura y la concentración, normalmente en
masa.
Hay punto y líneas en estos diagramas importantes para su caracterización:
Sólido puro o solución sólida
Mezcla de disoluciones sólidas (eutéctica, eutectoide, peritéctica, peritectoide)
Mezcla sólido - líquido
Únicamente líquido, ya sea mezcla de líquidos inmiscibles (emulsión)o un líquido
completamente homogéneo.
Mezcla líquido - gas
Gas (lo consideraremos siempre homogéneo, trabajando con pocas variaciones da
altitud).
En un diagrama binario pueden aparecer las siguientes regiones:
Línea de liquidus, por encima de la cual solo existen fases líquidas.
Línea de solidus, por debajo de la cual solo existen fases sólidas.
Línea eutéctica y eutectoide. Son líneas horizontales (isotermas) en las que tienen lugar
transformaciones eutécticas y eutectoides, respectivamente.
Línea de solvus, que indica las temperaturas para las cuales una disolución sólida (α) de
A y B deja de ser soluble para transformarse en dos disoluciones sólidas (α) + (β) de
distinta composición en A y B.
Concentraciones definidas, en las que tienen lugar transformaciones a temperatura
constante:
o Eutéctica
o Eutectoide
o Peritéctica
o Peritectoide
o Monotéctica
o Monotectoide
o Sintéctica
También podría gustarte
- Diagrama de Fase PuraDocumento6 páginasDiagrama de Fase Purajesus machinAún no hay calificaciones
- Diagrama de Fase y FisicoquimicaDocumento4 páginasDiagrama de Fase y FisicoquimicaRonal Vásquez BautistaAún no hay calificaciones
- Actividad 10 Diagrama de FasesDocumento8 páginasActividad 10 Diagrama de FasesCitlaly Montalvo100% (1)
- Diagrama de FaseeDocumento27 páginasDiagrama de FaseeCarolyn BennettAún no hay calificaciones
- Diagrama de FasesDocumento3 páginasDiagrama de FasesJorge MalmaAún no hay calificaciones
- Diagramas de FacesDocumento21 páginasDiagramas de FacesferminhernandezAún no hay calificaciones
- Energía en Los Cambios QuímicosDocumento12 páginasEnergía en Los Cambios QuímicossofiaAún no hay calificaciones
- Diagrama de FaseDocumento2 páginasDiagrama de FaseAuxiliadora BencomoAún no hay calificaciones
- Diagrama de FaseDocumento5 páginasDiagrama de FaseKevin Perez YalleAún no hay calificaciones
- Diagrama de FaseDocumento2 páginasDiagrama de FaseTeachmeonceagainAún no hay calificaciones
- Lectura Diagrama de Fases BinarioDocumento4 páginasLectura Diagrama de Fases BinarioJuan SotoAún no hay calificaciones
- Informe Equilibrio Liquido VaporDocumento25 páginasInforme Equilibrio Liquido VaporPaolo Guerra SteinAún no hay calificaciones
- Clasificacion Diagrama de FaseDocumento16 páginasClasificacion Diagrama de FaseMaría Jose Aranza Morales PalafoxAún no hay calificaciones
- Diagrama fases transformación estructuralDocumento17 páginasDiagrama fases transformación estructuralDavid PalaciosAún no hay calificaciones
- Diagrama de FaseDocumento11 páginasDiagrama de FaseAnonymous o5FX4oqBAún no hay calificaciones
- Quimica (Diagrama y EnLaces)Documento3 páginasQuimica (Diagrama y EnLaces)Eduardo GarcíaAún no hay calificaciones
- Guía Diagramas de FaseDocumento5 páginasGuía Diagramas de FaseFelipe Peña PeñaAún no hay calificaciones
- Diagrama de FasesDocumento4 páginasDiagrama de FasesJAVIERAún no hay calificaciones
- Informe de Diagrama de Fases U5 GjpsDocumento16 páginasInforme de Diagrama de Fases U5 Gjpsjose jose prieto santanaAún no hay calificaciones
- Transformacion Estructural MatmetDocumento58 páginasTransformacion Estructural MatmetcdfftfAún no hay calificaciones
- 5.1 Diagrama de FaseDocumento6 páginas5.1 Diagrama de FaseAntonio HermidaAún no hay calificaciones
- Diagrama de FaceDocumento8 páginasDiagrama de FaceLeonardo Daniel Toledo PresaAún no hay calificaciones
- Sustancias puras: propiedades, fases y diagramasDocumento15 páginasSustancias puras: propiedades, fases y diagramascesarAún no hay calificaciones
- Diagrama de FasesDocumento12 páginasDiagrama de FasesJason Q. CruzAún no hay calificaciones
- Tarea 1 de Tecnologia de Los Materiales 1Documento36 páginasTarea 1 de Tecnologia de Los Materiales 1Danny Carrasquedo Muñoz100% (2)
- Diagramas de EqulibrioDocumento9 páginasDiagramas de EqulibrioDiana Sañay GAún no hay calificaciones
- Ses 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaDocumento40 páginasSes 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaMaria AquiseAún no hay calificaciones
- Actividad 9Documento3 páginasActividad 9Serenity RicaldeAún no hay calificaciones
- Diagrama de fases binarioDocumento57 páginasDiagrama de fases binarioJulio GuerreroAún no hay calificaciones
- U6 2C 2017Documento32 páginasU6 2C 2017Flor MalamudAún no hay calificaciones
- DiagramadefasesDocumento43 páginasDiagramadefasesquimicocad9891Aún no hay calificaciones
- Diagrama de fases isomorfo del sistema cobre-níquelDocumento7 páginasDiagrama de fases isomorfo del sistema cobre-níquelJeremy Daniel Mendoza SegoviaAún no hay calificaciones
- Sem7 MF Diagrama de Fases de Aleaciones JRCL 202220Documento24 páginasSem7 MF Diagrama de Fases de Aleaciones JRCL 202220José ZavalaAún no hay calificaciones
- Diagrama de FasesDocumento6 páginasDiagrama de FasesNúria Tornay G.Aún no hay calificaciones
- Sustancias PurasDocumento73 páginasSustancias PurasMiliana LPAún no hay calificaciones
- Superficie P V TDocumento12 páginasSuperficie P V TWilman Freddy Arista TafurAún no hay calificaciones
- Diagrama de FasesDocumento7 páginasDiagrama de Fasesyorgelis angelAún no hay calificaciones
- FasesDocumento32 páginasFasesFredy GomezAún no hay calificaciones
- Regla de FasesDocumento16 páginasRegla de Faseskenyi8Aún no hay calificaciones
- Diagrama de FaseDocumento8 páginasDiagrama de FaseCristian valenzuela maciasAún no hay calificaciones
- Suarez-Equilibrio de FasesDocumento14 páginasSuarez-Equilibrio de FasesSusan Jeny Suarez AbadAún no hay calificaciones
- Trabajo Diagrama de FasesDocumento27 páginasTrabajo Diagrama de FasesAriana PérezAún no hay calificaciones
- FundicionDocumento18 páginasFundicionAriAún no hay calificaciones
- Clase 17 - Diagrama de Equilibrio Con Solubilidad TotalDocumento17 páginasClase 17 - Diagrama de Equilibrio Con Solubilidad TotalJOSE VALENTIN FLORES RODRIGUEZAún no hay calificaciones
- Sistema binario paradiclorobenceno-naftalenoDocumento71 páginasSistema binario paradiclorobenceno-naftalenoMalu AisneAún no hay calificaciones
- Diagrama fasesDocumento9 páginasDiagrama fasesPaola Pallares ÁvilaAún no hay calificaciones
- Tema 5.1 y 5.2Documento10 páginasTema 5.1 y 5.2Braian Ruben GonzalezAún no hay calificaciones
- Equilibrio de FasesDocumento34 páginasEquilibrio de FasesAndrea Gomez100% (1)
- IntroducciónDocumento19 páginasIntroducciónYerson JunesAún no hay calificaciones
- Equilibrio QuimicoDocumento8 páginasEquilibrio QuimicoDennis LinoAún no hay calificaciones
- Introducción a los diagramas de fases en materiales metálicosDocumento5 páginasIntroducción a los diagramas de fases en materiales metálicosAnother KidAún no hay calificaciones
- Lectura Diagrama de FasesDocumento3 páginasLectura Diagrama de FasesLuis Gustavo López PérezAún no hay calificaciones
- Investigacion FaseDocumento7 páginasInvestigacion FaseFlavio SiqueirosAún no hay calificaciones
- Propiedades y aplicaciones de las aleaciones metálicasDocumento9 páginasPropiedades y aplicaciones de las aleaciones metálicasfer fer ferAún no hay calificaciones
- Diagrama de fases: Solubilidad totalDocumento36 páginasDiagrama de fases: Solubilidad totalFranko Mendoza SueldoAún no hay calificaciones
- Guia Didactica Diagramas de FasesDocumento22 páginasGuia Didactica Diagramas de FasesBeliana de CabelloAún no hay calificaciones
- Diagrama PVT sustanciasDocumento4 páginasDiagrama PVT sustanciasNeilet Arias AgostiniAún no hay calificaciones
- MetalografiaDocumento44 páginasMetalografiaJavierPañahuaAún no hay calificaciones
- Diagrama TernarioDocumento3 páginasDiagrama TernarioSerenity RicaldeAún no hay calificaciones
- Registro de PozosDocumento1 páginaRegistro de PozosJudithAún no hay calificaciones
- Definición de ErrorDocumento2 páginasDefinición de ErrorJudithAún no hay calificaciones
- FRAGANCIASDocumento7 páginasFRAGANCIASJudithAún no hay calificaciones
- Reducción nitrobenceno fenilamonio fenilaminaDocumento2 páginasReducción nitrobenceno fenilamonio fenilaminaJudithAún no hay calificaciones
- Equilibrio de FasesDocumento3 páginasEquilibrio de FasesJudithAún no hay calificaciones
- ÉSTERESDocumento6 páginasÉSTERESJudithAún no hay calificaciones
- Reducción nitrobenceno fenilamonio fenilaminaDocumento2 páginasReducción nitrobenceno fenilamonio fenilaminaJudithAún no hay calificaciones
- Pluger LiftDocumento6 páginasPluger LiftJudithAún no hay calificaciones
- Rio AmazonasDocumento1 páginaRio AmazonasJudithAún no hay calificaciones
- Piratas en El CaribeDocumento2 páginasPiratas en El CaribeJudithAún no hay calificaciones
- Cuenca AmazoniicaDocumento1 páginaCuenca AmazoniicaJudithAún no hay calificaciones
- Almacenamiento de HidrocarburosDocumento1 páginaAlmacenamiento de HidrocarburosJudithAún no hay calificaciones
- MarcosDocumento6 páginasMarcosJudithAún no hay calificaciones
- CaratulasDocumento6 páginasCaratulasJudithAún no hay calificaciones
- AMAZONIADocumento1 páginaAMAZONIAJudithAún no hay calificaciones
- Gestion de Hidrocarburos BoDocumento1 páginaGestion de Hidrocarburos BoJudithAún no hay calificaciones
- AMAZONIADocumento1 páginaAMAZONIAJudithAún no hay calificaciones
- CavitacionDocumento1 páginaCavitacionJudithAún no hay calificaciones
- Formulas para DisolucionesDocumento2 páginasFormulas para DisolucionesJudithAún no hay calificaciones
- Cuenca AmazoniicaDocumento1 páginaCuenca AmazoniicaJudithAún no hay calificaciones
- Estado LaicoDocumento1 páginaEstado LaicoJudithAún no hay calificaciones
- Soluciones QuímicasDocumento3 páginasSoluciones QuímicasJudithAún no hay calificaciones
- Fenomenos FisicosDocumento2 páginasFenomenos FisicosJudithAún no hay calificaciones
- ViscosidadDocumento2 páginasViscosidadJudithAún no hay calificaciones
- ViscosidadDocumento2 páginasViscosidadJudithAún no hay calificaciones
- RefineríaDocumento1 páginaRefineríaJudithAún no hay calificaciones
- Soluciones QuímicasDocumento3 páginasSoluciones QuímicasJudithAún no hay calificaciones
- RefineriaDocumento1 páginaRefineriaJudithAún no hay calificaciones
- PetroquimicaDocumento2 páginasPetroquimicaJudithAún no hay calificaciones
- Indice IedDocumento4 páginasIndice IedJavier Salas0% (1)
- Manual UrdidoDocumento28 páginasManual Urdidojuliocesarsantana7400100% (4)
- Grupo ElectrógenoDocumento11 páginasGrupo Electrógenonestor cuadradoAún no hay calificaciones
- Dinámica y energía: Estudio colaborativoDocumento35 páginasDinámica y energía: Estudio colaborativoMateo SogaAún no hay calificaciones
- Programacion No LinealDocumento15 páginasProgramacion No LinealNestorAún no hay calificaciones
- Mat-212-T Calculo IIDocumento5 páginasMat-212-T Calculo IIRichard SantosAún no hay calificaciones
- Tesis Completa Xavier Fuentes BayneDocumento132 páginasTesis Completa Xavier Fuentes BayneHans Mikel Zapata SilvaAún no hay calificaciones
- Clase GeodesiaDocumento12 páginasClase GeodesiaCristhian Riveros RojasAún no hay calificaciones
- Método de Cono y ArenaDocumento7 páginasMétodo de Cono y ArenaAndres SalmeronAún no hay calificaciones
- Método Hartree-Fock resuelve ecuación de SchrödingerDocumento4 páginasMétodo Hartree-Fock resuelve ecuación de SchrödingerKey Yela ʚïɞAún no hay calificaciones
- Diseño Práctico de Un TransformadorDocumento3 páginasDiseño Práctico de Un TransformadorTu Cuaderno Virtual100% (4)
- UNIDAD 5 EntropiaDocumento37 páginasUNIDAD 5 EntropiaCamila Paz Cuadra RiosAún no hay calificaciones
- Ley de Ohm: Relación entre voltaje, corriente y resistenciaDocumento11 páginasLey de Ohm: Relación entre voltaje, corriente y resistenciaRoderick Raúl LópezAún no hay calificaciones
- Accesorios Enerpac PDFDocumento17 páginasAccesorios Enerpac PDFLuisFranciscoMarinMedranoAún no hay calificaciones
- Aplicación - Leyes de Kirchhoff PDFDocumento2 páginasAplicación - Leyes de Kirchhoff PDFOscar OmarAún no hay calificaciones
- MD Electricas ModuloDocumento4 páginasMD Electricas ModuloJorge Iriarte Velasquez100% (1)
- Aplicación de la teoría del polo en el círculo de MohrDocumento1 páginaAplicación de la teoría del polo en el círculo de MohrJosé H. GarnicaAún no hay calificaciones
- Practico Extremadura 2018Documento2 páginasPractico Extremadura 2018Manuel Herrera Kmuland0% (1)
- 303 Preguntas TeoricasDocumento6 páginas303 Preguntas TeoricasNatali AstudilloAún no hay calificaciones
- Laboratorio 2 Diodos SemiconductoresDocumento2 páginasLaboratorio 2 Diodos Semiconductoresopenid_0zAa4fpm100% (2)
- ElectrostáticaDocumento7 páginasElectrostáticaWanda FalkensteinAún no hay calificaciones
- Movimientos CompuestosDocumento4 páginasMovimientos CompuestosPIERO100% (1)
- Como Se Distribuye y Transporta La Energia ElectricaDocumento9 páginasComo Se Distribuye y Transporta La Energia Electricahian oñaAún no hay calificaciones
- Tema No 1 Torsión en VigasDocumento17 páginasTema No 1 Torsión en VigasCarlosPAún no hay calificaciones
- Charles HermiteDocumento7 páginasCharles Hermitex5003Aún no hay calificaciones
- El Mercurio Ebulle A 357Documento3 páginasEl Mercurio Ebulle A 357ErikaAún no hay calificaciones
- VoltioDocumento4 páginasVoltioEdgarVelasquezAún no hay calificaciones
- Examen Resuelto Matematica Basica 1 Segundo ParcialDocumento8 páginasExamen Resuelto Matematica Basica 1 Segundo Parcialvictor60% (5)
- Fenómenos de Calor 1.Documento2 páginasFenómenos de Calor 1.Matic Tube100% (1)
- Un Estudio Sobre La Localización, Detección y Diagnóstico de Fallas en Máquinas EléctricasDocumento25 páginasUn Estudio Sobre La Localización, Detección y Diagnóstico de Fallas en Máquinas Eléctricasokocha85Aún no hay calificaciones
- Resetea tu mente. Descubre de lo que eres capazDe EverandResetea tu mente. Descubre de lo que eres capazCalificación: 5 de 5 estrellas5/5 (196)
- Influencia. La psicología de la persuasiónDe EverandInfluencia. La psicología de la persuasiónCalificación: 4.5 de 5 estrellas4.5/5 (14)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaDe EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaCalificación: 5 de 5 estrellas5/5 (1867)
- Terapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSDe EverandTerapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSCalificación: 5 de 5 estrellas5/5 (1)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Psicogenealogía: Sanar las heridas del alma y encontrarse a uno mismoDe EverandPsicogenealogía: Sanar las heridas del alma y encontrarse a uno mismoCalificación: 5 de 5 estrellas5/5 (5)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaDe EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Disciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)De EverandDisciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)Calificación: 5 de 5 estrellas5/5 (10)
- ¿Por qué mis padres no me aman?: Empezando a sanarDe Everand¿Por qué mis padres no me aman?: Empezando a sanarCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaDe EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaCalificación: 5 de 5 estrellas5/5 (2)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Cómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.De EverandCómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.Calificación: 5 de 5 estrellas5/5 (54)
- Pensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.De EverandPensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.Calificación: 4.5 de 5 estrellas4.5/5 (33)
- El poder del optimismo: Herramientas para vivir de forma más positivaDe EverandEl poder del optimismo: Herramientas para vivir de forma más positivaCalificación: 4.5 de 5 estrellas4.5/5 (15)
- El lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanDe EverandEl lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanCalificación: 4 de 5 estrellas4/5 (49)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRADe EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRACalificación: 4 de 5 estrellas4/5 (26)
- La conciencia en el cerebro: Descifrando el enigma de cómo el cerebro elabora nuestros pensamientosDe EverandLa conciencia en el cerebro: Descifrando el enigma de cómo el cerebro elabora nuestros pensamientosCalificación: 2.5 de 5 estrellas2.5/5 (3)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Maneja tus emociones: Curso intensivo de mindfulness y regulación emocionalDe EverandManeja tus emociones: Curso intensivo de mindfulness y regulación emocionalCalificación: 4.5 de 5 estrellas4.5/5 (140)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Ansiedad infantil. Los trastornos explicados a los padresDe EverandAnsiedad infantil. Los trastornos explicados a los padresCalificación: 4.5 de 5 estrellas4.5/5 (25)