Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Lectura Diagrama de Fases
Cargado por
Luis Gustavo López PérezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Lectura Diagrama de Fases
Cargado por
Luis Gustavo López PérezCopyright:
Formatos disponibles
Diagrama de fases
Los sistemas homogéneos y heterogéneos involucran el concepto de fase, definiéndola como
toda porción de un sistema que tiene la misma estructura o arreglo atómico y como
consecuencia las propiedades y composición son las mismas en todo el sistema.
En un sistema homogéneo se tiene una sola fase. Un sistema heterogéneo tiene más de una fase
y puede tener uno o más componentes (se distinguen por su naturaleza o sustancia química
diferente). Ejemplo:
o Las soluciones son sistemas homogéneos (una sola fase) pero están formadas por más
de un componente (soluto o solutos y solvente).
o Una mezcla heterogénea aceite agua presenta dos fases y dos componentes
o Una sustancia pura (un solo componente) puede aparecer en dos de sus estados físicos
en determinadas condiciones y así identificarse dos fases con diferente organización
atómica y propiedades.
Los equilibrios entre fases pueden corresponder a los más variados tipos de sistemas
heterogéneos:
o Un líquido en equilibrio con su vapor
o Una solución saturada en equilibrio con el soluto en exceso
o Dos líquidos parcialmente solubles el uno en el otro
o Dos sólidos totalmente solubles en equilibrio con su fase fundida
o Dos sólidos parcialmente solubles en equilibrio con un compuesto formado entre ellos,
etc.
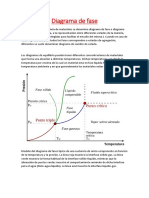
Se denomina Diagrama de Fase, diagrama de constitución o diagrama de equilibrio a la
representación gráfica de las diferentes fases de un sistema en equilibrio. Estado de equilibrio de
un sistema es aquel estado en el cual las propiedades del sistema no cambian con el tiempo, a
menos que se ejerza una restricción. En este último sentido, restricción significa normalmente
una alteración de la temperatura, la presión o la composición. En los diagramas de Fase se
acostumbra graficar la composición de fases presentes como función de la temperatura o la
presión. Cuando en una de estas representaciones todas las fases corresponden a estados de
agregación diferentes se suele denominar diagrama de cambio de estado.
Los materiales en estado sólido existen en
muchas formas diferentes o fases. El número de
tales fases puede ser grande incluso para
sustancias puras, por ejemplo el hielo (ver fig 1)
puede existir en varias fases sólidas y un metal
tan importante como el hierro presenta hasta
cuatro fases sólidas.
En los sistemas que presentan más de una especie
química el número de fases puede igualmente ser
grande.
Las propiedades de los materiales dependen
significativamente de la naturaleza, número,
cantidad, y forma de las posibles fases que se
presentan y pueden cambiarse por alteraciones en
dichas cantidades, es vital, en el uso de
materiales, conocer las condiciones bajo las Fig 1: Diagrama de Fase del Hielo a
cuales cualquier sistema dado puede existir en sus altas presiones
varias formas posibles.
Disolución sólida:
Algunos pares de sustancias forman disoluciones sólidas. En ella no existen cristales
individuales de A o de B. Las moléculas, átomos o iones se mezclan nos con otros a
nivel molecular, y la composición de la disolución se puede modificar de forma
continua a lo largo de un intervalo.
Es posible tener miscibilidad total y parcial, o inmiscibilidad completa de los sólidos A
y B. Las disoluciones sólidas se clasifican en intersticiales y sustitucionales.
En una disolución sólida intersticial, las moléculas o átomos de B (que deben ser
pequeños) ocupan los huecos (intersticios) de la estructura cristalina de la sustancia A.
Por ejemplo, el acero es una disolución en la cual los átomos de carbono ocupan los
intersticios de la estructura cristalina del Fe.
En una disolución sólida sustitucional, las moléculas átomos o iones de B se sustituyen
por otros de A en posiciones aleatorias de la estructura cristalina, esto ocurre en los
sistemas Cu-Ni, Cu-Zn, Na2CO3-K2CO3 y p-diclorobenceno-p-dibromobenceno. Los
sólidos sustitucionales están formados por átomos, moléculas o iones de forma y
estructura similares.
Fig. 2: Disoluciones substitucionales e intersticiales
Diagrama de fases de aleaciones
a) Miscibilidad en Fase líquida y sólida
Fig. 3: Diagrama de Fases de una aleación
Si se trata de una aleación de dos metales (A y B), se representa la temperatura en ordenadas y
la composición en abscisas. En los diagramas de fases las disoluciones sólidas se suelen
representar por las primeras letras del alfabeto griego.
Línea de líquidus: es la línea superior del diagrama; representa el inicio de la solidificación y
marca la transición entre la fase líquida y la fase liquida + sólida.
Línea de sólidus: es la línea inferior del diagrama; representa la transición entre la fase líquida
+ sólido y la fase sólida.
Regla de la palanca
En la fig. 3, el punto D se encuentra en un estado bifásico en el que coexisten una fase sólida α
y otra líquida L. La composición química del sólido y líquido puede determinarse por la regla
de la horizontal, trazando una horizontal que pase por el punto D y que corte las líneas de fase,
determinándose Cα y CL.
Si llamamos WL al tanto por uno que tenemos de masa líquida en el punto D y Wα al tanto por
uno que tenemos de la masa sólida en el mismo punto, podemos determinar dichas masas
mediante unas ecuaciones, aplicando lo que se conoce como regla de la palanca.
C0 = Concentración del elemento A o B correspondiente al punto D.
CL = Concentración del líquido correspondiente al elemento A o B.
Cα = Concentración del sólido correspondiente al elemento A o B.
Si utilizamos concentraciones del elemento A, las ecuaciones correspondientes a Wα y WL son:
b) Miscibilidad en fase líquida y miscibilidad parcial en fase sólida
Fig. 4: Diagrama de Fases de una aleación
Cuando A y B son totalmente miscibles en fase líquida y parcialmente miscibles en fase
sólida, el diagrama Temperatura versus composición se observará como en la fig. 4
Bibliografía:
Castillo C. Diagramas de Fase para dos y tres componentes. Universidad de Chile. Disponible
en: http://cabierta.uchile.cl/revista/23/articulos/pdf/edu1.pdf
Restrepo O.1998. Discusión general sobre los diagramas de fase. Universidad Nacional
de Colombia. Medellín. Diponible en
http://www.unalmed.edu.co/~cpgarcia/diagramasfases.pdf
También podría gustarte
- Diagrama de FaseeDocumento27 páginasDiagrama de FaseeCarolyn BennettAún no hay calificaciones
- Diagrama de FasesDocumento16 páginasDiagrama de FasesOrlando FernándezAún no hay calificaciones
- Ciencia de Los Materiales. Diagrama de FasesDocumento10 páginasCiencia de Los Materiales. Diagrama de FasesFelipe Balboa PolancoAún no hay calificaciones
- Diagrama de Fase PuraDocumento6 páginasDiagrama de Fase Purajesus machinAún no hay calificaciones
- Diagrama de FasesDocumento12 páginasDiagrama de FasesJason Q. CruzAún no hay calificaciones
- Equilibrio de FasesDocumento3 páginasEquilibrio de FasesJudithAún no hay calificaciones
- Diagramas de Equilibrio de FasesDocumento17 páginasDiagramas de Equilibrio de Fasesalexandra Fernández NietoAún no hay calificaciones
- Tema 5.1 y 5.2Documento10 páginasTema 5.1 y 5.2Braian Ruben GonzalezAún no hay calificaciones
- Actividad 10 Diagrama de FasesDocumento8 páginasActividad 10 Diagrama de FasesCitlaly Montalvo100% (1)
- Diagrama de Fase y FisicoquimicaDocumento4 páginasDiagrama de Fase y FisicoquimicaRonal Vásquez BautistaAún no hay calificaciones
- Diagrama Equilibrio SolidoDocumento57 páginasDiagrama Equilibrio SolidoJulio GuerreroAún no hay calificaciones
- Equilibrio Solido LiquidoDocumento37 páginasEquilibrio Solido LiquidoSantiagoFleitas100% (1)
- Miscibilidad de Metales 1.1Documento9 páginasMiscibilidad de Metales 1.1fer fer ferAún no hay calificaciones
- Las Derivadas y Sus AplicacionesDocumento66 páginasLas Derivadas y Sus AplicacionesPatricio Alejandro Benavides GuerraAún no hay calificaciones
- Diagrama de FasesDocumento66 páginasDiagrama de FasesEduardo Ortiz SAún no hay calificaciones
- Regla de Fases de GibbsDocumento15 páginasRegla de Fases de GibbsTania FloresAún no hay calificaciones
- Tarea 1 de Tecnologia de Los Materiales 1Documento36 páginasTarea 1 de Tecnologia de Los Materiales 1Danny Carrasquedo Muñoz100% (2)
- Gibbs Aliaciones Isoformas PDFDocumento7 páginasGibbs Aliaciones Isoformas PDFAnderson Flores RiveraAún no hay calificaciones
- Energía en Los Cambios QuímicosDocumento12 páginasEnergía en Los Cambios QuímicossofiaAún no hay calificaciones
- Clasificacion Diagrama de FaseDocumento16 páginasClasificacion Diagrama de FaseMaría Jose Aranza Morales PalafoxAún no hay calificaciones
- Diagramas de EquilibrioDocumento93 páginasDiagramas de EquilibrioricardoAún no hay calificaciones
- Diagrama de FasesDocumento7 páginasDiagrama de Fasesyorgelis angelAún no hay calificaciones
- FasesDocumento32 páginasFasesFredy GomezAún no hay calificaciones
- CAP9 RevenidoDocumento70 páginasCAP9 RevenidoFelipe Romario Hilario QuispeAún no hay calificaciones
- Diagrama de Fases en Aleaciones 21Documento3 páginasDiagrama de Fases en Aleaciones 21AbiAún no hay calificaciones
- 5.1 Construcción de Los Diagramas de FaseDocumento3 páginas5.1 Construcción de Los Diagramas de FaseCandido Alberto Almeida Herrera50% (2)
- Actividad 9Documento3 páginasActividad 9Serenity RicaldeAún no hay calificaciones
- Diagramas de FaseDocumento7 páginasDiagramas de FaseJuliana BarreraAún no hay calificaciones
- Ses 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaDocumento40 páginasSes 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaMaria AquiseAún no hay calificaciones
- Diagramas de FaseDocumento27 páginasDiagramas de FaseDanniel BloomAún no hay calificaciones
- NSMEF - Diagrama FaseDocumento17 páginasNSMEF - Diagrama FasekamigolAún no hay calificaciones
- Equilibrio de Fases y Endurecimiento Por Solucion Sólida Cuarta SesionDocumento69 páginasEquilibrio de Fases y Endurecimiento Por Solucion Sólida Cuarta Sesionvitucho92100% (2)
- Sem7 MF Diagrama de Fases de Aleaciones JRCL 202220Documento24 páginasSem7 MF Diagrama de Fases de Aleaciones JRCL 202220José ZavalaAún no hay calificaciones
- Digramas de FaseDocumento23 páginasDigramas de FaseJOTARUAún no hay calificaciones
- Unidad 5. - Tranformación EstructuralDocumento14 páginasUnidad 5. - Tranformación EstructuralAlex Garcia Ulloa100% (1)
- DiagramadefasesDocumento43 páginasDiagramadefasesquimicocad9891Aún no hay calificaciones
- Unidad 5. - Tranformación EstructuralDocumento14 páginasUnidad 5. - Tranformación EstructuralAlex Garcia UlloaAún no hay calificaciones
- Trabajo Diagrama de FasesDocumento27 páginasTrabajo Diagrama de FasesAriana PérezAún no hay calificaciones
- Diagrama TernarioDocumento3 páginasDiagrama TernarioSerenity RicaldeAún no hay calificaciones
- Diagramas de FaseDocumento13 páginasDiagramas de FasechentyAún no hay calificaciones
- Diagrama de FaceDocumento8 páginasDiagrama de FaceLeonardo Daniel Toledo PresaAún no hay calificaciones
- Trabajo de La Exposicion de MaterialesDocumento30 páginasTrabajo de La Exposicion de MaterialesCesar Chirinos Di GiovannantonioAún no hay calificaciones
- Diagrama de FasesDocumento3 páginasDiagrama de FasesJorge MalmaAún no hay calificaciones
- Diagramas de FasesDocumento30 páginasDiagramas de FasesmonserrathAún no hay calificaciones
- Guía Diagramas de FaseDocumento5 páginasGuía Diagramas de FaseFelipe Peña PeñaAún no hay calificaciones
- Informe Equilibrio Liquido VaporDocumento25 páginasInforme Equilibrio Liquido VaporPaolo Guerra SteinAún no hay calificaciones
- Diagrama de FasesDocumento51 páginasDiagrama de FasesXavier Andres Martínez GarciaAún no hay calificaciones
- Diagramas de FaseDocumento30 páginasDiagramas de FaseFelipe FlorezAún no hay calificaciones
- Diagrama de FasesDocumento16 páginasDiagrama de FasesMiriam Cantón Reyes100% (1)
- Diagrama de FaseDocumento5 páginasDiagrama de FaseKevin Perez YalleAún no hay calificaciones
- Taller Equilibrio de FasesDocumento5 páginasTaller Equilibrio de FasesAriel CastilloAún no hay calificaciones
- MetalografiaDocumento44 páginasMetalografiaJavierPañahuaAún no hay calificaciones
- Tema 2-Termodinámica. Sustancias PurasDocumento17 páginasTema 2-Termodinámica. Sustancias PurasJose DanielAún no hay calificaciones
- Sustancias PurasDocumento54 páginasSustancias PurasMayra Leal92% (13)
- Diagrama de Fases Tipo IDocumento36 páginasDiagrama de Fases Tipo IFranko Mendoza SueldoAún no hay calificaciones
- Diagramas Ternarios y ELSDocumento7 páginasDiagramas Ternarios y ELSVianey LunaAún no hay calificaciones
- Diagramas de FasesDocumento7 páginasDiagramas de FasesJULY RAMIREZAún no hay calificaciones
- Diagramas de EquilibrioDocumento26 páginasDiagramas de Equilibrioninoghg100% (3)
- Asociaciones Minerales, EquilibrioDocumento10 páginasAsociaciones Minerales, EquilibrioLiz AvilaAún no hay calificaciones
- Practica de Laboratorio - Identificacion de Fibras TextilesDocumento30 páginasPractica de Laboratorio - Identificacion de Fibras Textilesluz choquehuayta75% (4)
- Practica 8 TSPDocumento6 páginasPractica 8 TSPHannia AlmazánAún no hay calificaciones
- Metodos de Separación de SustanciasDocumento6 páginasMetodos de Separación de SustanciasMarco Antonio Alanoca100% (2)
- Práctica 1 - Determinación de La Entalpía de Descomposición Del Peróxido de HidrógenoDocumento7 páginasPráctica 1 - Determinación de La Entalpía de Descomposición Del Peróxido de HidrógenoMaría RodríguezAún no hay calificaciones
- El experimento de la turbina termodinámica o turbina de vapor en nuestro experimento funciona a través de agua caliente ya que una vela o una llama fuerte la calienta por debajo a la lata que contiene agua para así converDocumento3 páginasEl experimento de la turbina termodinámica o turbina de vapor en nuestro experimento funciona a través de agua caliente ya que una vela o una llama fuerte la calienta por debajo a la lata que contiene agua para así converasenfhnawf25% (4)
- Ejercicios Resueltos 1er ParcialDocumento13 páginasEjercicios Resueltos 1er ParcialLR Gaming0% (1)
- Protección Del Acero Por GalvanizadoDocumento5 páginasProtección Del Acero Por GalvanizadoAngel BuendiaAún no hay calificaciones
- Taller Estructura AtomicaDocumento3 páginasTaller Estructura Atomicaapi-241769574Aún no hay calificaciones
- ACETILENODocumento7 páginasACETILENOUlisces OlguinAún no hay calificaciones
- Practica 2 Uso Del PotenciometroDocumento10 páginasPractica 2 Uso Del PotenciometroRafael GonzálezAún no hay calificaciones
- LUCAS O - Práctica 9-DETERMINACIÓN DE LA CONSTANTE DEL PRODUCTO DE SOLUBILIDAD, KpsDocumento4 páginasLUCAS O - Práctica 9-DETERMINACIÓN DE LA CONSTANTE DEL PRODUCTO DE SOLUBILIDAD, KpsLucas OñoroAún no hay calificaciones
- Instalacion y Puesta en MarchaDocumento47 páginasInstalacion y Puesta en Marchacifpmsp100% (2)
- Fisics ASDocumento2 páginasFisics ASChris VasquezAún no hay calificaciones
- RyPP SerieDocumento3 páginasRyPP SerieMario HalleyAún no hay calificaciones
- Presentacion Capitulo IDocumento45 páginasPresentacion Capitulo IAndrés LlanoAún no hay calificaciones
- Compuestos Inorgánicos y OrganicosDocumento14 páginasCompuestos Inorgánicos y OrganicosDitxiz senpaiAún no hay calificaciones
- Teoria de La Doble CapaDocumento3 páginasTeoria de La Doble CapaJonathan VillafañeAún no hay calificaciones
- Trabajo Integrador Diciembre QUIMICADocumento25 páginasTrabajo Integrador Diciembre QUIMICAJuegos DigitalesAún no hay calificaciones
- 02 Det. Potenciométrica de CloruroDocumento3 páginas02 Det. Potenciométrica de CloruroVictor Aristizabal100% (1)
- Guia Enlaces QuimicosDocumento3 páginasGuia Enlaces QuimicosDeivy PulidoAún no hay calificaciones
- Practica #7Documento6 páginasPractica #7Jimena AlvaradoAún no hay calificaciones
- Configuración ElectrónicaDocumento23 páginasConfiguración ElectrónicaFabricio Mayta Benitez100% (1)
- 9-Ecuaciones Diferenciales de Energía PDFDocumento46 páginas9-Ecuaciones Diferenciales de Energía PDFValeria SosaAún no hay calificaciones
- Laboratorio de Cual-2Documento17 páginasLaboratorio de Cual-2Odalis Mallqui RiosAún no hay calificaciones
- Informe 3Documento16 páginasInforme 3maria camposAún no hay calificaciones
- El Hombre Como Sistema Fisico Quimico 22-04-2013Documento39 páginasEl Hombre Como Sistema Fisico Quimico 22-04-2013Lenin ReyesAún no hay calificaciones
- RP-CTA2-K04 - Ficha N°4Documento9 páginasRP-CTA2-K04 - Ficha N°4Rosmery Saenz CasanovaAún no hay calificaciones
- Apuntes de TermodinamicaDocumento298 páginasApuntes de TermodinamicaMaría Jose Rodriguez0% (1)
- Science Subject For Elementary - 4th Grade - Changes in Matter and Energy by SlidesgoDocumento11 páginasScience Subject For Elementary - 4th Grade - Changes in Matter and Energy by SlidesgoJOSE LUIS LOPEZ ORTEZAún no hay calificaciones
- Hidrologia UMSSDocumento22 páginasHidrologia UMSSAle HurtadoAún no hay calificaciones