Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Preinforme de Práctica 5
Cargado por
daniel0 calificaciones0% encontró este documento útil (0 votos)
225 vistas5 páginasfisicoquimica
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentofisicoquimica
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
225 vistas5 páginasPreinforme de Práctica 5
Cargado por
danielfisicoquimica
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
PREINFORME DE PRÁCTICA #5 DETERMINACIÓN DE CROMO COMO
DICROMATO
Daniel FARIAS FERNANDEZ.
Universidad Nacional Abierta y a Distancia. Escuela de Ciencias Básicas,
Tecnología e Ingeniería – Ingeniería en Alimentos. Química Analítica e
Instrumental. Grupo #1 CEAD: Cali Laboratorio Multipropósito #100 // UNAD
Palmira, Cra. 28 #40-56 //1er piso
Palmira - Colombia.
Sesión 2: 13, octubre del 2019
Entrega informe: 13, octubre del 2019
Estudiante Correo electrónico Código
Daniel FARIAS
dfariasf@unadvirtual.edu.co 1130682733
FERNANDEZ
OBJETIVOS una muestra problema a
GENERAL través de curvas de
Aplicar los principios de calibración.
espectroscopia UV-Vis para la ● Determinar la concentración
cuantificación de analitos en de cromo por medio de un
una muestra problema. método espectrofotométrico.
ESPECIFICOS CONCEPTOS TEÓRICOS
● Realizar un análisis de Espectrofotometría La
muestras a través de espectrofotometría UV-visible es
espectroscopia, para una técnica analítica que permite
cuantificación de analitos en determinar la concentración de un
compuesto en solución. Se basa en PARTE EXPERIMENTAL
Que las moléculas absorben las MATERIALES
radiaciones electromagnéticas y a ● Balanza Analítica
su vez que la cantidad de luz ● Cuatro balones aforados de
absorbida depende de forma lineal 100ml
de la concentración. ● Beaker (50-100 mL)
Ley de Beer-Lambert: es aquella ● Espátula
que relaciona la absorción de la ● Pipeta de 1,0ml
radiación electromagnética de una ● Espectrofotómetro
o varias especies químicas, con su REACTIVOS
concentración y la distancia que K2Cr2O7
recorre la luz en las interacciones Agua destilada
partícula-fotón. Esta ley reúne dos Solución patrón de hierro
leyes en una sola. (0,04 mg K2Cr2O7/mL(40
ppm))
HNO3
PROCEDIMIENTO
DIAGRAMA DE FLUJO
Parte I. Curva de calibración
1. En matraces aforados de 100 mL adicionar las cantidades correspondientes de
los reactivos a utilizar según la tabla No 1, después completar con agua
destilada hasta el volumen correspondiente, homogenizar y dejar reposar por
5 minutos para el desarrollo del color.
2. Lavar las celdas que van a ser usadas para la medición en el equipo.
3. Calibrar el espectrofotómetro a cero de absorbancia y medir el espectro de la
muestra patrón para determinar la longitud de onda máxima para la medición
de las muestras.
4. Seleccione la longitud de onda obtenida y mida la absorbancia a las
soluciones estándar.
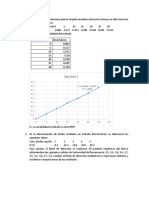
5. Haga una gráfica de absorbancia vs concentración de hierro en ppm y linealícela.
Parte II. Determinación de cromo en una muestra problema
6. Solicite la muestra problema al tutor (solución de cromo de concentración
desconocida).
7. Mida la absorbancia de la muestra problema a la longitud de onda
determinada en la parte I.
8. A través de la curva de calibración cuantifique la concentración de
hierro en la muestra problema.
CALCULOS
Cantidades de las soluciones para la preparación de la curva de calibración.
Solución Concentració Solución Ácido
estándar n de K2Cr2O7 patrón nítrico (mL)
ppm (mL)
1 3 7,5 1 mL
2 4 10,0 1 mL
3 6 15,0 1 mL
4 8 20,0 1 mL
5 10 25,0 1 mL
6 14 35,0 1 mL
7 20 50,0 1 mL
8 25 62,5 1 mL
9 30 75,0 1 mL
10 35 87,5 1 mL
FICHAS DE SEGURIDAD
BIBLIOGRAFIA
Bolívar, G. (s.f.). Ley de Beer-Lambert: aplicaciones y ejercicios
resueltos. Obtenido de https://www.lifeder.com/ley-de-beer-
lambert/
Díaz, N. A., Ruiz, J. A., & Reyes, E. F. (s.f.). Espectrofometría:
Espectros de absorción y cuantificación colorimétrica de
biomoléculas. Obtenido de
https://www.uco.es/dptos/bioquimica-biol-
mol/pdfs/08_ESPECTROFOTOMETRIA.pdf
FICHAS INTERNACIONALES DE SEGURIDAD QUÍMICA.
Obtenido de
http://saberdeciencia.blogspot.com/2013/09/fichas-
internacionales-de-seguridad.html
También podría gustarte
- Informe de Laboratorio de Bioquímica N°1Documento22 páginasInforme de Laboratorio de Bioquímica N°1FabiánAún no hay calificaciones
- Practica No 3-Guía-Estandarización de Un Método EspectrofotométricoDocumento3 páginasPractica No 3-Guía-Estandarización de Un Método EspectrofotométricoGINNA LORENA GOMEZ RONCANCIOAún no hay calificaciones
- Informe Preparación y Estandarización de Soluciones QuimicasDocumento12 páginasInforme Preparación y Estandarización de Soluciones QuimicasALVARO JOSE ROJAS LAMOSAún no hay calificaciones
- PRACTICA 4. DETERMINACION DE CR Con DifenilcarbazidaDocumento16 páginasPRACTICA 4. DETERMINACION DE CR Con DifenilcarbazidaLaura PerdomoAún no hay calificaciones
- POLARIMETRIADocumento6 páginasPOLARIMETRIAgerson polentinoAún no hay calificaciones
- Titulaciones ArgentométricasDocumento4 páginasTitulaciones Argentométricasnata fallaAún no hay calificaciones
- Informe de Lab - Bioquimica 2 SesiónDocumento17 páginasInforme de Lab - Bioquimica 2 SesiónJennifer SerratoAún no hay calificaciones
- Practica 6 Hidrolisis Enzimatica de AlmidonDocumento3 páginasPractica 6 Hidrolisis Enzimatica de AlmidonJhair Mendoza VelezAún no hay calificaciones
- TALLER 6 - Valoraciones ComplejométricasDocumento2 páginasTALLER 6 - Valoraciones ComplejométricasDanna Vanessa Paz RodriguezAún no hay calificaciones
- Determinacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerDocumento11 páginasDeterminacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerSEBASTIAN ALZATE ALZATEAún no hay calificaciones
- INFORME PRACTICA No 4 POTENCIOMETRIADocumento11 páginasINFORME PRACTICA No 4 POTENCIOMETRIAWilmer Stevens Mena Quintero100% (3)
- Informe 6 ANALITICADocumento10 páginasInforme 6 ANALITICAWalter Salazar SandiAún no hay calificaciones
- Gravimetria-1 InformeDocumento2 páginasGravimetria-1 InformeJ-r JesusAún no hay calificaciones
- Informe - Valoración Acido Cítrico en Bebida ComercialDocumento14 páginasInforme - Valoración Acido Cítrico en Bebida ComercialAlexander Omar Capcha RiosAún no hay calificaciones
- L11 Informe Grupo 3 BQ1 2020-2Documento16 páginasL11 Informe Grupo 3 BQ1 2020-2DavidOchoaAún no hay calificaciones
- Banco de Preguntas Unidad 1Documento37 páginasBanco de Preguntas Unidad 1PaitoGoyesAún no hay calificaciones
- Preparación de Patrones Ácido-BaseDocumento8 páginasPreparación de Patrones Ácido-BaseBrandon Smith100% (1)
- DicromatometriaDocumento6 páginasDicromatometriaVladislav Lambrecht Wagner100% (1)
- Anexo 1 - Tarea 1 ActualDocumento48 páginasAnexo 1 - Tarea 1 ActualDiana AvilaAún no hay calificaciones
- EVALUACION DEL PORCENTAJE DE ACIDEZ DE VINAGRE COMERCIAL TerminadoDocumento9 páginasEVALUACION DEL PORCENTAJE DE ACIDEZ DE VINAGRE COMERCIAL TerminadoJavier OrtizAún no hay calificaciones
- Informe (Determinacion de Acidez)Documento6 páginasInforme (Determinacion de Acidez)Juan Jose Vasquez SalazarAún no hay calificaciones
- Preguntas Reporte de Laboratorio #5 - 6Documento1 páginaPreguntas Reporte de Laboratorio #5 - 6Matius RSAún no hay calificaciones
- Aplicaciones de La Titulación de Neutralización Acido-BaseDocumento8 páginasAplicaciones de La Titulación de Neutralización Acido-BaseJosselyn Remache100% (1)
- Informe 5Documento4 páginasInforme 5Juan Pablo Gallego CardonaAún no hay calificaciones
- Informe FotocolorimetriaDocumento8 páginasInforme FotocolorimetriahemilyAún no hay calificaciones
- Informe Práctica #5Documento4 páginasInforme Práctica #5Diana Rueda100% (1)
- Informe de Química Orgánica Ensayos Preliminares y Análisis ElementalDocumento6 páginasInforme de Química Orgánica Ensayos Preliminares y Análisis ElementalSebastian Carrillo RojasAún no hay calificaciones
- Bioquimica Informe USCDocumento4 páginasBioquimica Informe USCDaniela Materon LunaAún no hay calificaciones
- Ley de Beer y Construcción de La Curva de Rigbom para El Indicador VBCDocumento6 páginasLey de Beer y Construcción de La Curva de Rigbom para El Indicador VBCfgranoblesAún no hay calificaciones
- Espectroscopía de Absorción AtómicaDocumento9 páginasEspectroscopía de Absorción AtómicaRicky AlvarezAún no hay calificaciones
- Ejercicio 1y 2 de CurvasDocumento2 páginasEjercicio 1y 2 de CurvasNatasha VargasAún no hay calificaciones
- Informe: Síntesis de Auxiliares de Formulación Síntesis de Estearato de Calcio y de MagnesioDocumento8 páginasInforme: Síntesis de Auxiliares de Formulación Síntesis de Estearato de Calcio y de MagnesioJorge Andrés Zambrano LeitónAún no hay calificaciones
- PRACTICA 9 Determinación Gravimétrica Del Contenido de Sulfato en Forma de Trióxido de Azufre (SO3) en Una Muestra de YesoDocumento4 páginasPRACTICA 9 Determinación Gravimétrica Del Contenido de Sulfato en Forma de Trióxido de Azufre (SO3) en Una Muestra de YesoDiana SalcedoAún no hay calificaciones
- Titulaciones ComplexometricasDocumento8 páginasTitulaciones ComplexometricasJulián EzAún no hay calificaciones
- Informe 4 PDFDocumento17 páginasInforme 4 PDFdavid espinoza avendañoAún no hay calificaciones
- Estandarizacion de Soluciones y Análisis EstadísticoDocumento7 páginasEstandarizacion de Soluciones y Análisis EstadísticoAdriana SantacruzAún no hay calificaciones
- Informe 3Documento8 páginasInforme 3DavidAún no hay calificaciones
- Taller1 - Volumetría 2020Documento3 páginasTaller1 - Volumetría 2020Valentina CalleAún no hay calificaciones
- Informe GlúcidosDocumento13 páginasInforme Glúcidosisabella vivas paezAún no hay calificaciones
- Molaridad Promedio HCLDocumento1 páginaMolaridad Promedio HCLOriana SalasAún no hay calificaciones
- Informe Práctica 3Documento7 páginasInforme Práctica 3Ada Linares06Aún no hay calificaciones
- Informe Analítica #2 Hidrólisis de SalesDocumento10 páginasInforme Analítica #2 Hidrólisis de SalesDavid GarciaAún no hay calificaciones
- EvaluacionDocumento3 páginasEvaluacionAdrian David Bermudez EstupiñanAún no hay calificaciones
- Taller 2 Quimica AnaliticaDocumento9 páginasTaller 2 Quimica AnaliticaPedro Alejandro Moncada Velandia0% (1)
- Laboratorio No 8 Química Analítica IIIDocumento5 páginasLaboratorio No 8 Química Analítica IIIJairArmandoGomezPerezAún no hay calificaciones
- Practica #1Documento5 páginasPractica #1juan david casas canizalesAún no hay calificaciones
- INFORME PRACTICA N°4 - UV-vis - Pte2Documento10 páginasINFORME PRACTICA N°4 - UV-vis - Pte2Andres Felipe Cuervo MoraAún no hay calificaciones
- El Marco Teorico - Docx555222Documento5 páginasEl Marco Teorico - Docx555222NoElia CaBreraAún no hay calificaciones
- Informe Analitica 3Documento10 páginasInforme Analitica 3Gisell HuapayaAún no hay calificaciones
- 943 3775 1 PBDocumento1 página943 3775 1 PBMaiikoll PriiethoAún no hay calificaciones
- Problemas de Gravimetria 2022Documento4 páginasProblemas de Gravimetria 2022Maytrel UracahuaAún no hay calificaciones
- Informe Destilaccion Sencilla y FraccionadaDocumento8 páginasInforme Destilaccion Sencilla y FraccionadaJess Lozada PantojaAún no hay calificaciones
- Aldehidos-Y-Cetonas-Informe 7...Documento13 páginasAldehidos-Y-Cetonas-Informe 7...Cristian BallaAún no hay calificaciones
- Determinacion de Humedad y Cenizas Informe #3Documento5 páginasDeterminacion de Humedad y Cenizas Informe #3Angelica Aponte MejiaAún no hay calificaciones
- Informe Laboratorio 2 BioquimicaDocumento7 páginasInforme Laboratorio 2 BioquimicaROMER SABOGAL VARGAS100% (1)
- Informe de Práctica 5Documento7 páginasInforme de Práctica 5danielAún no hay calificaciones
- Reporte No 8. Cuantificación de Hierro Por Espectrofotometría en El VisibleDocumento13 páginasReporte No 8. Cuantificación de Hierro Por Espectrofotometría en El VisibleKarla VillanuevaAún no hay calificaciones
- Informe #3 CompletoDocumento17 páginasInforme #3 CompletoCamilo Rafael Osorio PintoAún no hay calificaciones
- Calidad del agua para estudiantes de ciencias ambientalesDe EverandCalidad del agua para estudiantes de ciencias ambientalesAún no hay calificaciones
- Medicina PaliativaDocumento13 páginasMedicina PaliativadanielAún no hay calificaciones
- Paro CardiorrespiratorioDocumento7 páginasParo CardiorrespiratoriodanielAún no hay calificaciones
- Reino UnidoDocumento18 páginasReino UnidodanielAún no hay calificaciones
- Muerte DignaDocumento2 páginasMuerte DignadanielAún no hay calificaciones
- Psicoterapia PsicodélicaDocumento4 páginasPsicoterapia PsicodélicadanielAún no hay calificaciones
- Frente de Liberación Nacional (Argelia)Documento9 páginasFrente de Liberación Nacional (Argelia)danielAún no hay calificaciones
- Pacto Internacional de Derechos Económicos, Sociales y CulturalesDocumento11 páginasPacto Internacional de Derechos Económicos, Sociales y CulturalesdanielAún no hay calificaciones
- Abdelaziz ButeflikaDocumento18 páginasAbdelaziz ButeflikadanielAún no hay calificaciones
- ArgeliaDocumento12 páginasArgeliadanielAún no hay calificaciones
- Guerra de Independencia de ArgeliaDocumento14 páginasGuerra de Independencia de ArgeliadanielAún no hay calificaciones
- Gran BretañaDocumento7 páginasGran BretañadanielAún no hay calificaciones
- Fase 3 - G 24 - Aportecolaborativo - OsmiraMirandaDocumento9 páginasFase 3 - G 24 - Aportecolaborativo - OsmiraMirandadanielAún no hay calificaciones
- Chow ChowDocumento3 páginasChow ChowdanielAún no hay calificaciones
- MarimarDocumento8 páginasMarimardanielAún no hay calificaciones
- EsmirnaDocumento13 páginasEsmirnadanielAún no hay calificaciones
- AlaskaDocumento38 páginasAlaskadanielAún no hay calificaciones
- EstambulDocumento12 páginasEstambuldanielAún no hay calificaciones
- Ciclo de Vida en Opinión Con TorcheDocumento1 páginaCiclo de Vida en Opinión Con TorchedanielAún no hay calificaciones
- MassachusettsDocumento12 páginasMassachusettsdanielAún no hay calificaciones
- BangladésDocumento24 páginasBangladésdanielAún no hay calificaciones
- Introduccion Los Dos Males 22-07-2020Documento3 páginasIntroduccion Los Dos Males 22-07-2020danielAún no hay calificaciones
- GALACTOSEMIADocumento1 páginaGALACTOSEMIAdanielAún no hay calificaciones
- 1.2 Microscopio Obj #1Documento17 páginas1.2 Microscopio Obj #1Maria VivasAún no hay calificaciones
- Tabla PeriodicaDocumento25 páginasTabla PeriodicaJosé Carlos Torres VarillasAún no hay calificaciones
- Modelos 3D in SilicoDocumento6 páginasModelos 3D in SilicoEddy Rafael Diaz NuñezAún no hay calificaciones
- 4 Enlaces QuímicosDocumento13 páginas4 Enlaces QuímicosMelany Camila ChicoAún no hay calificaciones
- CUANTICADocumento10 páginasCUANTICALinaMarHernandezPerezAún no hay calificaciones
- Universidad de Los LlanosDocumento5 páginasUniversidad de Los LlanosMiguel GuzmanAún no hay calificaciones
- CONTENIDO PROGRAMÁTICO Electiva 5Documento2 páginasCONTENIDO PROGRAMÁTICO Electiva 5enderson cruzAún no hay calificaciones
- Pauli, Hunt y AufbauDocumento2 páginasPauli, Hunt y AufbauvictorAún no hay calificaciones
- Ejercicios de Números Cuánticos: Ing. Roberto VelásquezDocumento32 páginasEjercicios de Números Cuánticos: Ing. Roberto VelásquezYA GCAún no hay calificaciones
- Microscopio Optico y ElectronicoDocumento4 páginasMicroscopio Optico y ElectronicoNayelli AyaucanAún no hay calificaciones
- Matriz 3 NFDocumento14 páginasMatriz 3 NFJuan RinconAún no hay calificaciones
- Apuntes Quimica UP2020 (Parte 1)Documento23 páginasApuntes Quimica UP2020 (Parte 1)José Alberto Rosendo RicoAún no hay calificaciones
- Refractometria y PolarimetriaDocumento4 páginasRefractometria y PolarimetriaAbel de Jesús RiveraAún no hay calificaciones
- Actividad Óptica, Dispersión Rotatoria Óptica y Dicroísmo Circular en Química OrgánicaDocumento68 páginasActividad Óptica, Dispersión Rotatoria Óptica y Dicroísmo Circular en Química OrgánicaKenny SantaanaAún no hay calificaciones
- Tabla Periódica 2020Documento5 páginasTabla Periódica 2020hskv20025525Aún no hay calificaciones
- Cuadro SinópticoDocumento1 páginaCuadro Sinópticoel mago magicoAún no hay calificaciones
- Tarea2 - Fisica de SemiconductoresDocumento3 páginasTarea2 - Fisica de SemiconductoresHe Wu HuiAún no hay calificaciones
- Estructura AtómicaDocumento2 páginasEstructura AtómicaJhonayker Gormez Ramirez100% (1)
- Evaluación Diagnóstica de Química IDocumento2 páginasEvaluación Diagnóstica de Química IFisica Uno Conalep TolucaAún no hay calificaciones
- Métodos de Caracterización de Las MoléculasDocumento35 páginasMétodos de Caracterización de Las Moléculasdayono juAún no hay calificaciones
- Clase N°1 Quimica 7° - Peso MolecularDocumento8 páginasClase N°1 Quimica 7° - Peso MolecularRodriguez RodrigoAún no hay calificaciones
- Estructuras de LewisDocumento17 páginasEstructuras de LewisValentina MurielAún no hay calificaciones
- Vamos A Descubrir Cómo Hacer Un Láser en CasaDocumento10 páginasVamos A Descubrir Cómo Hacer Un Láser en CasahjsassoAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosvilmakillanesAún no hay calificaciones
- Difracción de Rayos XDocumento37 páginasDifracción de Rayos XjhankAún no hay calificaciones
- Tea 02Documento13 páginasTea 02Adrián RizzoAún no hay calificaciones
- Institución Educativa "San Carlos" Ficha de Trabajo III SecDocumento1 páginaInstitución Educativa "San Carlos" Ficha de Trabajo III SecNataly PACHECO LORENZOAún no hay calificaciones
- Wuolah Free Tema 1Documento4 páginasWuolah Free Tema 1sergio rocamoraAún no hay calificaciones
- Practica Estructura AtomicaDocumento5 páginasPractica Estructura AtomicaIsrael EsquivelAún no hay calificaciones
- Avtividad 2 Linea de Tiempo PDFDocumento3 páginasAvtividad 2 Linea de Tiempo PDFalexanderAún no hay calificaciones