Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Discusion de Resultados
Cargado por
Angie Yulieth Sissa FlorezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Discusion de Resultados
Cargado por
Angie Yulieth Sissa FlorezCopyright:
Formatos disponibles
DISCUSION DE RESULTADOS EVAPORACION
La evaporación de la DS permitió obtener una sustancia pura de (NaCl) en estado sólido a la cual
se le determino la densidad relativa, esto se pudo realizar gracias al aumento de temperatura de
la disolución salina que es una mezcla homogénea donde se separó fácilmente sus componentes
(el solvente del soluto) es decir, que se observó el recipiente y se vio que el agua se había
evaporado, pero la sal se había quedado allí.
Se pudo obtener la densidad relativa a partir de la masa de la DS y el agua dentro de un
picnómetro, teniendo en cuenta la densidad del agua a la temperatura a la que se encontraba
dentro del laboratorio (20°c); llegando así a obtener 1,070 g/ml de densidad relativa.
Conclusiones
DISCUSIÓN DE RESULTADOS DE DESTILACION
1. DISCUSIÓN DE RESULTADOS
La destilación es la separación de un líquido volátil de una sustancia no volátil o la
separación de líquidos con distintos puntos de ebullición. En esta actividad experimental la
sustancia alcohólica a trabajar fue etanol, al realizar la destilación simple para obtener su
contenido, se separaron los componentes de la mezcla trabajada, aprovechando la
diferencia de puntos de ebullición en Bogotá entre el agua y el alcohol, 92.6 °C y 71,0 ºC
respectivamente , ambas sustancias difieren en su presión de vapor, sus fuerzas de
cohesión no son semejantes (capacidad de ambas sustancias para formar puentes de
hidrogeno) , por ello sus puntos de ebullición distan entre si 21,6 ºC. Al contener etanol –
agua, para llevar a cabo el proceso de separación de esta mezcla también se aprovechó la
volatilidad, una de las propiedades de los líquidos que se define como la capacidad de
evaporarse fácilmente, el componente volátil es el alcohol etílico puesto este tiene un solo
puente de hidrogeno, mientras el agua tiene la capacidad de formar dos puentes de
hidrogeno de lo cual se infiere que las interacciones entre las moléculas de agua serán mas
fuertes entre si, por ello al destilar la solución etanólica conforme el tiempo transcurre, se
separan y condensan los vapores, y la cantidad del solución en el balon de destilación va
disminuyendo progresivamente, al igual que el contenido del etanol componente más
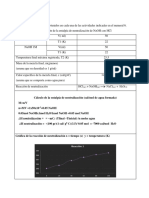
volátil en el líquido. Los resultados muestran una incongruencia entre el porcentaje
teórico (40%), y el porcentaje obtenido experimentalmente (27,5%), lo cual se expresa en
un porcentaje de error del 31,2%, en este caso particular es necesario plantear un análisis
de las irregularidades en el contenido de alcohol etílico reportado por parte del fabricante,
ya que el porcentaje de etanol experimental del grupo 9 que trabajo con la misma
muestra fue del 26%, coincide en gran medida con el valor obtenido en nuestro grupo;
permitiendo afirmar que la confiabilidad de la bebida alcohólica es bastante baja.
Añadiendo el hecho de que es contradictorio tan bajo costo ($10.000 pesos colombianos)
con respecto al supuestamente alto contenido de etanol (40%). En cuanto al análisis
estadístico de los grupos cuya bebida alcohólica fue Néctar rojo con un porcentaje de
etanol teórico del 29%, los resultados arrojados indican un valor bastante aproximado al
valor real, ya que los grupos 4 (25.65 %), 5 (25 %), 6 (24.06 %) y 8 (30%) tienen un
porcentaje de error relativamente bajo que se encuentra entre 1% y 16.03 %. Respecto al
grupo 8 es uno de los valores más acertados aunque el valor del etanol experimental (30
%) sobrepasa el porcentaje de etanol teórico (29 %); el grupo 3 (el cual obtuvo un 12% de
etanol experimental), se aleja bastante del valor real y tiene un porcentaje de error alto
(57.59 %), lo cual se puede deber a que la temperatura no llego hasta los 92 °C y por ello
no se obtuvo todo el etanol, lo que significa que en el matraz donde se encontraba la
bebida alcohólica, aún quedaba etanol; por la consideración anterior el resultado del
grupo 3 fue descartado para el análisis estadístico. Dicho análisis dio como resultado una
media de 26,18 % de contenido de alcohol, con una desviación estándar de 2,631 y un
error relativo del 9,72%, lo que nos indica que a pesar de ser un licor reconocido en el
mercado, su contenido de alcohol es muy variable, sin embargo con valores cercanos al
reportado en la etiqueta.
2. 5. CONCLUSIONES 1. La destilación es un método de separación de mezclas, útil para
purificar sustancias. En este caso la destilación simple es importante para separar los
componentes volátiles sin tener que recurrir a métodos más complicados. 2. El objetivo
principal de la destilación es separar una mezcla de varios componentes aprovechando sus
distintas volatilidades, o bien separar los componentes volátiles de los no volátiles. 3. Para
realizar dicha separación es necesario saber las propiedades físicas de la sustancia, como
en este caso el punto de ebullición y de fusión. 4. La destilación simple permite verificar la
veracidad del contenido de alcohol de la bebida alcohólica que se trabajó, mostrando una
disparidad entre el contenido teórico (40%), y el contenido experimental (27,5%),
expresado en un error del 31,25%. 5. Esta separación se pudo llevar a cabo gracias a la
diferencia de puntos de ebullición entre el agua y el alcohol. 6. Para llevar a cabo el
proceso de separación se aprovechó la volatilidad de los componentes de la bebida
alcohólica, en este caso el más volátil en esta mezcla es el alcohol etílico. 7. El porcentaje
de etanol obtenido depende la bebida alcohólica que se trabaje, si esta está adulterada o
no, igualmente depende de que el procedimiento se realice correctamente, de lo contrario
se puede desperdiciar cantidades de etanol de dicha bebida. 8. Este procedimiento facilita
la determinación del grado alcohólico de una bebida a partir de la densidad del destilado,
en el caso trabajado experimentalmente se obtiene una densidad de 0,96g/ml que refiere
un contenido de etanol del 27,5%. 9. Es importante manejar la técnica de destilación
simple (como proceso físico de separación) debido a que esta nos permite separar
fácilmente una mezcla de líquidos con diferentes puntos de ebullición. BIBLIOGRAFÍA [1]
Destilación Simple: Laboratorio de procesos de separación. Universidad Iberoamericana
de México. http://web.mac.com/fjguerra/Personal/8o_Semestre_files/DS.pdf
3. 6. [2] Tablas de densidades, puntos de fusión / ebullición, calores específicos y latentes, de
diversas sustancias.
DISCUSION DE RESULTADOS DILUCIONES
Se pudo observar que de la muestra principal a la muestra final la tonalidad del color fue variando
dejando como resultado una disminución en la intensidad de color de allí se podría suponer que la
concentración también disminuyo.
También podría gustarte
- Plantas piloto de tratamiento de agua potable y agua residualDe EverandPlantas piloto de tratamiento de agua potable y agua residualCalificación: 5 de 5 estrellas5/5 (1)
- Informe Destilación de VinoDocumento4 páginasInforme Destilación de VinoRosliana González100% (1)
- Pre Informe DestilacionDocumento11 páginasPre Informe DestilacionJavier ContrerasAún no hay calificaciones
- Práctica 5 EXTRACCIONDocumento6 páginasPráctica 5 EXTRACCIONJorge Angel S. CastAún no hay calificaciones
- Informe Práctica No. 1. Determinación Gravimétrica de SulfatoDocumento6 páginasInforme Práctica No. 1. Determinación Gravimétrica de Sulfatocamila moncayoAún no hay calificaciones
- Guia de Estudio 2 PDFDocumento5 páginasGuia de Estudio 2 PDFLuisa Rojas100% (1)
- Informe de RecristalizacionDocumento7 páginasInforme de RecristalizacionEli Fuertes67% (3)
- CuestionarioDocumento2 páginasCuestionarioLuis ArroyoAún no hay calificaciones
- Extracción Sólido-Líquido Resumen, Conclusiones y RecomendacionesDocumento3 páginasExtracción Sólido-Líquido Resumen, Conclusiones y RecomendacionesLuis MidWan0% (1)
- Transporte de MasaDocumento3 páginasTransporte de MasaJorge MuñozAún no hay calificaciones
- Resultados y DiscusionesDocumento2 páginasResultados y Discusioneselvisescorpio95100% (2)
- Reporte 3 - Destilación FraccionadaDocumento8 páginasReporte 3 - Destilación Fraccionadamario3312100% (1)
- DISCUSIÓN 1 3 DestilacionDocumento8 páginasDISCUSIÓN 1 3 DestilacionJoel MesiasAún no hay calificaciones
- Informe de CristalizacionDocumento12 páginasInforme de Cristalizacionever luis50% (2)
- Informe #10 RecristalizacionDocumento9 páginasInforme #10 RecristalizacionAndrés RodríguezAún no hay calificaciones
- Informe Punto de CongelacionDocumento6 páginasInforme Punto de CongelacionCamila100% (1)
- Practica 3 "Cristalización Por Par de Disolventes"Documento2 páginasPractica 3 "Cristalización Por Par de Disolventes"Ithalya OlveraAún no hay calificaciones
- Discusiones y Conclusiones DestilaciónDocumento1 páginaDiscusiones y Conclusiones DestilaciónCatherine AntonietaAún no hay calificaciones
- Conclusiones-Cuestionario 7Documento2 páginasConclusiones-Cuestionario 7Carla Andrea100% (1)
- Discusión de Informe 2 de QuímicaDocumento3 páginasDiscusión de Informe 2 de QuímicaJvr EnriwellAún no hay calificaciones
- Identificación y Caracterización de Alcoholes y FenolesDocumento8 páginasIdentificación y Caracterización de Alcoholes y FenolesFrancisco Javier Villafaña CorralesAún no hay calificaciones
- Practica de Laboratorio 2 ExtraccionDocumento42 páginasPractica de Laboratorio 2 ExtraccionJhulisa Torrez CondoriAún no hay calificaciones
- Informe de Aldehidos y CetonasDocumento12 páginasInforme de Aldehidos y CetonasHeidy Montes GalarzaAún no hay calificaciones
- Conclusion EsDocumento3 páginasConclusion EsTony Oliver100% (2)
- Informe de CristalizaciónDocumento7 páginasInforme de CristalizaciónJefferson Cárdenas100% (13)
- Informe 1 Pruebas de SolubilidadDocumento16 páginasInforme 1 Pruebas de SolubilidadAndresTobarAún no hay calificaciones
- Informe de Recristalizacion 1.Documento3 páginasInforme de Recristalizacion 1.braulio tobarAún no hay calificaciones
- Discuciones y Conclusiones S-NaftalaenoDocumento2 páginasDiscuciones y Conclusiones S-NaftalaenoAlexander Anderson100% (1)
- Informe FinalDocumento14 páginasInforme FinalGabriel FloresAún no hay calificaciones
- PracticaDocumento5 páginasPracticaAlex VelazquezAún no hay calificaciones
- Practica de Laboratorio Obtencion de Eter Etilico A Partir de EtanolDocumento8 páginasPractica de Laboratorio Obtencion de Eter Etilico A Partir de EtanolMichelle Jácome Fonseca33% (3)
- Introducción y Resumen - Destilación Por Arrastre de VaporDocumento2 páginasIntroducción y Resumen - Destilación Por Arrastre de VaporLuis MidWan0% (1)
- Informe CristalizacionDocumento25 páginasInforme CristalizacionMaria Jose Pelaez MartinezAún no hay calificaciones
- Informe Analisis Elemental OrganicoDocumento16 páginasInforme Analisis Elemental Organicofabrycio ch100% (2)
- Objetivo Marco Teorico Conclusiones SolubilidadDocumento4 páginasObjetivo Marco Teorico Conclusiones SolubilidadJosman Prite80% (5)
- Química Orgánica Informe n7Documento13 páginasQuímica Orgánica Informe n7Lmo MorAún no hay calificaciones
- Informe Clavos de OlorDocumento5 páginasInforme Clavos de OlorJesus Gerardo Lopez Colman50% (2)
- Informe de Fico II N°5 - Diagrama de Fase Etanol-AguaDocumento14 páginasInforme de Fico II N°5 - Diagrama de Fase Etanol-Aguatalia rodriguezAún no hay calificaciones
- Informe 8 de Destilacion Simple Fraccionada y Arrastre de Vapor BetaDocumento31 páginasInforme 8 de Destilacion Simple Fraccionada y Arrastre de Vapor Betamarco antoniAún no hay calificaciones
- Informe para La Práctica de Laboratorio 3 (Propiedades Coligativas)Documento6 páginasInforme para La Práctica de Laboratorio 3 (Propiedades Coligativas)Francisco Reyes AnaluisaAún no hay calificaciones
- INFORME-7Documento7 páginasINFORME-7AnaisBriggitJacintoChavezAún no hay calificaciones
- Informe de Laboratorio SolubilidadDocumento6 páginasInforme de Laboratorio SolubilidadVlado ManriqueAún no hay calificaciones
- Cuestionario Dra. NigdDocumento9 páginasCuestionario Dra. NigdChristiansito AndresitoAún no hay calificaciones
- Técnicas de Laboratorio CristalizaciónDocumento10 páginasTécnicas de Laboratorio CristalizaciónNicole VizueteAún no hay calificaciones
- Marco Teorico SaponificaciónDocumento5 páginasMarco Teorico SaponificaciónJorge DiazAún no hay calificaciones
- Practica Lab 3-Reacción de SaponificaciónDocumento17 páginasPractica Lab 3-Reacción de SaponificaciónAlejandrp Josue Cardeña Benitez100% (1)
- 1° INFORME: Identificación de CarbohidratosDocumento10 páginas1° INFORME: Identificación de CarbohidratosHarold González RamírezAún no hay calificaciones
- CRISTALIZACIÓN - Marco TeoricoDocumento7 páginasCRISTALIZACIÓN - Marco TeoricoRenzo SanchezAún no hay calificaciones
- Inclusiones VacuolaresDocumento5 páginasInclusiones VacuolaresNataliaAún no hay calificaciones
- ConclusiónDocumento6 páginasConclusiónYANEZ ALVARADO MARIA GUADALUPEAún no hay calificaciones
- Informe Identificación de Muestras OrgánicasDocumento9 páginasInforme Identificación de Muestras OrgánicasDylan Navarro L100% (1)
- Destilacion Por Arrastre de VaporDocumento7 páginasDestilacion Por Arrastre de VaporAlberto Aparicio LopezAún no hay calificaciones
- Práctica 6. Identificación de Grupos Funcionales (Alcoholes, Dobles Enlaces, Aminas, Aldehídos, Cetonas Ácidos Carboxílicos)Documento31 páginasPráctica 6. Identificación de Grupos Funcionales (Alcoholes, Dobles Enlaces, Aminas, Aldehídos, Cetonas Ácidos Carboxílicos)yukyAún no hay calificaciones
- Estequiometria Obtencion de Un CompuestoDocumento13 páginasEstequiometria Obtencion de Un CompuestoKatherine Torrez100% (1)
- Análisis de ResultadosDocumento2 páginasAnálisis de ResultadosJ Mora GañanAún no hay calificaciones
- Practica #2separación de Compuestos OrgánicosDocumento5 páginasPractica #2separación de Compuestos Orgánicossofía cepedaAún no hay calificaciones
- Informe de Laboratorio Módulo I (Laura Ballesteros y Karen Guzmán)Documento9 páginasInforme de Laboratorio Módulo I (Laura Ballesteros y Karen Guzmán)Karen GuzmanAún no hay calificaciones
- Alcohol EsDocumento16 páginasAlcohol EsCarol Alicia Gonzales SiñaniAún no hay calificaciones
- Inf 03 Destilación - V2Documento6 páginasInf 03 Destilación - V2Luzari Aparicio salasAún no hay calificaciones
- Informe de Laboratorio Práctica Destilación Simple de Una Bebida AlcohólicaDocumento13 páginasInforme de Laboratorio Práctica Destilación Simple de Una Bebida AlcohólicaAlexa Pérez CortesAún no hay calificaciones
- Informe Destilación Del VinoDocumento4 páginasInforme Destilación Del VinoinvestestudAún no hay calificaciones
- Práctica de Termódinamica Grupo 6Documento4 páginasPráctica de Termódinamica Grupo 6Yamel PocheAún no hay calificaciones
- Procesamiento de Cerámicos PDFDocumento44 páginasProcesamiento de Cerámicos PDFYolanda GelvezAún no hay calificaciones
- Adhesiòn - Tema N02 Opx IiDocumento6 páginasAdhesiòn - Tema N02 Opx IiCARLOS PAUL GAMBOA CULQUICHICONAún no hay calificaciones
- Practica 4. REACCIONES DE DESHIDRATACIÓN DE ALCOHOLESDocumento3 páginasPractica 4. REACCIONES DE DESHIDRATACIÓN DE ALCOHOLESManuel Mots100% (1)
- Informe 2 Propiedades Coligativas.Documento6 páginasInforme 2 Propiedades Coligativas.CAMILO ANDRES MELO CISNEROSAún no hay calificaciones
- Defectos CristalinosDocumento5 páginasDefectos CristalinosMaximo Vera100% (3)
- Grupo 9 - Cambios de Humectabilidad Con Nanopartículas de SilicepptxDocumento20 páginasGrupo 9 - Cambios de Humectabilidad Con Nanopartículas de SilicepptxJuan Camilo Aguilar MayaAún no hay calificaciones
- Taller 1 2022-1Documento3 páginasTaller 1 2022-1Yerson Yutmar Vargas HuamanAún no hay calificaciones
- Plantas Termosolares Con Ciclos Combinados PDFDocumento6 páginasPlantas Termosolares Con Ciclos Combinados PDFElvis TubonAún no hay calificaciones
- Deshidratación Del Crudo Mediante Tratamiento EléctricoDocumento4 páginasDeshidratación Del Crudo Mediante Tratamiento EléctricoJuliana CastellanosAún no hay calificaciones
- Clase 3 BDocumento16 páginasClase 3 BSilvia MiróAún no hay calificaciones
- Quimica 1Documento10 páginasQuimica 1Fabi Quispe BerrocalAún no hay calificaciones
- Fundamentos de PolimerosDocumento28 páginasFundamentos de PolimerosAltair PerezAún no hay calificaciones
- Reporte 1. Cumeno Eq. 4Documento33 páginasReporte 1. Cumeno Eq. 4mario3312Aún no hay calificaciones
- Leyes de FisicoquimicaDocumento8 páginasLeyes de FisicoquimicaJulioAún no hay calificaciones
- A Que Temperatura Hierve El Agua en Los PolosDocumento6 páginasA Que Temperatura Hierve El Agua en Los PolosSamy NiñoAún no hay calificaciones
- Analisis de TemperaturaDocumento11 páginasAnalisis de TemperaturaFRANKLIN TENORIO GARAMENDI100% (1)
- Problema de Evaporacion Con Epe GrupalDocumento5 páginasProblema de Evaporacion Con Epe GrupalGaby HuamaniAún no hay calificaciones
- Codigos Aplicables en Proyectos de PipingDocumento4 páginasCodigos Aplicables en Proyectos de Pipingmagnata01Aún no hay calificaciones
- 4.3. RMN-HDocumento17 páginas4.3. RMN-HIsabel IbañezAún no hay calificaciones
- 1 Balanceo Por Redox - Numero de OxidaciónDocumento9 páginas1 Balanceo Por Redox - Numero de OxidaciónAntonio piñonAún no hay calificaciones
- Celdas ElectrolíticasDocumento7 páginasCeldas Electrolíticasvicente_torres_1Aún no hay calificaciones
- Electronegatividad: Colegio EmpresarialDocumento3 páginasElectronegatividad: Colegio EmpresarialDani GcAún no hay calificaciones
- Estudio Del Efecto de La Temperatura Sobre La Velocidad de ReaccionDocumento13 páginasEstudio Del Efecto de La Temperatura Sobre La Velocidad de ReaccionJuanCarlosPeñaAyalaAún no hay calificaciones
- VISION INTEGRADA. Anyuly Hurtado.Documento7 páginasVISION INTEGRADA. Anyuly Hurtado.Anyuly Odilin Hurtado100% (1)
- Laboratorio 5 - Quimica Genreal I - Formula Empirica - INFORME PDFDocumento4 páginasLaboratorio 5 - Quimica Genreal I - Formula Empirica - INFORME PDFDavid IraeAún no hay calificaciones
- Taller Parcial 2 2020-2Documento3 páginasTaller Parcial 2 2020-2BREYLIS SOFIA CANTILLO FANEYTE ESTUDIANTE ACTIVOAún no hay calificaciones
- Evaluacion Refraccion Reflexión v1 SCRDocumento1 páginaEvaluacion Refraccion Reflexión v1 SCRMiguel Alfonso ValdiviesoAún no hay calificaciones
- Practica de Laboratorio - Mezclas 3°Documento4 páginasPractica de Laboratorio - Mezclas 3°Nick CahuapazaAún no hay calificaciones