Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Estandarización de Solución de AgNO3 Con Solución de Bromuro de Potasio
Cargado por
NNNDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Estandarización de Solución de AgNO3 Con Solución de Bromuro de Potasio
Cargado por
NNNCopyright:
Formatos disponibles
Estandarización de solución de AgNO3 con solución de
Bromuro de potasio:
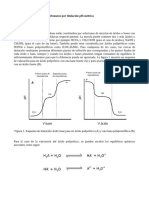
Correspondiente a la estandarización del AgNO3, se agregó 8,20 mL de AgNO3
para la obtención del punto de equivalencia presente en la reacción de titulación
(fig.), tal punto de equivalencia físicamente es indicado por una coloración rojo
ladrillo similar a la muestra de referencia BK2, por lo tanto, se obtiene una
concentración de 0,0610 M AgNO3.
𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑
Método Mohr:
Solución de Bromuro:
En la valoración de solución de Bromuros (Br-), se emplearon un total de 9,7mL
de solución de AgNO3, consecuentemente se restan a este volumen de
valoración 0,1mL AgNO3, correspondiente al volumen de valoración de solución
Blanco (BK2); determinada sustracción se debe a la cantidad de moles neta de
iones Ag+, que reaccionaron directamente con la cantidad de moles de
bromuros y no con la solución indicador del punto de equivalencia en la
valoración, por lo tanto, se obtiene un volumen de equivalencia de 9,60 mL de
AgNO3 (fig. ), sucesivamente a través de relaciones estequiometricas se
estable una concentración de Bromuros de 0,0586M (fig. ).
𝑽𝒐𝒍𝑹𝒙𝒏 = 𝑽𝒐𝒍𝒗𝒂𝒍 − 𝑽𝒐𝒍𝑩𝒍𝒂𝒏𝒄𝒐
𝑽𝒐𝒍𝑹𝒙𝒏 = 𝟗, 𝟕𝒎𝑳 − 𝟎, 𝟏𝒎𝑳 = 𝟗, 𝟔𝒎𝑳
𝒎𝒐𝒍 𝑩𝒓− =
𝑀𝑩𝒓− =
Solución de Haluros:
𝟎, 𝟎𝟔𝟏𝟎 𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑 𝟏 𝒎𝒐𝒍 𝑨𝒈+ 𝟏 𝒎𝒐𝒍 𝑯𝒂𝒍𝒖𝒓𝒐𝒔
𝒎𝒐𝒍 𝑯𝒂𝒍𝒖𝒓𝒐𝒔 = ( )( )( ) 𝒓𝒐𝒔
𝟏𝑳 𝟏 𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑 𝟏 𝒎𝒐𝒍 𝑨𝒈+
𝑀𝑲𝑩𝒓 == 𝟎, 𝟎
Estandarización de solución de KSCN con solución de AgNO3:
Correspondiente a la estandarización del KSCN, se agregó 9,30 mL de KSCN a
10,00mL de AgNO3 para la obtención del punto de equivalencia presente en la
reacción de titulación (fig.), tal punto de equivalencia físicamente es indicado por
una coloración rosada acorde a la reacción del KSCN con el indicador Fe+2, por
lo tanto, se obtiene una concentración de 0,0656 M KSCN.
𝟎, 𝟎𝟔𝟏𝟎 𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑 𝟏 𝒎𝒐𝒍 𝑨𝒈+ 𝟏 𝒎𝒐𝒍 𝑺𝑪𝑵−
𝒎𝒐𝒍 𝑲𝑺𝑪𝑵 = (𝟎𝒙𝟏𝟎−𝟑 𝑳) ( )( )( )
𝟏𝑳 𝟏 𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑 𝟏 𝒎𝒐𝒍 𝑨𝒈+
Método Volhard:
Solución de Bromuro:
Al adicionarse 1,5 veces la solución de valoración del AgNO3 por método Mohr
(14,55mL) a la solución de Bromuros, se emplearon 3,90 mL de KSCN para la
valoración de los iones Ag+ en exceso presente en la solución problema,
consecuentemente se determina la cantidad de sustancia (mol) de Ag + que
reaccionan con los bromuros presentes en la solución, dicho proceso consiste
en la cuantificación de la cantidad de moles de Ag+ adicionados a la solución
de bromuros (fig.) menos la cantidad de moles de Ag+ reaccionados con el
KSCN (fig.), por lo tanto, se determina estequiometricamente una cantidad de
sustancia de 6,232x10-4 mol Br- a un volumen de 10,00mL de muestra,
sucesivamente se cuantifica una concentración de bromuros de 0,06232M
(fig.).
+ −𝟑
𝟎, 𝟎𝟔𝟏𝟎 𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑 𝟏 𝒎𝒐𝒍 𝑨𝒈+
𝒎𝒐𝒍𝑻𝒐𝒕𝒂𝒍 𝑨𝒈 = (𝟏𝟒, 𝟓𝟓𝒙𝟏𝟎 𝑳 ) ( )( )
𝟏𝑳 𝟏 𝒎𝒐𝒍 𝑨𝒈𝑵𝑶𝟑
= 𝟖, 𝟖𝟕𝟔𝒙𝟏𝟎−𝟒 𝒎𝒐𝒍 𝑨𝒈+
Análisis estadístico de datos grupal
También podría gustarte
- EJERCICIOS 11 - Aplicación de La Precipitación y ComplejosDocumento5 páginasEJERCICIOS 11 - Aplicación de La Precipitación y ComplejosNelsy Soto Giraldo100% (1)
- Guía: GravimetríaDocumento4 páginasGuía: GravimetríaRulos QueteimportaAún no hay calificaciones
- Argentometria Parte I - Preparación y Valoración de Una Solución de Nitrato de Plata.Documento7 páginasArgentometria Parte I - Preparación y Valoración de Una Solución de Nitrato de Plata.Miller EspinozaAún no hay calificaciones
- DicromatometriaDocumento5 páginasDicromatometriaEliecer GonzalezAún no hay calificaciones
- Curvas de Titulacion PrecipitacionDocumento20 páginasCurvas de Titulacion PrecipitacionKarlos RamirezAún no hay calificaciones
- Práctica 5 Análisis Carbonatos BicarbonatosDocumento4 páginasPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaAún no hay calificaciones
- Efecto de Ion ComúnDocumento5 páginasEfecto de Ion ComúnKarlos RamirezAún no hay calificaciones
- Soluciones BufferDocumento4 páginasSoluciones Buffershunashi lorenzanaAún no hay calificaciones
- Aplicaciones de Las Titulaciones PotenciométricasDocumento8 páginasAplicaciones de Las Titulaciones Potenciométricas708170Aún no hay calificaciones
- ProblemasDocumento6 páginasProblemasClaudia BolijeAún no hay calificaciones
- Practico 3 - QMC 106 2020Documento5 páginasPractico 3 - QMC 106 2020Luis Miguel Tarqui0% (2)
- Titulaciones ArgentométricasDocumento4 páginasTitulaciones Argentométricasnata fallaAún no hay calificaciones
- Guía Principios de Química IIDocumento123 páginasGuía Principios de Química IIDouglas Nuñez100% (1)
- Problemas Espectroscopia 2021 - 1Documento7 páginasProblemas Espectroscopia 2021 - 1Uriel LujanAún no hay calificaciones
- 11 Titulaciones Por Precipitación Mediante PotenciometríaDocumento2 páginas11 Titulaciones Por Precipitación Mediante PotenciometríaDavid Garcia0% (1)
- Problemas de GravimetriaDocumento1 páginaProblemas de GravimetriaLeidy Karen Canaza100% (1)
- Taller Primer CorteDocumento2 páginasTaller Primer Cortesantiago cardonaAún no hay calificaciones
- Teoría Informe Método de MohrDocumento2 páginasTeoría Informe Método de MohrSamuel Garcia AvilaAún no hay calificaciones
- Determinacion Del Hierro Como Oxido FerricoDocumento12 páginasDeterminacion Del Hierro Como Oxido FerricoDalhia Susan Romero Villanueva100% (2)
- Cuestionario 7Documento2 páginasCuestionario 7erizoAún no hay calificaciones
- Práctica 6: Determinación de Ni en Una Muestra Comercial Por Gravimetría.Documento18 páginasPráctica 6: Determinación de Ni en Una Muestra Comercial Por Gravimetría.Enrique DelgadoAún no hay calificaciones
- Determinación de Hierro en Una Muestra Por GravimetriaDocumento4 páginasDeterminación de Hierro en Una Muestra Por GravimetriaGabriela PadillaAún no hay calificaciones
- Volumetría Por Precipitación 1Documento3 páginasVolumetría Por Precipitación 1Juan Luciano100% (1)
- Comparación de Métodos de Volumetría de Precipitación para Análisis de Cloruro en Muestra Comercial de SueroDocumento6 páginasComparación de Métodos de Volumetría de Precipitación para Análisis de Cloruro en Muestra Comercial de SueroNatalia León PatiñoAún no hay calificaciones
- Practica º 4 Titulaciones Potenciometricas de Precipitacion Determinacion de ClorurosDocumento11 páginasPractica º 4 Titulaciones Potenciometricas de Precipitacion Determinacion de ClorurosLuis CalcinaAún no hay calificaciones
- Determinación de Cloruros en Bebidas IsotónicasDocumento5 páginasDeterminación de Cloruros en Bebidas IsotónicasJorge LuisAún no hay calificaciones
- Unidad # 6 Potenciometria DirectaDocumento25 páginasUnidad # 6 Potenciometria DirectaDarkcacherAún no hay calificaciones
- Cuestionario N º7, 8, 9 y 10Documento12 páginasCuestionario N º7, 8, 9 y 10Jean Carla Canedo Zambrana100% (2)
- VOLUMETRÍA POR PRECIPITACIÓN Laboratorio InstrumentalDocumento6 páginasVOLUMETRÍA POR PRECIPITACIÓN Laboratorio InstrumentalDaniel Tancara QuispeAún no hay calificaciones
- Taller VolumetríaDocumento2 páginasTaller VolumetríaSergio GomezAún no hay calificaciones
- U2 EjerciciosDocumento28 páginasU2 Ejerciciosbyron100% (1)
- Taller Precipitación Agosto2020Documento2 páginasTaller Precipitación Agosto2020Joel CastilloAún no hay calificaciones
- Informe Analisis Metodo de VolhardDocumento9 páginasInforme Analisis Metodo de Volhardjhon esteban rodriguezAún no hay calificaciones
- Desea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasDocumento1 páginaDesea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasBrando Kevin Palomino MorenoAún no hay calificaciones
- Capitulo 4 FUNDAMENTOS DE QUÍMICA ANALÍTICA SKOOG - WESTDocumento7 páginasCapitulo 4 FUNDAMENTOS DE QUÍMICA ANALÍTICA SKOOG - WESTJuana Estefania Lopez DumesAún no hay calificaciones
- Taller 4 - Kps y Titulaciones de Precipitación 2018Documento3 páginasTaller 4 - Kps y Titulaciones de Precipitación 2018Erich AckermannAún no hay calificaciones
- Informe 4. Titulaciones de Precipitación FINALxDocumento5 páginasInforme 4. Titulaciones de Precipitación FINALxCamiloAún no hay calificaciones
- Ejercicios de Volumetria Por NeutralizacionDocumento2 páginasEjercicios de Volumetria Por NeutralizacionKatty Rojas DiazAún no hay calificaciones
- Gravimetría de Precipitacion Determinación de Calcio en CementoDocumento2 páginasGravimetría de Precipitacion Determinación de Calcio en CementoAdri EmmaAún no hay calificaciones
- Informe 3Documento10 páginasInforme 3Stefano D'AmicoAún no hay calificaciones
- Determinacion de MagnesioDocumento16 páginasDeterminacion de MagnesioRebeca Moran Campos50% (2)
- 9 Determinacion de Cloruros Mediante Los Metodos de Precipitacion Mohr y VolhardDocumento3 páginas9 Determinacion de Cloruros Mediante Los Metodos de Precipitacion Mohr y VolhardmarinagbelmontAún no hay calificaciones
- Lab Analisis 2 Determinación Del Error Relativo de La ConcentraciónDocumento9 páginasLab Analisis 2 Determinación Del Error Relativo de La Concentraciónjamop7Aún no hay calificaciones
- Teoría de Formacion de Complejos PDFDocumento5 páginasTeoría de Formacion de Complejos PDFgerson95Aún no hay calificaciones
- Informe Metodos Instrumentales de Analisis QuimicoDocumento4 páginasInforme Metodos Instrumentales de Analisis QuimicoGustavo Encina TroncosoAún no hay calificaciones
- Tema 3 Problemas 20 21 Acido BaseDocumento4 páginasTema 3 Problemas 20 21 Acido BaseCHOLOSIMEONEAún no hay calificaciones
- Problemario de Análisis Farmacéutico 2016 PDFDocumento68 páginasProblemario de Análisis Farmacéutico 2016 PDFEstefany GuerreroAún no hay calificaciones
- Volumetría de Oxido - Reducción IDocumento10 páginasVolumetría de Oxido - Reducción IingrossAún no hay calificaciones
- Guia Ejercicios Volumetria Acido-Base 83758Documento1 páginaGuia Ejercicios Volumetria Acido-Base 83758Matias Rubilar CortesAún no hay calificaciones
- Valoraciones Ácido-Base PotenciometricoDocumento5 páginasValoraciones Ácido-Base PotenciometricoDeiby ZambranoAún no hay calificaciones
- Valoraciones Por PrecipitaciónDocumento3 páginasValoraciones Por PrecipitaciónLenin Gil GilAún no hay calificaciones
- Aplicaciones de La PermanganometríaDocumento8 páginasAplicaciones de La PermanganometríaSebastian VillacresAún no hay calificaciones
- Informe de Lab.4 - Equilibrio QuimicoDocumento6 páginasInforme de Lab.4 - Equilibrio QuimicoNIDIAN LIZETH NARVAEZ GARCIAAún no hay calificaciones
- GRAVIMETRIADocumento1 páginaGRAVIMETRIAGregg JamesAún no hay calificaciones
- EstandarizacionDocumento14 páginasEstandarizacionJessiica Cano100% (1)
- Proyecto 3 Agua OxigenadaDocumento6 páginasProyecto 3 Agua OxigenadaHumbertoSalamancaAún no hay calificaciones
- Informe Pka Rojo de MetiloDocumento8 páginasInforme Pka Rojo de MetilomichAún no hay calificaciones
- Laboratorio 2 PDFDocumento7 páginasLaboratorio 2 PDFLu NaaraAún no hay calificaciones
- Taller N 1 Uv Vis y CalibracionDocumento2 páginasTaller N 1 Uv Vis y Calibracionmanuela Guzmán ochoaAún no hay calificaciones
- Capitulo X - Gravimetria Ii - AplicacionesDocumento8 páginasCapitulo X - Gravimetria Ii - AplicacionesMarco Antonio Sicard arceAún no hay calificaciones
- GravimetríaDocumento13 páginasGravimetríaCindy Mateo SoberanisAún no hay calificaciones
- Practica19 PDFDocumento9 páginasPractica19 PDFvalentina del valleAún no hay calificaciones
- CapacidadDocumento1 páginaCapacidadNNNAún no hay calificaciones
- Programa LPAQ 1000027 Grupo 9 2019-1Documento3 páginasPrograma LPAQ 1000027 Grupo 9 2019-1NNNAún no hay calificaciones
- Estandarización de Solución de AgNO3 Con Solución de Bromuro de PotasioDocumento2 páginasEstandarización de Solución de AgNO3 Con Solución de Bromuro de PotasioNNNAún no hay calificaciones
- Reglamento-Laboratorio 317Documento11 páginasReglamento-Laboratorio 317Bryan Steven González ArévaloAún no hay calificaciones
- Informe Laboratorio #3 Nicolás Rengifo y Sebastián ForeroDocumento10 páginasInforme Laboratorio #3 Nicolás Rengifo y Sebastián ForeroNNNAún no hay calificaciones
- MANUAL DE SEGURIDAD LABORATORIOS 31-10-2012 - Final PDFDocumento32 páginasMANUAL DE SEGURIDAD LABORATORIOS 31-10-2012 - Final PDFIsabelCamaAún no hay calificaciones
- Volumetria RedoxDocumento3 páginasVolumetria RedoxNNNAún no hay calificaciones
- CapacidadDocumento4 páginasCapacidadNNNAún no hay calificaciones
- Bitacora Circuito RC Con Osciloscopio - Documentos de GoogleDocumento6 páginasBitacora Circuito RC Con Osciloscopio - Documentos de GoogleNNNAún no hay calificaciones
- Respuestas A Problemas Harris Cap 11,12,13Documento2 páginasRespuestas A Problemas Harris Cap 11,12,13SebastianForeroAún no hay calificaciones
- CapacidadDocumento1 páginaCapacidadNNNAún no hay calificaciones
- CapacidadDocumento4 páginasCapacidadNNNAún no hay calificaciones
- CapacidadDocumento4 páginasCapacidadNNNAún no hay calificaciones
- La Rueda de La VidaDocumento1 páginaLa Rueda de La VidaNNNAún no hay calificaciones
- G1tema1espacios VectorialesDocumento13 páginasG1tema1espacios VectorialesAntonio Hernando MañeruAún no hay calificaciones
- Presentación Equilibrio Líquido-VaporDocumento12 páginasPresentación Equilibrio Líquido-VaporNNNAún no hay calificaciones
- Seminario MUESTREO Y PRETRATAMIENTOSDocumento24 páginasSeminario MUESTREO Y PRETRATAMIENTOSconmenplatAún no hay calificaciones
- Ejercicios Resueltos de Espacios VectorialesDocumento6 páginasEjercicios Resueltos de Espacios VectorialesjaprofesorAún no hay calificaciones
- Taller 03 SolucionarioDocumento1 páginaTaller 03 SolucionarioNNNAún no hay calificaciones
- Solucion Espacios VectorialesDocumento12 páginasSolucion Espacios VectorialesedyelroAún no hay calificaciones
- Autoevaluacion Unidades y Variables de Proceso PDFDocumento3 páginasAutoevaluacion Unidades y Variables de Proceso PDFNNNAún no hay calificaciones
- Informe Laboratorio #2Documento3 páginasInforme Laboratorio #2NNNAún no hay calificaciones
- VOLUMETRIA DE NEUTRALIZACIÓN - Estudiantes PDFDocumento8 páginasVOLUMETRIA DE NEUTRALIZACIÓN - Estudiantes PDFNNNAún no hay calificaciones
- Principal PDFDocumento107 páginasPrincipal PDFNNNAún no hay calificaciones
- Seminario Muest y PretratamientosDocumento2 páginasSeminario Muest y PretratamientosNNNAún no hay calificaciones
- 4079-Texto Del Artículo-15716-1-10-20180306Documento10 páginas4079-Texto Del Artículo-15716-1-10-20180306NNNAún no hay calificaciones
- Analisis Grafico2Documento9 páginasAnalisis Grafico2robefiAún no hay calificaciones
- 2 BTO Quimica Examen Ud 5 Equilibrio RESUELTODocumento7 páginas2 BTO Quimica Examen Ud 5 Equilibrio RESUELTOhectorAún no hay calificaciones
- Taller de Química OrgánicaDocumento4 páginasTaller de Química OrgánicaAndrea RodríguezAún no hay calificaciones
- Bromuro de MetiloDocumento56 páginasBromuro de MetiloTomas Ignacio Scagliotti100% (1)
- Cuentos en KichwaDocumento4 páginasCuentos en KichwaguidoaceroAún no hay calificaciones
- Manual Tratamientos Fitosanitarios 2016Documento215 páginasManual Tratamientos Fitosanitarios 2016Jesus Serrano LaraAún no hay calificaciones
- Informe de Quimica 2Documento25 páginasInforme de Quimica 2Andrea GilAún no hay calificaciones
- Metodos de ExtraccionDocumento3 páginasMetodos de ExtraccionCRISTIAN ANDRES LEDESMA CAÑONAún no hay calificaciones
- Taller de Nomenclatura Quimica 2020-2Documento3 páginasTaller de Nomenclatura Quimica 2020-2juanes cortesAún no hay calificaciones
- Evidencia 7 Respuesta A Preguntas Sobre Volumetrías de PrecipitaciónDocumento4 páginasEvidencia 7 Respuesta A Preguntas Sobre Volumetrías de PrecipitaciónDavid Cubillos Gómez100% (1)
- Metodo de Ion SelectivoDocumento6 páginasMetodo de Ion SelectivoOmar_Javier_8736Aún no hay calificaciones
- HannaDocumento20 páginasHannaMaria Jose Pasten BravoAún no hay calificaciones
- Liquidos ReveladoresDocumento5 páginasLiquidos ReveladoresTanairi EspinaAún no hay calificaciones
- Libro 1Documento23 páginasLibro 1Lopez R JaimeAún no hay calificaciones
- Guia QOII PDFDocumento40 páginasGuia QOII PDFkmga24Aún no hay calificaciones
- Taller 2 - Gravimetría - Equilibrio de Solubilidad y Volumetría de PrecipitaciónDocumento4 páginasTaller 2 - Gravimetría - Equilibrio de Solubilidad y Volumetría de PrecipitaciónPablo E Bravo SAún no hay calificaciones
- Formulas QuimicasDocumento23 páginasFormulas QuimicasDlcm Born To WinAún no hay calificaciones
- Tema 2 - HalógenosDocumento22 páginasTema 2 - HalógenosMario Jesus Salvatierra MuñozAún no hay calificaciones
- Guía 4. Problemario de Gravimetría 2013Documento8 páginasGuía 4. Problemario de Gravimetría 2013DomingoMillán0% (1)
- Problema de AQC1Documento3 páginasProblema de AQC1Leandro MontesAún no hay calificaciones
- Gravimrtria de PrecepitaciónDocumento16 páginasGravimrtria de Precepitaciónvictorerney25% (4)
- Cuadro Compuesto de Electroforesis FinalDocumento13 páginasCuadro Compuesto de Electroforesis FinalgiovanniAún no hay calificaciones
- Determinación de Cloruros Método de FajansDocumento10 páginasDeterminación de Cloruros Método de FajansSanti melendez Ana isabelAún no hay calificaciones
- Ejercicios Solubilidad Con RtaDocumento2 páginasEjercicios Solubilidad Con RtaAura Ballesteros MontealegreAún no hay calificaciones
- Catalogo de Equipos ProMinent 2011 PDFDocumento750 páginasCatalogo de Equipos ProMinent 2011 PDFMiguel Matias ReineroAún no hay calificaciones
- Actividad 6 Ejercicios Sobre Las NomenclaturasDocumento5 páginasActividad 6 Ejercicios Sobre Las NomenclaturasJess CamachoAún no hay calificaciones
- A6 NomenclaturaDocumento3 páginasA6 NomenclaturaQuimyTecAún no hay calificaciones
- Aniones Grupo 3Documento2 páginasAniones Grupo 3Eduardo Condeña Cachay100% (1)
- Determinación de Potenciométrica de Cloruro en Orina Humana y Suero FisiológicoDocumento5 páginasDeterminación de Potenciométrica de Cloruro en Orina Humana y Suero FisiológicoJoan Stiven Astudillo VAún no hay calificaciones
- Informe 2 Cloruro en Orina HumanaDocumento12 páginasInforme 2 Cloruro en Orina HumanaDuvan IbarguenAún no hay calificaciones
- Fomulación y Nomenclatura QI ExtraDocumento9 páginasFomulación y Nomenclatura QI ExtraVanilla TriggeredAún no hay calificaciones