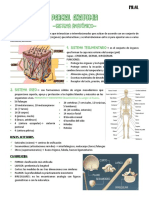
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
El Mecanismo de Accion de La Enolasa
Cargado por
Andrea MaloTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
El Mecanismo de Accion de La Enolasa
Cargado por
Andrea MaloCopyright:
Formatos disponibles
MECANISMO DE ACCION DE LA ENOLASA
Otra enzima glucolitica, la enolasa, cataliza la deshidratación reversible del 2-fosfoglicerato a fosfoenolpiruvato:
La enolasa de levadura (Mr 93.316) es un dimero con 436 residuos de aminoácidos por subunidad, la reacción de la enolasa ilustra un
tipo de catálisis por ion metálico y también proporciona un ejemplo de catálisis acido base general y de estabilidad del estado de
transición, la reacción tiene lugar en dos etapas (Figura (a)). En primer lugar el residuo Lys345 actúa como un catalizador acido general,
cediendo un protón al grupo –OH saliente. El protón en el C-2 del 2-fosfoglicerato no es muy acídico, por lo que no se atre fácilmente, sin
embargo en el sitio activo de la enzima, el 2-fosfoglicerato experimenta interacciones ionicas fuertes con dos iones Mg2+ unidos (Figura
(b)), que convierten el protón de C-2 en mas acídico (disminuye su pKa) lo que hace más fácil su extracción. Enlaces de hidrogeno con
otros residuos aminoácidos del sitio activo también contribuyen al mecanismo global. Las diversas interacciones estabilizan
efectivamente tanto el intermedio enolato como el estado de transición que precede a su formación.
Lys345 capta un Glu211 facilita la
protón mediante eliminación del
catálisis básica grupo-OH mediante
general. Dos iones catálisis dada
estabilizan el general.
intermedio enolico
resultante.
(a) 2-Fosfoglicerato unido al enzima
Andrea Malo Guadarrama, IBT 4 “A” Biocatálisis
Reacción en dos pasos catalizada por la enolasa. (a) Mecanismo mediante el que se convierte el 2-
fosfoglicerato (2-PGA) en fosfoenolpiruvato por la enolasa. El grupo carboxilo del 2-PCA está coordinado por
dos iones magnesio en el sitio activo, (b) El sustrato, 2-PCA, en relación a los iones magnesio, Lys345 y Glu211
en el sitio activo de la enolasa.
El nitrógeno se muestra en azul y el fosforo en naranja; no se muestran los átomos de hidrogeno (PDB ID
lONE).
Andrea Malo Guadarrama, IBT 4 “A” Biocatálisis
También podría gustarte
- Examen Micro.Documento5 páginasExamen Micro.Luis ArroyoAún no hay calificaciones
- Ensayos QuimicosDocumento5 páginasEnsayos QuimicosFrank BarreraAún no hay calificaciones
- Esquema CatabolismoDocumento10 páginasEsquema CatabolismoBegoña FolAún no hay calificaciones
- Buenas Practicas en La Produccion de AlpacasDocumento56 páginasBuenas Practicas en La Produccion de AlpacasDamian Arcos100% (1)
- Fisiologia Del RumenDocumento59 páginasFisiologia Del RumenNatalia Tabilo100% (1)
- Aplicación de Las Reacciones Ullmann y UllmanneFinkelstein para La SíntesisDocumento10 páginasAplicación de Las Reacciones Ullmann y UllmanneFinkelstein para La SíntesisDk-AngelAún no hay calificaciones
- Unidad IV. Alcoholes Fenoles Eteres y Compuestos RelacionadosDocumento49 páginasUnidad IV. Alcoholes Fenoles Eteres y Compuestos RelacionadosFabiana DazaAún no hay calificaciones
- Bioca Practica 5Documento11 páginasBioca Practica 5Alberto CoronadoAún no hay calificaciones
- Propiedades Químicas y Digestión Enzimática de Las ProteínasDocumento5 páginasPropiedades Químicas y Digestión Enzimática de Las ProteínasNoriega VictoriaAún no hay calificaciones
- Bioquimica Metabolica - L16.Degradacion de ProteinasDocumento3 páginasBioquimica Metabolica - L16.Degradacion de ProteinasBryan Alejandro Quispe Vargas33% (3)
- Conocimientos Basicos Del Caballo PDFDocumento20 páginasConocimientos Basicos Del Caballo PDFAlvaro Togni BonillaAún no hay calificaciones
- Pudrición Blandasixitna inDocumento16 páginasPudrición Blandasixitna inJoguard LofcraftAún no hay calificaciones
- TRIPSINADocumento1 páginaTRIPSINAJorge HueichaAún no hay calificaciones
- Equipo 7 Práctica 4 Electroforesis RevisadoDocumento14 páginasEquipo 7 Práctica 4 Electroforesis RevisadoSamuel SosaAún no hay calificaciones
- Balantidium ColiDocumento4 páginasBalantidium ColiWendy MoralesAún no hay calificaciones
- Intoxicación Por OrganofosforadosDocumento18 páginasIntoxicación Por OrganofosforadosKatherine HernandezAún no hay calificaciones
- INFORME N1 Extraccion ADNDocumento8 páginasINFORME N1 Extraccion ADNAnDrew DGAún no hay calificaciones
- Impacto de La Biotecnología en La Inmunología - EnsayoDocumento4 páginasImpacto de La Biotecnología en La Inmunología - EnsayoÁngel SotoAún no hay calificaciones
- Patologias Causadas Por ProteosomasDocumento4 páginasPatologias Causadas Por ProteosomasLuis Palacios Ramirez100% (1)
- Que Son Las AminoacidopatiasDocumento30 páginasQue Son Las AminoacidopatiasCarolinaAún no hay calificaciones
- Hemólisis PrácticaDocumento7 páginasHemólisis PrácticaMariana García GuzmánAún no hay calificaciones
- Leche OrganicaDocumento11 páginasLeche OrganicaLuz Mery BaqueroAún no hay calificaciones
- Bilirrubina TotalDocumento7 páginasBilirrubina TotalLendiMaidanyGomezAún no hay calificaciones
- Integracion Metabólica Bioquimica UBADocumento21 páginasIntegracion Metabólica Bioquimica UBAXXAún no hay calificaciones
- Ganaderia Biotecnologias Reproductivas en Bovinos Parte IDocumento8 páginasGanaderia Biotecnologias Reproductivas en Bovinos Parte Icamilo torradoAún no hay calificaciones
- Resultados Practica 4 Bioq FescDocumento1 páginaResultados Practica 4 Bioq FescMónica Campuzano ArmstrongAún no hay calificaciones
- Alteración de EnzimasDocumento3 páginasAlteración de EnzimasMariana LizzethAún no hay calificaciones
- HemoparasitosisDocumento99 páginasHemoparasitosisEbyAún no hay calificaciones
- Practica 6 Analisis de Vitaminas y MineralesDocumento5 páginasPractica 6 Analisis de Vitaminas y MineralesLuis BahachilleAún no hay calificaciones
- Proyecto Toxoplasmosis CorregidoDocumento65 páginasProyecto Toxoplasmosis Corregidoyisel florianAún no hay calificaciones
- Minerales Fisiologia AnimalDocumento14 páginasMinerales Fisiologia AnimaljoséAún no hay calificaciones
- ProtozoologiaDocumento30 páginasProtozoologiamorenoandyAún no hay calificaciones
- Microbiologia General IDocumento45 páginasMicrobiologia General IAnthonio MothaAún no hay calificaciones
- Manual de Analitica III 2 de MarzoDocumento56 páginasManual de Analitica III 2 de MarzoCarlos AyonAún no hay calificaciones
- Jugos GastricosDocumento8 páginasJugos GastricosBryan Giovanny ArmentaAún no hay calificaciones
- 1.estructura de LípidosDocumento37 páginas1.estructura de LípidosSophie100% (1)
- Los CarbohidratosDocumento22 páginasLos CarbohidratosGilberto Gutierrez RivasAún no hay calificaciones
- ProteinasDocumento7 páginasProteinascarolm1pAún no hay calificaciones
- ProtozoosDocumento213 páginasProtozoosSócrates Millman100% (1)
- Word de Patogenia e InmunidadDocumento4 páginasWord de Patogenia e InmunidadMAGYTACAISAPANTAAún no hay calificaciones
- 06-Manual Procedimientos Bienestar AnimalDocumento39 páginas06-Manual Procedimientos Bienestar AnimalJorge Rol100% (3)
- Glandulas Sexuales Accesorias en GatosDocumento2 páginasGlandulas Sexuales Accesorias en GatosLigia CorreaAún no hay calificaciones
- Lengua AzulDocumento1 páginaLengua AzulLESLLY VANESSA CRUZ GARCIAAún no hay calificaciones
- Sistema Nervioso de Los MamíferosDocumento5 páginasSistema Nervioso de Los MamíferosEliana PérezAún no hay calificaciones
- Practica 7Documento2 páginasPractica 7ruthAún no hay calificaciones
- Sarcocystis SuihominisDocumento2 páginasSarcocystis SuihominisJorge Luis Bury MaciasAún no hay calificaciones
- Biosintesis de Nucleotidos de NovoDocumento8 páginasBiosintesis de Nucleotidos de NovoMARIA FERNANDA JAIME CORREAAún no hay calificaciones
- Ingenieria de ProteínasDocumento7 páginasIngenieria de ProteínasloloalvkrnalAún no hay calificaciones
- Clase IV. Digestion de Los CarbohidratosDocumento85 páginasClase IV. Digestion de Los CarbohidratosJherson Guillermo Bonifacio EspinozaAún no hay calificaciones
- Practica7-Bioquimica1-Extraccion de DNADocumento6 páginasPractica7-Bioquimica1-Extraccion de DNAMarianaAún no hay calificaciones
- Estricnina y AnfetaminaDocumento14 páginasEstricnina y AnfetaminaLindsay Cuadros LeonAún no hay calificaciones
- Salmonelosis en TernerosDocumento26 páginasSalmonelosis en TernerosLaura RevoredoAún no hay calificaciones
- Arqueas-Y-Bacterias Trabajo MonograficoDocumento26 páginasArqueas-Y-Bacterias Trabajo MonograficoAntonio Ulloa TorresAún no hay calificaciones
- HaptenoDocumento6 páginasHaptenoAnira Angel Aguilar AguilarAún no hay calificaciones
- V+¡a de Las Hexosas MonofosfatoDocumento14 páginasV+¡a de Las Hexosas MonofosfatoLuisa LopezAún no hay calificaciones
- NanaDocumento10 páginasNanamaria cabrera gasteloAún no hay calificaciones
- Tema 5 Farmacodinamia 2021-2Documento95 páginasTema 5 Farmacodinamia 2021-2Athenas A.PAún no hay calificaciones
- Tratamiento Piometra CaninaDocumento5 páginasTratamiento Piometra CaninaBrunoParedesBarrantesAún no hay calificaciones
- Alquinos SN1 y SN2Documento20 páginasAlquinos SN1 y SN2Aviles Tapia MarleneAún no hay calificaciones
- 3 PARCIAL. BioquimicaDocumento3 páginas3 PARCIAL. BioquimicaBerenice Peinado AvarezAún no hay calificaciones
- Código de Ética de La BiotecnologíaDocumento4 páginasCódigo de Ética de La BiotecnologíaAndrea MaloAún no hay calificaciones
- TP0083 Oxígeno Disuelto Por ElectrometríaDocumento10 páginasTP0083 Oxígeno Disuelto Por ElectrometríaJose ReyesAún no hay calificaciones
- Vázquez Lizárraga Ri-Tipo de IngenierosDocumento12 páginasVázquez Lizárraga Ri-Tipo de IngenierosAndrea MaloAún no hay calificaciones
- Qia Seminario-1Documento9 páginasQia Seminario-1Anibal ChumpitaziAún no hay calificaciones
- Haruko ObokataDocumento3 páginasHaruko ObokataAndrea MaloAún no hay calificaciones
- BalletDocumento2 páginasBalletAndrea MaloAún no hay calificaciones
- Streptomyces GriseusDocumento3 páginasStreptomyces GriseusAndrea Malo0% (1)
- Clonación de ADNDocumento12 páginasClonación de ADNAndrea MaloAún no hay calificaciones
- Clonación de ADNDocumento12 páginasClonación de ADNAndrea MaloAún no hay calificaciones
- Clonación de ADNDocumento12 páginasClonación de ADNAndrea MaloAún no hay calificaciones
- ClonaciónDocumento11 páginasClonaciónAndrea MaloAún no hay calificaciones
- Fenomenos de TransporteDocumento6 páginasFenomenos de TransporteAndrea MaloAún no hay calificaciones
- Cepas MicrobianasDocumento5 páginasCepas MicrobianasAndrea MaloAún no hay calificaciones
- Candidatus Liberibacter AmericanusDocumento4 páginasCandidatus Liberibacter AmericanusAndrea MaloAún no hay calificaciones
- El Mecanismo de Accion de La EnolasaDocumento2 páginasEl Mecanismo de Accion de La EnolasaAndrea Malo100% (2)
- Ejercicios Formulacion Inorganica 02 CorrDocumento4 páginasEjercicios Formulacion Inorganica 02 CorrFortaleza Del SolAún no hay calificaciones
- Tesis Adicion de Ajo en La Dieta PDFDocumento106 páginasTesis Adicion de Ajo en La Dieta PDFMariela Yerèn ValenciaAún no hay calificaciones
- Riesgo 1Documento6 páginasRiesgo 1lucyalexandra2009Aún no hay calificaciones
- Anexo 3.7.2-1 Fichas Paleontológicas Chong 2014 - Rev.0 - EIADocumento16 páginasAnexo 3.7.2-1 Fichas Paleontológicas Chong 2014 - Rev.0 - EIACristobalAún no hay calificaciones
- PANCREATITISDocumento68 páginasPANCREATITISIsabella TolozaAún no hay calificaciones
- Athanor PDFDocumento92 páginasAthanor PDFAnonymous xKkcNEyG100% (1)
- Parcial Anatomia Sistema Tegumentario y OseoDocumento2 páginasParcial Anatomia Sistema Tegumentario y OseoMARIA DE LOURDES ARMAS LOPEZAún no hay calificaciones
- 05 Herramienta Corte PDFDocumento69 páginas05 Herramienta Corte PDFNevsaint MartinezAún no hay calificaciones
- Ebook Puntos GatillosDocumento12 páginasEbook Puntos Gatillosignacio lugo0% (1)
- Monografia ECOLOGIADocumento9 páginasMonografia ECOLOGIASusana LeonelliAún no hay calificaciones
- Aporte de Científicos A La BiologíaDocumento7 páginasAporte de Científicos A La BiologíaHebteco ShadAún no hay calificaciones
- Clonacià NDocumento1 páginaClonacià NBarbara Catalan PradoAún no hay calificaciones
- Libro Registro Fertilizantes 20140121Documento34 páginasLibro Registro Fertilizantes 20140121Justo Sihuincha LapaAún no hay calificaciones
- Manual de Plantación de Árboles en Áreas UrbanasDocumento94 páginasManual de Plantación de Árboles en Áreas UrbanasCeyanez100% (6)
- Guia Evaluar BiomoleculasDocumento4 páginasGuia Evaluar BiomoleculasDONALDO RODRIGUEZ PEINADOAún no hay calificaciones
- 1 Reactivo de FehlingDocumento10 páginas1 Reactivo de FehlingPeter AndressAún no hay calificaciones
- Teoria de La Cascada Del Beta Amiloide AlzheimerDocumento9 páginasTeoria de La Cascada Del Beta Amiloide AlzheimerOscar Aarón PalomaresAún no hay calificaciones
- Fisiologia Vegetal 4 ExpDocumento9 páginasFisiologia Vegetal 4 ExpJorge Luis Lemos ChaverraAún no hay calificaciones
- Ley de La Conservacion de La MateriaDocumento6 páginasLey de La Conservacion de La MateriaCoLLAún no hay calificaciones
- 2-09 Ciencia y Tecnología Encontramos Clorofila en Las PlantasDocumento8 páginas2-09 Ciencia y Tecnología Encontramos Clorofila en Las PlantasGonzales MikaAún no hay calificaciones
- Manejo de La AfectividadDocumento5 páginasManejo de La AfectividadJuan Pablo Sanchez Reyes100% (1)
- 23 DPCC S3 Cuaderno de TrabajoDocumento40 páginas23 DPCC S3 Cuaderno de TrabajoRonaldxIsai VCAún no hay calificaciones
- FERNANDEZ ACEVEDO - La Construccion de La Mente Por El Lenguaje..Documento3 páginasFERNANDEZ ACEVEDO - La Construccion de La Mente Por El Lenguaje..anon_903827420Aún no hay calificaciones
- LA FAUNA SILVESTRE CON VALOR de USO en LOS HUERTOS Fruticolas Tradicionales de Xoxocotla MorelosDocumento9 páginasLA FAUNA SILVESTRE CON VALOR de USO en LOS HUERTOS Fruticolas Tradicionales de Xoxocotla MorelosOscar OlivaresAún no hay calificaciones
- ENSAYO Legislación FarmacéuticaDocumento7 páginasENSAYO Legislación FarmacéuticaMariaDoraniSilvaLagunaAún no hay calificaciones
- Animales Vertebrados e Invertebrados para Segundo de PrimariaDocumento3 páginasAnimales Vertebrados e Invertebrados para Segundo de PrimariaLuigui Bruno Solis100% (3)
- 10) Espacio Visceral de Cuello 2018Documento10 páginas10) Espacio Visceral de Cuello 2018Catalina Ruiz LópezAún no hay calificaciones
- Anexo NANDA - NIC - NOCDocumento38 páginasAnexo NANDA - NIC - NOCNATALY FIORELLA CHUQUILIN ALVAAún no hay calificaciones
- Informe de MorfofisiologiaDocumento23 páginasInforme de MorfofisiologiaurielAún no hay calificaciones
- Fitoestrógenos en La Alimentación AnimalDocumento7 páginasFitoestrógenos en La Alimentación AnimalJean Piero L.EAún no hay calificaciones