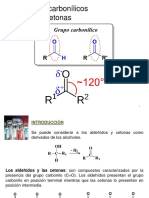
ALDEHDOS
ALDEHIDOS
Un aldehdo tiene un grupo alquilo y un tomo de hidrgeno enlazados al grupo
carbonilo.
Un aldehdo
Los
aldehdos
se
O
||
R C H
nombran
O
||
Ejemplo: CH 3CH
CH3COH
Etanal acetaldehdo
reemplazando
la
terminacin -ano del
alcano
correspondiente por -al. No es necesario especificar la posicin del grupo aldehdo,
puesto
que
ocupa
el
extremo
de
la
cadena
(localizador
1).
Cuando la cadena contiene dos funciones aldehdo se emplea el sufijo -dial.
El grupo -CHO unido a un ciclo se llama -carbaldehdo. La numeracin del ciclo se
realiza dando localizador 1 al carbono del ciclo que contiene el grupo aldehdo.
Algunos
nombres
comunes
de
aldehdos
aceptados
por
la
IUPAC
son:
�ALDEHDOS
REACCIONES
ACETALES
Los aldehdos y cetonas reaccionan con alcoholes bajo condiciones de catlisis cida,
formando en una primera etapa hemiacetales, que posteriormene evolucionan por
reaccin con un segundo equivalente de alcohol a acetales.
�ALDEHDOS
Mecanismo para la formacin de acetales
Etapa 1. Protonacin del grupo hidroxilo
Etapa 2. Prdida de agua.
Etapa 3. Ataque del alcohol al carbocatin
�ALDEHDOS
Etapa 4. Desprotonacin del acetal
IMINAS
La reaccin de aldehdos o cetonas [1] con aminas primarias genera iminas [2]. La
reaccin se favorece en un medio ligeramente cido (pH=4.5).
El control del pH es fundamental, puesto que se requiere la protonacin del oxgeno del
carbonilo para favorecer el ataque nuclefilo.
Mecanismo:
�ALDEHDOS
Etapa 1. Protonacin del grupo carbonilo que aumenta la polaridad positiva sobre el
carbono y favorece el ataque nuclefilo.
Etapa 2. Ataque nuclefilo de la amina primaria al carbono carbonilo.
Etapa 3. Protonacin del grupo hidroxilo para transformarlo en buen grupo saliente.
�ALDEHDOS
Etapa 4. Perdida de agua y formacin de la imina protonada.
Etapa 5. Desprotonacin del catin.
ENAMINAS
�ALDEHDOS
Sntesis de enaminas
Como vimos en apartados anteriores la condensacin de aminas primarias con
aldehdos y cetonas generan iminas. En este apartado estudiaremos la condensacin
de carbonilos con aminas secundarias que dan enaminas.
Mecanismo de formacin de enaminas
Despus del ataque inicial de la amina secundaria al carbonilo, se elimina agua
formndose el doble enlace entre el carbono carbonilo y el alfa del carbonilo de partida.
Etapa 1. Protonacin del carbonilo
Etapa 2. Ataque nuclefilo de la amina secundaria
Etapa 3. Equilibrio cido-base
�ALDEHDOS
Etapa 4. Prdida de agua
Etapa 5. Eliminacin
Los impedimentos estricos hacen que las enaminas menos sustituidas sean las ms
estables
�ALDEHDOS
CIANOHIDRINAS
Las cianhidrinas [3] se forman por reaccin de aldehdos o cetonas [1] con cido
cianhdrico [2] y son compuestos que contienen un grupo cinano y un hidroxi sobre el
mismo carbono.
El mecanismo de la reaccin transcurre en dos etapas:
Etapa 1. Los iones cianuro actan como nuclefilos atacando al carbono carbonilo. El
cido cianhdrico es demasiado dbil para generar cantidades importantes de cianuro,
por ello, se aade cianuro de sodio o potasio al medio, garantizando la cantidad
suficiente de cianuro para que la reaccin transcurra en buen rendimiento.
Etapa 2. En este paso el in alcxido [4] se protona arrancando hidrgenos al cido
cianhdrico. En esta etapa se regeneran los iones cianuro.
�ALDEHDOS
ALQUENO (REACCIN DE WITTIG
La reaccin de Wittig emplea Iluros de fsforo [2] para transformar aldehdos y
cetonas [1] en alquenos [3]. Como subproducto se obtiene el xido de trifenilfosfina [4].
En el mecanismo de la reaccin el iluro y el carbonilo se combinan para formar un
oxafosfetano que rompe dejando libre el alqueno final.
Etapa 1. El etanal y el iluro se combian formando el fosfetano.
�ALDEHDOS
Etapa 2. El fosfetano rompe formando el alqueno y oxido de trifenilfosfina.
{nota}Ejemplo - Obtener mediante Wittig el 2-Metilbut-2-eno
Se rompe el alqueno por el doble enlace y a cada carbono se le agrega el grupo
encerrado en verde.{/nota}
Los iluros de fsforo se preparan mediante reaccin de haloalcanos y trifenilfosfina,
seguido de desprotonacin del carbono con base fuerte (organometlicos de litio).
�ALDEHDOS
ALCOHOL 1
Tanto el borohidruro de sodio (NaBH4) como el hidruro de litio y aluminio (LiAlH4)
reducen aldehdos y cetonas a alcoholes.
El etanal [1] se transforma por reduccin con el borohidruro de sodio en etanol [2].
El mecanismo transcurre por ataque del hidruro procedente del reductor sobre el
carbono carbonilo. En una segunda etapa el disolvente protona el oxgeno del
alcxido.
ALCOHOL 2
Recordemos que el
reactivo de Grignard
tiene la frmula RMgX
prepara por la reaccin entre magnesio metlico y
un
que
se
halogenuro orgnico
apropiado. Este halogenuro puede ser de alquilo (1, 2 3), de alilo, de aralquilo
(por ejemplo, bencilo) o arilo (fenilo o fenilo sustituido). El halgeno puede ser -CI, -Br
o -l. (Los cloruros de arilmagnesio se deben preparar en el ter cclico tetrahidrofurano,
en vez de en ter etlico.)
�ALDEHDOS
Uno
de
los usos ms importantes del reactivo de Grignard es su reaccin con aldehdos
y
cetonas. El enlace carbono-magnesio del reactivo de Grignard es muy polar,
siendo negativo el carbono en relacin con el magnesio electropositivo. Luego, no
es
de
sorprender que
en
la
adicin
compuestos carbonlicos,
la
parte orgnica se una al carbono, y el magnesio, al oxgeno. El
producto es la sal magnsica del
alcohol dbilmente cido,
que es
fcilmente convertible en
el alcohol libre por la adicin de un cido ms fuerte, el agua.
Debido a
que el Mg(OH)X as formado es un material gelatinoso, dificil de
manejar, se utiliza a
menudo un cido
mineral diluido (HCI, H2SO4) en
agua, de modo que se formen sales magnsicas solubles en sta..
vez de
�ALDEHDOS
Ruleta de aldehdo
1. Alcohol 2
�ALDEHDOS
2. Ciano hidrina
3. Imina
�ALDEHDOS
4. Enamina
�ALDEHDOS
5. Acetal
�ALDEHDOS
6. Alqueno
�ALDEHDOS
7. Alcohol 1
BIBLIOGRAFA
�ALDEHDOS
http://www.quimicaorganica.org/aldehidos-y-cetonas/162-preparacion-de-aldehidos-ycetonas.html
http://www.quimicaorganica.org/aldehidos-y-cetonas/229-nomenclatura-de-aldehidos-ycetonas.html
http://portalacademico.cch.unam.mx/materiales/prof/matdidac/sitpro/exp/quim/quim2/qui
micaII/L_GruposF.pdf
http://www.quimicaorganica.org/aldehidos-y-cetonas.html
http://organica1.org/qo1/ok/alcohol/alco114.htm