Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tensión Superficial y Catálisis.
Cargado por
Marta Blanco RíoDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tensión Superficial y Catálisis.
Cargado por
Marta Blanco RíoCopyright:
Formatos disponibles
Catlisis micelar y
tensin superficial.
Marta Blanco Ro.
Grupo I.
Introduccin.
Desde principio de este siglo hasta el presente, el proceso de asociacin reversible de
molculas anfiflicas, es decir, molculas que poseen en su estructura qumica grupos
hidrfobos e hidrfilos, ha despertado un amplio inters, por sus aplicaciones
prcticas, lo que ha sido objeto de numerosas investigaciones. Uno de los primeros
investigadores que estudiaron este fenmeno fue J.W. McBain, quien constat el
hecho de que las molculas de tensoactivo disueltas en agua podan agregarse de un
modo reversible, dando el nombre de micelas a estos agregados.
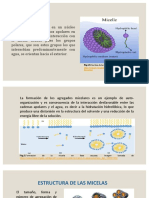
Una micela es una formacin geomtrica de molculas que tienen una "cabeza" polar
y una "cola" de naturaleza no polar adheridas a un partcula o glbulo de usa
sustancias que se encuentra en un medio en el cual no es soluble.
El carcter anfiptico o anfiflico de muchos lpidos hace que, como dedujo Langmuir
en 1917, las molculas de aceite de una monocapa estn orientadas de modo que
sus grupos o cabezas polares se encuentren en contacto con el agua, mientras que
sus partes lipdicas apolares se proyectan en el aire, donde estn en contacto con las
unidades lipdicas de sus vecinas. Esta la razn por la que el aceite se extiende sobre
el agua formando una capa de una sola molcula de grosor (monocapa).
En disoluciones acuosas las molculas anfiflicas forman micelas en las que los
grupos polares estn en la superficie y las partes apolares quedan inmersas en el
interior de la micela en una disposicin que elimina los contactos desfavorables entre
el agua y las zonas hidrfobas y permite la solvatacin de los grupos de las cadenas
polares. En otro tipo de medios, las molculas anfiflicas se pueden organizar como
micelas inversas.
La formacin de micelas es un proceso cooperativo, el ensamblaje de pocas
molculas no puede proteger las colas hidrfobas del contacto con el agua; en
consecuencia, las disoluciones acuosas de anffilos no forman micelas hasta que su
concentracin no sobrepasa un valor, la concentracin micelar crtica (CMC), por
encima del cual casi todo el anffilo adicional se agrega para formar micelas. El valor
de la CMC depende del
tipo de molcula, concretamente de su balance lipofilia/hidrofilia, y as molculas con
regiones hidrfobas largas tienen valores de CMC ms bajos; de las caractersticas de
la disolucin (fuerza inica) y de la temperatura.
Las molculas anfipticas con una cola hidrfoba nica, forman micelas esfricas o
elipsoides debido a su forma cnica (la cabeza hidratada de la molcula es ms ancha
que la cola). Los requerimientos estricos del empaquetamiento de estas molculas
entre s dan estructuras similares a discos que en realidad son extensas hojas de
grosor bimolecular, bicapas. Una micela es una estructura limitada, normalmente de
dimetro menor que 20 nm, mientras que una bicapa lipdica puede tener dimensiones
macroscpicas de hasta 1 mm.
Objetivo.
El objetivo de esta prctica es la determinacin del valor de la concentracin micelar
crtica (CMC) as como los parmetros K constante de equilibrio de la reaccin del
sustrato con el CTAB y km la constante de velocidad de la fase micelar.
Fundamento terico.
La micelizacin produce un cambio cualitativo del sistema: la transicin del sistema
homogneo a un sistema disperso coloidal microheterogneo. Este cambio cualitativo
viene acompaado de una variacin brusca, que se registra experimentalmente, de las
propiedades fsico-qumicas del sistema y que se manifiesta, en la mayora de los
casos, por la aparicin de una inflexin en las curvas de la variacin de los parmetros
fsico- qumicos con la concentracin de las sustancias tensioactivas. En las
disoluciones de tensoactivos
se produce una
inicos,
cuando
comienza
la
asociacin
micelar
disminucin de la velocidad de aumento de la conductividad con la concentracin de
tensoactivo. Este cambio de comportamiento se debe a que la micela no libera el
100% (como hace el monmero de tensoactivo libre) de los contraiones al seno de la
disolucin sino un 20-30% segn su grado de disociacin. Este cambio de las
propiedades elctricas de la disolucin permite calcular los parmetros relacionados
con el cambio:
* Concentracin micelar crtica (CMC).
*K y km.
La concentracin micelar crtica (CMC) constituye un proceso especfico de
asociacin molecular en disolucin. Ocurre simultneamente en el momento de la
saturacin de la superficie cuando la presin superficial es mxima. Como resultado
de estos eventos, la variacin de la tensin superficial con respecto a la
concentracin de CTAB, presenta un valor constante y mximo en las vecindades de la
concentracin micelar crtica (x xcmc), pudindose obtener una expresin lineal en
esta regin, que contiene en su ordenada al origen el valor de la CMC; el valor mximo
en la primera derivada permite su empleo como una segunda alternativa de
evaluacin.
Experimentalmente, el valor de CMC se calcula por diversos mtodos donde se mide
el cambio de alguna propiedad, en nuestro caso absorbancia; el valor de CMC lo
marca el cambio de rgimen en la variable experimental correspondiente (Patterson,
1987). La concentracin micelar crtica no constituye un proceso aislado; al contrario,
su ocurrencia se encuentra asociada a otros parmetros que resulta importante reunir
y destacar como condiciones de frontera en el proceso de adsorcin: la tensin
superficial es mxima ( mx.), la concentracin superficial del tensoactivo se satura
en ese punto ( mx), la concentracin de la solucin se contina incrementando
hasta un punto crtico donde se inicia la formacin de micelas (x xCMC).
Concentracin micelar crtica (CMC).- Se denomina concentracin micelar crtica
(CMC) a la concentracin mnima de surfactante a partir de la cual se forman micelas
espontneamente en una disolucin. La concentracin micelar crtica es un punto
definido con precisin para cada compuesto y se puede conocer mediante resonancia
magntica nuclear y otros mtodos. Para tensoactivos inicos el mtodo ms sencillo
y asequible es medir la conductividad molar () en funcin de la concentracin de
tensoactivo, ya que depende directamente de la concentracin de la disolucin e
inversamente de la concentracin de electrolito. Por debajo de la concentracin
micelar crtica aumenta la conductividad al aumentar la concentracin de monmero
de tensoactivo y su contrain. Por encima las adiciones sucesivas producen un
aumento de la concentracin de micelas, con menor conductividad inica y con
contraiones adsorbidos. El nmero de molculas de tensioactivo que se incluye en
cada micela se denomina nmero de agregacin (n).
[CTAB] efectiva = ([CTAB]0 CMC)/n n= n de agregacin = 65
Absorbancia.- Se define como la relacin logartmica entre la intensidad de la luz que
incide sobre una muestra y la intensidad de esa misma luz que es transmitida a travs
de esa muestra. Cuando una luz de una longitud de onda determinada, seleccionada
por un filtro, incide sobre una muestra, parte de esa luz es absorbida. La luz no
absorbida pasa a travs de la muestra y es recogida por un detector colocado en el
otro lado del pocillo
de
de
la
microplaca,
frente
la
fuente
luz.
Como la cantidad de luz absorbida por la muestra est en relacin con su
concentracin (Ley de Lambert-Beer), la absorbancia se emplea para la cuantificacin
de cidos nucleicos y protenas as como en reacciones colorimtricas.
Mtodo Guggenheim.- Se emplea cuando es imposible obtener la lectura infinita. Este
mtodo utiliza un incremento constante de tiempo t al menos igual a la vida media de
la reaccin, obtenindose constantes de velocidad para reacciones reversibles y
competitivas de primer orden y an para las de segundo orden. Este ltimo caso
debe ser calculada para indicar el error.
Modelo de la pseudofase.- En el primer modelo de Shinoda y Hutchinson (1962), se
considera que la micela es una pseudo-fase, es decir, que la micelizacin se asemeja
a una "micro precipitacin". Este modelo supone de manera implcita que la actividad
del surfactante permanece constante encima de la CMC, y que la concentracin en
especie monomrica corresponde a una saturacin. La relacin entre la concentracin
de surfactante en forma monomrica Cm, aquella en forma micelar CM, y la
concentracin total CT es por lo tanto:
Cm = CT para CT < CMC
Cm = CMC y CM = CT - Cm para CT > CMC.
Si este modelo corresponde a la realidad, las propiedades que dependen de la
concentracin monomrica no deberan variar cuando la concentracin del surfactante
sobrepase la CMC.
Tensin superficial.- Se denomina tensin superficial de un lquido a la cantidad de
energa necesaria para aumentar su superficie por unidad de rea. Esta definicin
implica que el lquido tiene una resistencia para aumentar su superficie. Las unidades
en el SI: N m-1.
Ley de Tate.- Segn esta ley el peso de la gota es proporcional al radio del tubo r
y a la tensin superficial del lquido, La gota se desprende del tubo en el
instante en el que su peso iguala a las fuerzas de tensin superficial que la
sostiene y que actan a lo largo de la circunferencia AB de contacto con el
tubo. Es proporcional al radio del tubo r y a la tensin superficial del lquido.
Estalagmmetro de Traube.- Es de los dispositivos ms empleados para la
determinacin de la tensin superficial e interfacial de los lquidos. Consta de un tubo
vertical de vidrio con un ensanchamiento situado entre un enrase superior y otro
inferior provisto ambos de sendas escalas grabadas sobre el vidrio en divisiones
arbitrarias; al extremo del tubo posee un ligero aplastamiento que constituye una
pequea plataforma plana.
Mediante una aspiracin se toma lquido de una pequea vasija situada bajo el
Estalagmmetro y se le hace ascender hasta el primer enrase. Seguidamente se deja
fluir el lquido libremente y se cuenta el nmero de gotas que se desprenden hasta que
se alcanza el enrase inferior. La operacin se repite de forma anloga empleando el
agua como referencia y anotando el nmero de gotas desprendidas en su caso. El
valor de la tensin superficial del lquido, s, se conoce a expensas de la del agua o
lquido de referencia, s, de sus respectivas densidades, r y r, y de los nmeros que
representan las gotas desprendidas en cada caso, n y n.
Parte experimental.
Partimos de la siguiente reaccin
Para
Clculo de K y km.
calcular
estos
parmetros
preparamos
diez
disoluciones
de
distintas
concentraciones de CTAB a partir de una disolucin madre CTAB de concentracin
5,0*10-3M. De estas disoluciones tomamos 5mL que haremos reaccionar con 5mL de
agua, se mide la absorbancia a distintos tiempos de intervalos constantes (cada 10
segundos) obtenemos y representamos los datos.
Resolviendo [1]
ln
[]0
[]
(1)
= [4]
Expresando [4] en absorbancias (A):
ln
[]0
[]
(1)
= (Espectros UV-VIS)
Calculamos la absorbancia infinita por el mtodo Guggenheim:
Mecanismo:
Etapa 1
S + CTAB (S-CTAB).
(K) equilibrio rpido formacin compuesto sustrato-catalizador).
Etapa 2
S + OH- P + H2O (fase
acuosa). (kW
(2)
Etapa 3
S-CTAB + OH P + H2O (fase micelar).
[OH-]).
(km (2) [OH-]).
Tratamiento cintico:
Teniendo en cuenta:
Sustituyendo y operando:
Reordenando:
Donde:
Obtenemos K y km.
Clculo de CMC.
Preparamos diez disoluciones de CTAB de concentraciones 1.2 10
1.8 10
M por
dilucin de una disolucin madre, medimos la cantidad de gotas de cada una de ellas
con el Estalagmmetro de Traube, llevando a cabo esta operacin previamente con
agua como referencia, tambin utilizando el picnmetro calcularemos la masa de la
disolucin contenida. As, mediante la Ley de Tate calcularemos el valor de la tensin
superficial y con este valor se determinar el valor de CMC para el CTAB ( vs.
[CTAB])
Ley de Tate:
Clculos.
Clculo de K y km.
Mtodo de Guggenheim:
kexp(1) = 0,0084t
kexp(2)= kexp (1)/[OH -]= 0,0084 /2,410 -2= 3,5
kexp(1) = 0,0081t
kexp(2)= kexp(1)/[OH-]= 0,0081 /2,410-2= 3,375
kexp(1) = 0,0094t
kexp(2)= kexp (1)/[OH -]= 0,0094 /2,410 -2= 3,9167
kexp(1) = 0,0095t
kexp(2)= kexp (1)/[OH -]= 0,0095 /2,410 -2= 3,9583
kexp(1) = 0,0096t
kexp(2)= kexp (1)/[OH -]= 0,0096 /2,410 -2= 4
kexp(1) = 0,01041t
kexp(2)= kexp(1)/[OH-]= 0,0104 /2,410-2= 4,333
kexp(1) = 0,0082t
kexp(2)= kexp (1)/[OH -]= 0,0082 /2,410 -2= 3,4167
kexp(1) = 0,0065t
kexp(2)= kexp(1)/[OH-]= 0,0065 /2,410-2= 2,7083
kexp(1) = 0,0128t
kexp(2)= kexp (1)/[OH -]= 0,0128 /2,410 -2= 5,333
kw(1) = 0,0051t
kw(2)= kexp(1)/[OH-]= 0,0051 /2,410-2= 2,125
K= 495750.
km= 7,1679.
Clculo de CMC.
CMC= 5,5448.
Conclusiones.
Calculados los valores de km y K, as como el valor de la concentracin micelar critica
que son los siguientes:
K= 495750.
km= 7,1679.
CMC= 5,5448.
Se ha eliminado algn dato que alteraba la recta, estos datos errneos pueden
deberse probablemente a que no han sido recogidos por un solo grupo de trabajo, sino
por varios por lo que se han podido sumar errores.
También podría gustarte
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Métodos Experimentales para La Determinación de La Concentración Micelar Crítica A Partir de La Tensión SuperficialDocumento8 páginasMétodos Experimentales para La Determinación de La Concentración Micelar Crítica A Partir de La Tensión SuperficialMARIA FERNANDA PALAFOX PEREZAún no hay calificaciones
- Practica 1 LUFDocumento1 páginaPractica 1 LUFLiz ColinAún no hay calificaciones
- CMC Por ConductividadDocumento8 páginasCMC Por ConductividadJefferson CobaAún no hay calificaciones
- Concentración Micelar CríticaDocumento2 páginasConcentración Micelar CríticaMaria NavasAún no hay calificaciones
- Cromatografia 1 PDFDocumento21 páginasCromatografia 1 PDFMónica Adriana Rodríguez CadenaAún no hay calificaciones
- Reporte 5 MicelizacionDocumento11 páginasReporte 5 MicelizacionAnonymous ExcNQWv7P100% (1)
- Marco TeóricoDocumento10 páginasMarco TeóricoFranco PérezAún no hay calificaciones
- Reología de PolímerosDocumento73 páginasReología de Polímerossecundaria92Aún no hay calificaciones
- Micelas: Fig.1.Estructura de La Micela Imagen Tomada deDocumento7 páginasMicelas: Fig.1.Estructura de La Micela Imagen Tomada dePATRICIA ROSARIO SANTANDER SALASAún no hay calificaciones
- Reporte de Energia Libre Me MicelizacionDocumento12 páginasReporte de Energia Libre Me MicelizacionCésar Mendiola San RómanAún no hay calificaciones
- Métodos de Presion OsmóticaDocumento5 páginasMétodos de Presion OsmóticaSergio Armando ResendizAún no hay calificaciones
- Clara Sainz UbideDocumento84 páginasClara Sainz UbideAndrés Oswaldo Rivera HérnandezAún no hay calificaciones
- Polimero Practica 3 EVALUACIÓN DEL PESO MOLECULARDocumento10 páginasPolimero Practica 3 EVALUACIÓN DEL PESO MOLECULARLuis Manuel Carreon BonillaAún no hay calificaciones
- Concentración Micelar Crítica El DocumentoDocumento3 páginasConcentración Micelar Crítica El DocumentoFernanda MartinezAún no hay calificaciones
- GL9 2019Documento3 páginasGL9 2019Mariangel GüilAún no hay calificaciones
- Metodos para Determinar El Peso Molecular de Un PolimeroDocumento10 páginasMetodos para Determinar El Peso Molecular de Un Polimeroxxxxalejoxxxx100% (1)
- Dokumen - Tips - Reporte 5 MicelizacionDocumento11 páginasDokumen - Tips - Reporte 5 MicelizacionJanet Victoria Maturano MartínezAún no hay calificaciones
- Separación Por MembranasDocumento6 páginasSeparación Por MembranasIsabel OlivaAún no hay calificaciones
- Informe Tema 6Documento13 páginasInforme Tema 6Daniel Vargas TrujilloAún no hay calificaciones
- El Fenómeno Mágico de La ÓsmosisDocumento18 páginasEl Fenómeno Mágico de La Ósmosistxerra3100% (3)
- Tarea 1-Transferencia de Masa.Documento33 páginasTarea 1-Transferencia de Masa.Hauslerr Mendoza LingánAún no hay calificaciones
- DocumentoDocumento11 páginasDocumentoAna Lucia Valdivia EspinozaAún no hay calificaciones
- Tema 2 Transferencia de Cantidad de Movimient1Documento10 páginasTema 2 Transferencia de Cantidad de Movimient1mauro guerraAún no hay calificaciones
- Informe Fenomenos de SuperficieDocumento26 páginasInforme Fenomenos de SuperficieJosé0% (1)
- Formación de MicelasDocumento2 páginasFormación de MicelasKevin Andrès100% (1)
- Separacion Por MembranasDocumento24 páginasSeparacion Por MembranasGutierrez Rojas Elio WilyAún no hay calificaciones
- Trabajo de Peso Molecular de Polimeros!Documento26 páginasTrabajo de Peso Molecular de Polimeros!Eliecer Mercado RangelAún no hay calificaciones
- Mice LasDocumento13 páginasMice LasFernanda GuerreroAún no hay calificaciones
- Laboratorio No 3 AIDocumento11 páginasLaboratorio No 3 AIVICTOR MANUEL BARRIOS ROMEROAún no hay calificaciones
- Las Membranas Biológicas y TransporteDocumento37 páginasLas Membranas Biológicas y Transportepaola diazAún no hay calificaciones
- Artículo Sobre El Efecto Del Alcohol en La Membrana CelularDocumento5 páginasArtículo Sobre El Efecto Del Alcohol en La Membrana CelularWilliam Ardila RojasAún no hay calificaciones
- Construccion y Utilizacion de Un Electrodializador en Serie para LaboratorioDocumento15 páginasConstruccion y Utilizacion de Un Electrodializador en Serie para LaboratoriomirkogragedaAún no hay calificaciones
- ElectroforesisDocumento15 páginasElectroforesisVero Silva VerdugoAún no hay calificaciones
- Resumen PoitabilizaciónDocumento5 páginasResumen PoitabilizaciónYasmin Mendez GarciaAún no hay calificaciones
- Deshidratacion Del PetroleoDocumento13 páginasDeshidratacion Del PetroleodavismoodyAún no hay calificaciones
- Tension Superficial LISTODocumento28 páginasTension Superficial LISTOCesar BriceñoAún no hay calificaciones
- Tecnicas Determinacin de Peso MolecularDocumento14 páginasTecnicas Determinacin de Peso MolecularAltair PerezAún no hay calificaciones
- Avance Informe 6 TensionDocumento11 páginasAvance Informe 6 TensionElizabeth EscalanteAún no hay calificaciones
- Osmosis InversaDocumento17 páginasOsmosis InversaFrancisco Torres ArellanoAún no hay calificaciones
- FLOTACIONDocumento64 páginasFLOTACIONjorgecatalinahuanca50% (2)
- Lectura Transporte Celular Teoria 2021bDocumento7 páginasLectura Transporte Celular Teoria 2021bAngie Valeria Cadena SalazarAún no hay calificaciones
- Practica Difusión MolecularDocumento22 páginasPractica Difusión MolecularWalter HerreraAún no hay calificaciones
- Determinacion de Las DesDocumento14 páginasDeterminacion de Las DesJuan Carlos Pacheco CáceresAún no hay calificaciones
- 3 Repartido Electroforesis 3Documento14 páginas3 Repartido Electroforesis 3Sophie LaurenceAún no hay calificaciones
- PESO MOLECULAR Por ViscosimetriaDocumento4 páginasPESO MOLECULAR Por Viscosimetriaalexadame2301100% (1)
- Cap 1Documento4 páginasCap 1Hermogenes Jorge Huamani FloresAún no hay calificaciones
- Teorías de La Cinética QuímicaDocumento12 páginasTeorías de La Cinética QuímicaMauricio BahenaAún no hay calificaciones
- Clase #2 - ProteínasDocumento65 páginasClase #2 - ProteínasMayra MendozaAún no hay calificaciones
- Tranf. Masa, EvaporacionDocumento30 páginasTranf. Masa, EvaporacionRoy Tristan Silva0% (1)
- Transferencia en La Interface Unidad 5Documento18 páginasTransferencia en La Interface Unidad 5christopher109a100% (1)
- Electro For Es IsDocumento14 páginasElectro For Es IsSele BouyssedeAún no hay calificaciones
- Fundamentos de Transferencia de MasaDocumento8 páginasFundamentos de Transferencia de Masakata_1994Aún no hay calificaciones
- Informe de CapilaridadDocumento19 páginasInforme de CapilaridadDiegoPomboAún no hay calificaciones
- HIDROMETALURGIADocumento27 páginasHIDROMETALURGIANataliaAún no hay calificaciones
- Parte1Capítulo1 MasaDocumento50 páginasParte1Capítulo1 MasaEdwin NumpaqueAún no hay calificaciones
- Dinamica de Adsorción de SurfactantesDocumento36 páginasDinamica de Adsorción de SurfactantesJaviera Navarro100% (2)
- Practica 4 Trabajo PrevioDocumento3 páginasPractica 4 Trabajo PrevioJuan carlos TorresAún no hay calificaciones
- Tensioactivos. CMC A Temperaturas Bajas o Moderadas. Influencia Sobre La CMC de La Presencia de Compuestos Neutros o Polares. L-ValinaDocumento49 páginasTensioactivos. CMC A Temperaturas Bajas o Moderadas. Influencia Sobre La CMC de La Presencia de Compuestos Neutros o Polares. L-ValinaAndrés Leonardo Díaz RodríguezAún no hay calificaciones
- Acordeon Fisicoquímica 3r ParcialDocumento21 páginasAcordeon Fisicoquímica 3r ParcialGerardo Vázquez RiveraAún no hay calificaciones
- Seccion Eficaz DiferencialDocumento5 páginasSeccion Eficaz DiferencialRene Hendrick Vargas CameroAún no hay calificaciones
- BombasmalmedicarcasaPartidaserie410Manual Carcaza Partida 410-420Documento16 páginasBombasmalmedicarcasaPartidaserie410Manual Carcaza Partida 410-420Anonymous pItIBpppAún no hay calificaciones
- Cic SueloDocumento39 páginasCic SueloAby CevallosAún no hay calificaciones
- Helado de FresaDocumento10 páginasHelado de FresagabAún no hay calificaciones
- Equipos de Concentración GravimetricaDocumento4 páginasEquipos de Concentración Gravimetricanachojn100% (1)
- Unidad I Fisicoquimica II 2020Documento23 páginasUnidad I Fisicoquimica II 2020ariel yana morgaAún no hay calificaciones
- Pasos para Diseñar Una Torre de Destilación MulticomponenteDocumento9 páginasPasos para Diseñar Una Torre de Destilación MulticomponenteGasersithoOnneAún no hay calificaciones
- Anexos Procesos de Sanitizacion Areas, Equipos y UtensiliosDocumento3 páginasAnexos Procesos de Sanitizacion Areas, Equipos y UtensiliospsydrianAún no hay calificaciones
- NORMAS DE SEGURIDAD DEL LABORATORIO - Docx Cuadro SinópticoDocumento6 páginasNORMAS DE SEGURIDAD DEL LABORATORIO - Docx Cuadro SinópticoEliana Castro0% (1)
- GRAFITODocumento2 páginasGRAFITOKaterine Serna100% (1)
- Diseño de Generadores de VaporDocumento2 páginasDiseño de Generadores de VaporMiguel Angel Espindola JuarezAún no hay calificaciones
- DESHIDRATACIÓNDocumento10 páginasDESHIDRATACIÓNLuis TrejoAún no hay calificaciones
- Balones VolumetricosDocumento12 páginasBalones VolumetricosJohan BenavidesAún no hay calificaciones
- WC TT12SAR1 User ManualDocumento16 páginasWC TT12SAR1 User Manualhoracio diazAún no hay calificaciones
- 03 - CronotanatologiaDocumento52 páginas03 - CronotanatologiaLili Pérez ArtolaAún no hay calificaciones
- Deteccion de Acs. Clinicamente SignificativosDocumento45 páginasDeteccion de Acs. Clinicamente SignificativosJose Luis Leiva IngaAún no hay calificaciones
- Informe de TorsionDocumento30 páginasInforme de Torsionmaria rivera chinchay100% (1)
- Cuestionario 2Documento5 páginasCuestionario 2clara97Aún no hay calificaciones
- Agitador MagnéticoDocumento10 páginasAgitador Magnéticoyenny100% (1)
- Muro de Concreto ArmadoDocumento7 páginasMuro de Concreto ArmadoWilson Torres TorresAún no hay calificaciones
- Resumen Hidráulica TeóricaDocumento13 páginasResumen Hidráulica TeóricarobertorcovAún no hay calificaciones
- ButilenoDocumento13 páginasButilenoFernando Aldana0% (1)
- Unidad 3. - Tipos de Defensas y Su ClasificacionDocumento18 páginasUnidad 3. - Tipos de Defensas y Su ClasificacionYadii Garcia0% (1)
- Trabajo QuimicaFDocumento9 páginasTrabajo QuimicaFKevin LongaAún no hay calificaciones
- Diseño de Conductores ElectricosDocumento28 páginasDiseño de Conductores ElectricosJerónimo Vela LlanosAún no hay calificaciones
- Manual LombrifiltroDocumento29 páginasManual LombrifiltroKelly Anely Coila Coaquira100% (6)
- Practica 3 FarmacologíaDocumento11 páginasPractica 3 FarmacologíaVictor ValderramaAún no hay calificaciones
- Disposicion Residuos Lavado Gun BarrelDocumento5 páginasDisposicion Residuos Lavado Gun BarrelCamilo SanchezAún no hay calificaciones
- Informe - Visita Banco de SemenDocumento2 páginasInforme - Visita Banco de Semenrodrigo vilcapomaAún no hay calificaciones