Estimacin del cambio de energa Trabajo y Entalpa
Rosa Devs, 2007
�Primera Ley de la Termodinmica
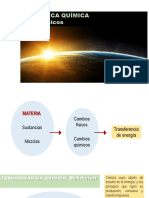
ENERGIA
Existe un invariante en la naturaleza:
La energa de universo es constante La energa no se puede crear ni destruir Un sistema puede variar su energa slo por intercambio con los alrededores
�Primera Ley de la Termodinmica
Un sistema puede variar su energa slo por intercambio con los alrededores: CALOR Y TRABAJO. El CAMBIO DE ENERGIA para un mismo proceso es siempre el mismo.
�E = q +w
Un sistema puede absorber o perder energa en la forma de calor o de trabajo.
Calor (+ q) Energa liberada: NEGATIVA Calor (- q)
Trabajo (+ w) Energa absorbida:
POSITIVA
Trabajo (- w)
�CALOR
El calor es transmisin de energa cintica molecular
El calor es una cantidad que aparece en los lmites de un sistema durante un cambio de estado y en virtud de una diferencia de temperatura
�Qu entendemos por trabajo?
�TRABAJO
El trabajo implica una modificacin de los alrededores
El trabajo es una cantidad que aparece en los lmites de un sistema durante un cambio de estado y que se traduce en una modificacin de los alrededores
�La termodinmica distingue dos formas de trabajo
Trabajo til (evitable)
Trabajo til
Trabajo expansivo (inevitable)
Trabajo expansivo
w total = wexpansivo + wtil
�Trabajo til
Trabajo asociado a una mquina
Una mquina es un dispositivo ajeno al sistema. Cuando la mquina se acopla al sistema puede usar el cambio que se produce en l para realizar un trabajo en los alrededores.
Batera
Energa
En la batera ocurre un proceso qumico, que ocurre muy lentamente en el sistema por s solo, pero rpidamente cuando se acopla al motor elctrico W en alrededores
Motor
�Trabajo til
Trabajo asociado a una mquina
ATP + H2O ADP + Pi + H+ (el sistema es la reaccin qumica)
Energa Motor molecular W en alrededores (sntesis qumica, bombeo de iones, etc.)
�Trabajo expansivo
Cambio de volumen contra una presin
�Trabajo expansivo
Cambio de volumen contra una presin De qu depende su magnitud?
Su magnitud depende de las magnitudes del cambio de volumen y de la presin que se opone
�Trabajo expansivo
Cambio de volumen contra una presin
Para la expansin de un gas a presin externa constante:
w = - pext V
�Problema 1
Se tiene un globo que contiene 2 moles de gas ideal a 30C y un volumen de 24,8 L . Qu ocurre con el globo si la presin externa es 1 atm? Cunto trabajo realiza el gas en el proceso?
�ESTIMACION DEL CAMBIO DE ENERGIA Cmo puede estimarse el cambio de energa en un proceso?
�Estimacin del cambio de energa en gases
�Cambio de energa en gases ideales
En gases ideales puede estimarse la energa cintica molecular (traslacin, rotacin, vibracin) a partir de la temperatura Energa cintica (molecular promedio) de traslacin: En gases : Ec = (3/2) k T k : constante de Boltzmann 1,38 x 10-23 J/ K
�Cmo puede obtenerse la Ec total a partir de la energa cintica promedio?
�Cambio de energa en gases
Para obtener la energa cintica molecular total se debe multiplicar la energa promedio por el nmero de molculas. Para un mol, se multiplica por el Nmero de Avogadro (No).
k = Constante de Boltzmann k No = R = Constante Universal de los Gases 8,31 joule/ K mol
No Ec = Ec = 3 k No T 2 Ec =
3 nRT 2
n = N de moles
�ESTIMACION DEL CAMBIO DE ENERGIA EN GASES
Ec = 3 n R T 2
R = 8,31 joule/ K mol
E= 3nRT 2 En gases se puede estimar el cambio de energa directamente del cambio de temperatura.
�Problema 2
Calcular la energa cintica promedio y la energa cintica total de 1 mol de gas monoatmico que se encuentra a 100 C.
�Cmo puede estimarse el cambio de energa en lquidos y slidos?
�Cmo puede estimarse el cambio de energa del proceso de fusin del agua?
HIELO AGUA LIQUIDA
La temperatura no cambia
E = q +w
q = calor de fusin w = trabajo de cambio de volumen
�Hidrlisis del ATP
Estado inicial
E=q+w
Estado final
ATP + H2O
ADP + H+ + P
ATP en solucin ATP + protenas musculares
Calor Calor Trabajo de contraccin
ATP + transportador
Calor Trabajo osmtico
�Estimacin del cambio de energa (E)
E = q + w
Para el camino sin trabajo w=0
E = q
Imaginar un cambio de estado (solidificacin del agua) El trabajo expansivo es inevitable.
w exp = -pext V
�Por lo tanto
E = q - pext V q = E + pext V pext = psist
Diferencia de entalpa
H = E + psist V q = H
�Estimacin del cambio de energa (E)
H = E + p V
Cuando el cambio de volumen es muy pequeo
H E
�El calor absorbido o liberado en un proceso que ocurre a presin constante y sin trabajo til corresponde al cambio de entalpa o H.
�El calor intercambiado puede medirse con un calormetro:
�El calor absorbido o liberado en un proceso que ocurre a presin constante y sin trabajo til corresponde al cambio de entalpa o H.
CH4 (g) + 2O2 (g) CO2(g) + 2 H2O H = - 802,4 kJ/mol Hielo agua lquida
H = 6,01 kJ/mol Agua lquida vapor de agua
H = 40,79 kJ/ mol H2 + 1/2 O2 H2O H = - 285,6 kJ/ mol
�2 H2 (g) + O2 (g)
PROCESO EXOTERMICO Calor liberado por el sistema hacia los alrededores
Como la entalpa es una funcin de estado, entonces su cambio depende solamente de los estados inicial y final
2 H2 (g) + O2 (g) 2 H2 O(l)
PROCESO ENDOTERMICO Calor absorbido por el sistema desde los alrededores
2 H2 O (l)
�Problema 3: Calcule cuanto calor se libera o absorbe en la reaccin: CO + O2 CO2
Sabiendo que: C(s) + O2 (g) CO (g) C(s) + O2 CO2 H = -110.5 kJ/mol H = -303.5 kJ/mol
�PROBLEMA FINAL Suponga que un gas encerrado en un cilindro metlico con una pared mvil se expande espontneamente contra la presin atmosfrica. Qu espera que ocurra con la presin del gas? Qu espera que ocurra ocurre con la temperatura del gas?
�La presin del gas disminuye hasta hacerse igual a la presin atmosfrica. Cuando las presiones se igualan el proceso se detiene.
La temperatura no cambia, pues en el estado final, el gas estar en equilibrio trmico con los alrededores
�Expansin espontnea a temperatura constante (isotrmica). Presin disminuye Volumen aumenta Temperatura no cambia Qu ocurre con la energa del gas? E= 3nRT 2
�La temperatura es un reflejo de la energa cintica molecular promedio y por lo tanto en una expansin isotrmica la energa del sistema se mantiene constante.
E= 3nRT 2
�Expansin espontnea a temperatura constante (isotrmica).
Presin disminuye Volumen aumenta Temperatura no cambia Energa no cambia Fluye calor a travs de los lmites del sistema?
�E = q +w
Energa no cambia Se realiza trabajo
E = 0
q=-w
En la expansin isotrmica se realiza trabajo y se absorbe calor
�Suponga ahora que el cilindro est hecho de un material que no deja pasar el calor. Que ocurre con la presin y el volumen? Qu ocurre con la energa? Qu ocurre con la temperatura?
E = q +w