Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practico 3 - 2012
Cargado por
sandra_muñoz_15Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practico 3 - 2012
Cargado por
sandra_muñoz_15Copyright:
Formatos disponibles
BIOQUMICA-PRCTICO 3
1. INTRODUCCIN
Gel Filtracin y Determinacin de Actividad Lisozima
1.1. Cromatografa de exclusin molecular o gel filtracin. En la cromatografa de exclusin molecular (llamada tambin, filtracin en gel o de tamiz molecular) los analitos de la muestra se separan en base a su tamao. Los mismos pueden o no ser retenidos por la fase estacionaria en base a su tamao, el que depender de la forma y de la masa molecular del analito en la fase mvil utilizada (llamada tambin masa molecular nativa). La cromatografa de exclusin molecular se realiza en columna. La fase estacionaria son partculas esfricas porosas e inertes que no interaccionan con los analitos. A la fase estacionaria la denominamos usualmente matriz, la que se utiliza para rellenar una columna hasta un volumen a determinar. Una vez lista la columna, decimos que la matriz est empaquetada. Una vez empaquetada, la matriz se equilibra en el buffer en el cul se realizar la cromatografa. Las partculas esfricas de matriz (fase estacionaria) son porosas y determinan una red de caminos entrecruzados (figura 1-A). Los analitos de mayor tamao no podrn entrar a dichos poros y sern excluidos de los mismos eluyendo en primer lugar (figura 1-D), los pequeos en cambio, entrarn a los poros de la matriz y sern retenidos ms tiempo en la columna, eluyendo ms tarde (figura 1-E).
Figura 1. Cromatografa de exclusin molecular. Una vez hidratada la fase estacionaria se empaqueta en una columna formando un lecho a travs del cual entra la fase mvil. La muestra de analitos que se quieren separar se aplica en la parte superior de la columna. Luego se va adicionando fase mvil (sin analitos) para comenzar la elucin. A medida que sta recorre la columna las molculas de la muestra se van repartiendo entre la fase mvil y la fase estacionaria. Aquellos analitos de tamao mayor que los poros de la fase estacionaria sern excluidos rpidamente. En cambio, los analitos de menor tamao que pueden entrar en los poros, difunden en el interior de los mismos en diferentes grados y se irn retardando en su recorrido eluyendo gradualmente.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
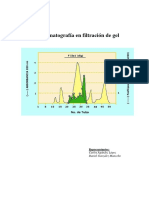
Por lo tanto, las molculas eluyen de la columna en orden decreciente de masa molecular, las ms grandes eluyen primero y luego las ms pequeas que se retardan en su recorrido. A la salida de la columna, lo que eluye se recoge en diferentes tubos (fracciones) de volumen deseado. En cada uno de ellos se monitorea la presencia del componente de inters. Para protenas y cidos nuclicos se controla la absorbancia a 280nm y 260 nm, respectivamente. El resultado de la separacin se visualiza en un diagrama de elucin o cromatograma (Figura 2), que muestra la absorbancia de cada fraccin en funcin del volumen de eluyente que ha pasado a travs de la columna (absorbancia vs volumen de elucin), visualizndose diferentes picos.
Figura 2 : Cromatograma de elucin.
A partir de este diagrama puede determinarse el volumen de elucin (Ve; volumen de lquido necesario para eluir un determinado analito). Cuando el volumen de la muestra de analitos aplicada a la columna tiene un volumen despreciable comparado con el volumen total de la columna, la posicin del mximo de pico en el diagrama de elucin se toma como el Ve (Figura 2). Para un mismo analito el volumen de elucin (Ve) puede variar al variar la columna utilizada (dametro y altura), el volumen total del lecho empaquetado o (Vt) (Figura 3-a) y las caractersticas de la fase estacionaria y de la fase mvil. Al igual que en otras cromatografas de particin, la elucin del analito est mejor caracterizada por una constante de reparto o distribucin=Kd, definida como sigue: Kd= (Ve Vo) / Vi
Ecuacin 1
Kd representa la fraccin de fase estacionaria en el cual puede difundir libremente el analito. El volumen muerto (Vo) es el volumen fuera de los poros de la matriz empaquetada en la columna (Figura 3-b). En dicho volumen muerto Vo es dnde se encontrarn los analitos que no son capaces de entrar en los poros debido a su gran tamao. Vo puede determinarse experimentalmente eluyendo un soluto de alto peso molecular y de fcil deteccin. Por ejemplo, el Azul Dextrano de 2.000.000 Da, en cualquier matriz que se utilice, siempre eluye en el volumen muerto y tiene color azul (mximo de absorcin a 600 nm), lo cual permite su deteccin.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
Figura 3 Volmenes de una columna cromatogrfica. En el interior de una columna de cromatografa pueden distinguirse varios volmenes: (a) el volumen total (Vt), que es el volumen que ocupa la fase estacionaria hidratada, (b) el volumen de vaco (Vo), o sea el volumen existente entre las esferas de la matriz o fase estacionaria, (c) el volumen ocupado por las esferas del gel, que se expresa como la diferencia entre los dos volmenes anteriores: Vt-Vo.
El volumen interno (Vi) de las partculas de la matriz o fase estacionaria est disponible para las molculas de menor tamao que logran entrar a los poros. En la prctica, Vi es difcil determinar y es sustitudo por su aproximacin (Vt Vo). Si sustitumos ahora en la ecuacin 1, se obtiene: Kav = (Ve Vo) / (Vt Vo)
Ecuacin 2
Kd ahora se denomina Kav y es una constante de distribucin aparente, que para cada tipo de matriz se relaciona de manera constante con Kd. Vt es el volumen total del lecho empaquetado (que si no se conoce puede detrminarse calculando el volumen de la columna, utilizando los valores de altura y dimetro de la misma). Para cualquier analito que eluya en el volumen muerto, el Ve es el Vo, con lo cual Kav vale 0 (sustituya en ecuacin 2). Para un analito que eluya en el Vt, Kav vale 1. Para aquellos solutos con tamaos que entren dentro del rango de fraccionamiento de la matriz, el volumen de elucin estar entre el volumen muerto y el volumen total de la matriz y Kav estar entre 0 y 1. 1.1.1. Matrices de exclusin molecular. Existe una gran variedad de materiales con los cuales construir matrices. Estos materiales son polmeros como: i) ii) iii) dextranos (polmeros de glucosa) como los matrices comerciales Sephadex; agarosa (polmero de D-galactosa y 3,2-anhidro-L-galactosa); polmeros sintticos (poliacrilamida, polivinilo), entre otros.
Estas cadenas polimricas se unen entre s por accin de agentes qumicos, que denominamos agentes de entrecruzamiento. La figura 4 muestra el Sephadex preparado en base a dextranos entrecruzados con epiclorhidirna. Controlando el grado de entrecruzamiento (ms epiclorhidrina, entonces ms entrecruzamiento) y el tamao de las partculas de la matriz, se pueden lograr matrices capaces de fraccionar (separar) molculas de diferente tamao (y por ende diferente peso molecular nativo), con diferente eficiencia.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
Polmeros de dextrano Agente entrecruzante Epiclorhidrina Polmeros de dextrano entrecruzados
Fig. 4 Representacin de dos cadenas de dextrano entrecruzadas utilizando epiclorhidrina.
Cada matriz utilizada en cromatografa de exclusin molecular se caracteriza por poseer un rango de fraccionamiento definido el que depende del tamao de los poros de sus partculas. El rango de fraccionamiento se expresa en unidades de masa molecular (Daltons: Da) y define los lmites en los cuales la matriz puede separar los componentes de una mezcla. Por ejemplo, si analizamos la Tabla 1, podemos ver que un Sephadex G-50 podr fraccionar molculas cuyo tamao est entre 1.500 Da y 30.000 Da. Aquellas molculas con un tamao mayor a 30.000 Da no podrn acceder al interior de los poros de la matriz, por poseer un tamao mayor al poro de las mismas. Estas molculas atraviesan la columna recorriendo el espacio existente entre las partculas de la matriz (volumen muerto). Aquellas molculas que posean un tamao comprendido dentro del rango de fraccionamiento accedern al interior de las partculas y logran separarse entre si. Por qu? Porque cuanto ms grande es una molcula, menos capacidad tiene de acceder a un mayor nmero de caminos dentro de los poros de la matriz y por lo tanto, menor ser el volumen de fase mvil que se requiere para eluya (extraerla) de la columna. Se discutirn ms detalles del fraccionamiento de molculas en la seccin Aspectos prcticos.
Tabla 1 . Algunos tipos de matrices Sephadex G * para protenas globulares en Da Tamao *Rango de Tipo de gel partcula La masa molecular de pptidos y protenas se expresa en fraccionamiento seca (m) daltons. Sephadex G10 40-120 0-700 Un dalton equivale a 1 g/mol. Sephadex G 25 coarse 100-300 1000-5000 Sephadex G 25 medium 50-150 1000-5000 Una protena de peso molecular 50.000 tiene una masa de Sephadex G 25 fine 20-80 1000-5000 50.000 daltons (Da) o lo que es lo mismo 50 kilodaltons Sephadex G 25 superfine 10-40 1000-5000 (KDa) o 50.000 g/mol. Sephadex G 50 coarse 100-300 1500-30000 Sephadex G 50 medium 50-150 1500-30000 Sephadex G 50 fine 20-80 1500-30000 Sephadex G 50 superfine 10-40 1500-30000
El Sephadex se encuentra disponible en diferentes tamaos de partculas que determinan que existan matrices con partculas finas, medias o superfinas. Las partculas finas se empaquetan mejor que las gruesas dando una mejor resolucin (separacin de molculas). Se compran en forma de polvo y para su uso deben hidratarse, y as toman su estructura de gel. Los Sephadex tipo G son aptos para trabajar en medio acuoso. Los Sephadex tipo LH tienen sus cadenas de dextranos modificadas con grupos hidroxipropilo, por lo cual son tiles para trabajar con solventes orgnicos poco polares o en mezcla de solventes orgnicos- agua. Las matrices de Sephadex son estables en un rango amplio de condiciones de trabajo, aunque generalmente se trabaja en condiciones moderadas de pH y fuerza inica. 1.2.3. Aplicaciones Fraccionamiento de mezclas
Una de las aplicaciones ms comunes de la cromatografa de exclusin molecular es el fraccionamiento de una mezcla de analitos de diferente tamao molecular, como polisacridos, cadenas de cidos nucleicos, protenas, pptidos y oligopptidos.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
Para ello debe elegirse la matriz o fase estacionaria apropiada segn el peso molecular estimado o conocido de los componentes de la mezcla y su grado de oligomerizacin (es decir si en solucin son monmeros, dmeros, etc.). Determinacin de la masa molecular (nativa) del analito en solucin. En el caso de protenas globulares es posible determinar mediante esta metodologa la masa molecular en solucin, tambin denominada masa nativa de la protena. Para ello se realizan cromatografas de exclusin molecular en una columna definida utilizando como muestra diferentes protenas de masa molecular conocida, que sern utilizadas como patrones de masa molecular. A partir del cromatograma de elucin de cada una de las protenas patrn se determina su Ve. Con dichos valores y utilizando la ecuacin 1 o 2 se calcula el Kd (si se conoce Vi o puede determinarse facilmente) o el Kav (si no se tiene Vi). Posteriormente se realiza un grfico del logaritmo de la masa molecular (en ingls Mw) de cada protena patrn en funcin de su valor de kd o Kav calculado. Si no se puede calcular kd o Kav (porque no se conoce el volumen total de la columna) tambin se puede graficar log Mw vs Ve/Vo. Posterirmente en iguales condiciones experimentales que las utilizadas para las protenas patrn (columna, buffer, volumen de muestra) se aplica a la columna la protena a analizar y se determina el Ve para la misma. Luego se calcula el Kd, (o Kav, o Ve/Vo) y utilizando la ecuacin de recta para el grfico anterior o interpolando, se determina el valor de la masa molecular nativa o en solucin de la protena de inters. La Fig. 5 muestra una curva de calibracin en la que se grafic la masa molecular en escala logartmica versus Ve/Vo.
Figura 5: Curva de calibracin en la que se grafica la masa molecular en escala logartmica versus Ve/Vo
Si conocemos la masa terica de una protena, la gel filtracin permite determinar por ejemplo, si la protena en las condiciones de la cromatografa, se encuentra como un monmero (una nica subunidad) o en forma multimrica (dmero, trmero, tetrmero). Tambin permite comparar la masa obtenida en condiciones nativas o desnaturalizantes (ver prctica de electroforesis) y analizar si coinciden o no. Desalado Consiste en separar molculas grandes como protenas de molculas pequeas tales como las sales, agentes reductores, colorantes, etc. Por ejemplo, la lisozima purificada por intercambio inico en el prctico anterior se encuentra en un buffer con una concentracin salina alta (0.4 M de NaCl). Podemos eliminar las sales de la muestra fcilmente mediante desalado. Para este fin se utiliza Sephadex G-25 que tiene un rango de fraccionamiento de 10005000 Da, que permite que las protenas mayores de 5000 Da (5kDa) eluyan en el volumen muerto de la columna, mientras que las sales se retrasan en su camino por la columna al entrar a las partculas de la matriz y eluyen en un volumen igual al volumen total de la columna. Este tipo de gel filtracin con Sephadex G-25 permite no slo eliminar las sales del buffer en el que se encuentra la protena, sino tambin cambiar el buffer en el cual la protena se encuentra.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
2. OBJETIVO DEL TRABAJO PRACTICO 2.1. 2.2. 2.3. Desalar la muestra de lisozima purificada por intercambio inico en el prctico anterior. Detectar la actividad enzimtica de la lisozima presente en las fracciones seleccionadas en la prctica de intercambio inico. Evaluar el efecto de un tratamiento con agente reductor en la actividad enzimtica de la lisozima.
3. REACTIVOS 3.1. Columna PD-10 Columna empaquetada con Sephadex G-25 medio (GE). Ver caractersticas de la Columna PD-10 en el anexo (tem 10) 3.2. Tampn de actividad lisozima: fosfato de potasio 0,5M pH 6,2. 3.3. Suspensin bacteriana de Micrococcus lysodeikticus (SIGMA) Preparada en el laboratorio a 0,2 mg de clulas por mL de tampn de actividad. 3.4. Lisozima comercial (SIGMA) Preparada en el laboratorio a 1 mg/mL en agua. 3.5. Ditiotreitol 1 M (DTT) (SIGMA), preparado en el laboratorio. 4. EQUIPOS Y MATERIALES 4.1. 4.2. 4.3. Lector de microplacas y microplaca de 96 pocillos, fondo plano. Soporte con pinza Material volumtrico (tubos, pipetas automticas)
5. PRECAUCIONES 5.1. 5.2. Ver ficha tcnica del DTT Generalmente las columnas con matriz vienen almacenadas en etanol al 20% para evitar su contaminacin con microorganismos, por lo cual antes de equilibrarlas con el tampn se debe retirar el etanol. Para ello, la columna se lava con agua MilliQ, utilizando como mnimo 2 volmenes de columna. El contacto del etanol directamente con algunos tampones puede causar la precipitacin de algunos componentes del mismo. No deje nunca las columnas sin lquido, no deben secarse nunca. En caso de secarse, la matriz se resquebraja produciendo caminos preferenciales diferentes al camino impuesto por las partculas de la matriz. En algunos casos ser necesario desgasificar las soluciones para evitar la entrada de aire a las mismas lo que causa que se seque la matriz. Cada columna, de origen comercial, presenta una ficha tcnica que describe cmo debe ser utilizada y almacenada, y debe ser leda con atencin antes de utilizar la columna.
5.3.
5.4.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
6. PROCEDIMIENTO 6.1. 6.2. Presenciarn una gel filtracin demostrativa cuyo objetivo es separar una mezcla coloreada preparada a partir de Azul Dextrano, cuya masa es 2.000.000 Da y DCFIF de masa 290 Da. Desalado de la muestra de lisozima purificada por intercambio inico en el prctico anterior. Cada subgrupo trabajar con una columna PD-10 (columna comercial empaquetada con Sephadex G-25) de acuerdo al siguiente protocolo:
a. Preparar la columna: - Colocar la columna en un soporte teniendo cuidado de que permanezca en forma vertical. - Quitar la tapa superior e inferior de la columna y descartar la solucin de almacenamiento (las columnas ya estarn en agua MilliQ) b. Equilibrar la columna - Llenar la columna con tampn de actividad (ver punto 3.2) hasta el tope y dejar pasar el tampn a travs de ella, realizar el lavado con un mnimo de dos volmenes de columna (2VC) - Descartar el lavado. - Tapar la salida de la columna c. Aplicar la muestra - Adicionar 2,5 mL de muestra en la parte superior de la columna. - Destapar la salida de la columna, dejando entrar toda la muestra a la columna. - Descartar el volumen desplazado. - Tapar la salida de la columna. d. Elucin - Colocar un tubo para colectar la muestra a la salida de la columna. - Adicionar 3.5 mL de tampn de actividad para elur. - Destapar la salida de la columna - Recoger todo el eluido y leer la absorbancia a 280 nm - Guardar la muestra desalada a 4C debidamente rotulada (Lisozima-Desalada, No.Grupo-X). - Tapar la columna. e. Lavado y reacondicionamiento - Lavar la columna con 20 mL de tampn de actividad para dejarla pronta para el grupo siguiente ya que estas columnas son reutilizables (si fuera el ltimo grupo prctico lavar la columna con agua y luego con la solucin de conservacin). - Tapar la columna con las tapas inferior y superior. - Almacenar a 4C.
6.3.
Medida de la actividad lisozima
La medida de la actividad lisozima se realizar utilizando como sustrato de reaccin una suspensin de clulas del microorganismo Micrococcus lysodeikticus. Esta suspensin presenta una turbidez que es detectada a una longitud de onda de 450 nm. Al incubar esta suspensin de clulas con lisozima las paredes celulares se hidrolizarn y las clulas se irn lizando dando lugar a una reduccin de la turbidez que pude detectarse a 450 nm. La actividad enzimtica ser proporcional a la disminucin de la absorbancia a 450 nm. Por definicin, en condiciones estndar se considera que 1 unidad de actividad enzimtica de lisozima (U) produce una disminucin en la Abs 450 nm de 0,001 en 1 minuto.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
El ensayo se realizar en microplaca de 96 pocillos. Se realizarn triplicados de cada una de las siguientes muestras: - Buffer (ste ser el Control Negativo: C-) - Lisozima comercial a 1 mg/mL (este ser el Control Positivo: C+) - Clara de huevo (fraccin aplicada a la columna de intercambio inico Fo) - Fraccin no retenida en la columna de intercambio o percolado (F1) - Muestra de lisozima eluda del intercambio inico (E) (slo el tubo de mayor Abs a 280nm). - Lisozima comercial a 1 mg/mL pre-incubada 15 min a temperatura ambiente con DTT 20 mM (Enzima con DTT). Adicionar a 100 uL de lisozima comercial a 1 mg/ml, un volumen de __________ uL de DTT 1M. a. Encender el lector de placas junto con el docente, y la computadora y el programa que controla dicho equipo. Debe seleccionar: el rea a leer (pocillos), la longitud de onda, el nmero de lecturas y la agitacin. b. Aadir 20 L de la muestra correspondiente en A1, A2, A3, B1, B2, B3, C1, C2, C3 tal como indica el esquema y contine como indica el punto 6.3.2. Posteriormente repita lo realizado para D1, D2, D3, E1. E2, E3 y F1, F2, F3.
c. Agregar 280 L suspensin de clulas bacterianas. ocurriera eliminarlas con la punta de un tip.
Verificar que no se formen burbujas, si esto
d. Coloque rpidamente la placa en el lector y realice 30 lecturas de absorbancia a 450nm cada 10 segundos (tiempo total 300 segundos). e. Copie o salve los datos de Abs en funcin del tiempo y grafique dichos Abs 450 nm en funcin del tiempo en segundos. Calcule la velocidad de la reaccin para cada muestra en Abs/min. f. Calcule la actividad por mL de muestra en unidades de enzima por mL (UE/mL) y complete el cuadro descrito en el punto 7.4 con los resultados obtenidos.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
7. CLCULOS Y RESULTADOS 7.1. Desalado de la muestra de lisozima purificada por intercambio inico (E) Muestra Lisozima purificada por Intercambio inico (E) Lisozima desalada 7.2. Determine el factor de dilucin que sufri la muestra E al ser desalada. Volumen (mL) Abs 280 nm Unidades de Abs 280 totales
7.3 Grficos de Abs 450 nm vs segundos
Pegue los grficos apilados.
7.4.
Transformar los valores de Abs/segundo a Abs/min
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
7.5 Complete la tabla siguiente
Actividad en Unidades de Enzima. (UE) Actividad por mL de muestra. (UE/mL de muestra) Volumen de muestra. (mL)
Muestra Fo F1 E CC+ Enzima con DTT
Abs/min
UE (totales)
N.A. N.A. N.A.
8. 9.
N.A.: No Aplica
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
8. CONCLUSION
9. EJERCICIOS 9.1. Una de las aplicaciones de la cromatografa de gel filtracin es la determinacin de la masa molecular de protenas. En la figura se muestra el cromatograma obtenido al aplicar una mezcla de protenas estndar a una columna de Superdex 200 HR 10/30 (Rango de fraccionamiento para protenas globulares: 10000 a 600000 Da) de volumen total igual a 30 mL.
El volumen muerto de la columna fue determinado previamente, siendo de 6,8 mL.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
I) Cual/es de los siguientes compuestos podra utilizar para determinar el volumen muerto de la columna de Superdex 200 HR? Justifique brevemente. Cloruro de sodio (58,4 g/mol), Tiroglobulina (Mr=660000 Da), Azul dextrano (2.000.000 Da) II) A partir del cromatograma se pueden determinar los volmenes de elucin de las protenas estndar y construir una curva de calibracin graficando Kav en funcin de log Mw. Complete la tabla y construya la curva de calibracin correspondiente.
Ve 12 14 16,5 18 Kav Mr (Da) 440000 158000 75000 43000 29000 13700 6500 Log Mw
Pegue aqu su curva de calibracin. III) El volumen de elucin de una solucin de lisozima aplicada a la columna fue 17,6 mL. A partir de la curva de calibracin calcule la masa molecular nativa de la lisozima.
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
9.2. En una columna de gel filtracin de Sephadex G-75 (Rango de fraccionamiento: 3 a 80 kDa) se aplica una muestra compuesta por: - una sal (200 Da). - una protena de alto PM (200 KDa) -un tetrmero cuya subunidad es de 12kDa.
I) Realice un diagrama de cmo imagina el perfil de elucin de dicha cromatografa.
II) Cmo se puede mejorar la separacin o resolucin de dos molculas de tamao similar en una misma matriz de gel filtracin?
BIOQUMICA-PRCTICO 3
Gel Filtracin y Determinacin de Actividad Lisozima
10. ANEXO y BIBLIOGRAFA
Caractersticas de la Columna PD-10 Matriz Rango de tamao de partculas Dimensiones del lecho empaquetado Tamao de muestra mximo Volumen de muestra eluida Capacidad de desalado Limite de exclusin Estabilidad qumica Rango de pH de trabajo Temperatura de almacenamiento Sephadex G-25 medio 85-260 m 1,45 x 5,0 cm (8,3 mL) 2,5 mL 3,5 mL >90% Mr 5.000 Todos las soluciones tampn comunes 2-13 4 a 30C
-Gel filtration in Scopes, R. Protein purification. Principles and practice. 2da edicin. Springer- Verlag. 1988. -Gel filtration. Principles and Methods. http://www.chromatographyamershambiosciences. com/aptrix/upp00919.nsf/ content/6EEE4799 0D9F933EC1256F90000DD697? OpenDocument -Sephadex LH-60 chromatography in organic solvents. Folleto tcnico Pharmacia Fine Chemicals
También podría gustarte
- Unidad 1. Investigacion Operativa de Bioprocesos-NeoDocumento38 páginasUnidad 1. Investigacion Operativa de Bioprocesos-NeoLidia AlvarezAún no hay calificaciones
- Procesos Electroquimicos de Sistemas Biológicos 1Documento21 páginasProcesos Electroquimicos de Sistemas Biológicos 1Gerardo Saldaña Gutierrez100% (1)
- Sensores y MedidoresDocumento52 páginasSensores y MedidoresAmérico RumínAún no hay calificaciones
- Biofarmacia - Investigacion Formativa - Jerson ContrerasDocumento21 páginasBiofarmacia - Investigacion Formativa - Jerson Contrerasgerson1contreras-1Aún no hay calificaciones
- Practico 1 Icp280Documento2 páginasPractico 1 Icp280marco antonio0% (1)
- Filtracion en Gel PDFDocumento5 páginasFiltracion en Gel PDFCecy HernándezAún no hay calificaciones
- Práctica 3 de Sistemas de ControlDocumento11 páginasPráctica 3 de Sistemas de ControlJorgeGarciaAún no hay calificaciones
- Control RetroalimentadoDocumento41 páginasControl RetroalimentadoJavier Chaiña0% (1)
- Medicion Precision y ExactitudDocumento7 páginasMedicion Precision y ExactitudAliceYevelHurtado100% (1)
- Control DerivativoDocumento13 páginasControl Derivativopepe martinezAún no hay calificaciones
- Lipidospor Metodo SoxhletDocumento20 páginasLipidospor Metodo SoxhletluisAún no hay calificaciones
- Conceptos de EntropiaDocumento50 páginasConceptos de Entropiajandresb230% (1)
- Introduccion A La Programacion PLCDocumento40 páginasIntroduccion A La Programacion PLCEdward50% (2)
- Minipreps, Tipos de Biotecnologia y Tipos de PromotoresDocumento12 páginasMinipreps, Tipos de Biotecnologia y Tipos de PromotoresManu RodriguezAún no hay calificaciones
- Elementos Finales de ControlDocumento8 páginasElementos Finales de ControlVianey GurubelAún no hay calificaciones
- Control de Relación GDocumento8 páginasControl de Relación GHugo Sanchez HuertaAún no hay calificaciones
- Conceptos Básicos de Cinética QuímicaDocumento8 páginasConceptos Básicos de Cinética QuímicaNicole Del Solar LagosAún no hay calificaciones
- Seminario 3 Farmacologia (Biotransformación)Documento47 páginasSeminario 3 Farmacologia (Biotransformación)TarritoRojoAún no hay calificaciones
- Reacción de HenryDocumento31 páginasReacción de HenryAlexa GarciamayorkAún no hay calificaciones
- Chapter16 Fundamentos Transporte MasaDocumento21 páginasChapter16 Fundamentos Transporte MasaDariana Balcázar MéndezAún no hay calificaciones
- Lab 01 Diagramas P&ID 2020 - 2Documento18 páginasLab 01 Diagramas P&ID 2020 - 2Jordan Jarry Canales CcalloAún no hay calificaciones
- Acido Borico - EspectrofotometriaDocumento4 páginasAcido Borico - EspectrofotometriaKñaus villAún no hay calificaciones
- Qué Es La Distribución Exponencial, EjemplosDocumento27 páginasQué Es La Distribución Exponencial, EjemplosFernando ReyesAún no hay calificaciones
- 7 Sintonización de Controladores IndustrialesDocumento12 páginas7 Sintonización de Controladores IndustrialesDiego Moreno BasmaAún no hay calificaciones
- Cinetica de Las FermentacionesDocumento28 páginasCinetica de Las FermentacionesJose ReynosoAún no hay calificaciones
- Apunte Calculo Numerico UBADocumento184 páginasApunte Calculo Numerico UBALuz MartinezAún no hay calificaciones
- Biologia MolecularDocumento61 páginasBiologia MolecularSharon Dayan CubasAún no hay calificaciones
- Lazos de Control PidDocumento6 páginasLazos de Control PidMary Cruz Santiestevez MamaniAún no hay calificaciones
- Instrumentos para Medir La TemperaturaDocumento5 páginasInstrumentos para Medir La TemperaturaPablo PadillaAún no hay calificaciones
- Calculo de Tierras para Lineas Por Medio de VarillasDocumento11 páginasCalculo de Tierras para Lineas Por Medio de VarillasInstalaciones Eléctricas ResidencialesAún no hay calificaciones
- Lazos de Control de Proceso-CompletoDocumento25 páginasLazos de Control de Proceso-CompletoEthel Andrea Morán ZapataAún no hay calificaciones
- Control FraccionarioDocumento16 páginasControl FraccionariomiguelAún no hay calificaciones
- Como Leer Un DTIDocumento6 páginasComo Leer Un DTIthekiller98Aún no hay calificaciones
- Herramientas Matemáticas para La Ubicación EspacialDocumento5 páginasHerramientas Matemáticas para La Ubicación EspacialJuan c sanchezAún no hay calificaciones
- Métodos de Separacion CromatograficosDocumento24 páginasMétodos de Separacion Cromatograficosalejandro_lozano_cAún no hay calificaciones
- MicrodiseccionDocumento4 páginasMicrodiseccionJose luis Cruz RamosAún no hay calificaciones
- Sistema MétricoDocumento12 páginasSistema MétricoAlejandro VásquezAún no hay calificaciones
- Propagacion Del ErrorDocumento8 páginasPropagacion Del ErrorLuis Francisco Sifuentes PalominoAún no hay calificaciones
- Introducción A Los Sistemas de ControlDocumento24 páginasIntroducción A Los Sistemas de ControlJerri BetancourtAún no hay calificaciones
- EnzimasDocumento72 páginasEnzimasJose MarioAún no hay calificaciones
- Control Proporcional DerivativoDocumento2 páginasControl Proporcional Derivativoalanbf3Aún no hay calificaciones
- Manual de Prácticas Del Laboratorio de BiorreactoresDocumento108 páginasManual de Prácticas Del Laboratorio de BiorreactoresingeestrellaAún no hay calificaciones
- Simulación Dinámica de Tiempo Real. Pasteurizador HTST 1.0 PDFDocumento140 páginasSimulación Dinámica de Tiempo Real. Pasteurizador HTST 1.0 PDFMenelao ZubiriAún no hay calificaciones
- Linea Del TiempoDocumento2 páginasLinea Del TiempoDaila CárdenasAún no hay calificaciones
- PID2Documento42 páginasPID2Kevin LopezAún no hay calificaciones
- Variables de InstrumentacionDocumento5 páginasVariables de InstrumentacionRey Sergio Lerma Cano0% (1)
- 2 Gel FiltracionDocumento8 páginas2 Gel Filtracionluxy12Aún no hay calificaciones
- Guia Laboratorio #2 Cromatografía de Exclusión MolecularDocumento3 páginasGuia Laboratorio #2 Cromatografía de Exclusión Molecularkevin.lopez.bAún no hay calificaciones
- Cromatografia de Exclusion MolecularDocumento7 páginasCromatografia de Exclusion MolecularAnaid Lopez100% (1)
- Gel de FiltraciónDocumento20 páginasGel de FiltraciónEduardo Camarena SullcaAún no hay calificaciones
- Cromatografía de Exclusión Molecular o Filtración en GelDocumento5 páginasCromatografía de Exclusión Molecular o Filtración en GelninnaesolfenAún no hay calificaciones
- CromatografiaDocumento9 páginasCromatografiaRogelio Hernandez GAún no hay calificaciones
- 13 Filtración en GelDocumento7 páginas13 Filtración en GelGuadalupe AlvaradoAún no hay calificaciones
- Cromatografía de Exclusión Molecular Informe FinalDocumento11 páginasCromatografía de Exclusión Molecular Informe Finalmonica curtiñezAún no hay calificaciones
- Separacion de BiomoleculasDocumento11 páginasSeparacion de BiomoleculasMA BDAún no hay calificaciones
- Bioquimica 11 Cromatografia de Exclusión MolecularDocumento5 páginasBioquimica 11 Cromatografia de Exclusión MolecularjosejoliAún no hay calificaciones
- Prelaboratorio 5 BioquimicaDocumento11 páginasPrelaboratorio 5 BioquimicaAmarilis GómezAún no hay calificaciones
- Cromatografía de Exclusión MolecularDocumento21 páginasCromatografía de Exclusión MolecularJenny Alexandra Santamaria Maldonado100% (1)
- Cromatografia en Colmna Analitica 3 Segundo InformeDocumento6 páginasCromatografia en Colmna Analitica 3 Segundo InformeLeidys Begambre VergaraAún no hay calificaciones
- Polimeros SecDocumento4 páginasPolimeros SecDaniela Suárez CárdenasAún no hay calificaciones
- Banco de filtros: Información sobre las técnicas del banco de filtros de Computer VisionDe EverandBanco de filtros: Información sobre las técnicas del banco de filtros de Computer VisionAún no hay calificaciones
- La Extracción de ADN Se Realiza en Tres EtapasDocumento3 páginasLa Extracción de ADN Se Realiza en Tres Etapassandra_muñoz_15100% (1)
- ManualDocumento46 páginasManualHellen Orellana Salas100% (1)
- Cap 1 para Entender La Economia Del UruguayDocumento41 páginasCap 1 para Entender La Economia Del Uruguaysandra_muñoz_1557% (7)
- Diseño TextilDocumento42 páginasDiseño Textilsandra_muñoz_15Aún no hay calificaciones
- Eficiencia Maquinas de VaporDocumento10 páginasEficiencia Maquinas de Vaporangel ruizAún no hay calificaciones
- Planeamiento de Minado en CuajoneDocumento57 páginasPlaneamiento de Minado en CuajoneMadissonDaphneAragónMenéndez100% (6)
- EJEMPLO Programa Calidad Agua PotableDocumento6 páginasEJEMPLO Programa Calidad Agua PotableEver alexander VelandiaAún no hay calificaciones
- Tarea06 - FdtiDocumento8 páginasTarea06 - FdtiJesus HernandezAún no hay calificaciones
- PRACTICADocumento3 páginasPRACTICAJerson LavoeAún no hay calificaciones
- Compania Minera Poderosa S DiaposDocumento33 páginasCompania Minera Poderosa S DiaposAntony Alfaro Valencia100% (1)
- Absorcion Atomica Del PlomoDocumento13 páginasAbsorcion Atomica Del PlomoDAVID FELIX CAYETANO CRISTOBALAún no hay calificaciones
- Informe TT Acero Recocido 1045Documento16 páginasInforme TT Acero Recocido 1045Omar Andres Useda RodriguezAún no hay calificaciones
- Adhesivos Dentales ExposicionDocumento11 páginasAdhesivos Dentales ExposicionDemy Galvez AlfaroAún no hay calificaciones
- Indicadores de PHDocumento3 páginasIndicadores de PHManuel DiazAún no hay calificaciones
- Modulo de Quimica 10 y 11 PDFDocumento61 páginasModulo de Quimica 10 y 11 PDFRobin De La PerlaAún no hay calificaciones
- Monografia de Mantenimiento de RodamientosDocumento37 páginasMonografia de Mantenimiento de RodamientosLuis MaytaAún no hay calificaciones
- Taller IRCA-IRABA - BPSDocumento5 páginasTaller IRCA-IRABA - BPSjosephAún no hay calificaciones
- SRK Soave-Redlich-Kwong - PR Peng-RobinsDocumento20 páginasSRK Soave-Redlich-Kwong - PR Peng-RobinsEuler CauchiAún no hay calificaciones
- CaracteristicasDocumento7 páginasCaracteristicasAngel TargeryanAún no hay calificaciones
- Informe de "Efectos de Las Operaciones Unitarias, en El Contenido de Nutrientes (Vitamina C) de Productos de Frutas y Hortalizas"Documento30 páginasInforme de "Efectos de Las Operaciones Unitarias, en El Contenido de Nutrientes (Vitamina C) de Productos de Frutas y Hortalizas"Antonny Jean Zamudio LimasAún no hay calificaciones
- Presentación de ConcentracionDocumento10 páginasPresentación de ConcentracionJesus Gelder Zarate CastroAún no hay calificaciones
- Inf N°3 - PQ223 - Carbajal FloresDocumento21 páginasInf N°3 - PQ223 - Carbajal FloresJhandy Carlos Octavio Martinez CondorAún no hay calificaciones
- Guia 1 Ciencias Naturales 11Documento4 páginasGuia 1 Ciencias Naturales 11cindry hoyosAún no hay calificaciones
- Palabras Sobre El Medio AmbienteDocumento6 páginasPalabras Sobre El Medio AmbientemakkrzAún no hay calificaciones
- Guia de Ejercicios QMC FinalDocumento22 páginasGuia de Ejercicios QMC FinalAlejandra SiñaniAún no hay calificaciones
- Guía 2. Química. Noveno. Propiedades PeriódicasDocumento5 páginasGuía 2. Química. Noveno. Propiedades PeriódicasSonia Pirateque0% (1)
- Clase T.PDocumento2 páginasClase T.PYessenia Yakelin Hernandez GutierrezAún no hay calificaciones
- Propuesta de MonografiaDocumento33 páginasPropuesta de Monografiaedis diazAún no hay calificaciones
- Respirador Descartable Steelpro N95 2730 (20 Un)Documento1 páginaRespirador Descartable Steelpro N95 2730 (20 Un)miguel ángel VillarroelAún no hay calificaciones
- Energía QuímicaDocumento3 páginasEnergía Químicabigarcia123Aún no hay calificaciones
- Microscopia Electrónica de BarridoDocumento5 páginasMicroscopia Electrónica de BarridoEfrain ArreazaAún no hay calificaciones
- NFP 566Documento7 páginasNFP 566Edwin MarsigliaAún no hay calificaciones