Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tema - 3 - Orbitales y Enlaces Quimicos
Tema - 3 - Orbitales y Enlaces Quimicos
Cargado por
Ravi SharmaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tema - 3 - Orbitales y Enlaces Quimicos
Tema - 3 - Orbitales y Enlaces Quimicos
Cargado por
Ravi SharmaCopyright:
Formatos disponibles
2003, Ernesto de Jess Alcaiz
_________________________________________________________________________________________
3 Orbitales y enlaces qumicos
3.1
3.2
3.3
3.4
La descripcin mecano-cuntica del enlace qumico
La teora del enlace de valencia (TEV)
La teora de los orbitales moleculares (TOM)
cidos y bases de Lewis
_________________________________________________________________________________________
3.1 La descripcin mecano-cuntica del enlace qumico
La resolucin exacta de la ecuacin de Schrdinger es imposible para molculas polielectrnicas, por lo
se precisa realizar algunas aproximaciones. Estas aproximaciones se basan en dos modelos alternativos.
La teora del enlace de valencia construye la funcin de onda de la molcula vista como un
conjunto de pares electrnicos localizados en un tomo o entre dos tomos. Se trata de la versin
mecano-cuntica de las ideas de Lewis y comparte con ellas conceptos como la resonancia.
La teora de los orbitales moleculares construye la funcin de onda de la molcula como un
conjunto de orbitales moleculares deslocalizados por toda la molcula.
En ambas teoras, el solapamiento de orbitales atmicos juega un papel fundamental. Cuando
participan orbitales direccionales, el solapamiento depende de la direccin de interaccin:
A
Mximo Solapamiento
Solapamiento intermedio
Solapamiento nulo
3.2 La teora del enlace de valencia (TEV)
La teora de enlace de valencia supone que un enlace entre dos tomos se forma por el solapamiento de
dos orbitales, uno de cada tomo, si el total de electrones que ocupan ambos orbitales es de dos.
Un enlace ptimo exige un mximo solapamiento entre los orbitales participantes, por lo que cada
tomo debe tener orbitales adecuados dirigidos hacia los otros tomos con los que se enlaza. A menudo
esto no es as, y en la formacin de un enlace no participa un orbital atmico puro sino una mezcla
(hibridacin) de orbitales atmicos adecuada para que los orbitales hbridos se encuentren orientados en
las direcciones de enlace. Por ejemplo, en una molcula lineal como BeCl2 , los enlaces BeCl estarn
previsiblemente formados por orbitales hbridos sp (50% s, 50% p) del berilio:
s
& p
equivale a
A
sp
&
A
sp
En la tabla 3.1, se da la hibridacin necesaria para cada tipo de geometra. En los ejemplos, la hibridacin
dada es la de los orbitales del tomo central.
Tabla 3.1. Hibridacin de orbitales atmicos y geometra electrnica
Geometra electrnica
Orbitales necesarios
Orbitales hbridos
Lineal
s +p
sp
Ejemplos
BeCl2 , CO2
Triangular plana
Tetraedro
s +p+p
s +p+p +p
sp2
sp3 (o sd3 )
BF3, SnCl2 , C 2H4
CH4, NH3 , H2 O
Bipirmide trigonal
Octaedro
s +p+p +p+ d
s +p+p +p+ d+d
sp3d (o spd3 )
sp3d2
PCl5, SF4 , ClF3, I 3
SF6, BrF 5, XeF 4
La energa de un orbital hbrido es la media aritmtica de la de los orbitales mezclados. Es importante
resaltar que la tabla anterior predice los orbitales hbridos que participarn en los enlaces a partir de la
geometra de molcula (estimada por la VSEPR u obtenida experimentalmente), y no viceversa.
Tema 3: Orbitales y enlaces qumicos | 55
Universidad de Alcal
Enlaces sencillos. Se forman por solapamiento frontal de orbitales, llamado solapamiento .
1s
BeH2
H
2sp(Be)
1s(H)
2p(Be)
2sp
2p
Be
2p
2s
Enlaces
Orbitales 2p vacos
Be
1s
BH3
1s(H)
H
2sp2
2sp2 (B)
2p
2p(B)
B
2p
2s
Enlaces
Orbital 2p vaco
B
1s
CH4
1s(H)
2sp3 (C)
H
2sp3
C
2p
2s
C
Enlaces
1s
NH3
H
2sp3 (N)
2sp3
1s(H)
N
2s
Enlaces
2p
56 | Enlace qumico y estructura de la materia
Licenciatura en Qumica
Enlaces dobles y triples. Slo se puede formar un enlace entre dos tomos por solapamiento . En los
enlaces mltiples, un enlace se forma por solapamiento frontal y el resto por solapamiento lateral .
1s
C2H4
1s(H)
H
2sp2
2sp (C)
C
2p
2s
Enlaces
2p(C)
2p
Enlaces
Molculas con direcciones de enlace no equivalentes. En molculas como el NH3 o el C2H4 , todos los
hbridos no tienen por qu ser exactamente iguales, ya que juegan papeles diferentes (en el NH 3, 3 sirven
enlazan N con H y otro aloja un par solitario; en el C2H4, dos enlazan C con H y otro C con C). En
dichos casos se pueden esperar separaciones de la hibridacin prevista. Para el H2O o el H2S, podemos
pensar en dos modelos extremos (ver figura 3.1). Posiblemente el modelo con hibridacin sea ms real
para el H2 O, ya que HOH = 104, y el modelo sin hibridacin lo sea para el H2 S, ya que HSH = 92.
Slo mediante el clculo mecano-cuntico correspondiente se podra confirmar esa previsin.
Figura 3.1. Dos
modelos para el enlace XH
en el agua y en el sulfuro
de hidrgeno.
Modelo CON hibridacin
Modelo SIN hibridacin
(Por claridad, no se
han dibujado los
orbitales s y p de
los pares solitarios)
nsp3(X)
1s(H)
X = O (n = 2), S (n = 3)
np(X) 1s(H)
nsp3
X
Angulo HXH acorde con hibridacin
np
ns
Carcter en orbitales de X del enlace XH
109,5
25% s ms caracter p
75% p
90
0% s
100% p
Carcter en orbitales de X de los pares solitarios
25% s ms caracter s
75% p
50% s
50% p
Hibridacin y electronegatividad. Recordemos (ver tema 2) que la capacidad de un tomo para atraer los
electrones de un enlace covalente puede ser modificada por varios factores, de manera que la
electronegatividad de un tomo es mayor cuanto mayor es su estado de oxidacin y cuanto mayor es el
carcter s del orbital hbrido que participa en el enlace.
3.3 La teora de los orbitales moleculares
Muchas molculas no son descritas correctamente mediante la teora de Lewis. Un ejemplo es el
diborano (B2H6) que es un compuesto electro-deficiente: no hay suficientes electrones de valencia para
poder asignarle una estructura de Lewis. Otro ejemplo es el O2 que es paramagntico, mientras que la
teora de Lewis prevee que sea diamagntico.
Orbitales enlazantes y antienlazantes. En la teora de orbitales moleculares, los orbitales atmicos al
solapar forman orbitales moleculares. Dos orbitales atmicos solapan dando un orbital molecular
enlazante y otro antienlazante. En un orbital enlazante, los electrones que lo ocupan tienen una alta
Tema 3: Orbitales y enlaces qumicos | 57
Universidad de Alcal
probabilidad de situarse entre los tomos, por lo que su llenado estabiliza la molcula. En un orbital
antienlazante, los electrones que lo ocupan tienen una baja probabilidad de situarse entre los tomos, por
lo que su llenado desestabiliza la molcula. En un diagrama de interaccin (fig. 3.2) se muestran los
niveles de energa de los orbitales atmicos y moleculares, as como los orbitales atmicos que
contribuyen a cada orbital molecular.
Energa creciente
HA
HH
HB
s
*
1s(A)
1s(B)
1s
1s
A +
1s(A)
1s(B)
Figura 3.2. Diagrama de
interaccin para la
molcula de hidrgeno.
Como <*, las interacciones entre 2 orbitales son estabilizadoras si son a 2 electrones y
desestabilizadoras si son a 4 electrones. El orden de enlace es igual a
(nmero de electrones en orbitales enlazantes nmero de electrones en orbitales antienlazantes)/2.
La interaccin entre dos orbitales atmicos es mayor cuanto mayor sea su solapamiento y menor su
diferencia de energa.
Diagramas de interaccin para molculas homodiatmicas del segundo perodo. (Figura 3.3). El
diagrama de la figura 3.3 es cualitativamente correcto slo cuando se puede despreciar la interaccin
entre el orbital 2s de un tomo y el 2pz del otro. Si dicha interaccin no es despreciable, los orbitales
moleculares s y z se mezclan entre s. El resultado de su mezcla es, de acuerdo a una propiedad general
de la mecnica cuntica, un alejamiento de sus energas: el orbital s refuerza su carcter enlazante,
disminuyendo algo su energa, mientras que el orbital z pierde carcter enlazante, aumentando su
energa. Lo mismo ocurre con los orbitales s * y z*. El resultado puede ser un cambio en el diagrama
cualitativo tal como se muestra en el diagrama de la figura 3.4. Esta mezcla en la TOM entre 2s y 2pz es
equivalente a la hibridacin sp en la TEV.
XA
XX
XB
x y
z
A
Energa creciente
x y
2p
2px(A)
2px(B)
2p
x y
2pz (A)
z
s
2s
2s
A
2s(A)
2pz(B)
B
2s(B)
Figura 3.3. Diagrama de interaccin cualitativo para molculas homodiatmicas del segundo perodo en las
que la interaccin entre el orbital 2s de un tomo con el 2pz del otro es pequea.
Diagramas de interaccin para molculas heterodiatmicas. (Ver figura 3.5) El tomo ms
electronegativo (el oxgeno en este caso) tiene los orbitales ms bajos en energa. Los orbitales
moleculares enlazantes tienen ms participacin de los orbitales atmicos del oxgeno, pues estn ms
58 | Enlace qumico y estructura de la materia
Licenciatura en Qumica
prximos en energa, que del nitrgeno (matemticamente z = ap z(N) + bp z(O), donde a < b) y los
antienlazantes del nitrgeno ( z* = bpz(N) apz(O), donde a < b. Por ello, los orbitales enlazantes estn ms localizados sobre el oxgeno y los antienlazantes sobre el nitrgeno. Como hay ms orbitales
enlazantes llenos que antienlazantes llenos, el resultado es que la densidad electrnica total est ms
localizada sobre el oxgeno.
XA
XX
XB
y
z
Energa creciente
xy
2p
2p
z
x y
2s
Figura 3.4. Diagrama de interaccin
cualitativo para molculas
homodiatmicas del segundo perodo en
las que la interaccin entre el orbital 2s de
un tomo con el 2pz del otro es grande.
2s
s
N
NO
y
z
xy
Energa creciente
2p
2p
x y
N
s
2s
2s
Figura 3.5.
Diagrama de interaccin para la
molcula NO.
3.4. cidos y bases de Lewis
cidos y bases de Brnsted (revisin). En 1923 Brnsted y Lowry propusieron la siguiente definicin de
cido y base:
Un cido de Brnsted es cualquier molcula o ion dadora de iones hidrgeno, H+ .
Una base de Brnsted es cualquier molcula o ion aceptora de iones hidrgeno, H +.
Las sustancias que pueden comportarse como cidos y como bases de Brnsted se llaman anfiprticas.
Ejemplos: H2O, HCO3, HS, HSO4. En una reaccin cido-base se transfieren iones hidrgeno del
A + BH+ , donde HA y BH+ son los cidos conjudados de las bases B y A.
cido
a la base HA + B
_____________________________________________________________________________________________________
cidos y bases conjugados
cido
HCl
HNO 3 H2 SO4
HSO4 H2 CO3 CH3COOH H2 O OH H3 O+ H2 S HS NH3 NH4 +
Base
Cl
NO3
HSO4
SO42 HCO3 CH3COO
OH O2
H2 O
HS S 2 NH2 NH3
_____________________________________________________________________________________________________
Universidad de Alcal
Tema 3: Orbitales y enlaces qumicos | 59
La constante del equilibrio HA + B
A + BH+ ser tanto mayor cuanto mayor sea la fuerza del
cido y de la base. Los cidos (o bases) se clasifican por su fuerza cida midiendo la constante de
equilibrio
frente a una base (o cido) de referencia, por ejemplo el agua.
_____________________________________________________________________________________________________
Constantes de ionizacin de cidos en agua a 25C, HA + H2 O
A + H3O +
+
HA
HClO4 H2 SO4 HCl HNO 3 H3 O
HF
CH3COOH
H2 CO3
NH4 +
H2 O
1
4
5
7
K (mol l )
1
3,5 10
1,8 10
4,3 10
5,6 1010 1,0 1014
_____________________________________________________________________________________________________
Constantes de ionizacin de bases en agua a 25C, B + H2O
OH + BH +
B
H2 O
CO(NH 2)2
CH3COO
NH3
OH
NaOH NH2
O2
1
14
14
10
5
K (mol l )
1,0 10
1,3 10
5,6 10
1,8 10
1
_____________________________________________________________________________________________________
cidos y bases de Lewis. Lewis formul en 1923 una definicin alternativa a la de Brnsted:
Un cido de Lewis es un ion o molcula aceptor de pares electrnicos.
Una base de Lewis es un ion o molcula dador de pares electrnicos.
Se denominan anfteras a las sustancias que pueden actuar como cidos y como bases de Lewis. En una
reaccin cido-base, el cido y la base comparten el par electrnico aportado por la base, formando un
AB. La definicin de una base de Brnsted como aceptora de H+, H+ +
enlace covalente, A + :B
BH+, no es ms que un caso particular de base de Lewis, donde H+ es el cido de Lewis. Sin
B
embargo, muchos cidos de Lewis no son cidos de Brnsted. Por ejemplo, BF3 (BF3 + :NH3
F3BNH3) o SO3 (SO 3 + H2O:
H2SO4).
Fuerza de cidos y bases de Lewis: cidos y bases duros y blandos, efectos estricos. En la definicin de
AB,
Lewis, la fuerza de un cido se puede evaluar mediante la constante del equilibrio A + :B
donde B es una base de referencia. En realidad, la escala de fuerza cida depende de la base escogida
como referencia, de forma que un cido puede ser ms fuerte que otro frente a una base pero ms dbil
frente a otra. Para los cidos y bases de Lewis se han desarrollado reglas cualitativas que permiten
preveer su fuerza y estimar qu clases de bases preferir un cido determinado y viceversa. Estas reglas
se basan en dividir las bases en:
bases duras, que son aquellas que tienen un tomo dador cuya densidad electrnica se polariza (se
deforma) difcilmente. Por ello, normalmente el tomo dador es pequeo y muy electronegativo (N, O y
F). Ejemplos: F, OH, O2, H2O, R2O (teres), NH3.
bases blandas que son aquellas que tienen un tomo dador cuya densidad electrnica se polariza (se
deforma) con facilidad. Los tomos dadores son generalmente menos electronegativos y mayores que los
de las bases duras (elementos no cabecera de los grupos 15 a 17). Ejemplos: Br, I, CN, SCN, H, R,
RS, CO, RNC.
En general, las bases blandas deberan ser ms fuertes que las duras pues ceden con mayor facilidad
el par electrnico. Ahora bien, se ha observado que ciertos cidos forman enlaces ms estables con las
bases duras que con las blandas. Los cidos que en proporcin se enlazan mejor con las bases duras
reciben el nombre de cidos duros. Los cidos que en proporcin se enlazan mejor con las bases blandas
reciben el nombre de cidos blandos. La siguiente tabla muestra una lista de cidos blandos y duros.
_____________________________________________________________________________________________________
cidos duros
cidos intermedios
cidos blandos
H+, Li+, Na +, K+
Cu +, Ag+, Au+, Tl+, Hg 22+ , Cs+
Be2+ , Mg2+, Ca2+ , Sr2+, Sn 2+
Fe2+ , Co2+ , Ni2+, Cu 2+ , Zn2+, Pb 2+
Pd 2+, Cd 2+, Pt 2+, Hg 2+
3+
Al
Tl3+
4+
Si
I+, Br+, HO +, RO+
_____________________________________________________________________________________________________
Para explicar este comportamiento experimental, se pueden utilizar dos modelos complementarios:
modelo inicocovalente. Los cidos duros se encuentran con preferencia entre los cationes metlicos
pequeos y/o con alta carga, mientras que los cidos blandos se encuentran con preferencia entre los
60 | Enlace qumico y estructura de la materia
Licenciatura en Qumica
cationes grandes y/o con baja carga. Una base dura es poco polarizable por lo que tender a formar
enlaces con una importante componente inica. Estos enlaces importantemente inicos sern ms fuertes
cuando el catin sea un cido duro, es decir pequeo y/o con alta carga. Una base blanda tender a
formar enlaces con una importante componente covalente. Estos enlaces covalentes sern ms fuertes con
un cido blando (ver escala de electronegatividad de Jaff en tema 2).
modelo de enlace . Es un modelo apropiado para los cationes de los metales de transicin. Entre los
cationes de transicin blandos predominan aquellos que tienen electrones en orbitales d dbilmente
sujetos (a consecuencia de la baja carga y/o gran tamao). Las bases blandas contienen ligandos con
orbitales d vacos en el tomo dador (P, As, S, I, etc.) o tienen orbitales vacos (CO). El enlace entre
un cido blando y una base blanda se encuentra reforzado por una contribucin . La caracterstica
principal de los cidos duros es tener orbitales d vacos que tienen tendencia a aceptar electrones y
pueden recibir pares electrnicos de ligandos con tomo dador pequeo como O F.
..
A
..
:
cido blando - base blanda
cido duro - base dura
Bibliografa
Seminarios
hibridacin
3.1
3.2
3.3
3.4
3.5
3.6
3.7
3.8
Para las siguientes molculas y iones, escribe una estructura de Lewis razonable (o ms de una, si crees
que mediante la resonancia de ellas se mejora la descripcin de la molcula), cuenta el nmero de
electrones del tomo central, propn una estructura (en base a la VSEPR), y estima la hibridacin
previsible que tienen los orbitales atmicos del tomo central.
a) SF4, b) SF6 , c) ICl4 , d) O3 , e) CO32.
Indica la geometra de la molcula, la hibridacin ms probable para los orbitales atmicos de valencia
del tomo central y la polaridad de cada una de las siguientes molculas:
a) CS2, b) CBr4 , c) H2Te, d) SiH 4, e) OF2, f) SF 2, g) BF3, h) XeOF 4.
Seala la hibridacin de cada tomo de carbono en las siguientes molculas:
a) CH3CH2CH3, b) CH2 =CHCH3, c) CH3 CCH, d) CH2 =C=C=CH2, e) HCCCCH,
f) C6H6 (benceno), g) HCHO (formaldehido).
Cul es la geometra de los entornos de cada uno de los tomos del cido actico (H3CCOOH)? Cul
es la hibridacin de los orbitales atmicos de cada uno de los tomos? Qu enlace carbonooxgeno ser
ms largo?
Da la composicin de cada uno de los enlaces de cada molcula en la forma, por ejemplo, (Csp, H1s):
a) C2 H6 , b) C2H2 , c) HCN, d) CH3OH, e) NO3 .
En el etileno (H2C=CH 2) los cuatro hidrgenos estn en el mismo plano. Explica si la VSEPR y la TEV
justifican dicha observacin experimental.
Describe el enlace en las molculas de CH4, NH 3 y H2 O, de acuerdo a la teora de enlace de valencia.
Qu diferencias pueden sealarse entre ellas?
La adicin de cierto carcter d a un orbital hbrido, aumenta o disminuye la electronegatividad del
tomo?
Tema 3: Orbitales y enlaces qumicos | 61
Universidad de Alcal
3.9
Calcula cualitativamente el carcter s del orbital hbrido que el tomo de carbono emplea en los orbitales
que estn dirigidos hacia los tomos de H y F, en los siguientes compuestos:
Compuesto
CH3F
CH2F 2
CHF3
ngulo HCH
110112
119 0,4
ngulo FCF
108,30,1
108,80,75
solapamiento
3.10
Cules de los siguientes orbitales atmicos situados sobre tomos diferentes en la geometra
representada solapan entre s?
a)
3.11
b)
d)
c)
e)
f)
Di cuando el solapamiento de los siguientes orbitales situados en tomos vecinos producir un enlace y
cuando . El eje z es el que une los dos tomos.
a) (1s, 1s), b) (2pz, 2pz), c) (2px, 2px ), d) (2s, 2pz), e) (3dz2, 3dz2 )
teora de orbitales moleculares
3.12
Cules de los siguientes orbitales moleculares son enlazantes y cules antienlazantes? Cules son y
cules ?
A
a)
3.13
3.15
3.16
3.17
3.18
c)
b)
d)
e)
Cul de las siguientes combinaciones de los tomos A(a) y A(b) debe conducir al orbital molecular
representado en la figura? Es un orbital enlazante o antienlazante? Qu combinacin debe conducir al
correspondiente orbital antienlazante?
a)
A(a)
A(b)
b)
A(a)
A(b)
A(a)
A(b)
c)
3.14
d)
A(a)
A(b)
A(a)
e)
A(a)
A(b)
A(b)
Orbital Molecular
Cul es el orden de enlace del catin Cl2 +? Sera su energa de enlace mayor o menor que la del Cl2 ?
Es paramagntico?
Escribe las configuraciones electrnicas moleculares para las especies O22, O2 , O2 y O2+.
a) Diferencia las que sean diamagnticas de las que sean paramagnticas.
b) Ordnalas de mayor a menor distancia de enlace.
c) Ordnalas de menor a mayor energa de enlace.
Cul de los siguientes procesos endotrmicos debe tener mayor entalpa?
a) O2 (g) O (g) + O(g); b) O2 (g) O(g) + O(g); c) O2 +(g) O+(g) + O(g)
Podran existir las siguientes molculas (aplica la teora que consideres ms adecuada)?
a) He2 2+, b) C2 , c) Ne2 , d) F2 , e) F2+.
Cul de las siguientes especies debe tener el enlace ms largo?
a) CN+, b) CN, c) CN.
62 | Enlace qumico y estructura de la materia
Licenciatura en Qumica
Cules de las siguientes molculas son paramagnticas? (aplica la teora que consideres ms adecuada):
a) CO, b) Cl2 , c) NO, d) N2 , e) BN, f) NO.
3.20 La figura siguiente representa el diagrama de interaccin para el fluoruro de hidrgeno. Contesta a las
siguientes preguntas empleando nicamente la informacin aportada por el diagrama.
a) Qu interpretacin en trminos de electronegatividad puedes dar al hecho de que los orbitales del
flor tengan menor energa que los del hidrgeno?
b) Por qu son no enlazantes los orbitales moleculares procedentes de los orbitales atmicos 2px y 2py
del flor?
c) Por qu el orbital 2s del flor no interacciona con el 1s del hidrgeno y, en cambio, si lo hace el 2pz?
d) Coloca los electrones adecuados en el diagrama.
e) Cul es el orden de enlace?
f) Cmo es la forma aproximada del orbital enlazante? De qu orbitales atmicos procede?
g) Es el enlace HF un enlace covalente puro?
h) Quien tendr la carga parcial negativa?
H
HF
F
x y
3.19
Energa creciente
nx, ny
Energas relativas de los orbitales atmicos y moleculares
del HF. La energa del electrn 1s del tomo de hidrgeno
es 1310 kJ mol -1 (la primera entalpa de ionizacin del
hidrgeno es +1310 kJ mol -1 ) y la de los orbitales 2 p del
flor es 1682 kJ mol -1 (la primera entalpa de ionizacin
del flor es +1682 kJ mol -1 )
2px , 2py , 2pz
z
2s
Dibuja el diagrama de interaccin para el LiH.
3.22 Qu diferencias existen entre la teora de enlace de valencia y la teora de orbitales moleculares al
estudiar las molculas de B2 y de O2?
3.23 Discute la existencia o no de las siguientes molculas, clasificndolas por orden de estabilidad: H2 +, H 2 ,
H22 y H2.
3.21
cidos y bases de Lewis
3.24
3.25
3.26
3.27
3.28
Es SiO2 + CaO
CaSiO3 una reaccin cidobase de Brnsted? Y de Lewis?
Clasifica las siguientes sustancias como cidos o bases de Lewis: NH 3, PH 3, Fe3+, H2O, CO, BF3, Cl,
CO32, BeCl2.
En las siguiente reaccin, el dixido de carbono se comporta como cido o como base de Lewis?
HCO3 (ac) + OH(ac)
CO2(g) + H 2O(l)
Cul de los dos aductos F3BNH 3 y F3BPH 3 es ms estable?
La siguiente lista recoge algunos minerales comunes de los que se extraen metales. Podras sugerir qu
metales son blandos, cules son duros y cules tienen un carcter intermedio?
xidos: hematites, Fe2O3; magnetita, Fe3O4; bauxita, Al2O3; periclas, MgO; slice, SiO2
sulfuros: calcopirita, CuFeS2; calcocita, Cu2S; esfalerita, PbS; pirita de hierro, FeS2; cinabrio, HgS
Tema 3: Orbitales y enlaces qumicos | 63
Universidad de Alcal
Soluciones a los seminarios
3.1
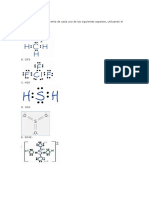
a)
F
F
c)
Cl
e)
3.2
3.3
3.4
3.5
3.6
3.7
3.8
3.9
3.10
3.11
3.12
3.13
3.14
3.15
3.16
3.17
3.18
3.19
3.20
I
Cl
Cl
Cl
C O
En torno al S hay 4 Pares
b)
F
F
de enlace y 1 Par solitario
F
S
F
F
Geometra electrnica:
S
F
F
F
F
Bipirmide trigonal
F
Geometra
molecular:
Hibridacin: dsp3
tetraedro deformado
En torno al S hay 6 Pares
F
F
de enlace
S F
F
F
Geometra electrnica:
F
Octadrica
Geometra molecular:
Hibridacin: d2sp3
octadrica
En torno al I hay 4 Pares de
d)
O O O
enlace y 2 Pares solitarios Cl
Cl
I
Geometra electrnica:
Cl
Cl
Octadrica
Geometra molecular:
O O O
Hibridacin: d2sp3
planocuadrada
En torno al O central hay
2 En torno al C hay 3 Pares
2 Pares de enlace y 1
O
par solitario
O
O
Geometra electrnica: Geometra molecular:
angular
Triangular plana
Hibridacin: sp2
de enlace (y uno )
C
O
Geometra electrnica:
O
O
Hay otras 2 est.
Triangular
plana
Geometra
molecular:
resonantes de la
triangular plana
Hibridacin: sp2
misma energa.
(Entre parntesis se indica la geometra electrnica cuando es distinta de la molecular). a) lineal, sp, no polar; b) tetradrica,
sp3, no polar; c) angular (tetradrica), sp3 , polar; d) tetradrica, sp3, no polar; e) angular (tetradrica), sp3 , polar; f) angular
(tetradrica), sp3, polar; g) triangular plana, sp2, no polar; h) pirmide de base cuadrada (octadrica), d2sp3 , polar.
a) sp3 , sp3, sp3; b) sp2 , sp2, sp3 ; c) sp3 , sp, sp; d) sp2 , sp, sp, sp2; e) sp, sp, sp; f) todos sp2; g) sp2 .
De izquierda a derecha: C: tetradrica, sp3 ; C: triangular plana, sp2 ; O: angular, sp3 . El enlace COH es ms largo que C=O.
a) 6 enlaces sigma (C2sp3 , H1s), 1 enlace sigma (C2sp3 , C2sp3 ); b) 2 enlaces sigma (C2sp, H1s), 1 enlace sigma (C2sp, C2sp),
2 enlaces pi (C2p, C2p) (C2p, C2p); c) 1 enlace sigma (C2sp, H1s), 1 enlace sigma (C2sp, N2sp), 2 enlaces pi (C2p, N2p)
(C2p, N2p); d) 3 enlaces sigma (C2sp3 , H1s), 1 enlace sigma (C2sp3, O2sp3), 1 enlace sigma (O2sp3 , H1s); e) 3 enlaces sigma
(N2sp2 , O2p), 1 enlace pi (N2p, O2p).
Ver teora.
Los cuatro hbridos sp3 nicamente son puros e iguales entre s en el metano.
Disminuye si es un orbital d de la misma capa (su energa es mayor que la de los orbitales s y p). Aumenta si es un orbital d de
la capa anterior (su energa es menor que la de los orbitales s y p).
Posiblemente, los hbridos sp3 del carbono tienen mayor participacin s en los enlaces con el H que con el F.
b, c y f.
Sigma: a, b, d y e; Pi: c.
Enlazantes: a y c; antienlazantes: b y d. Sigma: a y b. Pi: c, d y e.
El c.
(Rellenar el apropiado diagrama de orbitales moleculares). O.E.(Cl2+) = 1,5, O.E.(Cl2) = 1. La energa de enlace del Cl 2+ ser
mayor que la del Cl2. El Cl2 + es paramagntico mientras que el Cl2 es diamagntico.
a) O2 +
KK(2s)2 (*2s) 2(2pz)2 (2px , 2py) 4(*2px,*2py )1
Paramagntica
O.E. = 2,5
O2
KK(2s)2 (*2s) 2(2pz)2 (2px , 2py) 4(*2px,*2py )2
Paramagntica
O.E. = 2
O2
KK(2s)2 (*2s) 2(2pz)2 (2px , 2py) 4(*2px,*2py )3
Paramagntica
O.E. = 1,5
O2 2
KK(2s)2 (*2s) 2(2pz)2 (2px , 2py) 4(*2px,*2py )4
Diamagntica
O.E. = 1
2
+
b) O2 > O2 > O2 > O 2 .
c) O2 2 < O 2 < O 2 < O2 +.
El c) ya que la mayor energa de enlace corresponde al O2 + (ver 3.21).
Aplicamos la teora de orbitales moleculares (rellena el diagrama apropiado). a) O.E. = 1, si; b) O.E. = 2, si; c) O.E. = 0, no; d)
O.E. = 1, si; e) O.E. = 1,5, si.
Aplicamos la teora de orbitales moleculares (rellena el diagrama apropiado). a) O.E. = 2; b) O.E. = 2,5; c) O.E. = 3. El CN+
tiene el menor O.E. por lo que tendr la mayor longitud de enlace.
Aplicamos la teora de orbitales moleculares (rellena el diagrama apropiado). a) diamagntica, b) diamagntica, c)
paramagntica, d) diamagntica, e) diamagntica, f) paramagntica.
a) Que los orbitales de valencia del F tengan menor energa que los del H est relacionado con su mayor electronegatividad.
b) Porque no solapan con el orbital s del hidrgeno (su simetra es , mientras que la del orbital s del H es ).
c) En realidad s interacciona, pero la interaccin fundamental es la del orbital pz pues su energa es ms cercana a la del s(H).
d) (2s)2 ( z)2 ( xn , y n) 4
e) O.E. = 1.
f) Procede del orbital s del H y del pz del F. Hay ms participacin del segundo que del primero.
g) No, el orbital enlazante est ms centrado sobre el flor que sobre el hidrgeno.
64 | Enlace qumico y estructura de la materia
Licenciatura en Qumica
h) De acuerdo a lo dicho, el F tendr la carga parcial negativa.
3.21
Energa creciente
Li
2p
LiH
z
s
y
z
xn yn
2s
1s
Diagrama de interaccin para el hidruro de litio.
3.22 Segn la teora de orbitales moleculares, B2 tiene OE = 1 y es paramagntico; O 2 tiene OE = 2 y es paramagntica (en
3.23
3.24
3.25
3.26
3.27
3.28
concordancia con los datos experimentales). Una aplicacin intuitiva de la teora de enlace de valencia, hara pensar que B2 y
O2 son diamagnticas.
H2 (OE =1) > H2 + (OE =0,5) , H2 (OE =0,5). H22 (OE =0) no es estable.
Es una reaccin cidobase de Lewis pero no de Brnsted.
cidos de Lewis: Fe3+ , BF3 , BeCl2 . Bases de Lewis: NH3 , PH3, H2 O, CO, Cl , CO32.
Como cido de Lewis.
El del borano con el amonaco, ya que ambos son duros.
Podramos sugerir que son duros: Al, Mg, Si; blandos: Pb, Hg, Cu; intermedios: Fe.
También podría gustarte
- Folleto Quimica General I ESPOL PDFDocumento91 páginasFolleto Quimica General I ESPOL PDFPatoCepedaAún no hay calificaciones
- Circuito Luces de Automóvil PolicíaDocumento5 páginasCircuito Luces de Automóvil PolicíaDabnysdAún no hay calificaciones
- Orbitales y Enlaces QuimicosDocumento7 páginasOrbitales y Enlaces QuimicosMerche García SáezAún no hay calificaciones
- Teoria de Orbitales MolecularesDocumento13 páginasTeoria de Orbitales MolecularesDalia Soria100% (1)
- Enlace de ValenciaDocumento14 páginasEnlace de ValenciaMiguel SánchezAún no hay calificaciones
- Tema 2 Orbitales MolecularesDocumento14 páginasTema 2 Orbitales MolecularesIsmael Angel NietoAún no hay calificaciones
- Teorias de EnlaceDocumento7 páginasTeorias de Enlacevquispeasc100% (4)
- Enlace 1BDocumento8 páginasEnlace 1Bbryan3717790Aún no hay calificaciones
- Teoría Del Orbital MolecularDocumento33 páginasTeoría Del Orbital MolecularJorge Oswaldo Toro Jaimes92% (13)
- Clase 3 Inorganica AvanzadaDocumento160 páginasClase 3 Inorganica Avanzadafranklingarcia2009Aún no hay calificaciones
- Investigación GryvDocumento7 páginasInvestigación GryvGarcía Robledo Yara VaniaAún no hay calificaciones
- Teorías Del Enlace Covalente Teoría Del Orbital MolecularDocumento3 páginasTeorías Del Enlace Covalente Teoría Del Orbital MolecularLuis Daniel Garcia MarquezAún no hay calificaciones
- 12.enlacecovalente2 11697Documento37 páginas12.enlacecovalente2 11697Anonymous IG3Pj6AwAún no hay calificaciones
- Teoria de Orbitales AtomicosDocumento7 páginasTeoria de Orbitales AtomicosDark HikaruAún no hay calificaciones
- EnlacecovalenteDocumento64 páginasEnlacecovalenteSergio QCAún no hay calificaciones
- Química (Temas 9-10)Documento13 páginasQuímica (Temas 9-10)mgc00191Aún no hay calificaciones
- Punto 1 de ContenidoDocumento6 páginasPunto 1 de ContenidoArmando ArmendarizAún no hay calificaciones
- Orbitales HibridosDocumento18 páginasOrbitales Hibridosmasisvargas010802Aún no hay calificaciones
- Estructura de LewisDocumento14 páginasEstructura de LewisEdwin Roberto Molina RamirezAún no hay calificaciones
- Tema 4 Teoría Del Orbital MolecularDocumento15 páginasTema 4 Teoría Del Orbital MolecularVale ITreAún no hay calificaciones
- Teoría Del Orbital MolecularDocumento5 páginasTeoría Del Orbital MolecularTL MilagrosAún no hay calificaciones
- Cuestionarios de QuimicaDocumento13 páginasCuestionarios de QuimicaAnita EspinosaAún no hay calificaciones
- Método de Orbitales Moleculares Como Una Combinación Lineal de Orbitales AtómicosDocumento5 páginasMétodo de Orbitales Moleculares Como Una Combinación Lineal de Orbitales AtómicosRuben FloresAún no hay calificaciones
- Ejercicios Resueltos de EnlaceDocumento4 páginasEjercicios Resueltos de EnlaceKarol GonzálezAún no hay calificaciones
- Teoria de Enlace ValenciaDocumento10 páginasTeoria de Enlace ValenciaANDREWAún no hay calificaciones
- Unidad II Teoría Orbital MlecularDocumento82 páginasUnidad II Teoría Orbital Mlecularvillegas.angelaAún no hay calificaciones
- CTM - Clase 7T - 23-2Documento51 páginasCTM - Clase 7T - 23-2Sebastian TafurAún no hay calificaciones
- Práctica No 1 Enlaces HíbridosDocumento9 páginasPráctica No 1 Enlaces HíbridosZury Carrion100% (1)
- Notas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaDocumento7 páginasNotas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaEgcrisostomoAún no hay calificaciones
- Notas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaDocumento10 páginasNotas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaEgcrisostomoAún no hay calificaciones
- El Enlace Quimico y La Mecanica CuanticaDocumento10 páginasEl Enlace Quimico y La Mecanica CuanticaSusana galvezAún no hay calificaciones
- Laboratorio Analisis Organico PDFDocumento9 páginasLaboratorio Analisis Organico PDFCaroline Carreon MuñoaAún no hay calificaciones
- Práctica N. 3 GEOMETRIA MOLECUARDocumento14 páginasPráctica N. 3 GEOMETRIA MOLECUARJuan JaramilloAún no hay calificaciones
- Hibridación Orbital y Teoría de Orbitales MolecularesDocumento4 páginasHibridación Orbital y Teoría de Orbitales MolecularesazulcathalinagAún no hay calificaciones
- 04 Excepciones Lewis y Geometria MolecularDocumento35 páginas04 Excepciones Lewis y Geometria MolecularEve ValdesAún no hay calificaciones
- Teoria Del Enlace CovalenteDocumento13 páginasTeoria Del Enlace Covalenteロサレスアヤラ キンAún no hay calificaciones
- Unidad I 2020Documento104 páginasUnidad I 2020MARCELO ORELLANA CARTAGENAAún no hay calificaciones
- Orbitales Atómicos HíbridosDocumento13 páginasOrbitales Atómicos HíbridositechhacksAún no hay calificaciones
- Puntos 4-6Documento4 páginasPuntos 4-6alejo uribeAún no hay calificaciones
- Teoria Del Orbital Molecular PDFDocumento9 páginasTeoria Del Orbital Molecular PDFamgel9267% (3)
- Geometria MolecularDocumento9 páginasGeometria MolecularJuan RomanAún no hay calificaciones
- Estructura AtomicaDocumento6 páginasEstructura Atomicallibra985Aún no hay calificaciones
- Tarea 2 - Ejercicios Química InorgánicaDocumento9 páginasTarea 2 - Ejercicios Química InorgánicaAlejandra PedraosAún no hay calificaciones
- Op Sec Fisqui T 42 Orbitales MolecularesDocumento16 páginasOp Sec Fisqui T 42 Orbitales MolecularesCristina Martinez GonzalezAún no hay calificaciones
- Enlace Químico (I)Documento25 páginasEnlace Químico (I)inmaalfafochia2006Aún no hay calificaciones
- Tema IV Enlace Químico 2015 Parte IIDocumento69 páginasTema IV Enlace Químico 2015 Parte IIOlmedo Aedo Huyhua AcevedoAún no hay calificaciones
- Qoi Unab 01Documento41 páginasQoi Unab 01Necroz182Aún no hay calificaciones
- QC Lectura 9Documento5 páginasQC Lectura 9Mario Ivan Martinez DominguezAún no hay calificaciones
- Unidad 1 - Tarea 2 - Geometría Molecular y Compuestos CoordinadosDocumento10 páginasUnidad 1 - Tarea 2 - Geometría Molecular y Compuestos CoordinadosAnderson Céspedes MarínAún no hay calificaciones
- Enlace Covalente y Geometria (Tom) Iii ParteDocumento14 páginasEnlace Covalente y Geometria (Tom) Iii ParteLUIS FERNANDO TAPARA QUISPEAún no hay calificaciones
- Química: Profesor: Miguel ZavalaDocumento62 páginasQuímica: Profesor: Miguel ZavalatutorialesgameplaysloquendoAún no hay calificaciones
- Geometria MolecularDocumento22 páginasGeometria MolecularRey Bryan VicenteAún no hay calificaciones
- Actividad1 - U3 InvestigacionDocumento9 páginasActividad1 - U3 Investigacionmara alvarezAún no hay calificaciones
- Investigación 3 09Documento3 páginasInvestigación 3 09Atzin mohamed Corzo FloresAún no hay calificaciones
- Teoria Orbital MolecularDocumento7 páginasTeoria Orbital MolecularMarco Antonio Cutimbo PacoAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosDe EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosAún no hay calificaciones
- Hoja Punteada para Bullet JournalDocumento1 páginaHoja Punteada para Bullet JournalDabnysd100% (1)
- Tesis Aplicando La Metodología SCRUMDocumento122 páginasTesis Aplicando La Metodología SCRUMDabnysdAún no hay calificaciones
- Java ScriptDocumento14 páginasJava ScriptDabnysdAún no hay calificaciones
- Ejercicios de Teoria de ColasDocumento9 páginasEjercicios de Teoria de ColasDabnysdAún no hay calificaciones
- Formulas de Teoria de Colas Mm1Documento1 páginaFormulas de Teoria de Colas Mm1DabnysdAún no hay calificaciones
- Cómo Elaborar Un Plan de Negocios - Jack FleitmanDocumento18 páginasCómo Elaborar Un Plan de Negocios - Jack FleitmanDabnysdAún no hay calificaciones
- Formato INFORME Servicio Comunitario UDODocumento14 páginasFormato INFORME Servicio Comunitario UDODabnysdAún no hay calificaciones
- ISOMERÍA - BachilleratoDocumento8 páginasISOMERÍA - BachilleratoDabnysdAún no hay calificaciones
- El Uso de Algunos Oxidos en La IndustriaDocumento2 páginasEl Uso de Algunos Oxidos en La IndustriaDabnysdAún no hay calificaciones
- Comportamiento organizacional-INFORMEDocumento7 páginasComportamiento organizacional-INFORMEDabnysdAún no hay calificaciones
- Potencia (Física)Documento4 páginasPotencia (Física)DabnysdAún no hay calificaciones
- Manual Statgraphics CenturionDocumento16 páginasManual Statgraphics CenturionDabnysdAún no hay calificaciones
- El Ambiente de 100 Años de SoledadDocumento6 páginasEl Ambiente de 100 Años de SoledadDabnysdAún no hay calificaciones