Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Evaluación Parcial Química 11-2024
Evaluación Parcial Química 11-2024
Cargado por
liliana baron0 calificaciones0% encontró este documento útil (0 votos)
8 vistas3 páginasTítulo original
EVALUACIÓN PARCIAL QUÍMICA 11-2024
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas3 páginasEvaluación Parcial Química 11-2024
Evaluación Parcial Química 11-2024
Cargado por
liliana baronCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
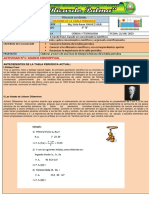
EVALUACIÓN PARCIAL QUÍMICA 11°
TEMAS: HISTORIA DE LA TABLA PERIÓDICA, CONFIGURACIÓN ELECTRONICA Y CICLO DEL
NITRÓGENO
NOMBRE: ________________________________________________ FECHA: _______________
1) Relaciona la columna A con la columna B según corresponda aporte vs. Científico use líneas de diferentes
colores y en lo posible regla para identificar mejor su desarrollo.
COLUMNA A COLUMNA B
Clasifico los 33 elementos conocidos en ese momento, en metales Marie Curie
y no metales, unos formaban sales y ácidos respectivamente.
Descubrió el protactinio en 1918 quién contribuyó decisivamente a John Newlands
la comprensión de la fisión nuclear.
Implantó el sistema de símbolos químicos y descubrió el cerio, Dimitri Mendelieve
selenio y Torio y consiguió aislar el silicio, el circonio y el titanio.
Expuso con toda claridad sus ideas sobre la teoría atómica y Lisa Meitner
aclaró los conceptos de peso atómico y peso molecular.
Dijo que había una cierta peridiocidad en el volumen atómico, Antoine Lavoisier
asistió a un congreso usando lo expuesto por Canizaro y organizo
en forma horizontal y vertical ciertos elementos cuya división hoy
en día son los períodos y grupos respectivamente.
Descubrió el Polonio y el radio y le otorgaron dos premios nobel, Alexandre de Chancourtois
uno de física y otro de química
Ley de las octavas y la asimilaba a las notas musicales pero solo Johan Dobereiner
hasta el elemento Calcio.
Creo la primera formación de la tabla periódica con 63 elementos; Jacob Berzelius
escribió el libro “principios de Química” que fue la principal razón
del nacimiento de la tabla periódica. Él tuvo la genial idea de dejar
espacios para los elementos que aún no se habían descubierto.
Ley de las triadas (grupos de 3 elementos con propiedades Stanislao Canizaro
similares) quien permitió el primer paso de una clasificación
consistente.
Propuso una clasificación de los elementos colocándolos sobre la Lothar Meyer
superficie de un cilindro, según su peso atómico creciente.
2) En cada una de las imágenes diga a que representación corresponde:
3) Escriba falso (F) o verdadero (V) según corresponda:
a) El esquema simplificado que ayuda a ubicar los electrones en niveles y subniveles de energía se lama
Diagrama de Moeller. ( )
b) El llenado de los subniveles energéticos se efectúa desde los que tienen menor energía hacia los de mayor
energía haciendo uso de las anomalías de la configuración electrónica. ( )
c) Según el principio de exclusión de Paulli, los iones de los elementos del sistema periódico tienen la
tendencia a completar sus últimos niveles de energía con una cantidad de 8 electrones para ser estables. (
)
d) La estructura Lewis consiste en representar el símbolo del elemento y ubicar alrededor de él los electrones
con puntos, asteriscos o equis que corresponden a los electrones contenidos en su capa de valencia. ( )
e) Los niveles de energía consiste en la migración, por lo general de un electrón (a veces 2 electrones) de un
subnivel s a un subnivel d ( )
f) La configuración electrónica del calcio cuyo número atómico es 20 es: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1. ( )
También podría gustarte
- AASHTO M80.en - EsDocumento3 páginasAASHTO M80.en - EsJanina Barrios100% (3)
- Actividad Evalutiva Quimica Eje 4Documento16 páginasActividad Evalutiva Quimica Eje 4seider yaruro75% (4)
- Tarea QuimicaDocumento5 páginasTarea QuimicaWebsistec CanelaAún no hay calificaciones
- Tabla Periodica 8º BasicoDocumento21 páginasTabla Periodica 8º BasicoCristian CarrascoAún no hay calificaciones
- Modelo Atómico de BohrDocumento8 páginasModelo Atómico de BohrEmilio Antonio Zepeda GutierrezAún no hay calificaciones
- Tabla PeriódicaDocumento27 páginasTabla PeriódicaKarla Daniela Castillo SerranoAún no hay calificaciones
- Trabajo de Investigación QuímicaDocumento7 páginasTrabajo de Investigación QuímicaBlinker 182Aún no hay calificaciones
- Modulo Historia de La QuimicaDocumento5 páginasModulo Historia de La QuimicaValentin Jordan SaidAún no hay calificaciones
- Cuadernillo Quimica 3 AñoDocumento32 páginasCuadernillo Quimica 3 AñoPATO VALLESPINOSAún no hay calificaciones
- Teoría - Tabla PeriódicaDocumento6 páginasTeoría - Tabla Periódicabryan Cc MAún no hay calificaciones
- La Tabla PeriodicaDocumento6 páginasLa Tabla PeriodicaFelipe SANCHEZ RETANAAún no hay calificaciones
- Principio de La Teoría Atómica ModernaDocumento11 páginasPrincipio de La Teoría Atómica ModernaFernando Portugal PacompiaAún no hay calificaciones
- Solucion Guia QuimicaDocumento5 páginasSolucion Guia QuimicaElena RIANOS HERNANDEZAún no hay calificaciones
- Periodicidad Química, Símbolo Quimico PDFDocumento69 páginasPeriodicidad Química, Símbolo Quimico PDFShamira Geydi Mamani AucapinoAún no hay calificaciones
- Guia 2 La Tabla Periodica y Sus Propiedades ItpDocumento5 páginasGuia 2 La Tabla Periodica y Sus Propiedades ItpANDRES FERNANDO ROSERO ORTIZAún no hay calificaciones
- Tema 08 - Tabla PeriodicaDocumento2 páginasTema 08 - Tabla PeriodicaJænFêr HYAún no hay calificaciones
- Tabla Periodica PPTDocumento21 páginasTabla Periodica PPTMONTES BRICEÑO JACK DEYVIDAún no hay calificaciones
- Guía 2 de XDocumento9 páginasGuía 2 de Xdfsg dsdgdsAún no hay calificaciones
- T4 Cruz Carbarin Cristian UrielDocumento12 páginasT4 Cruz Carbarin Cristian UrielCristian Uriel Cruz CarbarinAún no hay calificaciones
- Examen Final Clei 6 2021Documento2 páginasExamen Final Clei 6 2021Breidys FortichAún no hay calificaciones
- 03 Química Modelos Atomicos ParticulasDocumento25 páginas03 Química Modelos Atomicos ParticulasJorge Gabriel LópezAún no hay calificaciones
- Quimica QU001Documento7 páginasQuimica QU001Mati ReyesAún no hay calificaciones
- Serie 4. PropiedadesPeriodicas PDFDocumento2 páginasSerie 4. PropiedadesPeriodicas PDFDiego PalomoAún no hay calificaciones
- Capitulo - 19 - Historia Tabla PeriodicaDocumento28 páginasCapitulo - 19 - Historia Tabla PeriodicaAndrybel JimymanAún no hay calificaciones
- Tabla PeriodicaDocumento6 páginasTabla PeriodicaJesus “Elias” DiazAún no hay calificaciones
- Tabla PeriodicaDocumento19 páginasTabla PeriodicaGIOVANNI MARTINEZAún no hay calificaciones
- Así El Científico Niels Bohr Nos Demostraría La Estructura Atómica Que Sería Mayormente Conocida Alrededor Del MundoDocumento2 páginasAsí El Científico Niels Bohr Nos Demostraría La Estructura Atómica Que Sería Mayormente Conocida Alrededor Del MundoSha HdezAún no hay calificaciones
- Clase 5Documento10 páginasClase 5JHORMAN SANCHEZ PISAMINAAún no hay calificaciones
- Presentación QI1Documento13 páginasPresentación QI1Karen CoteAún no hay calificaciones
- Quimica 3ero - Tabla PeriodicaDocumento14 páginasQuimica 3ero - Tabla Periodicaxchinodany100% (2)
- Triadas de DobereinerDocumento4 páginasTriadas de DobereinerAdrian ReyesAún no hay calificaciones
- Guia Quimica2do - ParcialDocumento25 páginasGuia Quimica2do - ParcialSaúl RomeroAún no hay calificaciones
- Taller de Tabla PeriodicaDocumento9 páginasTaller de Tabla PeriodicaquedolimpioAún no hay calificaciones
- Tabla PeriódicaDocumento9 páginasTabla Periódicamarisol.hernandezAún no hay calificaciones
- Historia de La Tabla PeridodicaDocumento8 páginasHistoria de La Tabla PeridodicaDany LuzaAún no hay calificaciones
- Bloque FISICOQUIMICA 2024Documento57 páginasBloque FISICOQUIMICA 2024Jacqueline BiondiAún no hay calificaciones
- Investigacion QuimicaDocumento9 páginasInvestigacion QuimicaJavier Mariano Diaz OrozcoAún no hay calificaciones
- Modelos Atomicos - QuimicaDocumento7 páginasModelos Atomicos - QuimicaCarolina StaudterAún no hay calificaciones
- Guia Tabla Periodica y Des Periodic AsDocumento13 páginasGuia Tabla Periodica y Des Periodic AsIngrid Galvez SalinasAún no hay calificaciones
- Evidencia 6 QuimicaDocumento2 páginasEvidencia 6 QuimicaAdelaida GonzálezAún no hay calificaciones
- 7 AHG NielsBohr 7 PNF 1922 GuiaAudioDocumento3 páginas7 AHG NielsBohr 7 PNF 1922 GuiaAudiofmartineznavarro7343Aún no hay calificaciones
- Tabla Periódica de Los Elementos QuímicosDocumento12 páginasTabla Periódica de Los Elementos QuímicosÁnghelo A.B.DAún no hay calificaciones
- Evolucion Del Modelo AtomicoDocumento4 páginasEvolucion Del Modelo Atomicojohnlovecraft100% (3)
- Teoria AtomicaDocumento25 páginasTeoria AtomicaCarlos AlbertoAún no hay calificaciones
- Historia de La Tabla PeríodicaDocumento10 páginasHistoria de La Tabla PeríodicaburgoindarellAún no hay calificaciones
- Sintesis 7°Documento7 páginasSintesis 7°Quimica SebastianaAún no hay calificaciones
- Triada Octetos Tabla AplicacionesDocumento12 páginasTriada Octetos Tabla AplicacionesGabriela Villafuerte PonceAún no hay calificaciones
- Lectura Modelos AtómicosDocumento5 páginasLectura Modelos AtómicosJuan Jose EusseAún no hay calificaciones
- Segundo Parcial - Actividades y Teoría - Qúimica I - 270921Documento14 páginasSegundo Parcial - Actividades y Teoría - Qúimica I - 270921PROFE GABY TRASVIÑAAún no hay calificaciones
- Tecnologico Nacional de México Instituto Tecnologico de TlalnepantlaDocumento14 páginasTecnologico Nacional de México Instituto Tecnologico de TlalnepantlaDaniel LazcanoAún no hay calificaciones
- Resumen de Los Antecedentes de La Mecánica CuánticaDocumento10 páginasResumen de Los Antecedentes de La Mecánica CuánticaAnonymous DCOee86JnAún no hay calificaciones
- Estructura Atómica, Tabla Periódica.Documento25 páginasEstructura Atómica, Tabla Periódica.Sepulveda Cervantes María GuadalupeAún no hay calificaciones
- La Ley PeriódicaDocumento10 páginasLa Ley PeriódicaJose JoseAún no hay calificaciones
- Qui Mica TrabajoDocumento23 páginasQui Mica Trabajoemijared1004Aún no hay calificaciones
- Articulo CientíficoDocumento11 páginasArticulo CientíficoSILVANA CAMILA VALLE YNGAAún no hay calificaciones
- Taller 2 Tabla Periódica - Doc - Documentos de GoogleDocumento5 páginasTaller 2 Tabla Periódica - Doc - Documentos de Googleyurley yeseniaAún no hay calificaciones
- Modelos Atómicos y Tabla PeriodicaDocumento6 páginasModelos Atómicos y Tabla PeriodicaDiego Josué Guerrero MorenoAún no hay calificaciones
- Que Es La Quimica EstructuralDocumento3 páginasQue Es La Quimica EstructuralLomeliMerinoAún no hay calificaciones
- BIOLOGIA OCTAVO 4P 2023 TerminadaDocumento15 páginasBIOLOGIA OCTAVO 4P 2023 TerminadaPiti Lam100% (1)
- UNIDAD II - PPT1 - Modelo Atomico, Sistema PeriodicoDocumento46 páginasUNIDAD II - PPT1 - Modelo Atomico, Sistema PeriodicoanaisAún no hay calificaciones
- Quimica de La Cordinacion FnialDocumento66 páginasQuimica de La Cordinacion FnialAury TeacherAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 4.5 de 5 estrellas4.5/5 (2)
- EDA4 Actividad2A Ficha de Estudiante WhatsaapDocumento2 páginasEDA4 Actividad2A Ficha de Estudiante WhatsaapRoy García CalderonAún no hay calificaciones
- InterrelacionesDocumento24 páginasInterrelacionesEmery Sofía C. D. BustamanteAún no hay calificaciones
- Apuntes Quimica 4Documento54 páginasApuntes Quimica 4Ernesto Atzin Bahena LedezmaAún no hay calificaciones
- Ceramicos y PolimerosDocumento11 páginasCeramicos y PolimerosArmando Basilis0% (1)
- Copia de Tema 18 - Leyes EstequiométricasDocumento4 páginasCopia de Tema 18 - Leyes EstequiométricasNick RiveraAún no hay calificaciones
- Caracteristicas de MonomerosDocumento20 páginasCaracteristicas de MonomerosKaren Palacios AlfonsoAún no hay calificaciones
- Oxidacion de AminasDocumento5 páginasOxidacion de AminasEudoro TrejosAún no hay calificaciones
- Matriz Compatibilidad Productos QuimicosDocumento1 páginaMatriz Compatibilidad Productos QuimicosCamilo Revelo ZambranoAún no hay calificaciones
- Universidad Nacional Del Santa: Escuela Académica Profesional Ingeniería AgroindustrialDocumento4 páginasUniversidad Nacional Del Santa: Escuela Académica Profesional Ingeniería Agroindustrialjasmin Zotelo villanuevaAún no hay calificaciones
- Traduccion Experimento 2Documento4 páginasTraduccion Experimento 2Seilin De LeónAún no hay calificaciones
- B.M. Con Reacción QuímicaDocumento42 páginasB.M. Con Reacción QuímicacibordroideAún no hay calificaciones
- Evaluación Diagnostica BiologíaDocumento5 páginasEvaluación Diagnostica BiologíachaperoninaAún no hay calificaciones
- Ciclo - Refrigeracion Por Compreison de VaporDocumento21 páginasCiclo - Refrigeracion Por Compreison de Vapormarisela catañoAún no hay calificaciones
- Qa 2017 ProteinasDocumento69 páginasQa 2017 ProteinasGustavo100% (2)
- Catalogo Desague 2017 Pequeno - 0Documento20 páginasCatalogo Desague 2017 Pequeno - 0Bil BustamanteAún no hay calificaciones
- Quinua Habas Formula Peso (G) Proteína (G) Quinua 100 11,7 Habas 100 22,6Documento7 páginasQuinua Habas Formula Peso (G) Proteína (G) Quinua 100 11,7 Habas 100 22,6Yuliza Lucio RoqueAún no hay calificaciones
- ENSAYO DEL CARBONO EN NUESTRA VIDA DIARIA Parte MejoradaDocumento11 páginasENSAYO DEL CARBONO EN NUESTRA VIDA DIARIA Parte MejoradaGaby Basiliano RomaynaAún no hay calificaciones
- Ebeduc-LABORATORIO DE QUÍMICA2090204022Documento2 páginasEbeduc-LABORATORIO DE QUÍMICA2090204022Anais mariam Caicedo fuentesAún no hay calificaciones
- PDF Jirafa CompressDocumento4 páginasPDF Jirafa CompressBrenda Aguilar100% (1)
- Guía Virtual 2. Titulación PotenciométricaDocumento9 páginasGuía Virtual 2. Titulación Potenciométricathe gamer alejandroAún no hay calificaciones
- Reporte Metales Pesados 06-06-2023Documento5 páginasReporte Metales Pesados 06-06-2023John GraosAún no hay calificaciones
- Planta Concentradora MallayDocumento77 páginasPlanta Concentradora MallayAntony David C.SAún no hay calificaciones
- Presentación Corrección de Irregularidades en La Pintura Automotriz Polimericos Dial de Colombia y Alpha Chrome S.A.SDocumento95 páginasPresentación Corrección de Irregularidades en La Pintura Automotriz Polimericos Dial de Colombia y Alpha Chrome S.A.Sjorge armandoAún no hay calificaciones
- Roca AcidificadaDocumento8 páginasRoca AcidificadaRobertoSanMartinAún no hay calificaciones
- 2020 Clase 13 Fundamentos Video Audio ELECTROLISISDocumento21 páginas2020 Clase 13 Fundamentos Video Audio ELECTROLISISHer ShinsAún no hay calificaciones
- Fibra de CarbonoDocumento27 páginasFibra de Carbonoblazquez.madAún no hay calificaciones
- Manual GCII 2023Documento73 páginasManual GCII 2023Alejandro Colocho ReyesAún no hay calificaciones
- La Magia Del Carbono-NphsDocumento9 páginasLa Magia Del Carbono-NphsLeonid Castillo SilvaAún no hay calificaciones