Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Formulario Pa Examen fq2
Cargado por
Steven Azañedo AranaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Formulario Pa Examen fq2
Cargado por
Steven Azañedo AranaCopyright:
Formatos disponibles
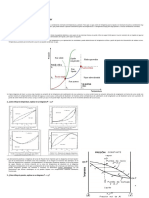
para confirmar si la mezcla sigue la ley de Raoult para el componente en exceso y la ley de Henry para el
componente en menor proporción, podemos comparar las presiones parciales medidas con las predichas
por estas leyes.
La ley de Raoult establece que la presión parcial de un componente en una mezcla líquida es igual al
producto de la presión de vapor del componente puro y su fracción molar en la mezcla. En este caso, el
componente en exceso es la propanona. Podemos calcular las presiones parciales de propanona predichas
utilizando la ley de Raoult:
Podemos observar que las presiones parciales de propanona predichas utilizando la ley de Raoult son
consistentes con las medidas experimentalmente.
Por otro lado, la ley de Henry establece que la presión parcial de un gas en una mezcla líquida es
proporcional a su fracción molar en la mezcla. En este caso, el componente en menor proporción es el
cloroformo. Podemos calcular las constantes de la ley de Henry gráficamente trazando un gráfico de
presión parcial de cloroformo versus fracción molar de cloroformo:
Al trazar el gráfico, podemos ver que los puntos se ajustan a una línea recta, lo que indica que la presión
parcial de cloroformo sigue la ley de Henry. La constante de proporcionalidad es la pendiente de la línea
recta, que podemos calcular utilizando métodos de regresión lineal.
En resumen, los resultados experimentales indican que la mezcla sigue la ley de Raoult para la propanona
y la ley de Henry para el cloroformo. Las presiones parciales predichas por estas leyes son consistentes
con las medidas experimentalmente.
También podría gustarte
- Ley de Raount y DaltonDocumento6 páginasLey de Raount y Daltonalci_c0% (1)
- Conceptos de Propiedades de GasesDocumento7 páginasConceptos de Propiedades de GasesYariela CedeñoAún no hay calificaciones
- Raoult RecopilacionDocumento22 páginasRaoult RecopilacionMaría Argomedo Reyes100% (1)
- Unidad 5 Termo.Documento17 páginasUnidad 5 Termo.hogo omar ramos hernandezAún no hay calificaciones
- Historia La Ley de RaoulDocumento5 páginasHistoria La Ley de RaoulMinerva MartinezAún no hay calificaciones
- Ejemplo de Metodo-Unifac Reporte 1Documento7 páginasEjemplo de Metodo-Unifac Reporte 1chavaAún no hay calificaciones
- Consideraciones Importantes en El Equilibrio LíquidoDocumento2 páginasConsideraciones Importantes en El Equilibrio LíquidoJanexi YamilethAún no hay calificaciones
- Ley de RaoultDocumento3 páginasLey de Raoultloah_123Aún no hay calificaciones
- Diferencia Entre Gas y VaporDocumento8 páginasDiferencia Entre Gas y VaporJosé TorrezAún no hay calificaciones
- Ley de HenrryDocumento7 páginasLey de HenrryJhon ChavezAún no hay calificaciones
- Ley de RaoultDocumento6 páginasLey de RaoultGiuseppe Luigi Nuñez AguilarAún no hay calificaciones
- Ley de DaltonDocumento14 páginasLey de DaltonBRAULIOAún no hay calificaciones
- Atarés - La Ley de RaoultDocumento6 páginasAtarés - La Ley de Raoultjefferson rualesAún no hay calificaciones
- Ingenieria Del Gas NaturalDocumento33 páginasIngenieria Del Gas NaturalMilli PalaciosAún no hay calificaciones
- Tarea 2.2 EquilibrioDocumento8 páginasTarea 2.2 Equilibriopaola poma gutierrez0% (1)
- Ley de RaoultDocumento6 páginasLey de RaoultCarlos ValdezAún no hay calificaciones
- Presión Parcial - Wikipedia, La Enciclopedia LibreDocumento36 páginasPresión Parcial - Wikipedia, La Enciclopedia LibreAnaAún no hay calificaciones
- Fugacidad y ActividadDocumento9 páginasFugacidad y ActividadOrlando Huarcaya VallesAún no hay calificaciones
- Ley de Avogadro, Dalton, Volumenes Parciales de Amagat y GrahamDocumento3 páginasLey de Avogadro, Dalton, Volumenes Parciales de Amagat y GrahamLilian Juntamay100% (1)
- Gases Ideales y Reales. Grupo Nro 2Documento23 páginasGases Ideales y Reales. Grupo Nro 2Jose RamosAún no hay calificaciones
- Gases y DisolucionesDocumento2 páginasGases y DisolucionesAIMEE VAZQUEZ ENRIQUEZAún no hay calificaciones
- Tarea 2 - p2Documento2 páginasTarea 2 - p2jose daniel TrujilloAún no hay calificaciones
- Actividad 7 FDocumento9 páginasActividad 7 FItzel López EugenioAún no hay calificaciones
- Resumen Gases Ideales y RealesDocumento8 páginasResumen Gases Ideales y RealesValentin Cruz MartinezAún no hay calificaciones
- MEZCLASDocumento5 páginasMEZCLASCarla Lara SalgadoAún no hay calificaciones
- Calculo de Fugacidad en Sistemas No IdealesDocumento13 páginasCalculo de Fugacidad en Sistemas No IdealesLucio David Ramírez GarcíaAún no hay calificaciones
- Equilibrio Vapor LiquidoDocumento13 páginasEquilibrio Vapor LiquidoERCI100% (1)
- Ley de Dalton y HenryDocumento62 páginasLey de Dalton y HenryLaura ReyesAún no hay calificaciones
- ANEXO 4 Cuest de La Ley de RoultDocumento5 páginasANEXO 4 Cuest de La Ley de Roultluis alonso fernandez alvirdeAún no hay calificaciones
- Mezcla de GasesDocumento13 páginasMezcla de Gaseseli saul alvarez prada100% (1)
- ANEXO 4 Cuest de La Ley de RoultDocumento6 páginasANEXO 4 Cuest de La Ley de Roultluis alonso fernandez alvirdeAún no hay calificaciones
- CUESTIONARIO3Documento16 páginasCUESTIONARIO3Yennifer Giselle MartinezAún no hay calificaciones
- Equilibrio Liquido VapoDocumento4 páginasEquilibrio Liquido Vaporompecaminos02Aún no hay calificaciones
- Informe de Gas Natural 2Documento20 páginasInforme de Gas Natural 2Salustria Cabezas SánchezAún no hay calificaciones
- FugacidadDocumento4 páginasFugacidadRitch de la CalleAún no hay calificaciones
- Resumen 2.2Documento2 páginasResumen 2.2Yosmar RenfijoAún no hay calificaciones
- Operacion UnitariaDocumento5 páginasOperacion UnitarialioAún no hay calificaciones
- Como Se Determina o Se Mide El Factor de Compresibilidad de Un GasDocumento6 páginasComo Se Determina o Se Mide El Factor de Compresibilidad de Un GasPatricia Rojas PintoAún no hay calificaciones
- Informe 2-Mezcla MulticomponentesDocumento19 páginasInforme 2-Mezcla MulticomponentesSalustria Cabezas SánchezAún no hay calificaciones
- Termo III (Práctica 4)Documento37 páginasTermo III (Práctica 4)Jesus Vazquez60% (5)
- Problemas 3.1 - 3.6Documento8 páginasProblemas 3.1 - 3.6Gabriel K. FonsecaAún no hay calificaciones
- Equilibrio Liquido VaporDocumento6 páginasEquilibrio Liquido VaporAlexChacónAún no hay calificaciones
- Determinación de La Masa MolarDocumento3 páginasDeterminación de La Masa MolarChrisgodterraAún no hay calificaciones
- Aqui Editar111Documento14 páginasAqui Editar111SHsaavedraAún no hay calificaciones
- Trabajo de InvestigacionDocumento6 páginasTrabajo de InvestigacionblademirAún no hay calificaciones
- MezclasDocumento2 páginasMezclasFrankiSerrudoAún no hay calificaciones
- 1 Preexamen Termodinamica de Procesos IIDocumento24 páginas1 Preexamen Termodinamica de Procesos IIPaul Ruiz BaldeonAún no hay calificaciones
- Conceptos de FugacidadDocumento3 páginasConceptos de FugacidadCarlos HinojosaAún no hay calificaciones
- Equilibrio Liquido Vapor - InformeDocumento36 páginasEquilibrio Liquido Vapor - InformeCristhianPalaciosAún no hay calificaciones
- Ley de RaoultDocumento5 páginasLey de RaoultGibran VargasAún no hay calificaciones
- Ley de Las Presiones ParcialesDocumento3 páginasLey de Las Presiones ParcialesDavid JoseAún no hay calificaciones
- Ley de Raoult y HenryDocumento4 páginasLey de Raoult y HenrySofia Cabarcas100% (1)
- BinariosDocumento100 páginasBinariosOscar RodriguezAún no hay calificaciones
- Ley de Raoult y HenryDocumento21 páginasLey de Raoult y HenryCamiHoyosBetancourt100% (1)
- Informe T BurbujaDocumento14 páginasInforme T BurbujaRicardo Felipe Cortes CruzAún no hay calificaciones
- Comportamiento Cuantitativo Sistema Bifasico de HCsDocumento39 páginasComportamiento Cuantitativo Sistema Bifasico de HCsAbel MoralesAún no hay calificaciones
- Mezclas y SolucionesDocumento15 páginasMezclas y SolucionesEmerson RodriguezAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Farmacometría:Curvas dosis-respuesta de tipo gradual. Volumen 1De EverandFarmacometría:Curvas dosis-respuesta de tipo gradual. Volumen 1Aún no hay calificaciones
- S 01 - Guia de Aprendizaje - LcyrtaDocumento2 páginasS 01 - Guia de Aprendizaje - LcyrtaSteven Azañedo AranaAún no hay calificaciones
- Ejercisios de QuimicaDocumento39 páginasEjercisios de QuimicaSteven Azañedo AranaAún no hay calificaciones
- 'K X (1) X (2) X (3) X (4) Norma/n' '-': While For For If End End EndDocumento1 página'K X (1) X (2) X (3) X (4) Norma/n' '-': While For For If End End EndSteven Azañedo AranaAún no hay calificaciones
- Carga EléctricaDocumento3 páginasCarga EléctricaSteven Azañedo AranaAún no hay calificaciones
- Teoria de Mediciones y Cálculo de Errores - para ExplicacionDocumento5 páginasTeoria de Mediciones y Cálculo de Errores - para ExplicacionSteven Azañedo AranaAún no hay calificaciones
- Muy Avanze-Libro-De-EticaDocumento113 páginasMuy Avanze-Libro-De-EticaSteven Azañedo AranaAún no hay calificaciones
- Independencia de América 1776Documento17 páginasIndependencia de América 1776Steven Azañedo AranaAún no hay calificaciones
- MATERIALESDocumento3 páginasMATERIALESSteven Azañedo AranaAún no hay calificaciones
- Analizar El PFD de Un Proceso Industrial:: Identificar Las Etapas y Unidades de SeparaciónDocumento2 páginasAnalizar El PFD de Un Proceso Industrial:: Identificar Las Etapas y Unidades de SeparaciónSteven Azañedo AranaAún no hay calificaciones
- Niveles de Investigación M.MENTALDocumento3 páginasNiveles de Investigación M.MENTALSteven Azañedo AranaAún no hay calificaciones
- CritigaaaDocumento1 páginaCritigaaaSteven Azañedo AranaAún no hay calificaciones
- Método de JacobiDocumento11 páginasMétodo de JacobiSteven Azañedo AranaAún no hay calificaciones
- Comportamiento P, V, T de Los Gases No IdealesDocumento30 páginasComportamiento P, V, T de Los Gases No IdealesSteven Azañedo AranaAún no hay calificaciones
- T1 - Método de Punto Fijo y Newton-RapshonDocumento22 páginasT1 - Método de Punto Fijo y Newton-RapshonSteven Azañedo AranaAún no hay calificaciones
- Lavoratorio de FisioquimicaDocumento6 páginasLavoratorio de FisioquimicaSteven Azañedo AranaAún no hay calificaciones
- Ejercicios y Problemas FluidosDocumento2 páginasEjercicios y Problemas FluidosSteven Azañedo AranaAún no hay calificaciones
- Gas IdealDocumento1 páginaGas IdealSteven Azañedo AranaAún no hay calificaciones
- Circuito ElectricosDocumento5 páginasCircuito ElectricosSteven Azañedo AranaAún no hay calificaciones
- ACTIVIDAD Sincrónica N°11Documento5 páginasACTIVIDAD Sincrónica N°11Steven Azañedo AranaAún no hay calificaciones
- 1 - Ministerio Del Ambiente (Conceptos Adicionales)Documento14 páginas1 - Ministerio Del Ambiente (Conceptos Adicionales)Steven Azañedo AranaAún no hay calificaciones
- Una Mirada A La Importancia Del Pensamiento Crítico en El Proceso Como Estudiante UniversitarioDocumento6 páginasUna Mirada A La Importancia Del Pensamiento Crítico en El Proceso Como Estudiante UniversitarioSteven Azañedo AranaAún no hay calificaciones