Documentos de Académico
Documentos de Profesional
Documentos de Cultura
1 - Etileno
Cargado por
Heriberto Gonzalez Brito0 calificaciones0% encontró este documento útil (0 votos)
6 vistas4 páginasDescripción del elemento usado en algunos polímeros de base monomerica.
Título original
1.-ETILENO
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoDescripción del elemento usado en algunos polímeros de base monomerica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas4 páginas1 - Etileno
Cargado por
Heriberto Gonzalez BritoDescripción del elemento usado en algunos polímeros de base monomerica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 4
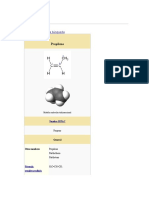
Etileno
Nombre (IUPAC) sistemático
Eteno
General
Fórmula
CH2=CH2
semidesarrollada
Fórmula estructural Ver imagen
Fórmula molecular C2H4
Identificadores
Número CAS == 74-85-1 ==
Propiedades físicas
Estado de agregación Gas
Apariencia Incoloro
Densidad 567 kg/m3; ? g/cm3
Masa 28,05 u
Punto de fusión 103.96 K (-169.2 °C)
Punto de ebullición 169.46 K (-103.7 °C)
Punto de
K (-273,15 °C)
descomposición
282.9 K (Expresión errónea: carácter de
Temperatura crítica
puntuación "." desconocido °C)
Propiedades químicas
Acidez (pKa) 44
Solubilidad en agua Miscible
KPS n/d
Termoquímica
ΔfH0gas n/d kJ/mol
ΔfH0líquido n/d kJ/mol
S0líquido, 1 bar n/d J·mol-1·K-1
Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referencias
ETILENO
El etileno o eteno es un compuesto químico orgánico formado por dos
átomos de carbono enlazados mediante un doble enlace. Es uno de los
productos químicos más importantes de la industria química. Se halla
de forma natural en las plantas.
Contenido
1 Estructura
2 Reactividad química
3 Obtención
4 Aplicaciones
Estructura
La molécula no puede rotar alrededor del doble enlace y todos los
átomos están en el mismo plano. El ángulo entre los dos enlaces
carbono-hidrógeno es de 117º, muy próximo a los 120º
correspondientes a una hibridación sp2.
Reactividad química
La región del doble enlace es relativamente rica en densidad
electrónica (es un centro nucleófilo) y puede reaccionar con
electrófilos (con deficiencia de electrones) a través de reacciones de
adición. Mediante este tipo de reacciones se pueden sintetizar
derivados halogenados.
También se puede adicionar agua (reacción de hidratación) para dar
etanol; se emplea un ácido como el ácido sulfúrico o el ácido fosfórico
como catalizador. La reacción es reversible.
A altas presiones y con un catalizador metálico (platino, rodio, níquel)
se puede hacer reaccionar con hidrógeno molecular para dar etano.
Obtención
La industria petroquímica obtiene el etileno a partir del reformado
catalítico de naftas o a partir de gas natural (Oxidative Coupling of
Methane, OCM).
También puede obtenerse en laboratorios de Química Orgánica
mediante la oxidación de Alcoholes
Aplicaciones
La mayor parte del etileno se emplea para la obtención de polímeros.
Mediante reacciones de polimerización se obtiene el polietileno de
alta densidad y el de baja densidad. También se obtiene dicloroetileno,
intermedio para la síntesis de cloruro de vinilo, que se polimeriza a
cloruro de polivinilo, y otros hidrocarburos clorados. Además se
puede hacer reaccionar con benceno para dar etilbenceno,
obteniéndose estireno, que puede polimerizarse dando poliestireno.
Se emplea como producto de partida de otros polímeros, como la
síntesis del monómero acetato de vinilo para la obtención de acetato
de polivinilo o la síntesis de etilenglicol (a través del intermedio óxido
de etileno) que con ácido terftálico da tereftalato de polietileno.
El etileno se utiliza, en combinación con otros hidrocarburos saturados
e insaturados, sintetizados a partir del caucho, teniendo estos muchas
aplicaciones en la industria. Destaca fundamentalmente el EPDM,
Etileno Propileno Dieno Monómero, con el que se obtienen películas
de caucho saturado con múltiples aplicaciones en la industria
automovilística y de la construcción, por su alta resistencia a las
oscilaciones de temperatura, su flexibilidad y su capacidad
impermeabilizante.
El etilenglicol también sirve como anticongelante, y el óxido de
etileno se puede emplear para la síntesis de algunos éteres glicólicos
(para pinturas o tensioactivos) y otros productos.
El etanol se puede obtener mediante la hidratación del etileno y se
emplea como combustible o en la síntesis de ésteres etílicos,
disolventes, y otros productos. También se puede obtener, a través de
la síntesis de propionaldehido, ácido propiónico y alcohol n-propílico.
Por oxidación del etileno se obtiene acetaldehido, el cual se emplea en
la síntesis de n-butanol y ácido acético.
El etileno, que se encuentra naturalmente en las plantas, también se
emplea para provocar la maduración de la fruta. Esto se debe a que se
libera un gas, que al entrar en contacto con otros vegetales, ya sea
fruta o planta, provoque su precoz maduración, o en el caso de l
planta, un envejecimiento prematuro.
También podría gustarte
- Proceso SDocumento13 páginasProceso SAnonymous xg41pSEoAún no hay calificaciones
- Etileno Metodo Mas Utilizado en La IndustriaDocumento4 páginasEtileno Metodo Mas Utilizado en La IndustriaMAYRA HURTADO MARCANOAún no hay calificaciones
- EtilenoDocumento16 páginasEtilenoDiana Rodriguez NAún no hay calificaciones
- Cuestionario #8 QumicaDocumento12 páginasCuestionario #8 QumicaYuli CVAún no hay calificaciones
- Etileno - Wikipedia, La Enciclopedia LibreDocumento7 páginasEtileno - Wikipedia, La Enciclopedia LibreLorenzo JimenezAún no hay calificaciones
- Oxido de Etileno ADKNDocumento40 páginasOxido de Etileno ADKNDionimar 'MrtnzAún no hay calificaciones
- EtilenoDocumento3 páginasEtilenoLily RíosAún no hay calificaciones
- EtilenoDocumento3 páginasEtilenoChristopher Castillo GutierrezAún no hay calificaciones
- Etil Engli ColDocumento15 páginasEtil Engli ColRoberto RamírezAún no hay calificaciones
- ANALSIS Y DISEÑO-AdriDocumento31 páginasANALSIS Y DISEÑO-AdriFabiana Gonzales CastilloAún no hay calificaciones
- Obtencion Del Acetaldehido A Partir de La Oxidacion Del EtanolDocumento15 páginasObtencion Del Acetaldehido A Partir de La Oxidacion Del EtanolHarry Vara MarceloAún no hay calificaciones
- Aminas para Tratar El GasDocumento6 páginasAminas para Tratar El GasSalvadorManuelGoyonagaRocha100% (2)
- 1 Obtencion Del Etilenglicol CDDocumento29 páginas1 Obtencion Del Etilenglicol CDanon_22914928Aún no hay calificaciones
- Exposicion de OXDocumento14 páginasExposicion de OXMariaAlejandraBagurAún no hay calificaciones
- Previo 1 - Equipo 5 - Reacción Diels-AlderDocumento5 páginasPrevio 1 - Equipo 5 - Reacción Diels-AlderMedina Posadas Ana KarenAún no hay calificaciones
- AlquenosDocumento9 páginasAlquenosFRAún no hay calificaciones
- Practica 04 QuimicaDocumento10 páginasPractica 04 QuimicaGabriel DuqueAún no hay calificaciones
- DietanolaminaDocumento9 páginasDietanolaminaAlondraLaimeAún no hay calificaciones
- Termodinamica Del Equilibrio QuimicoDocumento31 páginasTermodinamica Del Equilibrio QuimicoFrancisco Ramirez SantosAún no hay calificaciones
- Produccion Oxido de EtilenoDocumento51 páginasProduccion Oxido de EtilenoMarco Antonio Quino Mendoza0% (1)
- PropilenoDocumento8 páginasPropilenoJorobadoAún no hay calificaciones
- Practica 3 Reacción de Diels-AlderDocumento11 páginasPractica 3 Reacción de Diels-AlderAlice Rosas MarquezAún no hay calificaciones
- Eter EtilicoDocumento6 páginasEter EtilicoCristhian CarrizalesAún no hay calificaciones
- ALQUENOSDocumento6 páginasALQUENOSEnrique Rojas BermudoAún no hay calificaciones
- Practica No. 3 Reccion de Diels - AlderDocumento11 páginasPractica No. 3 Reccion de Diels - AlderCristian SanchezAún no hay calificaciones
- Acides Del EntanolDocumento8 páginasAcides Del EntanolgeanAún no hay calificaciones
- Informe de Laboratorio-AlcoholesDocumento15 páginasInforme de Laboratorio-AlcoholesJ Hans Alberca CarrascoAún no hay calificaciones
- PetroquímicaDocumento3 páginasPetroquímicaValeria Gutierrez LopezAún no hay calificaciones
- Estireno 0Documento15 páginasEstireno 0Karlo Eduardo Sedano AvellanedaAún no hay calificaciones
- Quimica AcetilenoDocumento3 páginasQuimica AcetilenoGioo NolascoAún no hay calificaciones
- Actividades PreviasDocumento4 páginasActividades PreviasDiego Emmanuel Sánchez CalderónAún no hay calificaciones
- ToluenoDocumento7 páginasToluenoCristobal LopezAún no hay calificaciones
- Investigación Previa de - Obtención de Un Oxirano y Apertura Del EpóxidoDocumento15 páginasInvestigación Previa de - Obtención de Un Oxirano y Apertura Del EpóxidoValeria Michelle Reyes GomezAún no hay calificaciones
- Nivel 0 Produccion de Cloruro de EtiloDocumento9 páginasNivel 0 Produccion de Cloruro de EtiloMarcel ChevalierAún no hay calificaciones
- AlquenosDocumento18 páginasAlquenosChris Flores GonzalesAún no hay calificaciones
- Orgánica 2 Previo 1Documento6 páginasOrgánica 2 Previo 1Ortiz Rojano HugoAún no hay calificaciones
- EtanolDocumento5 páginasEtanolMarcosAún no hay calificaciones
- Acetato de EtiloDocumento9 páginasAcetato de EtiloGENESIS KARISMA LIZARRAGA DIAZAún no hay calificaciones
- Previo OxiranoDocumento10 páginasPrevio Oxiranoedsonalonso51Aún no hay calificaciones
- Previo 10Documento6 páginasPrevio 10Carlos CastilloAún no hay calificaciones
- Sesion 3 ALQUENOS, ALQUINOS Y PETROLEODocumento38 páginasSesion 3 ALQUENOS, ALQUINOS Y PETROLEOJosé Antonio Ramos MuñozAún no hay calificaciones
- Esterificación Del Ácido Acrílico WDocumento17 páginasEsterificación Del Ácido Acrílico WLorena VivasAún no hay calificaciones
- Etilbenceno - EstirenoDocumento18 páginasEtilbenceno - EstirenoVANESSA LISSETH RAMOS BENITO100% (1)
- Aldehidos y CetonasDocumento7 páginasAldehidos y CetonasDayanna Soto CondoriAún no hay calificaciones
- Obtención de EtilenoDocumento4 páginasObtención de EtilenoandreaAún no hay calificaciones
- Obtencion Del EtilenglicolDocumento13 páginasObtencion Del EtilenglicolJosé Gregorio MartínezAún no hay calificaciones
- EstequiometríaDocumento13 páginasEstequiometríaBarragán Delgado Pedro OmarAún no hay calificaciones
- EstequiometríaDocumento13 páginasEstequiometríaBarragán Delgado Pedro OmarAún no hay calificaciones
- Productos Químicos Basados en EtilenoDocumento15 páginasProductos Químicos Basados en EtilenoEdwin YugchaAún no hay calificaciones
- ETILENODocumento19 páginasETILENOMelania Bermudo CoronadoAún no hay calificaciones
- Estireno Ó VinilbencenoDocumento21 páginasEstireno Ó VinilbencenoArletteAún no hay calificaciones
- Obtención Del AcetilenoDocumento13 páginasObtención Del Acetilenolilibeth ramosAún no hay calificaciones
- Ejercicios Cap2 27545 Sintesis y Analisis PQ, EFC PDFDocumento3 páginasEjercicios Cap2 27545 Sintesis y Analisis PQ, EFC PDFMaria Camila QuinteroAún no hay calificaciones
- Informe de Etilen GlycolDocumento34 páginasInforme de Etilen GlycolJenny Ojeda CastillonAún no hay calificaciones
- Expo Olefinas 120606212042 Phpapp02Documento44 páginasExpo Olefinas 120606212042 Phpapp02Danny Lugo100% (1)
- ALDEHÍDOS y CETONASDocumento15 páginasALDEHÍDOS y CETONASDanna Gabriela Cortes MorenoAún no hay calificaciones
- Poli Olefin ADocumento2 páginasPoli Olefin AOsvaldo TrejoAún no hay calificaciones
- Unidad 1Documento4 páginasUnidad 1Heriberto Gonzalez BritoAún no hay calificaciones
- Prueba de FisicaDocumento1 páginaPrueba de FisicaHeriberto Gonzalez BritoAún no hay calificaciones
- Tema 8 FisicaDocumento33 páginasTema 8 FisicaHeriberto Gonzalez BritoAún no hay calificaciones
- Respuestas Prueba FisicaDocumento2 páginasRespuestas Prueba FisicaHeriberto Gonzalez BritoAún no hay calificaciones
- 2 EtilenoDocumento7 páginas2 EtilenoHeriberto Gonzalez BritoAún no hay calificaciones
- 2 - PolimeroDocumento12 páginas2 - PolimeroHeriberto Gonzalez BritoAún no hay calificaciones
- Retiro Mebranas 08-09-21Documento4 páginasRetiro Mebranas 08-09-21Heriberto Gonzalez BritoAún no hay calificaciones
- Guia de Fisica Prueba 3Documento1 páginaGuia de Fisica Prueba 3Heriberto Gonzalez BritoAún no hay calificaciones
- Guía de Fisica Prueba 2Documento1 páginaGuía de Fisica Prueba 2Heriberto Gonzalez BritoAún no hay calificaciones
- Res. Dinamica.Documento1 páginaRes. Dinamica.Heriberto Gonzalez BritoAún no hay calificaciones
- Caudal Fuido WordDocumento4 páginasCaudal Fuido WordHeriberto Gonzalez BritoAún no hay calificaciones
- Guia de Fisica Prueba 1Documento1 páginaGuia de Fisica Prueba 1Heriberto Gonzalez BritoAún no hay calificaciones
- Respuestas Prueba FisicaDocumento2 páginasRespuestas Prueba FisicaHeriberto Gonzalez BritoAún no hay calificaciones
- FisicaDocumento2 páginasFisicaHeriberto Gonzalez BritoAún no hay calificaciones
- Caudal Fuido WordDocumento9 páginasCaudal Fuido WordHeriberto Gonzalez BritoAún no hay calificaciones
- Axonometria y Figuras AxonometricasDocumento8 páginasAxonometria y Figuras AxonometricasabracingAún no hay calificaciones
- Caldereria TrigonometricaDocumento22 páginasCaldereria TrigonometricaHeriberto Gonzalez BritoAún no hay calificaciones
- Metrologia IndustrialDocumento33 páginasMetrologia IndustrialHeriberto Gonzalez BritoAún no hay calificaciones
- Pts 01 Pts Instalacion de FaenaDocumento19 páginasPts 01 Pts Instalacion de FaenaHeriberto Gonzalez BritoAún no hay calificaciones
- Conceptos Fundamentales de Mecánica de FluidosDocumento3 páginasConceptos Fundamentales de Mecánica de FluidosHeriberto Gonzalez BritoAún no hay calificaciones
- Recursos Humanos ProjectDocumento20 páginasRecursos Humanos Projectvaleritap7Aún no hay calificaciones
- Estequiometria QuimicaDocumento5 páginasEstequiometria QuimicaHeriberto Gonzalez BritoAún no hay calificaciones
- Hidrodinamica o Dinamica de Fluidos WordDocumento10 páginasHidrodinamica o Dinamica de Fluidos WordHeriberto Gonzalez BritoAún no hay calificaciones
- Caldereria TrigonometricaDocumento22 páginasCaldereria TrigonometricaHeriberto Gonzalez BritoAún no hay calificaciones
- Conceptos Fundamentales de Mecánica de FluidosDocumento3 páginasConceptos Fundamentales de Mecánica de FluidosHeriberto Gonzalez BritoAún no hay calificaciones
- Unidades y Medidas WordDocumento44 páginasUnidades y Medidas WordHeriberto Gonzalez Brito0% (1)
- Acidos CarboxilicosDocumento2 páginasAcidos CarboxilicosJuan PabloAún no hay calificaciones
- Conceptos Fundamentales de Mecánica de FluidosDocumento11 páginasConceptos Fundamentales de Mecánica de FluidosHeriberto Gonzalez BritoAún no hay calificaciones
- Qué Es La TransesterificaciónDocumento4 páginasQué Es La TransesterificaciónCarlos herazoAún no hay calificaciones
- Espectros InfrarrojoDocumento14 páginasEspectros InfrarrojoMaira Alejandra Cubillos TorresAún no hay calificaciones
- Biotoxicidad PresentaciónDocumento20 páginasBiotoxicidad PresentaciónMaría Luisa AvendañoAún no hay calificaciones
- Universidad Nacional Del Callao: Química OrgánicaDocumento6 páginasUniversidad Nacional Del Callao: Química OrgánicaVictor Josué BolivarAún no hay calificaciones
- Proyecto IntegradorDocumento12 páginasProyecto IntegradorJohn Brayhan Candia CutipaAún no hay calificaciones
- Ficha Técnica ENZIPROM v11.2021Documento4 páginasFicha Técnica ENZIPROM v11.2021Charles Cipriano AvalosAún no hay calificaciones
- Soluciones Acidas Básicas y Neutras 2Documento7 páginasSoluciones Acidas Básicas y Neutras 2Yoel Andres SalinaAún no hay calificaciones
- ARTICULO UFPS. Extraccion de ADN para ConservarDocumento5 páginasARTICULO UFPS. Extraccion de ADN para ConservarmaferAún no hay calificaciones
- Proceso OxiquimDocumento244 páginasProceso OxiquimEdith Ingles MAún no hay calificaciones
- República Bolivariana de VenezuelaDocumento12 páginasRepública Bolivariana de VenezuelaMaiveli EscalaAún no hay calificaciones
- Ficha Técnica KelpakDocumento3 páginasFicha Técnica KelpakAdrian Rodriguez BetancourtAún no hay calificaciones
- Trabajo Final de EnzimasDocumento30 páginasTrabajo Final de EnzimasJose ChavezAún no hay calificaciones
- FitoterapiaDocumento82 páginasFitoterapiamadben5Aún no hay calificaciones
- Banco Qui Mica Primer Parcial PropeDocumento7 páginasBanco Qui Mica Primer Parcial PropeMisael OrellanoAún no hay calificaciones
- EnzimasDocumento15 páginasEnzimasThereza TrevizanAún no hay calificaciones
- Taller 3 - Trabajos de Madera Con ResinaDocumento37 páginasTaller 3 - Trabajos de Madera Con ResinaConstanza Arancibia100% (2)
- Quimica Medicinal-1t3-1.Documento35 páginasQuimica Medicinal-1t3-1.Rosmery GaitanAún no hay calificaciones
- Obtencion de Shampoo Liquido Por Sulfatacion de Alcohol LauricoDocumento18 páginasObtencion de Shampoo Liquido Por Sulfatacion de Alcohol Lauricolisete perez ruizAún no hay calificaciones
- Práctica 6 - CromatografíaDocumento7 páginasPráctica 6 - Cromatografíaksajdka kJADSAún no hay calificaciones
- Los HidrocarburosDocumento7 páginasLos HidrocarburosSofia Basilio DiazAún no hay calificaciones
- Plástico A Base de Esperma de SalmónDocumento2 páginasPlástico A Base de Esperma de SalmónSaúl MagañaAún no hay calificaciones
- Condimentos y EspeciasDocumento5 páginasCondimentos y EspeciasMige Angel CastroAún no hay calificaciones
- Taller Bases Moleculares y Celulares de La HerenciaDocumento2 páginasTaller Bases Moleculares y Celulares de La HerenciaKareth MuñozAún no hay calificaciones
- Actividad Pág#35 Biología Aracely RodríguezDocumento3 páginasActividad Pág#35 Biología Aracely RodríguezBryanAún no hay calificaciones
- Manual TecnoAlimentosDocumento55 páginasManual TecnoAlimentosBrenda PalaciosAún no hay calificaciones
- Manejo Renal de Compuestos OrganicosDocumento8 páginasManejo Renal de Compuestos OrganicosRegina TobioAún no hay calificaciones
- Práctica Identificación de PlasticosDocumento9 páginasPráctica Identificación de PlasticosmartinAún no hay calificaciones
- Informe de Experimento Jabon CaseroDocumento8 páginasInforme de Experimento Jabon CaseroarnoldAún no hay calificaciones
- Informe - Práctica N°01 - Destilación Simple y Fraccionada - Equipo 04 - 2IV2Documento2 páginasInforme - Práctica N°01 - Destilación Simple y Fraccionada - Equipo 04 - 2IV2jose perezAún no hay calificaciones
- Introduccion Fibras TextilesDocumento31 páginasIntroduccion Fibras TextilesCris Segura mamaniAún no hay calificaciones