Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Deterioro Cognitivo: Clasificación Mediante Espectroscopia de Resonancia Magnética de Protón y Contribución de La Imagen Convencional
Cargado por
juan antonio cruz velardeTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Deterioro Cognitivo: Clasificación Mediante Espectroscopia de Resonancia Magnética de Protón y Contribución de La Imagen Convencional
Cargado por
juan antonio cruz velardeCopyright:
Formatos disponibles
ORIGINALES
Deterioro cognitivo: clasificación mediante
espectroscopia de resonancia magnética
de protón y contribución de la imagen
convencional
M. C. Martínez-Bisbala,b, E. Aranaa, L. Martí-Bonmatíb,c, B. Martínez-Granadosa y B. Celdaa
a
Departamento de Química-Física. Universidad de Valencia. España.
b
Servicio de Radiología. Hospital Quirón. Valencia. España.
c
Servicio de Radiología Hospital Universitario Dr. Peset. Valencia. España.
Cognitive impairment: classification
by proton magnetic resonance
spectroscopy and the contributions
of conventional magnetic resonance
imaging
Objetivo. Analizar la eficacia diagnóstica de la espectroscopia de Objective. To analyze the diagnostic accuracy of proton magnetic
resonancia magnética de protón (1H ERM) en pacientes con deterioro resonance spectroscopy (1H MRS) in patients with cognitive impair-
cognitivo y establecer la complementariedad de la información de ima- ment and to establish the usefulness of complementary information
gen de resonancia magnética (RM) mediante curvas ROC. provided by conventional magnetic resonance imaging (MRI).
Material y métodos. Se estudian 64 pacientes con deterioro cogni- Material and methods: 64 patients with cognitive impairment, in-
tivo, incluyendo enfermedad de Alzheimer (EA) (N = 31), demencia cluding Alzheimer’s disease (AD) (n=31), vascular dementia (n=6),
vascular (N = 6), deterioro cognitivo leve (DCL) (N = 9) y depresión mild cognitive impairment (MCI) (n=9), and major depression (n=18),
mayor (N = 18). Todos se exploraron con RM cerebral y 1H ERM were studied. All patients underwent cerebral MRI and single-volume
usando dos tiempos de eco (TE, 31 y 136 ms) con volumen único en la 1
H MRS using two echo times (TE, 31 and 136 ms) in the posterior
circonvolución cingular posterior y lóbulo temporal derecho. Los me- cingulate gyrus and right temporal lobe. The metabolites analyzed we-
tabolitos analizados fueron N-acetilaspartato (NAA), mio-Inositol re N-acetylaspartate (NAA), myo-Inositol (mI), choline (Ch), and cre-
(mI), colina (Co), y creatina (Cr) calculando las relaciones Co/Cr, atine (Cr), and the ratios of Ch/Cr, mI/Cr, NAA/mI and NAA/Cr were
mI/Cr, NAA/mI y NAA/Cr. Para diferenciar entre las distintas formas calculated. In order to differentiate among the different types of cogni-
de deterioro cognitivo, las alteraciones en imagen y en espectroscopia tive impairment, the alterations in imaging and spectroscopy findings
fueron graduadas de 0 a 4, así como la combinación promedio de las were graded from 0 to 4, as was the mean combination of the two, and
mismas, obteniéndose posteriormente curvas ROC. then ROC curves were obtained.
Resultados. Se obtuvieron diferencias estadísticamente significativas Results. Statistically significant differences were found between the
entre los espectros de pacientes con demencia (EA y demencia vascular) spectra of patients with dementia (AD and vascular dementia) and tho-
y los que no presentaban demencia (DCL y depresión) en la circunvolu- se without dementia (MCI and depression) in the posterior cingulate
ción cingular posterior. La relación NAA/mI proporcionó la mejor área gyrus. The NAA/mI ratio yielded the best area under the ROC curve,
bajo la curva ROC con la mayor sensibilidad (82,5%) y especificidad with the best sensitivity (82.5%) and specificity (72.7%) in the diagno-
(72,7%) en el diagnóstico de EA. Los cocientes NAA/mI y mI/Cr dife- sis of AD. The NAA/mI and mI/Cr quotients differentiated between
renciaron entre las cuatro patologías degenerativas de deterioro cognitivo. the four degenerative pathologies causing the cognitive impairment.
La combinación de imagen de RM y ERM mejoró significativamente el The combination of MRI and 1H MRS significantly improved the ac-
diagnóstico de la EA. curacy of the diagnosis of AD.
Conclusiones. Las diferencias metabólicas encontradas mediante Conclusions. The metabolic differences found among patients with
ERM entre pacientes con deterioro cognitivo pueden ser útiles para di- cognitive impairment using 1H MRS can be useful for differentiating
ferenciar la EA, demencia vascular, DCL y depresión. La combinación AD, vascular dementia, MCI, and depression. The combination of
de espectroscopia e imagen de RM es útil para el diagnóstico de la EA. spectroscopy and MRI findings is useful in the diagnosis of AD.
Palabras clave: deterioro cognitivo leve, resonancia magnética, imagen, Key words: mild cognitive impairment, magnetic resonance image,
espectroscopia en vivo, enfermedad de Alzheimer, demencia vascular. magnetic resonance, in vivo spectroscopy, Alzheimer’s disease, vas-
cular dementia.
Este trabajo es fruto de la Beca de Investigación «Complementariedad de las alteraciones metabólicas en espectroscopia y los cambios de imagen en RM para el diag-
nóstico y graduación del deterioro cognitivo» otorgada por la SERAM.
El trabajo ha sido presentado parcialmente en:
— XXVII Congreso Nacional de la Sociedad Española de Radiología Médica. Bilbao, 2004 obteniendo el Premio «Magna Cum Laude».
— Congreso Europeo de Radiología ECR 2003 y ECR 2004.
— Reunión Anual de la Sociedad Europea de Resonancia Magnética en Medicina y Biología (ESMRMB) 2003.
Correspondencia:
E. ARANA. Servicio de Radiología. Clínica Quirón. Av. Blasco Ibáñez, 14. 46010 Valencia. España.
Correo electrónico: rmquironv.val@quiron.es
Radiología. 2006;48(5):301-7 301
Martínez-Bisbal MC et al. Deterioro cognitivo: clasificación mediante espectroscopia de resonancia magnética de protón y contribución de la imagen convencional
INTRODUCCIÓN fermedades venéreas (VDRL), prueba Mini examen cognosciti-
vo (Mini Mental State Examination, MMSE) y estudio del siste-
Se ha estudiado mediante espectroscopia de resonancia magné- ma nervioso central mediante RM.
tica (1H ERM) a los pacientes con deterioro cognitivo, principal-
Como criterios de exclusión se consideraron los diagnósticos fi-
mente cuando éste va asociado a demencias, tanto vasculares co-
nales de infarto agudo, tumor, hematoma subdural, pérdida senso-
mo enfermedad de Alzheimer (EA)1-4. Sin embargo, el deterioro
rial, síndrome confusional, intoxicación, hipovitaminosis, hidro-
cognitivo leve (DCL) también se ha descrito5 como un estado clí-
cefalia a presión normal e intoxicación. No se excluyó a ningún
nico de transición entre la normalidad para la edad y la EA. En su-
paciente por presentar leucoaraiosis. Dado que se excluyeron 8 su-
jetos con DCL se han observado cambios patológicos similares a
jetos el grupo de estudio final estaba compuesto por 64 pacientes.
la fase temprana de EA, y existe una proporción significativamen-
te más elevada de progresión hacia la sintomatología clínica clási- El diagnóstico de EA se realizó de acuerdo con el criterio de-
ca de EA (12-15% por año) comparado con ancianos sin deterioro finido como «probable enfermedad de Alzheimer» según DSM-
cognitivo (incidencia 1-2%)3,5. Además, diversos estudios recien- IV17, y el de demencia vascular siguiendo las pautas del National
tes indican la coexistencia de depresión y DCL6-8. Desgraciada- Institute of Neurological Disorders and Stroke18. Se diagnosticó
mente, no se conoce un marcador biológico definitivo para el depresión a los pacientes que cumplían el criterio de inclusión
diagnóstico diferencial de la EA, demencia vascular, DCL y de- del Manual del diagnóstico y estadística de trastornos mentales
p r e s i ó n . (DSM-IV)17. El criterio para DCL se consideró cuando el pa-
ciente presentaba pérdida de memoria, referida por él o por las
La 1H ERM es una técnica incruenta capaz de proporcionar
personas de su entorno, pérdida de la actividad diaria normal con
información bioquímica espacialmente localizada de un órgano.
funciones cognitivas generales normales y ejecución anormal de
En el cerebro se ha utilizado ampliamente en el estudio de las di-
la memoria para la edad, pero sin evidenciarse demencia ni de-
ferentes patologías y desórdenes neurodegenerativos, principal-
presión de acuerdo con DSM-IV.
mente tumores, esclerosis múltiple y demencias3,9,10. Diversos
estudios de 1H ERM han revelado en la EA, considerando la cre-
atina (Cr) como una referencia interna estable, un descenso del
Estudios RM y 1H ERM
N-acetilaspartato (NAA) y un incremento de mio-Inositol (mI)
respecto a los sujetos sanos1,11,12, considerando que las alteracio-
Las secuencias de RM convencional y la 1H ERM se adquirie-
nes de colina (Co) no han sido concluyentes13. La demencia vas-
ron en la misma sesión en un equipo superconductor de 1,5 T
cular se ha relacionado con una discreta disminución de la rela-
(Philips Sistemas Médicos, Gyroscan ACS-NT Intera, Holanda).
ción NAA/Cr y un valor normal del cociente mI/Cr2,14. En el
DCL también se han descrito anomalías metabólicas, con un ma- Las imágenes de RM se adquirieron mediante secuencias tur-
yor aumento de mI/Cr, así como una disminución, no significati- bo espín eco (TSE), según el siguiente orden: sagital IR-T1
va, del cociente NAA/Cr con respecto a sujetos normales1. (TR:4092 ms, TE:20 ms, TI:400 ms, factor de ecos 16), axial
densidad protónica / T2 (TR:2100 ms, TE:13/115 ms, factor de
La imagen de RM presenta diferencias entre las entidades aso-
ecos 10), coronal FLAIR (TR:6914 ms, TE:110 ms, TI:200 ms,
ciadas al deterioro cognitivo, pero sólo en situaciones severas.
factor de ecos 12) e imagen potenciada en difusión (TR:4618
Así, la pérdida de volumen de los lóbulos temporales se observa
ms, TE:146 ms, B:1000, factor EPI 67).
en estados iniciales de la EA y la depresión15. Sin embargo, en
esta última también pueden existir las lesiones de sustancia blan- Las imágenes coronales fueron graduadas basándose en el
ca, que predominan en la demencia vascular15. análisis visual de la anchura de la cisura coroidea, anchura del
asta temporal y altura del hipocampo, según lo publicado por
Dado que la 1H ERM y la imagen de RM se obtienen a la par en
Scheltens et al19. Esta clasificación produce una escala de 0 a 4
estos pacientes, parece evidente que la combinación de ambas téc-
indicativa de atrofia de estas estructuras (0 = ausencia, 1 = míni-
nicas dará el perfil global de la eficacia diagnóstica de una explo-
ma, 2 = discreta, 3 = moderada y 4 = severa) con progresiva pro-
ración completa de RM en ellos. Sin embargo, esta aproximación
babilidad para la clasificación de demencia de Alzheimer.
no ha sido suficientemente analizada, existiendo un único estudio
que analiza la contribución de la espectroscopia a la morfometría La secuencia de pulso de 1H ERM fue la PRESS con 128 re-
de la imagen de RM para el diagnóstico de la EA y el DCL16. peticiones y supresión de agua mediante inversión selectiva. En
cada espectro se adquirieron 512 puntos. El volumen único de
El objetivo de este trabajo es analizar la eficacia para diferen- 1
H ERM se adquirió en dos localizaciones: la circunvolución pe-
ciar entre las 4 formas clínicas más comunes asociadas con el
ricallosa cingular posterior y el lóbulo temporal derecho (fig. 1).
deterioro cognitivo (EA, demencia vascular, DCL y depresión)
Para cada una de las localizaciones se emplearon dos TE (31 y
mediante 1H ERM e imagen convencional de RM, establecién-
136 ms), y el mismo tiempo de repetición (TR) de 2.000 ms. Las
dose la utilidad combinada de ambos métodos.
dimensiones del volumen único fueron diferentes según la loca-
lización, dado que se ajustaron a la extensión del área de interés.
Este volumen fue de 20 x 20 x 20 mm (8 cm3) en la circunvolu-
MATERIAL Y MÉTODOS
ción cingular posterior, y de 18 x 18 x 18 mm (5,8 cm3) en el ló-
bulo temporal derecho. El volumen más pequeño en el lóbulo
Pacientes
temporal derecho se seleccionó para evitar las inhomogeneida-
des del campo próximas a la interfase con el peñasco.
Se realizó un estudio prospectivo de 72 pacientes con deterio-
ro cognitivo temprano, de una media de edad de 70 ± 9 años. A El espectro obtenido en cada volumen se transformó y analizó
todos los sujetos se les sometió a una batería de pruebas diag- con el programa jMRUI20. La señal de agua residual se elimi-
nósticas, incluyendo radiografías de tórax, electrocardiograma, nó con filtro Hankel Lanczos Singular Values Decomposition
estudio de bioquímica y hemograma, pruebas de función tiroi- Filter (SVD), y el llenado con ceros fue de 512 puntos. Para la
dea, niveles de vitamina B-12 y ácido fólico, serología para en- apodización se utilizó una forma de línea lorenziana de 2 Hz. El
302 Radiología. 2006;48(5):301-7
Martínez-Bisbal MC et al. Deterioro cognitivo: clasificación mediante espectroscopia de resonancia magnética de protón y contribución de la imagen convencional
truncamiento del primer punto se aplicó exclusivamente para de menor a mayor probabilidad, de manera similar a la imagen.
aquellos espectros con línea base muy distorsionada. Las áreas
Posteriormente se obtuvo un diagnóstico global que consistía
de NAA, Cr, Co y mI en el espectro a TE 31 ms, y de NAA, Cr y
en el promedio de las dos graduaciones previamente establecidas
Co en el espectro a 136 ms se calcularon con el algoritmo AMA-
(puntuación global = [puntuación RM imagen + puntuación RM
RES incluido en el programa jMRUI. Las fases de cada pico
espectroscopia] / 2). La clasificación, tanto de la imagen RM co-
individual (0º), frecuencia (NAA 2,01 ppm, Cr 3,01 ppm, Co
mo de la espectroscopia, se realizó de forma independiente y
3,21 ppm y mI 3,56 ppm), anchura de línea (3 Hz) y forma (lo-
ambas se obtuvieron sin conocer el diagnóstico final, aunque se
renciana) se ajustaron y se fijaron de forma empírica. Se ajustó
sabía que todos los pacientes padecían deterioro cognitivo.
la amplitud estimada inicialmente por el programa hasta anular
prácticamente el espectro diferencial final. Se calcularon las si-
guientes relaciones para ambas localizaciones: NAA/Cr, Co/Cr,
ANÁLISIS ESTADÍSTICO
NAA/Co en ambos TE, y mI/Cr sólo en el espectro a TE corto.
En función de estas relaciones se graduaron las alteraciones es-
La distribución normal del cociente de los metabolitos y las
pectroscópicas también de 0 a 4 para la clasificación de Alzheimer,
variables se evaluó mediante la prueba de Kolmogorov-Smirnov.
Se examinaron las diferencias en los cocientes de los metaboli-
tos para los dos TE y entre las 4 formas clínicas asociadas al de-
terioro cognitivo usando el análisis de la varianza (ANOVA). Pa-
ra reducir la probabilidad de encontrar alteraciones significativas
debidas al azar en cualquier región, el nivel de significación para
ANOVA se incrementó a α = 0,05/8 = 0,006; usando las correc-
ciones de Bonferroni para comparaciones múltiples (dos pruebas
independientes y 4 enfermedades). Para las comparaciones bila-
terales (por ejemplo demencia frente a no-demencia) se emplea-
ron dos pruebas «t» de Student dirigidas con α = 0,012 (0,05/4)
con la prueba posterior de Scheffé para las comparaciones múlti-
ples. La prueba «t» de Student se empleó para valorar las dife-
rencias entre subtipos de demencia en las distintas localizaciones
y TE. Se utilizó también la prueba U de Mann-Whitney para ve-
rificar las diferencias en los cocientes NAA/Co a TE 136 ms de-
bido a la distribución no normal. El análisis estadístico se realizó
utilizando el programa SPSS versión 11.5.1 (SPSS Inc., Chica-
go, EE.UU.).
El análisis de rendimiento diagnóstico mediante curvas ROC
(características operativas del receptor) se llevó a cabo para
comparar la exactitud del diagnóstico mediante el cociente más
significativo encontrado para la diferenciación de la EA de otras
formas de deterioro cognitivo. La habilidad discriminatoria se
basó en el área bajo la curva ROC (Az). Se compararon las cur-
vas diagnósticas de la imagen de RM, la espectroscopia y el
diagnóstico global con la combinación de RM y ERM.
RESULTADOS
De los 64 pacientes incluidos con deterioro cognitivo tempra-
no, 45 eran mujeres y 19 hombres con una media de edad de
70 ± 9 años. De estos 64 pacientes, 31 fueron finalmente clasifi-
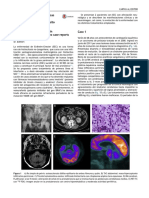
Fig. 1.— Examen de espectroscopia. Localización del volumen único cados como casos de EA, 18 de depresión, 9 de DCL y 6 de de-
en la circunvolución cingular posterior y el lóbulo temporal derecho.
TABLA 1
ASPECTOS CLÍNICOS Y DEMOGRÁFICOS DE LOS PACIENTES
EA DCL Depresión Demencia vascular
Pacientes 31 9 18 6
Edad (media ± DE) 71,1 ± 8,2 67,8 ± 10,1 67,3 ± 10,1 69,3 ± 9,2
Hombres/mujeres 10/21 4/5 5/13 3/3
Educación 13 (7;20) 14 (7;20) 11 (6;17) 12 (8;17)
MMSE 20 (15;25) 28 (21;30) 25 (23;30) 19 (14;24)
Edad y educación en años. En educación y MMSE la mediana y el rango se expresan entre paréntesis. MMSE: Mini examen cognoscitivo; EA: enfermedad de Alzheimer; DCL: deterioro cognitivo leve.
Radiología. 2006;48(5):301-7 303
Martínez-Bisbal MC et al. Deterioro cognitivo: clasificación mediante espectroscopia de resonancia magnética de protón y contribución de la imagen convencional
mencias vasculares. Los datos clínicos más relevantes se pre- TABLA 2
sentan en la tabla 1. Los pacientes con EA tuvieron valores más RELACIONES ESTADÍSTICAS ENTRE LOS COCIENTES
bajos en el MMSE que los otros pacientes (F = 4,5, grados de li- DE LOS METABOLITOS
bertad [gl] = 3, p < 0,001; prueba de ANOVA).
Debido a que en los 4 grupos las proporciones observadas de IC 95%
Localización/TE Media ± DE ANOVA
hombres y mujeres fueron diferentes, se utilizó la suma de la hi- Media
lera de pruebas para comprobar si existían diferencias en los
CPP / 31 ms
cocientes de los metabolitos entre sexos. No se encontraron dife- EA 1,52 ± 0,36 1,39-1,66
rencias entre los cocientes de los metabolitos para los dos géne- DCL 1,52 ± 0,34 1,26-1,78
ros, por lo que el análisis estadístico no se estratificó por sexo. NAA/Cr p = 0,83
Todas las variables presentaron una distribución normal, con DM 1,61 ± 0,27 1,47-1,74
DV 1,55 ± 0,30 1,23-1,86
la excepción de la relación NAA/Co en la circunvolución cin-
EA 0,73 ± 0,20 0,66-0,81
gular posterior a TE 136 ms (prueba de Kolmogorov-Smirnov; DCL 0,59 ±0,11 0,51-0,67
p = 0,034). Los cocientes de los metabolitos usados en la clasifi- Co/Cr p = 0,04
cación del deterioro cognitivo están recogidos en la tabla 2. DM 0,62 ± 0,14 0,55-0,68
DV 0,65 ± 0,11 0,54-0,76
Para diferenciar los pacientes con demencia de aquellos con
EA 0,83 ± 0,21 0,75-0,91
deterioro, pero sin demencia, se les agrupó dos a dos (EA y de- DCL 0,60 ±0,14 0,50-0,71
mencia vascular frente a DCL y depresión). El grupo demencia mI/Cr p > 0,0001
presentó en la circunvolución cingular posterior unos cocientes DM 0,64 ±0,12 0,58-0,70
más altos de Co/Cr y mI/Cr (TE 31 ms, «t»-Student, p = 0,011 y DV 0,59 ±0,13 0,45-0,73
p = 0,001, respectivamente) y una disminución del NAA/mI (TE EA 2,10 ±0,75 1,93-2,40
31 ms, «t»-Student, p = 0,010), NAA/Co (TE 31 ms, U-Mann- DCL 2,67± 0,82 2,04-3,3
Whitney, p = 0,011), y del NAA/Cr (TE 136 ms, prueba de NAA/Co p = 0,11
«t»-Student, p = 0,011). DM 2,74 ± 0,8 2,34-3,14
DV 2,41 ± 0,53 1,85-2,97
Analizando sólo los pacientes con demencia, la demencia vas- NAA/mI p = 0,008
cular frente a la EA se diferenció estadísticamente mediante los EA 1,98 ±0,74 1,68-2,27
cocientes Co/Cr, mI/Cr y NAA/Cr obtenidos en la circunvo- DCL 2,56 ± 0,42 2,23-2,89
lución cingular posterior con TE 31 ms («t»-Student, t = 2,6, DM 2,58 ± 0,7 2,24-2,94
p = 0,011; t = 2,76, p = 0,009; t = 3,1, p = 0,004, respectivamente). DV 2,67± 0,54 2,10-3,23
CPP / 136 ms
Dada la alta prevalencia e importancia de la EA, los cocientes EA 1,46±0,27 1,35-1,57
mI/Cr y NAA/mI a TE 31 ms se compararon para discriminar DCL 1,67±0,19 1,47-1,87
entre EA y las otras tres formas de deterioro cognitivo. Las cur- NAA/Cr p = 0,11
vas ROC muestran que ambos metabolitos obtuvieron una buena DM 1,61±0,23 1,48-1,73
discriminación (p < 0,0001) sin diferencias estadísticas entre DV 1,57±0,23 1,20-1,93
ellos (p = 0,5). El cociente NAA/mI a TE 31 ms obtuvo la mayor LTD / 31 ms
sensibilidad (81,5%) y especificidad (72,7%) con un valor de EA 1,09±0,25 1,00-1,18
DCL 1,17±0,23 0,98-1,37
corte de 2,32 (fig. 2). La EA y la depresión se diferenciaron a
Co/Cr p = 0,22
través de los cocientes mI/Cr y NAA/mI (TE 31 ms, «t»-Student, DM 1,14±0,27 0,99-1,29
t = 3,55, p = 0,002; p = 0,001, respectivamente). DV 1,35±0,30 0,98-1,72
Cuando se compararon las 4 entidades entre sí, las relaciones
CPP: circunvolución pericallosa posterior; LTD: lóbulo temporal derecho; NAA: N-acetilas-
mI/Cr y NAA/mI a TE 31 ms en la circunvolución cingular pos- partato; DCL: deterioro cognitivo leve; Co: colina; mI: mio-Inositol; Cr: creatina; EA: enfer-
terior demostraron muy claramente diferencias estadísticas en- medad de Alzheimer; DV: demencia vascular; DM: depresión mayor.
A B
Fig. 2.— Localización del VOI (volumen de interés) en la circunvolución pericallosa posterior (20 × 20 × 20 mm3) y lóbulo temporal derecho
(25 × 18 × 18 mm3). Nótense las bandas de supresión ortogonales al VOI.
304 Radiología. 2006;48(5):301-7
Martínez-Bisbal MC et al. Deterioro cognitivo: clasificación mediante espectroscopia de resonancia magnética de protón y contribución de la imagen convencional
1,0
1,2
0,8
1 p = 0,003 p = 0,005
Sensibilidad
0,8 NAA/ml Az: 0,81±0,06
PCG ,ml/Cr
0,6 Cl 95%: 0,68-0,92
0,6
0,4 ml/Cr Az:0,79±0,05
0,3 Cl 95%: 0,68-0,91
0,2
0
AD MCI MD VD 0,0
0,0 0,3 0,5 0,8 1,0
1-Especificidad
Fig. 3.— Resultados de la prueba ANOVA de mio-Inositol /creatina
(mI/Cr) en la circunvolución cingular pericallosa posterior (PCG) a TE Fig. 4.— Curvas ROC demostrando la discriminación de Alzheimer
de 31 ms (p < 0,0001). La comparación entre Alzheimer (AD) y la de- frente a no-Alzheimer en la circunvolución pericallosa posterior a TE
mencia vascular (VD) no fue estadísticamente significativa (p = 0,014, 31 ms. Az: área bajo la curva; CI: intervalo de confianza al 95%.
según corrección comentada previamente). Las barras expresan la me-
dia ± desviación estándar. MCI: deterioro cognitivo temprano;
MD: depresión mayor.
1
tre los grupos. La prueba posterior de Scheffé mostró que el 0,9
cociente mI/Cr aumenta en la EA (TE 31 ms, F = 7,79, gl = 3, 0,8
p < 0,0001), discriminando la EA del DCL y la depresión (fig. 3).
Los pacientes con EA tuvieron una reducción del NAA/mI en la 0,7
circunvolución cingular posterior comparado con los pacientes 0,6
Sensibilidad
con demencia vascular, depresión y DCL (TE 31 ms, F = 5,21, rm
0,5 erm
gl = 3, p = 0,008) (fig. 4). Los pacientes con EA presentaron los
daglobal
valores más elevados de Co/Cr, aunque sin evidencia de signifi- 0,4
cación estadística (TE 31 ms, F = 2,72, gl = 3, p = 0,04). 0,3
En la figura 5 se muestran las curvas ROC para cada una de las 0,3
pruebas diagnósticas. La menor capacidad discriminatoria la mos- 0,1
tró aisladamente la imagen de RM (Az: 0,584 ± 0,0475). Aunque 0
la espectroscopia por RM presentó una mayor área bajo la curva, 0 0,2 0,4 0,6 0,8 1
no se observaron diferencias significativas (Az: 0,697 ± 0,0442) 1-Especificidad (falsos positivos)
(p = 0,053). Cuando se combinaron estas dos pruebas el diagnós-
tico mejoró globalmente con una mayor área bajo la curva (Az:
0,699 ± 0,0447) y con diferencias significativas respecto a la RM Fig. 5.— Curvas ROC de las distintas técnicas para el diagnóstico glo-
aislada (p = 0,002) pero no frente a la espectroscopia (p = 0,39). bal de demencia de Alzheimer. La combinación (daglobal) de imagen
Así, para un nivel constante de especificidad del 60% para las tres por resonancia magnética (rm) y espectroscopia (erm) mostró la mayor
capacidad diagnóstica con diferencias significativas respecto a la RM
pruebas, la sensibilidad de la RM es del 52,5%, de la 1H ERM del aislada (p = 0,002).
65% que pasa con la combinación de ambas al 66,3%.
la EA y la demencia vascular, los estudios de RM convencional
DISCUSIÓN no permiten una diferenciación precisa ni concreta de las formas
clínicas que se presentan con deterioro cognitivo2. El análisis vi-
Se ha demostrado que el deterioro cognitivo temprano puede sual ha mostrado que en población sana frente a EA se puede
presentarse relacionado con las demencias, la depresión, o ser un conseguir una adecuada sensibilidad (74%) y especificidad
estado transicional entre la degeneración fisiológica de la edad y (82%)15. Para determinaciones más específicas, o en estadios ini-
la EA3,21. Así, el deterioro cognitivo se encuentra presente hasta ciales, tanto la morfometría del córtex entorrinal como la seg-
en un 87% de los pacientes con depresión7, no estando relaciona- mentación de lesiones de sustancia blanca han mostrado resulta-
do ni con la duración de la enfermedad ni con el número de epi- dos aceptables15. Sin embargo, la superposición de alteraciones
sodios y no siendo reversible en su totalidad6,7. El diagnóstico entre las distintas entidades con deterioro cognitivo hace que el
precoz de la depresión puede ser difícil, de acuerdo con el criterio diagnóstico sea complejo basándose sólo en una prueba15.
del sistema de clasificación internacional22, pudiendo ser una de
Existen diversos estudios de 1H ERM que analizan la diferen-
las presentaciones de la demencia, particularmente en la EA6.
ciación de las demencias, especialmente la EA, de los sujetos
Aunque se han descrito diferencias en la imagen de RM en las controles sanos2,11,14. Aunque existen informes de anormalidades
entidades que cursan con deterioro cognitivo, y especialmente en en la RM de imagen en el síndrome de DCL23, la evidencia es-
Radiología. 2006;48(5):301-7 305
Martínez-Bisbal MC et al. Deterioro cognitivo: clasificación mediante espectroscopia de resonancia magnética de protón y contribución de la imagen convencional
pectroscópica de alteraciones en esta entidad es escasa16. Los pa- de distinguir entre pacientes con EA, por un lado, y aquellos con
cientes con depresión también se han estudiado con 1H ERM y depresión y deterioro cognitivo por otro. La depresión está aso-
comparado con sujetos sanos15. Sin embargo, hasta la fecha no ciada con la atrofia del hipocampo y el descenso de NAA, Cr y
hay estudios previos de 1H ERM con una comparación global Co, pero no se han observado cambios en la concentración de
entre EA, demencia vascular, depresión y DCL. Así mismo, son mI25. Estudios de 1H ERM han observado un aumento en los co-
escasos los trabajos que traten de la complementariedad de la in- cientes Co/Cr y Co/NAA en pacientes con alteraciones anímicas
formación suministrada con la imagen de RM16. comparados con sujetos control26. Estos cambios no se han ob-
servado en las 4 formas clínicas de nuestro estudio, debido pro-
Tanto el sustrato patológico como las áreas afectas en estas
bablemente a la disminución común de los niveles de NAA en
distintas enfermedades asociadas con el deterioro cognitivo son di-
todas estas patologías27. El cociente Co/Cr no permitió diferen-
ferentes, incluyendo el entramado neurofibrilar del córtex tran-
ciar entre depresión y DCL, que probablemente está asociada a
sentorrinal y entorrinal, el hipocampo con la corteza límbica y la
la comorbilidad de ambas enfermedades7.
circunvolución cingular posterior. Esta diversidad de regiones alte-
radas también se ha puesto de manifiesto en diversos estudios pre- Se ha observado en los pacientes con subtipo DCL amnésico
vios empleando la 1H ERM con el método del volumen úni- que hasta la mitad de ellos desarrollan demencia en un período
co1,11,12,15. Por este motivo, en el presente trabajo se han utilizado de 5 años28. Por esta razón, un claro objetivo sanitario debería
dos TE diferentes (31 y 136 ms) en dos localizaciones topográficas ser encontrar los marcadores biológicos que permitieran selec-
distintas, la circunvolución cingular posterior y el lóbulo temporal, cionar entre la población con DCL los casos preclínicos de EA y
por su relación con los procesos de memoria y su teórica capacidad los de otras demencias1,23. En este sentido, para diferenciar EA
consiguiente para la diferenciación del deterioro cognitivo inicial. y DCL se ha encontrado en nuestra serie que la relación mI/Cr
presenta unas diferencias estadísticamente significativas. Aun-
El NAA y el mI se han usado ampliamente en el diagnóstico
que en un estudio previo el cociente NAA/Cr permitió una
de EA, mostrando variaciones incluso en los estados clínicos pre-
mayor capacidad discriminatoria entre EA y DCL16, estos re-
coces3,16,21. Para establecer un diagnóstico diferencial eficaz me-
sultados no se han replicado en nuestro trabajo, donde se han
diante 1H ERM de la EA se deberían incluir al menos dos regio-
constatado unos valores menores de NAA/Cr en los sujetos con
nes de interés13. Usualmente se considera que la circunvolución
EA, pero sin alcanzar diferencia estadística.
cingular posterior y el lóbulo temporal son las regiones que se
afectan más precozmente en la EA y el DCL3. Por otra parte, la Finalmente, en la comparación global de las 4 formas clínicas
localización del volumen de 1H ERM en la circunvolución cingu- asociadas con el deterioro cognitivo, sólo los cocientes mI/Cr y
lar posterior se justifica también por los estudios de tomografía NAA/mI fueron estadísticamente diferentes en la circunvolución
por emisión de positrones (PET) que identifican esta área como la cingular posterior con un mayor mI/Cr y menor NAA/mI en la
región significativamente más afecta del cerebro tanto en pacien- EA (tabla 2). En el único estudio publicado en el que se compa-
tes con EA precoz como en sujetos portadores asintomáticos del raba espectroscopia, morfometría por RM y difusión, el paráme-
alelo APO ε4 con riesgo de EA21. El vóxel en la circunvolución tro aislado que mostró una mayor sensibilidad, con el 67%, fue
cingular posterior incluye el núcleo precúneo inferior, donde se el NAA/Cr21. Cuando se trataba de conseguir una alta especifici-
ha medido la relación más alta de atrofia en pacientes con leve dad (> 85%) las combinaciones de morfometría y 1H ERM fue-
EA usando una serie imágenes registradas temporalmente24. ron los mejores predictores, indicando que las medidas de RM
Los pacientes con demencia (EA y demencia vascular) pre- que mejor diagnostican van cambiando con el curso de la enfer-
sentan diferencias respecto de aquellos con deterioro cognitivo medad. Así, para distinguir la EA tanto del DCL como del en-
no asociado a demencia (depresión y DCL), sólo significativas vejecimiento normal sería mejor la ERM. Sin embargo, en una
en la circunvolución cingular posterior. Los distintos cocientes primera fase, la distinción entre normal y DCL estaría mejor
valorados muestran un mayor contenido de mI y Co y una menor lograda con la morfometría del hipocampo21. Nuestros datos re-
proporción de NAA en el grupo de la demencia. Merece reseñar flejan que la combinación de imagen por RM y 1H ERM propor-
que el uso de NAA/mI16, que es una combinación de las relacio- ciona la mayor capacidad diagnóstica, con un aumento de la sen-
nes NAA/Cr y mI/Cr, da la mayor sensibilidad en la discrimina- sibilidad a un nivel constante de especificidad (fig. 5). Hemos
ción de pacientes con EA de otros sujetos de nuestra serie con obtenido menores valores de sensibilidad y especificidad respec-
deterioro cognitivo. Además, este cociente de metabolitos es to a otros trabajos con clasificación visual12. Esto se debe a que
muy útil para diferenciar EA de los controles normales16,21. nuestro estudio no diferenciaba sanos frente a EA, sino que com-
prendía las 4 clases de deterioro cognitivo más frecuentes15.
El análisis de las diferencias espectroscópicas entre los dos ti-
pos de demencias más comunes asociada con el deterioro cogniti- A pesar de los problemas generales que presenta la definición
vo, EA y demencia vascular, ha demostrado que es posible dife- del deterioro cognitivo29 y el pequeño grupo de pacientes con de-
renciarlas de forma estadísticamente significativa empleando los mencia vascular y DCL en nuestro estudio, se ha podido demos-
cocientes mI/Cr, NAA/mI y Co/Cr obtenidos en la circunvolución trar la presencia de claras diferencias significativas en los meta-
cingular posterior. Sin embargo, en el lóbulo temporal derecho el bolitos analizados. Otra de las limitaciones del presente trabajo
cociente Co/Cr no da ninguna diferencia significativa (ni a TE es el pequeño tamaño muestral, y que la propia definición de de-
corto ni medio). Estas observaciones metabólicas son coherentes mencia de Alzheimer y vascular es heterogénea desde el punto
con los datos publicados acerca de los cocientes de Co en el lóbu- de vista clínico17,29.
lo temporal y la circunvolución cingular posterior, con distintos Las diferencias metabólicas de 1H ERM en pacientes con de-
perfiles metabólicos2,13. Esto indica un aumento global de los va- terioro cognitivo son útiles para diferenciar EA, demencia vas-
lores Co en esta localización para las demencias, pero que no ayu- cular, DCL y depresión. De gran importancia es la constatación
dan a su diagnóstico diferencial con otras entidades ni entre ellas. del mayor valor combinado de las dos técnicas de RM, siendo el
diagnóstico global más discriminatorio que el obtenido con la
La diferencia significativa entre los cocientes mI/Cr y imagen aislada.
NAA/Cr en la circunvolución cingular posterior a TE corto pue-
306 Radiología. 2006;48(5):301-7
Martínez-Bisbal MC et al. Deterioro cognitivo: clasificación mediante espectroscopia de resonancia magnética de protón y contribución de la imagen convencional
Por todo esto, el análisis del deterioro cognitivo de causa no es- 14. MacKay S, Meyerhoff DJ, Constans JM, Norman D, Fein G, Weiner
tablecida debe siempre complementarse con los estudios de RM MW. Regional gray and white matter metabolite differences in sub-
de imagen y de espectroscopia, ya que la imagen observa otras le- jects with AD, with subcortical ischemic vascular dementia, and el-
derly controls with 1H Magnetic Resonance Spectroscopic Imaging.
siones cerebrales que ayudan al diagnóstico de la demencia. Arch Neurol. 1996;53:167-74.
15. Frisoni P, Scheltens S, Galluzzi F, Nobili M, Fox NC, Robert PH, et
al. Neuroimaging tools to rate regional atrophy, subcortical cerebro-
AGRADECIMIENTOS vascular disease, and regional cerebral blood flow and metabolism:
consensus paper of the EADC. J Neurol Neurosurg Psychiatry.
Este trabajo se ha realizado con el apoyo de una beca de la 2003;74:1371-81.
Sociedad Española de Radiología Médica y el soporte de la red 16. Kantarci K, Xu Y, Shiung MM, O’Brien PC, Cha RH, Smith GE, et
temática española IM3 del Instituto de Salud Carlos III al. Comparative diagnostic utility of different MR modalities in mild
(G03/185). Es de agradecer también la contribución de los doc- cognitive impairment and Alzheimer’s disease. Dement Geriatr
tores Gil Rodrigo, Pallardó, Masbout, Valero, Latorre, López- Cogn Disord. 2002;14:198-207.
Trigo, Yayá, Laínez y Cervelló en la selección de pacientes y re- 17. Asociación Americana de Psiquiatría. DSM-IV Manual diagnóstico
cogida de los datos clínicos. y estadístico de los trastornos mentales. 1st ed. Barcelona: Masson;
2003.
A todo el personal de Resonancia Magnética.
18. Roman G, Tabemichi T, Erkinjuntti T. Vascular dementia: diagnostic
criteria for research studies. Report of the NINDS-AIREN interna-
tional workshop. Neurology. 1993;43:250-60.
BIBLIOGRAFÍA 19. Scheltens P, Leys D, Barkhof F, Huglo D, Weinstein HC, Vermersch
P, et al. Atrophy of medial temporal lobes on MRI in «probable»
1. Martínez-Bisbal MC, Arana E, Martí-Bonmatí L, Molla E, Celda B. Alzheimer’s disease and normal ageing: diagnostic value and neu-
Cognitive impairment: classification by 1H magnetic resonance ropsychological correlates. J Neurol Neurosurg Psychiatry.
spectroscopy. Eur J Neurol. 2004;11:187-93. 1992;55:967-72.
2. Capizzano AA, Schuff N, Amend DL, Tanabe JL, Norman D, 20. Naressi A, Couturier C, Devos JM, Janssen M, Mangeat C, de Beer
Maudsley AA, et al. Subcortical ischemic Vascular Dementia: as- R, et al. Java-based graphical user interface for the MRUI quantita-
sessment with quantitative MR Imaging and 1H MR Spectroscopy. tion package. MAGMA; 12:141-52.
AJNR. 2000;21:621-30. 21. Kantarci K, Smith GE, Ivnik RJ, Petersen RC, Boeve BF, Knopman
3. Kantarci K, Jack CR, Xu YC, Campeau NG, O´Brien PC, Smith GE, DS, et al. 1H magnetic resonance spectroscopy, cognitive function,
et al. Regional metabolic patterns in mild cognitive impairment and and apolipoprotein E genotype in normal aging, mild cognitive im-
Alzheimer’s disease. A 1HMRS study. Neurology. 2000;55:210-7. pairment and Alzheimer ’s disease. J Int Neuropsychol Soc.
4. Chantal S, Labelle M, Bouchard RW, Braun CMJ, Boulanger Y. Co- 2002;8:934-42.
rrelation of regional proton magnetic resonance spectroscopic meta- 22. Gottfries C. Late life depression. Eur Arch Psychiatry Clin Neurosci.
bolic changes with cognitive deficits in mild Alzheimer Disease. 2001;251:57-61.
Arch Neurol. 2002;59:955-62. 23. Wolf H, Jelic V, Gertz H, Nordberg A, Julin P, Wahlund LO. A criti-
5. Burns A, Zaudig M. Mild cognitive impairment in older people. cal discussion of the role of neuroimaging in mild cognitive impair-
Lancet. 2002;360:1963-5. ment. Acta Neurol Scand. 2003;107:52-76.
6. Evans M, Mottram P. Diagnosis of depression in elderly patients. 24. Scahill R, Schott J, Stevens J, Rossor M, Fox N. Mapping the evolu-
Adv Psychiatr Trends. 2000;6:49-56. tion of regional atrophy in Alzheimer’s disease: unbiased analysis of
7. Reischies F, Neu P. Comorbidty of mild cognitive disorder and de- fluid-registered serial MRI. Proc Natl Acad Sci. 2002;99:4703-7.
pression- a neuropsychological analysis. Eur Arch Psychiatry Clin 25. Czeh B, Michaelis T, Watanabe T, Frahm J, de Biurrun G, van Kam-
Neurosci. 2000;250:186-93. pen M, et al. Stress-induced changes in cerebral metabolites, hippo-
8. Murata T, Kimura H, Omori M, Kado H, Kosaka H, Iidaka T, et al. campal volume, and cell proliferation are prevented by antidepressant
MRI white matter hyperintensities, 1H-MR spectroscopy and cogni- treatment with tianeptine. Proc Natl Acad Sci. 2001;98:12796-801.
tive function in geriatric depression: a comparison of early- and late- 26. Silverstone P, Hanstock C, Rotzinger S. Lithium does not alter the
onset cases. Int J Geriatr Psychiatry. 2001;16:1129-35. choline/creatine ratio in the temporal lobe of human volunteers as
9. Castillo M, Kwock L. Clinical applications of proton magnetic reso- measured by proton magnetic resonance spectroscopy. J Psychiatry
nance spectroscopy in the evaluation of common intracranial tumors. Neurosci. 1999;24:222-6.
Top Magn Reson Imaging. 1999;10:104-13. 27. Hamakawa H, Kato T, Murashita J, Kato N. Quantitative proton
10. Casanova B, Martínez-Bisbal MC, Valero C, Celda B, Martí-Bonma- magnetic resonance spectroscopy of the basal ganglia in patients
tí L, Pascual A, et al. Evidence of Wallerian degeneration in normal with affective disorders. Eur Arch Psychiatry Clin Neurosci.
appearing white matter in the early stages of relapsing-remitting 1998;248:53-8.
multiple sclerosis. A 1H MRS study. J Neurol. 2003;250:22-8. 28. Morris J, Price J. Pathologic correlates of non demented aging, mild
11. Pfefferbaum A, Adalsteinsson E, Spielman D, Sullivan EV, Lim KO. cognitive impairment and early-stage Alzheimer’s disease. J Mol
In vivo brain concentrations of N-acetyl compounds, creatine, and Neurosci. 2001;17:101-18.
choline in Alzheimer disease. Arch Gen Psychiatry. 1999;56:185-92. 29. Palmer K, Fratiglioni L, Winblad B. What is mild cognitive impair-
12. Jessen F, Block W, Traber F, Keller E, Flacke S, Papassotiropoulos ment? Variations in definitions and evolution of nondemented persons
A, et al. Proton MR spectroscopy detects a relative decrease of N- with cognitive impairment. Acta Neurol Scand. 2003;107:14-20.
acetylaspartate in the medial temporal lobe of patients with AD.
Neurology. 2000;55:684-8. Declaración de conflicto de intereses.
13. Valenzuela MJ, Sachdev P. Magnetic resonance spectroscopy in AD. Declaramos no tener ningún conflicto de intereses.
Neurology. 2001;56:592-8.
Radiología. 2006;48(5):301-7 307
También podría gustarte
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Comparación de La Capacidad Diagnóstica Precoz de LosDocumento5 páginasComparación de La Capacidad Diagnóstica Precoz de LossebasAún no hay calificaciones
- Orientación y manejo del estado epiléptico en niñosDe EverandOrientación y manejo del estado epiléptico en niñosAún no hay calificaciones
- Sindrome de La Mano AjenaDocumento131 páginasSindrome de La Mano AjenaAnaaaerobiosAún no hay calificaciones
- Deterioro Cognitivo en Pacientes Con Enfermedad de ParkinsonDocumento9 páginasDeterioro Cognitivo en Pacientes Con Enfermedad de ParkinsonVanessa HernandezAún no hay calificaciones
- Enfermedad De Parkinson: Últimas EtapasDe EverandEnfermedad De Parkinson: Últimas EtapasAún no hay calificaciones
- Correlacion Entre Spect y Eval Nps en Estadio Leve AlzDocumento16 páginasCorrelacion Entre Spect y Eval Nps en Estadio Leve AlzFelipeWebster CorderoAún no hay calificaciones
- Estudio de Correlacion Histologica de LeucoaraiosiDocumento10 páginasEstudio de Correlacion Histologica de LeucoaraiosiEduardo RamírezAún no hay calificaciones
- FAB Aplicación Preliminar Española de La Batería NeuropsicológicaDocumento4 páginasFAB Aplicación Preliminar Española de La Batería NeuropsicológicaJoha Castillo SotoAún no hay calificaciones
- Actualizacio N Radiopatolo Gica en Demencias. Resonancia Magne Tica PosmortemDocumento13 páginasActualizacio N Radiopatolo Gica en Demencias. Resonancia Magne Tica PosmortemA&R NeurorehabAún no hay calificaciones
- CB 070228Documento4 páginasCB 070228Alexandra Ioana MiclausAún no hay calificaciones
- Deterioro Cognitivo Leve PDFDocumento3 páginasDeterioro Cognitivo Leve PDFDaniel0% (1)
- A. Secuencial 2014Documento11 páginasA. Secuencial 2014ELIZABETH MONDRAGON DIAZAún no hay calificaciones
- Tractografía Del Fascículo Uncinado y El Fascículo Cingulado Posterior en Pacientes Con Deterioro Cognitivo Leve y Enfermedad de AlzheimerDocumento10 páginasTractografía Del Fascículo Uncinado y El Fascículo Cingulado Posterior en Pacientes Con Deterioro Cognitivo Leve y Enfermedad de Alzheimeresme30alcazarAún no hay calificaciones
- Deterioro Cognitivo en AcV CerebelosoDocumento8 páginasDeterioro Cognitivo en AcV CerebelosoSilvina CaretoAún no hay calificaciones
- 1040-Presentación Electrónica Educativa-1156-1-10-20190214Documento9 páginas1040-Presentación Electrónica Educativa-1156-1-10-20190214Cecilio MartínAún no hay calificaciones
- Paralelismo Clínico e Imagenológico Por Resonancia Magnética de Los Procesos Inflamatorios de La Médula Espinal.Documento6 páginasParalelismo Clínico e Imagenológico Por Resonancia Magnética de Los Procesos Inflamatorios de La Médula Espinal.jahir24ghAún no hay calificaciones
- Dialnet Demencia 6143813Documento6 páginasDialnet Demencia 6143813Aviel VasquezAún no hay calificaciones
- Neuroimágenes Estructurales en Demencias para El Consultorio GeneralDocumento11 páginasNeuroimágenes Estructurales en Demencias para El Consultorio GeneralMaría Celeste BalmacedaAún no hay calificaciones
- 2549 8394 2 PBDocumento8 páginas2549 8394 2 PBFranklin MartinezAún no hay calificaciones
- Electroencephalographic Markers in DementiaDocumento6 páginasElectroencephalographic Markers in DementiasimonaemoracAún no hay calificaciones
- 6850-Texto Del Artículo-26466-1-10-20160804Documento6 páginas6850-Texto Del Artículo-26466-1-10-20160804Paula VanessaAún no hay calificaciones
- Grupo 3 - Estudio Del Colículo Inferior de Pacientes Con EsquizofreniaDocumento7 páginasGrupo 3 - Estudio Del Colículo Inferior de Pacientes Con EsquizofreniaJaneth GuzmanAún no hay calificaciones
- Mutismo en EsDocumento9 páginasMutismo en EsNathaly MoraAún no hay calificaciones
- Incomplete Cord Syndromes - En.esDocumento22 páginasIncomplete Cord Syndromes - En.esMarcos Chusin Montesdeoca100% (1)
- Benefico InhibidoresDocumento7 páginasBenefico InhibidoresJordan ReyesAún no hay calificaciones
- 1 s2.0 S0716864016300384 Main 3Documento12 páginas1 s2.0 S0716864016300384 Main 3Fernando Rodríguez BogasAún no hay calificaciones
- 40 en EsDocumento5 páginas40 en EsMAYRA PAZAún no hay calificaciones
- Neuro UrgenciasDocumento45 páginasNeuro UrgenciasEduardo Jonathan Laos PlasierAún no hay calificaciones
- Criterios de Diagnóstico de La Enfermedad de Alzheimer Aplicaciones PracticasDocumento3 páginasCriterios de Diagnóstico de La Enfermedad de Alzheimer Aplicaciones PracticasJairo Mak SalazarAún no hay calificaciones
- Perfil Neuropsicológico Del Deterioro Cognitivo LeveDocumento5 páginasPerfil Neuropsicológico Del Deterioro Cognitivo LeveWicho DíazAún no hay calificaciones
- Cisticercosis Lesiones CerebralesDocumento4 páginasCisticercosis Lesiones CerebralesJhon Guzman MaestreAún no hay calificaciones
- Medicina Nuclear - 221027 - 091418Documento5 páginasMedicina Nuclear - 221027 - 091418Lakshmi BAAún no hay calificaciones
- Anexo 11. Haddad M. Validez Diagnostica de La Exografia en El Sindrome de Tunel CarpianoDocumento6 páginasAnexo 11. Haddad M. Validez Diagnostica de La Exografia en El Sindrome de Tunel CarpianoLeticia Puerta RochaAún no hay calificaciones
- Alzheimer OkDocumento36 páginasAlzheimer OkEvelyn FloresAún no hay calificaciones
- Evaluación Ecológica en El Deterioro Cognitivo Leve y EnfermedadDocumento7 páginasEvaluación Ecológica en El Deterioro Cognitivo Leve y EnfermedadsebasAún no hay calificaciones
- Enfermedades Degenerativas Del Sistema Nervioso Central: April 2020Documento9 páginasEnfermedades Degenerativas Del Sistema Nervioso Central: April 2020Luz Andrea H. OlarteAún no hay calificaciones
- Análisis Deterioro Cognitivo LeveDocumento2 páginasAnálisis Deterioro Cognitivo LevenataliaAún no hay calificaciones
- 2 PsterTCSREMDocumento2 páginas2 PsterTCSREMBrenoAún no hay calificaciones
- El Diagnóstico Molecular de Enfermedades NeurodegenerativasDocumento13 páginasEl Diagnóstico Molecular de Enfermedades NeurodegenerativasNathWoodAún no hay calificaciones
- Deterioro Cognitivo en Pacientes Con Esclerosis MúltipleDocumento8 páginasDeterioro Cognitivo en Pacientes Con Esclerosis MúltipleAlicia HernandezAún no hay calificaciones
- Enfermedad MitocondrialDocumento4 páginasEnfermedad MitocondrialDamian WayneAún no hay calificaciones
- Resumen Protocolos de Electrodiagnostico Unal - AcmfrDocumento5 páginasResumen Protocolos de Electrodiagnostico Unal - AcmfrFisiatria UN100% (1)
- Trastornos Neuropsicológicos PDFDocumento9 páginasTrastornos Neuropsicológicos PDFCesar AqsAún no hay calificaciones
- Aart NuevDocumento19 páginasAart NuevLaura Arbelaez ArcilaAún no hay calificaciones
- Sindrome Del Tunel Carpiano Articulo 2Documento8 páginasSindrome Del Tunel Carpiano Articulo 2Cassandra LunaAún no hay calificaciones
- Amnesia Topográfica Transitoria, Descripción de 8 Casos PDFDocumento4 páginasAmnesia Topográfica Transitoria, Descripción de 8 Casos PDFPaco100% (1)
- Tratamiento de Metastasis EncefalicasDocumento8 páginasTratamiento de Metastasis EncefalicasMartin GonzalezAún no hay calificaciones
- 4-4 NPS AM - Prueba Del RelojDocumento7 páginas4-4 NPS AM - Prueba Del RelojArturo CrespoAún no hay calificaciones
- Neuroimagen Estructural en EsquizofreniaDocumento4 páginasNeuroimagen Estructural en EsquizofreniaOscar Alejandro Cardenas QuinteroAún no hay calificaciones
- 1856 PDFDocumento10 páginas1856 PDFLidia LizzieAún no hay calificaciones
- ResonanciaDocumento11 páginasResonanciaAlondra TaveraAún no hay calificaciones
- Xxix Congreso Academia Iberoamericana Neurología Pediatrica (Ainp) QUITO 2023 Abstracts de ComunicacionesDocumento5 páginasXxix Congreso Academia Iberoamericana Neurología Pediatrica (Ainp) QUITO 2023 Abstracts de Comunicacionestomas arturo tejeda rodalAún no hay calificaciones
- Memoria, Fluidez y Orientacion MEFO TESTDocumento8 páginasMemoria, Fluidez y Orientacion MEFO TESTRubhen A. Campos SepúlvedaAún no hay calificaciones
- SX RettDocumento1 páginaSX RettYadira Jiménez ZárateAún no hay calificaciones
- Noc30105 en EsDocumento4 páginasNoc30105 en EsALEJANDRA BELÉN BASTÍAS PAILALEFAún no hay calificaciones
- Manifestaciones Neurológicas en La Enfermedad de Erdheim-Chester: A Propósito de 2 CasosDocumento3 páginasManifestaciones Neurológicas en La Enfermedad de Erdheim-Chester: A Propósito de 2 CasosGerman HaroAún no hay calificaciones
- Memoria, Fluidez y OrientacionDocumento8 páginasMemoria, Fluidez y OrientacionComunidad BaltazarianaAún no hay calificaciones
- 7 MinutosDocumento7 páginas7 MinutosJulia MendozaAún no hay calificaciones
- Fisiopatologã A de La Dislexia Visuomotricidad y Alteraciones VisuoespacialesDocumento2 páginasFisiopatologã A de La Dislexia Visuomotricidad y Alteraciones Visuoespacialesjuan antonio cruz velardeAún no hay calificaciones
- Optometrico Auditivo Cuestionario PacienteDocumento6 páginasOptometrico Auditivo Cuestionario Pacientejuan antonio cruz velardeAún no hay calificaciones
- Sndromedeguillain Barr 130327121516 Phpapp01Documento32 páginasSndromedeguillain Barr 130327121516 Phpapp01jose luisAún no hay calificaciones
- Cribado Del Deterioro Cognitivo Con El Test SDMT en Formas Iniciales de Esclerosis MúltipleDocumento22 páginasCribado Del Deterioro Cognitivo Con El Test SDMT en Formas Iniciales de Esclerosis Múltiplejuan antonio cruz velardeAún no hay calificaciones
- BAT-7 Informe PsicopedagogicoDocumento6 páginasBAT-7 Informe PsicopedagogicoAngélica María100% (1)
- Numeros en Cifras y LetrasDocumento6 páginasNumeros en Cifras y Letrasjuan antonio cruz velardeAún no hay calificaciones
- PruebaDocumento11 páginasPruebaMauricio Ramírez AristizábalAún no hay calificaciones
- Microhemorragias CerebralesDocumento11 páginasMicrohemorragias Cerebralesjuan antonio cruz velardeAún no hay calificaciones
- Criterios DSM 5 para El Diagnostico Del TDAHDocumento2 páginasCriterios DSM 5 para El Diagnostico Del TDAHJavier Cotobal100% (1)
- Cobre y Colesterol en AlzheimerDocumento33 páginasCobre y Colesterol en Alzheimerjuan antonio cruz velarde100% (1)
- Cuestionario Funciones EjecutivasDocumento15 páginasCuestionario Funciones Ejecutivasjuan antonio cruz velardeAún no hay calificaciones
- Enzimopatias IntestinalesDocumento24 páginasEnzimopatias Intestinalesjuan antonio cruz velardeAún no hay calificaciones
- Trastorno DisocialDocumento92 páginasTrastorno DisocialMaribelAún no hay calificaciones
- Propuesta Actualización Ley de Autismo en Chiapas 220523 Andrea Nataren RuizDocumento10 páginasPropuesta Actualización Ley de Autismo en Chiapas 220523 Andrea Nataren RuizAndrea Nataren RuizAún no hay calificaciones
- Revista World Psychiatry PDFDocumento126 páginasRevista World Psychiatry PDFMarcoAún no hay calificaciones
- La TricotilomaniaDocumento4 páginasLa Tricotilomanialimber5Aún no hay calificaciones
- CafeinaDocumento9 páginasCafeinaLuis MorenoAún no hay calificaciones
- Depresion en El EmbarazoDocumento3 páginasDepresion en El EmbarazoMichael GuevaraAún no hay calificaciones
- FETICHISMODocumento15 páginasFETICHISMOYasmin GonzálezAún no hay calificaciones
- Historia Clinica XDDocumento13 páginasHistoria Clinica XDjavier collinAún no hay calificaciones
- Lectura ComprensivaDocumento2 páginasLectura ComprensivaDiego Fernando PaquiAún no hay calificaciones
- Sindrome UlisesDocumento23 páginasSindrome UlisesDenisse Tercero-CanoAún no hay calificaciones
- TJVMODocumento357 páginasTJVMOgonzalo ZRAún no hay calificaciones
- SylabusDocumento7 páginasSylabusAntonellaGodinezSalazarAún no hay calificaciones
- PsicopatologíasDocumento3 páginasPsicopatologíasCesar Ramirez EgasAún no hay calificaciones
- Personalidad AntisocialDocumento19 páginasPersonalidad AntisocialJosue Leiva100% (1)
- Theodore Millon Una Teoria de La Personalidad y SuDocumento13 páginasTheodore Millon Una Teoria de La Personalidad y SucRISTIANAún no hay calificaciones
- Actividad TX DepresivoDocumento6 páginasActividad TX Depresivolinachar2Aún no hay calificaciones
- DSM VDocumento32 páginasDSM VReyes Amaya KarenAún no hay calificaciones
- Trastornos Neuróticos XXXDocumento30 páginasTrastornos Neuróticos XXXCristian OreAún no hay calificaciones
- Concepto y Criterios Actuales para Diagnóstico de Demencia PDFDocumento15 páginasConcepto y Criterios Actuales para Diagnóstico de Demencia PDFvaleria caraguayAún no hay calificaciones
- Dialnet UnProyectoDeOcioYActividadFisicaParaPersonasConTra 5323359 PDFDocumento16 páginasDialnet UnProyectoDeOcioYActividadFisicaParaPersonasConTra 5323359 PDFCarolina RomeroAún no hay calificaciones
- 2Documento10 páginas2JOAQUIN VARGAS HERNANDEZAún no hay calificaciones
- Autoevaluación Psicologia ClinicaDocumento14 páginasAutoevaluación Psicologia ClinicaLISAURA MEDINAAún no hay calificaciones
- La NomofobiaDocumento18 páginasLa NomofobiaMarjhori Olortegui JaraAún no hay calificaciones
- DSM IV R Criterios DiagnosticosDocumento10 páginasDSM IV R Criterios Diagnosticosnorthcarolina1Aún no hay calificaciones
- Guiasap 033 AnsiedadDocumento72 páginasGuiasap 033 AnsiedadSezar Xose Jose Lanes KanalerAún no hay calificaciones
- Trastorno Depresivo FinDocumento56 páginasTrastorno Depresivo FinStephany Merino DiazAún no hay calificaciones
- Lis Tarea3 Psicopatologia 1Documento11 páginasLis Tarea3 Psicopatologia 1Lismak del Carmen Peña ReyesAún no hay calificaciones
- Desviaciones Del Comportamiento SexualDocumento82 páginasDesviaciones Del Comportamiento SexualTomas Mendoza CanchariAún no hay calificaciones
- Laurent-Big FelicidadDocumento16 páginasLaurent-Big FelicidadMariela FerraroAún no hay calificaciones
- Apuntes Psicología ClínicaDocumento8 páginasApuntes Psicología ClínicacarolinaAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Cardiología y enfermedades cardiovascularesDe EverandCardiología y enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Sana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónDe EverandSana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónCalificación: 5 de 5 estrellas5/5 (4)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- Muchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)De EverandMuchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)Calificación: 4 de 5 estrellas4/5 (475)
- Altas Dosis: Los efectos milagrosos de dosis extremadamente altas de vitamina D3. El gran secreto que la industria farmacéutica quiere ocultarle.De EverandAltas Dosis: Los efectos milagrosos de dosis extremadamente altas de vitamina D3. El gran secreto que la industria farmacéutica quiere ocultarle.Calificación: 5 de 5 estrellas5/5 (4)
- La Dieta Mediterránea Para Principiantes, Guía Paso A Paso Con Recetas Para Comer Mejor Y Bajar De PesoDe EverandLa Dieta Mediterránea Para Principiantes, Guía Paso A Paso Con Recetas Para Comer Mejor Y Bajar De PesoCalificación: 5 de 5 estrellas5/5 (2)
- Shiatsu: Conozca las técnicas y tratamientos de una de las terapias más antiguasDe EverandShiatsu: Conozca las técnicas y tratamientos de una de las terapias más antiguasAún no hay calificaciones
- TDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosDe EverandTDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosCalificación: 4 de 5 estrellas4/5 (8)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- El Libro de la Dieta Antiinflamatoria: Plan de 14 días para Sanar el Sistema inmunológico y Sentirte Mejor que NuncaDe EverandEl Libro de la Dieta Antiinflamatoria: Plan de 14 días para Sanar el Sistema inmunológico y Sentirte Mejor que NuncaCalificación: 4.5 de 5 estrellas4.5/5 (14)
- Psicópatas seriales: Un recorrido por su oscura e inquietante naturalezaDe EverandPsicópatas seriales: Un recorrido por su oscura e inquietante naturalezaCalificación: 4 de 5 estrellas4/5 (3)
- La acupuntura para prevenir y curar las enfermedadesDe EverandLa acupuntura para prevenir y curar las enfermedadesAún no hay calificaciones
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Fundamentos de ginecología y obstetriciaDe EverandFundamentos de ginecología y obstetriciaCalificación: 3.5 de 5 estrellas3.5/5 (2)
- ¿Cómo Prevenir O Curar El Cáncer?: ¡Conozca Los 3 Métodos Probados Contra El Cáncer!De Everand¿Cómo Prevenir O Curar El Cáncer?: ¡Conozca Los 3 Métodos Probados Contra El Cáncer!Aún no hay calificaciones
- ABC de los procedimientos médicos básicos: Una guía de aprendizaje y enseñanza para profesionales de medicinaDe EverandABC de los procedimientos médicos básicos: Una guía de aprendizaje y enseñanza para profesionales de medicinaCalificación: 4 de 5 estrellas4/5 (4)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Cómo dormir bien: Cómo reconocer, prevenir y tratar las dificultades para dormir bienDe EverandCómo dormir bien: Cómo reconocer, prevenir y tratar las dificultades para dormir bienCalificación: 5 de 5 estrellas5/5 (1)
- Limpiar, Nutrir, Reparar: Adiós a Las Enfermedades, En Tres Pasos NaturalesDe EverandLimpiar, Nutrir, Reparar: Adiós a Las Enfermedades, En Tres Pasos NaturalesCalificación: 4 de 5 estrellas4/5 (6)
- El autismo: Reflexiones y pautas para comprenderlo y abordarloDe EverandEl autismo: Reflexiones y pautas para comprenderlo y abordarloCalificación: 4 de 5 estrellas4/5 (7)
- Candidiasis, tu amiga del alma: Nueva información sobre la enfermedad que afecta a muchas personas sin saberloDe EverandCandidiasis, tu amiga del alma: Nueva información sobre la enfermedad que afecta a muchas personas sin saberloCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Cómo curar la artritis: Curación natural de la artritis, la artrosis, la gota y la fibromialgiaDe EverandCómo curar la artritis: Curación natural de la artritis, la artrosis, la gota y la fibromialgiaCalificación: 5 de 5 estrellas5/5 (17)
- El daño cerebral invisible (3ª edición, revisada y actualizada): Alteraciones cognitivas en TCE, ictus y otras lesiones cerebralesDe EverandEl daño cerebral invisible (3ª edición, revisada y actualizada): Alteraciones cognitivas en TCE, ictus y otras lesiones cerebralesCalificación: 4.5 de 5 estrellas4.5/5 (9)