Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Repaso Clasificación Da Materia
Cargado por
Alternativa Canguesa de EsquerdasDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Repaso Clasificación Da Materia
Cargado por
Alternativa Canguesa de EsquerdasCopyright:
Formatos disponibles
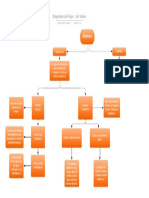
Clasificación de la materia.
Mezclas heterogéneas
1. Relaciona las características de la siguiente lista con las partículas subatómicas a las que
hacen referencia. ¡Atención: algunas de ellas pueden aplicarse a más de una partícula
subatómica !
carga negativa, carga positiva, no tiene carga eléctrica, masa parecida a la del protón,
masa unas 2 000 veces mayor que la del electrón, se encuentra en el núcleo,
tiene muy poca masa en comparación con las otras partículas subatómicas
Electrón Neutrón Protón
2. Completa la tabla con los ejemplos de sistemas materiales de la siguiente lista:
agua con aceite, agua de mar, agua pura, aire, azufre, café (bebida), dióxido de carbono,
granito, hierro, latón, leche de vaca, mercurio, metano, nitrógeno, oxígeno, sal común
Sustancias puras Mezclas
elementos compuestos homogéneas heterogéneas
3. Completa la tabla sobre tipos de dispersiones con los conceptos de la lista:
aerosol, aerosol líquido, cerveza, emulsión, emulsión sólida o gel, espuma,
espuma sólida, flan, humo, leche, merengue, niebla, piedra preciosa coloreada,
pintura, sol o suspensión coloidal, sol sólido
Medio de dispersión Fase dispersa Tipo de dispersión Ejemplo
sólido
sólido líquido
gas
sólido
líquido líquido
gas
sólido
gas
líquido
4. ¿Qué técnica de separación utilizarías para separar las siguientes mezclas? Escoge la
opción correcta a partir de la lista y escríbela junto a cada mezcla.
centrifugación, decantación, filtración, imantación, sublimación, tamizado
a) agua con aceite:
b) arena, grava y limos:
c) virutas de hierro y serrín:
d) agua y arena:
e) arena y yodo:
f) componentes de la sangre:
5. Fíjate en el siguiente cuadro, que resume algunas propiedades características
de cinco sustancias puras, y marca con una cruz la respuesta correcta de las
preguntas que hay a continuación.
Temperatura Temperatura Calor
Sustancia Densidad Dureza
Composición de fusión de ebullición específico
pura (kg/m3) (Mohs)
(ºC) (ºC) kcal/kgK
agua H2 0 1000 o 100 1 -
alcohol etílico C 2 H60 1190 -117 78 0,58 -
cobre Cu 8 960 1083 2 600 0,093 -
carbono (diamante) c 2 260 3 727 4830 0,689 10
cuarzo Si02 3 180 1410 2 355 0,19 7
•¿Cuál es la sustancia más densa?
a) El agua.
b) El alcohol etílico.
c) El cobre.
•¿Cuál es la sustancia menos densa?
a) El agua.
b) El alcohol etílico.
c) El carbono (diamante).
•¿Cuáles de estas sustancias encontraremos en estado sólido a 20 ºC?
a) El agua y el alcohol etílico.
b) Solo el cuarzo.
c) El carbono, el cobre y el cuarzo.
•Si tenemos a 20 ºC una muestra de 200 g de cada una de las sustancias, ¿a
cuál tendremos que suministrar más calor para aumentar su temperatura
hasta los 25 ºC?
a) Al agua porque tiene mayor calor específico.
b) Al cobre porque tiene menor calor específico.
c) A ninguna, todas se calientan igual.
•¿Podrá el cuarzo rayar al diamante?
a) Sí.
b) No, no podrá, porque la dureza del cuarzo es menor que la del diamante.
c) Dependerá de la temperatura a la que se encuentren.
6. Indica si las siguientes definiciones corresponden a una sustancia pura, una mezcla
homogénea, una mezcla heterogénea o una dispersión.
a) Sustancia que tiene densidad, punto de fusión y color variables y que al observarla
a simple vista tiene un aspecto distinto según la parte que miremos:
b) Sustancia con punto de fusión variable que muestra el mismo aspecto en todo su
contenido:
c) Sustancia que tiene una composición química constante y unas propiedades
características invariables:
d) Sustancia que tiene una densidad y un punto de fusión variable y que al observarla
al microscopio se distinguen unas gotas de aspecto distinto al resto del sistema:
7. Completa las definiciones sobre técnicas de separación con las palabras de la lista.
cedazos, centrífuga, centrifugación, decantación, densidad, densidades, filtración, filtro,
fluido, imán, imantación, mezcla, miscibles, sólidos, tamaño, tamices, tamizado
a) La se define como separación de uno o más elementos de
un componente (líquido o gas), haciendo pasar este último a través de
un
que retiene los sólidos en su superficie.
b) La es un método para separar dos componentes líquidos no de
diferente , que forman una mezcla heterogénea.
c) La consiste en aprovechar la fuerza para separar los
componentes de una mezcla según sus distintas .
d) El es la separación de partículas sólidas de diferente con la
ayuda de o .
e) La consiste en separar los componentes magnéticos de una
mediante un .
8. Clasifica los siguientes materiales en mezclas heterogéneas naturales o sintéticas:
algodón, cerámica, pintura, lana, papel,
arcilla, madera, piel, plástico, seda
Materiales naturales Materiales artificiales
9. Completa las siguientes definiciones con las palabras de la lista.
a simple vista, átomos, componente, compuesto, distintos tipos, elemento,
instrumentos ópticos, lupa, mezcla, mezcla heterogénea, mezcla homogénea,
microscopio óptico, solución, sustancia pura
a) Una es un sistema material homogéneo constituido por un único
componente.
b) Un es una sustancia pura formada por la combinación de iguales.
c) Un es una sustancia pura formada por la combinación de de
átomos.
d) Una es un sistema material constituido por más de un
e) Una o es un sistema material formado por dos o más
componentes que no se pueden distinguir ni con la ayuda de
f) Una es un sistema material formado por más de un componente, del
cual se pueden distinguir los diferentes constituyentes a simple vista, con la ayuda de una
o utilizando un
10. Indica cuál es el soluto y cuál es el disolvente en las siguientes disoluciones:
Solución Soluto Disolvente
sal en agua
vinagre (3 gramos de ácido acético en 100 g de agua)
lejía (100 gramos de hipoclorito de sodio en 1 litro
de disolución acuosa)
11. Clasifica las sustancias de la lista en función de si son solubles en agua o no o si se
trata de líquidos inmiscibles con el agua:
aceite, ácido acético, ácido benzoico, ácido clorhídrico, alcohol, amoníaco, azúcar,
azufre, carbón, gasolina, metanol, oxígeno, sal, yodo
Sustancias solubles Sustancias insolubles Líquidos inmiscibles
en agua en agua con el agua
12. Marca con una X la respuesta correcta.
•Una solución es:
a) una mezcla heterogénea.
b) una mezcla homogénea.
c) un compuesto.
d) un elemento.
•El disolvente:
a) es el componente minoritario de la solución.
b) es el componente mayoritario de la solución.
c) siempre es un líquido.
d) siempre es un sólido.
•El soluto:
a) es el componente minoritario de la solución.
b) es el componente mayoritario de la solución.
c) siempre es un líquido.
d) siempre es un sólido.
•De una solución de agua con sal podemos decir que:
a) la sal es el disolvente.
b) el agua es el soluto.
c) el agua es el disolvente.
d) no existe tal solución.
•Una aleación es una solución en la que:
a) el soluto es aire.
b) el disolvente y el soluto son gases.
c) el disolvente y el soluto son líquidos a 25 ºC.
d) el disolvente y el soluto son sólidos a 25 ºC.
•Un ejemplo de solución en la que tanto el disolvente como el soluto son gases es:
a) el agua de mar.
b) el agua con gas.
c) el aire.
d) el vino.
•Una solución saturada es aquella en la que:
a) si añadimos más soluto ya no se disuelve.
b) hay muy poco soluto y si añadimos más se sigue disolviendo.
c) hay la misma cantidad de soluto que de disolvente.
d) hay grasas saturadas.
13. Completa los siguientes textos sobre la solubilidad con los conceptos de la lista:
cantidad máxima, disolvente, disolver, inmiscibles, insoluble,
saturada, sobresaturada, solubilidad, soluto
a) La solubilidad de un en un es la de soluto que
podemos en una determinada cantidad del disolvente a una
tempera-tura concreta.
b) Una solución se encuentra si ya no cabe más soluto en el disolvente. Si la
can- tidad de soluto es superior a la , la solución está
c) Una sustancia es en un disolvente si su solubilidad en él es muy pequeña.
d) Dos líquidos que no pueden mezclarse son
14. Marca con una X la respuesta correcta:
• La concentración de una solución es...
e) la cantidad de disolvente en relación con una determinada cantidad de solución.
f) la cantidad de soluto en relación con una determinada cantidad de solución.
g) la suma de la cantidad de soluto y de disolvente.
h) el hecho de que en una solución haya mucha cantidad de disolvente.
• En una solución de 15 g/L de sal tenemos ...
a) 15 g de sal en un litro de solución.
b) 15 g de solución en un litro de sal.
c) 15 g de sal de una densidad tal que ocupa 1 L.
d) 15 litros de sal.
• Si tenemos 50 g de azúcar en 200 g de solución, la concentración de la
solución en porcentaje de masa es...
a) 50 % .
b) 4 %.
c) 25 % .
d) 0,25 % .
También podría gustarte
- Actividades 2020-2021Documento3 páginasActividades 2020-2021maria moyano caleroAún no hay calificaciones
- Hoja 3 - 2ºESO - Diversidad de La Materia - 22-23Documento2 páginasHoja 3 - 2ºESO - Diversidad de La Materia - 22-23Nacho Picazo LópezAún no hay calificaciones
- Capitulo5 Propiedades de Etanol-AguaDocumento3 páginasCapitulo5 Propiedades de Etanol-AguaSantiago Alfredo MoscosoAún no hay calificaciones
- Sistemas Materiales Guia de EjerciciosDocumento8 páginasSistemas Materiales Guia de EjerciciosJosé Manuel Grande89% (9)
- Pendientes 22-23 Hoja 2Documento3 páginasPendientes 22-23 Hoja 2Javier GonzálezAún no hay calificaciones
- Sistemas Materiales GuiaDocumento7 páginasSistemas Materiales Guiaenderseek100% (1)
- Repaso Verano Hoja 2 FYQ3 Mezclas y SPDocumento2 páginasRepaso Verano Hoja 2 FYQ3 Mezclas y SPmariaAún no hay calificaciones
- Ejercicios Tema 3Documento2 páginasEjercicios Tema 3Pasar ContactosAún no hay calificaciones
- Repaso FyQ Ex 1 Eva 2Documento3 páginasRepaso FyQ Ex 1 Eva 2Sara GaonaAún no hay calificaciones
- REPASO SolucionesDocumento5 páginasREPASO Solucionesgema gonzalezAún no hay calificaciones
- Pruebaaula 3Documento2 páginasPruebaaula 3Eduardo Valera CalvoAún no hay calificaciones
- Guia de MezclasDocumento2 páginasGuia de MezclasJacqueline Betancourtt MejíasAún no hay calificaciones
- Ejercicios Sistemas MaterialesDocumento7 páginasEjercicios Sistemas MaterialesKarin Johanna ColomboAún no hay calificaciones
- Evaluacion DecimoDocumento2 páginasEvaluacion DecimoOsvaldo100% (1)
- Guia Resuelta Clase 1Documento20 páginasGuia Resuelta Clase 1Maria Julia GomezAún no hay calificaciones
- REPASO - EjerciciosDocumento3 páginasREPASO - Ejerciciosgema gonzalezAún no hay calificaciones
- MEZCLASDocumento3 páginasMEZCLASInma InmaAún no hay calificaciones
- Quimica 2.0Documento8 páginasQuimica 2.0Maria PalmaAún no hay calificaciones
- Evaluación N°3 de Química - DisolucionesDocumento3 páginasEvaluación N°3 de Química - DisolucionesCamila AlvaradoAún no hay calificaciones
- Fyq Tema 3, 3ESODocumento7 páginasFyq Tema 3, 3ESOnupynira2009Aún no hay calificaciones
- Sistema MaterialesDocumento2 páginasSistema MaterialesDany GoycoAún no hay calificaciones
- Trabajo Práctico #1 - 2014Documento4 páginasTrabajo Práctico #1 - 2014Micaela MenbribeAún no hay calificaciones
- Ejercicios Tema 3Documento11 páginasEjercicios Tema 3gema gonzalezAún no hay calificaciones
- Copia de QUÍMICA I. Grupo Nro. 05 Trabajo Grupal Semana 01Documento5 páginasCopia de QUÍMICA I. Grupo Nro. 05 Trabajo Grupal Semana 01Alonso JustinianoAún no hay calificaciones
- Taller 5 MezclasDocumento3 páginasTaller 5 MezclasJulián Mesüt GöAún no hay calificaciones
- Cuestionario 1.1 Preparar Muestras para La Ejecución de Los Análisis Teniendo en Cuenta Parámetros A DeterminarDocumento3 páginasCuestionario 1.1 Preparar Muestras para La Ejecución de Los Análisis Teniendo en Cuenta Parámetros A DeterminarSusana MontealegreAún no hay calificaciones
- Ejercicios Sistemas MaterialesDocumento5 páginasEjercicios Sistemas MaterialessarayrafaAún no hay calificaciones
- Guia de Reforzamiento de Clasificación de La Materia 7Documento5 páginasGuia de Reforzamiento de Clasificación de La Materia 7SANDRA IVONNE ANDRADES TABILOAún no hay calificaciones
- PRUEBA DE UNIDAD N°1 II° MEDIO QUÍMICA f1Documento5 páginasPRUEBA DE UNIDAD N°1 II° MEDIO QUÍMICA f1Leslie ParraAún no hay calificaciones
- Prueba Disoluciones FD Quimica 4to MedioDocumento4 páginasPrueba Disoluciones FD Quimica 4to MediomargaritaAún no hay calificaciones
- EJERCICIOS 1.1 - Capitulo 1. Clasificacion de La Materia-2019 PDFDocumento2 páginasEJERCICIOS 1.1 - Capitulo 1. Clasificacion de La Materia-2019 PDFMartin ZatarainAún no hay calificaciones
- DECIMOS - QUIMICA TALLER 1-1-CopiarDocumento3 páginasDECIMOS - QUIMICA TALLER 1-1-CopiarDJ FAVAún no hay calificaciones
- Prueba Septimo MezclasDocumento4 páginasPrueba Septimo MezclasAlejandro Ernesto Muñoz VasquezAún no hay calificaciones
- Guía Clasificación de La Materia Química 10Documento2 páginasGuía Clasificación de La Materia Química 10AdrianaAún no hay calificaciones
- Taller N °4 SolucionesDocumento4 páginasTaller N °4 SolucionesFeña Ibarra FuentesAún no hay calificaciones
- Ejercicios: Unidad IDocumento2 páginasEjercicios: Unidad IBenja MenendezAún no hay calificaciones
- Prueba SamuelDocumento4 páginasPrueba SamueleinstenioAún no hay calificaciones
- Soluciones Tema 3Documento8 páginasSoluciones Tema 3Marta De Diego GómezAún no hay calificaciones
- FENÓMENOSDocumento6 páginasFENÓMENOSJorge S GhmAún no hay calificaciones
- Ud02 - Las DisolucionesDocumento14 páginasUd02 - Las DisolucionesJorge Vázquez NuñoAún no hay calificaciones
- Evaluacion Formativa 2 NM2 Quimica - 2020Documento3 páginasEvaluacion Formativa 2 NM2 Quimica - 2020DANNA MARCELA HERRERA BELTRAN (DOCENTE QUIMICA)Aún no hay calificaciones
- Guía #4 SUSTANCIAS PURAS Y MEZCLAS 7°Documento2 páginasGuía #4 SUSTANCIAS PURAS Y MEZCLAS 7°Kassandra PortillaAún no hay calificaciones
- Evaluación Nº2 de Química-Propiedades Generales de KaDocumento5 páginasEvaluación Nº2 de Química-Propiedades Generales de KaAner BelloAún no hay calificaciones
- Prueba Unidad 7 2018Documento4 páginasPrueba Unidad 7 2018Cynthia AvgAún no hay calificaciones
- U1 II Mini ControlDocumento3 páginasU1 II Mini ControlLeslie ParraAún no hay calificaciones
- Trabajo Práctico 1 RevDocumento4 páginasTrabajo Práctico 1 RevYaki AlancayAún no hay calificaciones
- Taller de Química #1Documento3 páginasTaller de Química #1Ana Nomberto LuperdiAún no hay calificaciones
- Evaluacion 10d Metodos de Separacion de MezclasDocumento2 páginasEvaluacion 10d Metodos de Separacion de MezclasSergio Cruz100% (4)
- Ev Formativa 2 Medio QuimicaDocumento3 páginasEv Formativa 2 Medio Quimicanatalia osorioAún no hay calificaciones
- Guía #4 SUSTANCIAS PURAS Y MEZCLAS 7°BÁSICODocumento4 páginasGuía #4 SUSTANCIAS PURAS Y MEZCLAS 7°BÁSICOJohanna Manzano de Urra100% (4)
- Prueba Mezclas BDocumento5 páginasPrueba Mezclas BElsa Cortes100% (3)
- Guía de Ejercicios UC1Documento6 páginasGuía de Ejercicios UC1nikol dayanna henao barreraAún no hay calificaciones
- EJE 2 - Sistemas MaterialesDocumento3 páginasEJE 2 - Sistemas Materialesalamparon0% (1)
- Prueba C2 Segundo MedioDocumento10 páginasPrueba C2 Segundo MediodanielaAún no hay calificaciones
- Guia de Nivelacion Quimica Grado 8° La MezclaDocumento5 páginasGuia de Nivelacion Quimica Grado 8° La MezclajosafathAún no hay calificaciones
- GUIA N°2 Solubilidad RENOVADODocumento12 páginasGUIA N°2 Solubilidad RENOVADOfelipe jara0% (1)
- Practica 1Documento5 páginasPractica 1Jeshua Rojas EnriquezAún no hay calificaciones
- Taller Final de AnaliticaDocumento13 páginasTaller Final de AnaliticaEdward AlexanderAún no hay calificaciones
- Examen Química Ud4Documento3 páginasExamen Química Ud4Alberto Sanchez de la Campa RodriguezAún no hay calificaciones
- Formato Permiso Espacio Confinado V1Documento3 páginasFormato Permiso Espacio Confinado V1Marcela Quiroz BahamondesAún no hay calificaciones
- Ejercicios Segunda UnidadDocumento4 páginasEjercicios Segunda UnidadMiriam valenzuelaAún no hay calificaciones
- 1.-Formula y Nombre de Compuestos QuimicosDocumento9 páginas1.-Formula y Nombre de Compuestos QuimicosDaniel Hernandez LopezAún no hay calificaciones
- Trabajo Practico 2Documento6 páginasTrabajo Practico 2Andrew CarrasqueroAún no hay calificaciones
- Practica VII Cromatografia FlashDocumento19 páginasPractica VII Cromatografia FlashAngelica UsugaAún no hay calificaciones
- Quimica Proyecto 2doDocumento5 páginasQuimica Proyecto 2doRichard LopezAún no hay calificaciones
- Laboratorio Tabla PeriodicaDocumento4 páginasLaboratorio Tabla PeriodicaNaydelin LifonzoAún no hay calificaciones
- Caracterización de Alcoholes y HaloalcanosDocumento12 páginasCaracterización de Alcoholes y HaloalcanosSebastian Ramirez AreizaAún no hay calificaciones
- P8 - Reporte - Ley FaradayDocumento3 páginasP8 - Reporte - Ley FaradayDemian MendozaAún no hay calificaciones
- Examen Parcial - Semana 4 - CB - SEGUNDO BLOQUE-FUNDAMENTOS DE QUIMICA - (GRUPO6) 2Documento5 páginasExamen Parcial - Semana 4 - CB - SEGUNDO BLOQUE-FUNDAMENTOS DE QUIMICA - (GRUPO6) 2Johana MorenoAún no hay calificaciones
- GUIA # 4 Funciones Quimicas y Grupos Funcionales Grado, 10-01 Asignatura de QuimicaDocumento10 páginasGUIA # 4 Funciones Quimicas y Grupos Funcionales Grado, 10-01 Asignatura de QuimicaJuan Jose MaestreAún no hay calificaciones
- Informe Laboratorio3Documento12 páginasInforme Laboratorio3José Alberto Moscoso MoinaAún no hay calificaciones
- Diagrama de FlujoDocumento1 páginaDiagrama de FlujoAlex David Roldan CevallosAún no hay calificaciones
- CASTRO GONZALES Y MORI BARTRA - TESIS ÚltimoDocumento102 páginasCASTRO GONZALES Y MORI BARTRA - TESIS ÚltimoFlavio Cesar Riofrio CardenasAún no hay calificaciones
- Convergencia de Las Rutas MetabólicasDocumento9 páginasConvergencia de Las Rutas MetabólicasHelen AlcivarAún no hay calificaciones
- Ellingham EjerciciosDocumento14 páginasEllingham EjerciciosBart FrienderAún no hay calificaciones
- Ejercicos PirometalurgiaDocumento4 páginasEjercicos Pirometalurgiadaniel carhuallanqui100% (1)
- Ejemplos Problemas Masa Atomica, Composicion CentesimalDocumento14 páginasEjemplos Problemas Masa Atomica, Composicion CentesimalbfvAún no hay calificaciones
- Eacv U1 A2 CoscDocumento8 páginasEacv U1 A2 CoscBazar ArteAún no hay calificaciones
- CurtiembresDocumento66 páginasCurtiembresARLY MOLINAAún no hay calificaciones
- Material CerámicoDocumento18 páginasMaterial Cerámicodrqqzwqv87Aún no hay calificaciones
- Informe de Hidrocarburos.Documento11 páginasInforme de Hidrocarburos.giselleAún no hay calificaciones
- Origen y Evolución de La VidaDocumento6 páginasOrigen y Evolución de La VidaCRUZ GOMEZ DOMINGUEZAún no hay calificaciones
- 5 Reacciones de Sustitución Nucleófila y EliminaciónDocumento24 páginas5 Reacciones de Sustitución Nucleófila y EliminaciónValeria Laura Vera EscobarAún no hay calificaciones
- Sexto Examen Cepre 2021-IbDocumento11 páginasSexto Examen Cepre 2021-IbGustavo Rolando Llatas DelgadoAún no hay calificaciones
- Manometría GR E1 - Laboratorio Mecanica de FluidosDocumento14 páginasManometría GR E1 - Laboratorio Mecanica de FluidosJaviera CasillaAún no hay calificaciones
- Problem 30, 31 y 32Documento14 páginasProblem 30, 31 y 32Adrian VergaraAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (206)
- Cómo Aprender por tu Cuenta: Los Secretos de los Mejores Autodidáctas para Acelerar tu Aprendizaje sin Depender de los DemásDe EverandCómo Aprender por tu Cuenta: Los Secretos de los Mejores Autodidáctas para Acelerar tu Aprendizaje sin Depender de los DemásCalificación: 4 de 5 estrellas4/5 (10)
- Manual de ortopedia maxilar: Modelo diagnóstico de maloclusiones para pacientes en crecimientoDe EverandManual de ortopedia maxilar: Modelo diagnóstico de maloclusiones para pacientes en crecimientoCalificación: 4.5 de 5 estrellas4.5/5 (14)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Tu futuro: Consejos de una Premio Nobel a los jóvenesDe EverandTu futuro: Consejos de una Premio Nobel a los jóvenesCalificación: 3.5 de 5 estrellas3.5/5 (5)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Confección de cojines y ropa de hogar. TCPF0309De EverandConfección de cojines y ropa de hogar. TCPF0309Aún no hay calificaciones
- PREM de Pediatría: capacitación para el ENARMDe EverandPREM de Pediatría: capacitación para el ENARMCalificación: 1 de 5 estrellas1/5 (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Mini granja para principiantes: La guía definitiva para convertir su jardín en una mini granja y crear un jardín orgánico autosuficienteDe EverandMini granja para principiantes: La guía definitiva para convertir su jardín en una mini granja y crear un jardín orgánico autosuficienteCalificación: 2 de 5 estrellas2/5 (1)
- Limpiar, Nutrir, Reparar: Adiós a Las Enfermedades, En Tres Pasos NaturalesDe EverandLimpiar, Nutrir, Reparar: Adiós a Las Enfermedades, En Tres Pasos NaturalesCalificación: 4 de 5 estrellas4/5 (6)
- Electricidad: Fundamentos y problemas de electrostática, corriente continua, electromagnetiDe EverandElectricidad: Fundamentos y problemas de electrostática, corriente continua, electromagnetiCalificación: 3.5 de 5 estrellas3.5/5 (5)