Documentos de Académico
Documentos de Profesional
Documentos de Cultura
12 FII Calores Especificos 2022
Cargado por
STEPHANIE PEREGRINA RAMOS ALARCONTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
12 FII Calores Especificos 2022
Cargado por
STEPHANIE PEREGRINA RAMOS ALARCONCopyright:
Formatos disponibles
LABORATORIO DE FÍSICA II – 12ª Edición DAFI – FCF – UNMSM
CALOR ESPECÍFICO
EXPERIENCIA N° 12
Las moléculas tienen una estructura interna porque están compuestas de átomos que tienen diferentes grados de
libertad. La energía cinética almacenada en estos grados de libertad internos no contribuye a la temperatura de la
sustancia sino a su calor específico.
I. OBJETIVO
Determinar el calor específico de objetos sólidos
EQUIPOS / MATERIALES
1 Equipo de calentamiento 2 sugetador ( Clamp )
1 Soporte universal 1 Varilla metálica
1 Calorímetro de mezclas 1 Termómetro
1 Probeta graduada, 100 ml 1 Vaso de precipitado, 500 ml
1 Balanza Agua potable
Muestras metálicas
III. FUNDAMENTO TEÓRICO
La cantidad de calor Q disipado o absorbido por cuerpos de la misma sustancia es
directamente proporcional a la variación de la temperatura T:
(1)
También, el calor cedido o absorbido por cuerpos distintos, pero de la misma sustancia,
son directamente proporcionales a la masa m:
(2)
El calor específico (c ) de un cuerpo se define como:
(3)
Donde dQ es el elemento de la cantidad de calor que intercambian los cuerpos con el
medio que lo rodea, mientras que dT es el elemento de variación de temperatura que
experimentan los cuerpos.
EXP. N° 11 – CALOR ESPECÍFICO 56
LABORATORIO DE FÍSICA II – 12ª Edición DAFI – FCF – UNMSM
La cantidad de calor transferida/absorbida por el cuerpo depende de las condiciones
en que se ejecuta el proceso. En la presente experiencia se utilizará el método de
mezclas y el proceso de medida se realizará a presión constante.
Medida del calor especifico de una muestra sólida
Método de mezclas
En un sistema convenientemente aislado para evitar perdida de calor, que contiene en
su interior agua cuya masa fue previamente medida, y un termómetro sumergido en el
para medir la temperatura inicial del agua, se introduce la muestra previamente
calentada, entonces la muestra de mayor temperatura transfiere energía calorífica al
agua que se encuentra en el calorímetro, Observándose luego un equilibrio térmico o
temperatura final entre la muestra y el agua.
La ecuación que rige este sistema está dado de la siguiente, manera
(4)
En el equilibrio térmico
(5)
Donde
Masa de la muestra. Masa del agua, masa del calorímetro
IV. PROCEDIMIENTO
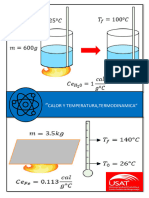
DETERMINACIÓN DEL CALOR ESPECÍFICO DE UN METAL
1. Dentro del calorímetro, vierta 150 ml de agua ( )y
mida la temperatura inicial del sistema Ti.
2. Con la balanza de tres brazos determine la masa del
cilindro de metal mm y anote este valor en la tabla 1.
3. En vaso de pirex vierta 500 ml de agua. Suspenda el
termómetro y los cilindros de metal como se muestra en
la figura y proceda a calentar el sistema con el mechero
bunsen hasta que el agua hierva a la temperatura de
, mantener la muestra durante 7 minutos,
EXP. N° 11 – CALOR ESPECÍFICO 57
LABORATORIO DE FÍSICA II – 12ª Edición DAFI – FCF – UNMSM
4. Retire la muestra del pirex e Introduzca rápidamente dentro del calorímetro y cierre
herméticamente y espere 2 minutos para que llegue al equilibrio térmico
(temperatura final).
5. Con un termómetro mida la temperatura del sistema en equilibrio TF.
6. Con la ecuación (5) y los valores de la tabla 1, determine el calor especifico de cada
muestra
Tabla 1
Muestra
V. EVALUACIÓN
1. Defina el calor específico de un material, cual es la diferencia con capacidad
calorífica.
2. Enumere y explique tres fuentes de error cometidos en este experimento.
3. ¿Qué es un calorímetro? y explique su uso.
4. ¿Cuál sería la diferencia si en vez de agua usamos aceite para determinar el calor
específico del aluminio?
5. Investigue cuántos tipos de calorímetros hay en el mercado y cuál es el uso de
cada uno de ellos.
VI. CONCLUSIONES
………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………
EXP. N° 11 – CALOR ESPECÍFICO 58
También podría gustarte
- Informe Lab Física 2 Experiencia N°9Documento4 páginasInforme Lab Física 2 Experiencia N°9Anthony GodoyAún no hay calificaciones
- Informe-Calor Específico 1Documento8 páginasInforme-Calor Específico 1Jhilmar Arroyo UribeAún no hay calificaciones
- Informe #9Documento9 páginasInforme #9Gary E. OrtizAún no hay calificaciones
- Informe Lab de Fisica II - Calor EspecificoDocumento8 páginasInforme Lab de Fisica II - Calor EspecificoPIERO MATIAS HERRERA SUAREZAún no hay calificaciones
- Física S9Documento10 páginasFísica S9ISAAC ELIAS REGALADO RAMIREZAún no hay calificaciones
- Informe Final N°9 Lab Física IIDocumento8 páginasInforme Final N°9 Lab Física IIGianfrancoAún no hay calificaciones
- Exerimento 9 - Calor Específico - Grupo 3 - Laboratorio de Física LLDocumento16 páginasExerimento 9 - Calor Específico - Grupo 3 - Laboratorio de Física LLJesús SolisAún no hay calificaciones
- Laboratorio N°05 - Calor Específico en Los Cuerpos SólidosDocumento16 páginasLaboratorio N°05 - Calor Específico en Los Cuerpos SólidosJosé Enmanuel Guevara GamarraAún no hay calificaciones
- Pre Informe Ondas EstacionariasDocumento4 páginasPre Informe Ondas Estacionariasemmanuel gonzalezAún no hay calificaciones
- GUÍA N°05 - Calor Específico en Los Cuerpos SólidosDocumento7 páginasGUÍA N°05 - Calor Específico en Los Cuerpos SólidosAngel Fernando Huamanchumo BarreraAún no hay calificaciones
- Exp9 - GRUPO 2-2-8Documento7 páginasExp9 - GRUPO 2-2-8GianfrancoAún no hay calificaciones
- GUÍA N°05 - Calor Específico en Los Cuerpos SólidosDocumento9 páginasGUÍA N°05 - Calor Específico en Los Cuerpos SólidosLiza Junco FardyAún no hay calificaciones
- Pre Informe 5Documento4 páginasPre Informe 5emmanuel gonzalezAún no hay calificaciones
- Laboratorio 09 Calorimetría PDFDocumento26 páginasLaboratorio 09 Calorimetría PDFJAIME REDOLFO YUPANQUIAún no hay calificaciones
- INFORME-N10FISICA UnmsmDocumento16 páginasINFORME-N10FISICA UnmsmhollyAún no hay calificaciones
- Informe N°8Documento12 páginasInforme N°8FABIAN DIAZ DIAZAún no hay calificaciones
- Calor EspecificoDocumento5 páginasCalor EspecificojuanAún no hay calificaciones
- Reporte 4. MEDICIÓN DE CALOR LIBERADO EN REACCIONES QUÍMICASDocumento7 páginasReporte 4. MEDICIÓN DE CALOR LIBERADO EN REACCIONES QUÍMICASDeisy Cielo RamirezAún no hay calificaciones
- Calor EspecificoDocumento3 páginasCalor EspecificoJuan Manuel DIAZ QUIROGAAún no hay calificaciones
- Lab 11 Calor EspecíficoDocumento7 páginasLab 11 Calor EspecíficoRafaela Santa Cruz HuamanAún no hay calificaciones
- Informe de Laboratorio #1 Ondas y Optica (Dilatacion Termica)Documento4 páginasInforme de Laboratorio #1 Ondas y Optica (Dilatacion Termica)Pipe AnguloAún no hay calificaciones
- Calor EspecificoDocumento15 páginasCalor Especificoluis antpnyAún no hay calificaciones
- Guía de Práctica TermoDocumento4 páginasGuía de Práctica TermoAntonella APAún no hay calificaciones
- NalaDocumento17 páginasNalazapatacodybryamnAún no hay calificaciones
- Informedel Lab. 6Documento24 páginasInformedel Lab. 6NicolasMinayaOrtegaAún no hay calificaciones
- CalorimetriaDocumento3 páginasCalorimetriaJohana DazaAún no hay calificaciones
- Informe Lab1. FQDocumento6 páginasInforme Lab1. FQmaribel herrera ramirezAún no hay calificaciones
- Guia 9 LaboratorioDocumento10 páginasGuia 9 LaboratorioLUIS ANTONIO BELIIDO ARANDAAún no hay calificaciones
- Lab Sesión 11 - Guía de Lab 08 - CalorimetríaDocumento2 páginasLab Sesión 11 - Guía de Lab 08 - CalorimetríaMiguel Polo GutierrezAún no hay calificaciones
- Informe Calor EspecificoDocumento4 páginasInforme Calor EspecificoAndrés Felipe Gómez GAún no hay calificaciones
- Fisica2 Semana09 Anthony GodoyMenzalaDocumento5 páginasFisica2 Semana09 Anthony GodoyMenzalaAnthony GodoyAún no hay calificaciones
- Ley Cero de La TermodinámicaDocumento7 páginasLey Cero de La TermodinámicahtmuroAún no hay calificaciones
- Practica 1 Equilibrio T RmicoDocumento2 páginasPractica 1 Equilibrio T RmicoCinthya AcurioAún no hay calificaciones
- Calor EspecificoDocumento9 páginasCalor EspecificoMaria Del CarmenAún no hay calificaciones
- Calor EspecíficoDocumento11 páginasCalor EspecíficoGiorgio ViteriAún no hay calificaciones
- Practica No 1Documento15 páginasPractica No 1Osiris Zeraju RevoredaAún no hay calificaciones
- Calor Especifico InformeDocumento7 páginasCalor Especifico Informeluisa madera100% (1)
- Laboratorio 5 de Fisica 2Documento11 páginasLaboratorio 5 de Fisica 2amelyn31Aún no hay calificaciones
- Calorimetria PDFDocumento4 páginasCalorimetria PDFdhaniel13Aún no hay calificaciones
- Informe Laboratorio de Termodinámica PDFDocumento15 páginasInforme Laboratorio de Termodinámica PDFNico Reyes PerezAún no hay calificaciones
- 4-Informe de Laboratorio - Calor Especifico de Un SolidoDocumento5 páginas4-Informe de Laboratorio - Calor Especifico de Un Solidoandrea delgadoAún no hay calificaciones
- Laboratorio de CalorimetríaDocumento8 páginasLaboratorio de CalorimetríaCarlos Navarro NavarroAún no hay calificaciones
- GUÍA N°04 - Calor Específico en Los Cuerpos SólidosDocumento11 páginasGUÍA N°04 - Calor Específico en Los Cuerpos SólidosVictor YaltaAún no hay calificaciones
- Informe 4 de FisicoquimicaDocumento11 páginasInforme 4 de FisicoquimicaEdson CarvajalAún no hay calificaciones
- Laboratorio N°05 - Calor Específico en Los Cuerpos Sólidos - Docx - CompressedDocumento17 páginasLaboratorio N°05 - Calor Específico en Los Cuerpos Sólidos - Docx - CompressedAnderson Flores diasAún no hay calificaciones
- MARCO TEORICO CalorimetriaDocumento18 páginasMARCO TEORICO CalorimetriaKeithy CgAún no hay calificaciones
- Calor Especifico-Informe....Documento3 páginasCalor Especifico-Informe....Lineth GarciaAún no hay calificaciones
- Informe 8 Calor Específico UTPDocumento14 páginasInforme 8 Calor Específico UTPE. R. Reinoso NúñezAún no hay calificaciones
- Lab 05 Final KKDocumento20 páginasLab 05 Final KKSergio HoyosAún no hay calificaciones
- Ultimo PaperDocumento5 páginasUltimo Papergustavounac2018Aún no hay calificaciones
- Calor EspecificoDocumento11 páginasCalor EspecificoCinthia M. ViillafaniAún no hay calificaciones
- Práctica CALOR Y TEMPERATURADocumento8 páginasPráctica CALOR Y TEMPERATURANayeli Calapucha100% (1)
- Calor y Temperatura Informe de Fisica IIIDocumento19 páginasCalor y Temperatura Informe de Fisica IIICharly Loor L Primos100% (3)
- Calor Especifico de SolidosDocumento4 páginasCalor Especifico de SolidosGeanpiero Touzet MálagaAún no hay calificaciones
- LABORATORIO EXPERIMENTAL #05. Calor Específico de Los Cuerpos SolidosDocumento17 páginasLABORATORIO EXPERIMENTAL #05. Calor Específico de Los Cuerpos SolidosCarlos Becerra salazarAún no hay calificaciones
- Equilibrio TermicoDocumento4 páginasEquilibrio TermicoDaniel EbrathAún no hay calificaciones
- Calor Especifico en SolidosDocumento8 páginasCalor Especifico en SolidosSofia Castillo RamirezAún no hay calificaciones
- Preinforme N°5Documento3 páginasPreinforme N°5JULIO RUBEN ORTIZ DE ORUE HUAMANIAún no hay calificaciones
- UF0565 - Eficiencia energética en las instalaciones de calefacción y ACS en los edificiosDe EverandUF0565 - Eficiencia energética en las instalaciones de calefacción y ACS en los edificiosAún no hay calificaciones
- UF1026 - Caracterización de procesos e instalaciones frigoríficasDe EverandUF1026 - Caracterización de procesos e instalaciones frigoríficasCalificación: 4 de 5 estrellas4/5 (1)
- 02a HidrocarburosDocumento68 páginas02a HidrocarburosSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- FedfsDocumento1 páginaFedfsSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- Notas de Don GilDocumento2 páginasNotas de Don GilSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- Formato para Registro de Fuentes para Idea Emprendedora (1) OkDocumento4 páginasFormato para Registro de Fuentes para Idea Emprendedora (1) OkSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- Notas de Don GilDocumento2 páginasNotas de Don GilSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- Notas de BiologíaDocumento2 páginasNotas de BiologíaSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- Presentación - NichoDocumento1 páginaPresentación - NichoSTEPHANIE PEREGRINA RAMOS ALARCONAún no hay calificaciones
- Nias NombresDocumento4 páginasNias NombresCristian RicoAún no hay calificaciones
- Lectura 4 Erp Casos de Éxito Incakola WongDocumento4 páginasLectura 4 Erp Casos de Éxito Incakola WongKarBeto SanchezAún no hay calificaciones
- Modelos de Evaluacion SpicologicaDocumento14 páginasModelos de Evaluacion Spicologicaeuler100% (1)
- Investigación de MercadosDocumento15 páginasInvestigación de MercadosWendyAún no hay calificaciones
- Delta Del Orinoco-San JuanDocumento6 páginasDelta Del Orinoco-San JuanAngelica YsaccisAún no hay calificaciones
- Cómo Convertir La Falta de Experiencia Por Ser Joven en Una Virtud para La Empresa - HBRDocumento4 páginasCómo Convertir La Falta de Experiencia Por Ser Joven en Una Virtud para La Empresa - HBRJesus BriceñoAún no hay calificaciones
- Hexacta Austral PDFDocumento38 páginasHexacta Austral PDFJuan Manuel GutierrezAún no hay calificaciones
- CSI-001-Solicitud de Autorización de Acceso A La RedDocumento1 páginaCSI-001-Solicitud de Autorización de Acceso A La Redjairo bravoAún no hay calificaciones
- Sesión Académica 04 Probabilidades y Teorema de BayesDocumento55 páginasSesión Académica 04 Probabilidades y Teorema de BayesFiorella Bravo PradoAún no hay calificaciones
- CURRICULUM VITAE FormatoDocumento4 páginasCURRICULUM VITAE FormatoAndres Chamorro TelloAún no hay calificaciones
- Luis-Medero-Tarea Semana 2Documento6 páginasLuis-Medero-Tarea Semana 2Sebastian Jimenez100% (1)
- Metropoli PDFDocumento57 páginasMetropoli PDFfcozambrana100% (2)
- 4.0 - Analisis LexicoDocumento21 páginas4.0 - Analisis LexicoDj frogyAún no hay calificaciones
- Configuracionde Prodigy Mailen AndroidDocumento4 páginasConfiguracionde Prodigy Mailen AndroidOscar GonzalezAún no hay calificaciones
- Práctica Blended Sobre Calor Latente de FusiónDocumento9 páginasPráctica Blended Sobre Calor Latente de FusiónSantyneitorGMAún no hay calificaciones
- Memoria Descriptiva de AsociacionDocumento11 páginasMemoria Descriptiva de AsociacionFredy PerAún no hay calificaciones
- Aspectos GeneralesDocumento4 páginasAspectos GeneralesYahita Ventura ParedesAún no hay calificaciones
- Amanecida 2 Geometri Sept 2020Documento23 páginasAmanecida 2 Geometri Sept 2020Fabricio Bustamante :3Aún no hay calificaciones
- ¿Que Es La Litosfera?Documento3 páginas¿Que Es La Litosfera?Sergio Diego Vargas100% (1)
- A Cuentas de Terceros EE - ss.MI CARIÑITODocumento5 páginasA Cuentas de Terceros EE - ss.MI CARIÑITODeysiAún no hay calificaciones
- Detectores de HumoDocumento8 páginasDetectores de HumoMage BaldiviesoAún no hay calificaciones
- Origen Histórico de La FilosofíaDocumento29 páginasOrigen Histórico de La FilosofíaSamir Hinostroza TolentinoAún no hay calificaciones
- Maestú, Ríos & Cabestrero (2008) - Resonancia Magnético-Funcional, Tomografía Por Emisión de Positrones y ElectroencefalografíaDocumento67 páginasMaestú, Ríos & Cabestrero (2008) - Resonancia Magnético-Funcional, Tomografía Por Emisión de Positrones y ElectroencefalografíaJuan Jesus Navarro MirandaAún no hay calificaciones
- Capitulo 1 de AlgebraDocumento2 páginasCapitulo 1 de AlgebraLeonel BCAún no hay calificaciones
- Aplicaciones de Biotecnologia AmbientalDocumento4 páginasAplicaciones de Biotecnologia AmbientalChac Gal CastAún no hay calificaciones
- Recetario Masas LaminadasDocumento10 páginasRecetario Masas LaminadasKOGI Productos y AlimentosAún no hay calificaciones
- Laboratorio 15 C#Documento16 páginasLaboratorio 15 C#jhvalenrAún no hay calificaciones
- Unidad 1 PoliticasDocumento18 páginasUnidad 1 PoliticasClaudia Iglesias DiazAún no hay calificaciones
- Crego Etal 2018 MagallaniaDocumento18 páginasCrego Etal 2018 Magallaniapaula caballero sotoAún no hay calificaciones
- Edu in TeatroDocumento21 páginasEdu in TeatroClaudioMaizAún no hay calificaciones