0% encontró este documento útil (0 votos)
182 vistas9 páginasCalor Latente de Fusión del Hielo
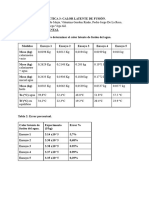
Este documento describe una práctica sobre el calor latente de fusión del hielo. Los objetivos de aprendizaje son determinar el calor latente de fusión del hielo usando el principio de conservación de la energía, comprobar que los cambios de fase ocurren a temperatura constante, y aplicar los principios de calor latente en situaciones cotidianas. La práctica implica medir las masas y temperaturas iniciales y finales de hielo y agua en un calorímetro para calcular el calor latente de fusión.
Cargado por
SantyneitorGMDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
182 vistas9 páginasCalor Latente de Fusión del Hielo
Este documento describe una práctica sobre el calor latente de fusión del hielo. Los objetivos de aprendizaje son determinar el calor latente de fusión del hielo usando el principio de conservación de la energía, comprobar que los cambios de fase ocurren a temperatura constante, y aplicar los principios de calor latente en situaciones cotidianas. La práctica implica medir las masas y temperaturas iniciales y finales de hielo y agua en un calorímetro para calcular el calor latente de fusión.
Cargado por
SantyneitorGMDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd