Documentos de Académico
Documentos de Profesional
Documentos de Cultura
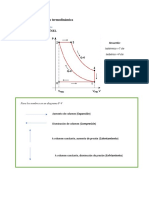
TTyTC19 - Resumen PPolitrópicos
Cargado por
Óscar GándaraTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
TTyTC19 - Resumen PPolitrópicos
Cargado por
Óscar GándaraCopyright:
Formatos disponibles
TERMODINÁMICA TÉCNICA Y TRANSMISIÓN DE CALOR Grado en Ingeniería Eléctrica
PROBLEMAS BLOQUE I – Fundamentos de Termodinámica
SISTEMA CERRADO EN REPOSO
I.2.- PRIMER PRINCIPIO – Sistemas cerrados
Guía para la aplicación del primer principio a procesos politrópicos
ΔU12 + ΔEc12 +ΔEp12 = Q12 - W12 1ºPpio
ECUACIONES CLAVE:
Relación PVT gas ideal: PV=nRT
Definición de las capacidades caloríficas: ¿PROCESO REVERSIBLE (IDEAL)?
𝑐𝑐𝑣𝑣 = (𝜕𝜕𝜕𝜕/𝜕𝜕𝜕𝜕)𝑣𝑣 → ∆𝑈𝑈𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑛𝑛 ∙ 𝑐𝑐̅𝑣𝑣 ∙ ∆𝑇𝑇 = 𝑚𝑚 ∙ 𝑐𝑐𝑣𝑣 ∙ ∆𝑇𝑇 (Todos los subprocesos cuasiestacionarios, trabajo
exclusivamente de expansión/ compresión)
𝑐𝑐𝑝𝑝 = (𝜕𝜕ℎ/𝜕𝜕𝜕𝜕)𝑝𝑝 → ∆𝐻𝐻𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑛𝑛 ∙ 𝑐𝑐̅𝑝𝑝 ∙ ∆𝑇𝑇 = 𝑚𝑚 ∙ 𝑐𝑐𝑝𝑝 ∙ ∆𝑇𝑇
SÍ NO
Relación entre las capacidades caloríficas:
𝑐𝑐̅𝑝𝑝 − 𝑐𝑐̅𝑣𝑣 = 𝑅𝑅 ; 𝑐𝑐𝑝𝑝 − 𝑐𝑐𝑣𝑣 = 𝑅𝑅𝑔𝑔
PROCESO POLITRÓPICO (Proceso disipativo)
𝑅𝑅
Constante de gas ideal específica: 𝑅𝑅𝑔𝑔 = 𝑖𝑖2
𝑀𝑀𝑚𝑚
𝑊𝑊𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝 = 𝑊𝑊𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = � 𝑃𝑃𝑃𝑃𝑃𝑃
𝑖𝑖1
Índice de politropía (n):
𝑐𝑐𝑝𝑝 −𝑐𝑐 P cte C=Cp n=0
𝑛𝑛 = V cte C=Cv n=∞
𝑐𝑐𝑣𝑣 −𝑐𝑐
T cte Cp=Cv=0 n=1 ¿CÍCLICO?
Q=0 C=0 n= γ
SÍ NO
Coeficiente adiabático:
𝑐𝑐𝑝𝑝 𝑐𝑐̅𝑝𝑝
𝛾𝛾 = = ∆𝑈𝑈𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝 = 0 ⟹
𝑐𝑐𝑣𝑣 𝑐𝑐̅𝑣𝑣
𝑄𝑄𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝 = � 𝑄𝑄𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑊𝑊𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝
Ecuaciones politrópicas generalizadas:
1−𝑛𝑛
𝑇𝑇 ∙ 𝑉𝑉 𝑛𝑛−1 = 𝑐𝑐𝑐𝑐𝑐𝑐; 𝑃𝑃 ∙ 𝑉𝑉 𝑛𝑛 = 𝑐𝑐𝑐𝑐𝑐𝑐; 𝑇𝑇 ∙ 𝑃𝑃 𝑛𝑛 = 𝑐𝑐𝑐𝑐𝑐𝑐
Tipo de subprocesos…
P cte V cte T cte Q=0
𝑊𝑊𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑃𝑃 ∙ (𝑉𝑉𝑖𝑖2 − 𝑉𝑉𝑖𝑖1 ) 𝑊𝑊𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 0 𝑃𝑃 ∙ 𝑉𝑉 ]𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑐𝑐𝑐𝑐𝑐𝑐 𝑊𝑊𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = ∆𝑈𝑈𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑛𝑛 ∙ 𝑐𝑐̅𝑣𝑣 ∙ ∆𝑇𝑇
∆𝑈𝑈𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 0 ∆𝐻𝐻𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 0
∆𝐻𝐻𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 0 𝑃𝑃 ∙ 𝑉𝑉 𝛾𝛾 ]𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑐𝑐𝑐𝑐𝑐𝑐
𝑊𝑊𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑄𝑄𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 𝑇𝑇 ∙ 𝑉𝑉 𝛾𝛾−1 ]𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠𝑠 𝑖𝑖 = 𝑐𝑐𝑐𝑐𝑐𝑐
También podría gustarte
- Formulario de TermodinámicaDocumento2 páginasFormulario de TermodinámicaTania Fuentes OroscoAún no hay calificaciones
- Transformaciones Politropicas 2022Documento22 páginasTransformaciones Politropicas 2022ivan camilliAún no hay calificaciones
- Tabla Resumen Sobre Procesos TermodinámicosDocumento1 páginaTabla Resumen Sobre Procesos TermodinámicosAlex VelardeAún no hay calificaciones
- Propiedades de Los LiquidosDocumento2 páginasPropiedades de Los LiquidosFrancisco MendozaAún no hay calificaciones
- Formulario de Termodinámica-1-1Documento2 páginasFormulario de Termodinámica-1-1CristhianMauricioAguilarAún no hay calificaciones
- Formulario de Gases y TablasDocumento3 páginasFormulario de Gases y TablasFelix Montaño HuarachiAún no hay calificaciones
- Formulario de Termodinámica-1Documento2 páginasFormulario de Termodinámica-1Osvaldo VascoAún no hay calificaciones
- Ejercicios de TermodinamicaDocumento10 páginasEjercicios de TermodinamicaMauricioLlanosAún no hay calificaciones
- TermodinámicaDocumento10 páginasTermodinámicasalvador castilloAún no hay calificaciones
- FormularioDocumento3 páginasFormularioJessica ChiriAún no hay calificaciones
- FormularioDocumento5 páginasFormulario317073023Aún no hay calificaciones
- Diseño-Reactores Ideales-V Cte-T Cte - 2020-I - G2Documento7 páginasDiseño-Reactores Ideales-V Cte-T Cte - 2020-I - G2Juan Pablo Cardenas GarzonAún no hay calificaciones
- Parte Dos FisicaDocumento6 páginasParte Dos Fisicavladimirrafael01Aún no hay calificaciones
- Reactores Semi-BatchDocumento20 páginasReactores Semi-BatchJOSE DAVID MARTINEZ MENCO ESTUDIANTEAún no hay calificaciones
- Tarea 2 FormularioDocumento2 páginasTarea 2 FormularioJorgee BarzolaAún no hay calificaciones
- CONDUCCIÓNDocumento2 páginasCONDUCCIÓNNOELIA GALLARDO DIAZAún no hay calificaciones
- Potenciales Termodinámicos y Criterios de Espontaneidad y EquilibrioDocumento15 páginasPotenciales Termodinámicos y Criterios de Espontaneidad y EquilibrioDaniel Melo100% (1)
- Formulario TermodinamicaDocumento2 páginasFormulario TermodinamicaDavito Garka GHAún no hay calificaciones
- Teo Diseño Práctico Compresores en Clase Industrial Clase Ver 1Documento7 páginasTeo Diseño Práctico Compresores en Clase Industrial Clase Ver 1leandro lopezAún no hay calificaciones
- Práctica 10 Carga y Descarga Del CondensadorDocumento19 páginasPráctica 10 Carga y Descarga Del CondensadorPablito PabliñoAún no hay calificaciones
- Hoja de Fórmulas PsicrometríaDocumento3 páginasHoja de Fórmulas Psicrometríamarco cruzAún no hay calificaciones
- REACCIONES - ECUACIONES 2 - Trabajo GrupalDocumento5 páginasREACCIONES - ECUACIONES 2 - Trabajo GrupalRubi TapiaAún no hay calificaciones
- Problemas ReactoresDocumento3 páginasProblemas ReactoresLucero MejiaAún no hay calificaciones
- Version Final Primer TallerDocumento10 páginasVersion Final Primer TallerJayder FontalvoAún no hay calificaciones
- Primera Ley-Calor y TrabajoDocumento29 páginasPrimera Ley-Calor y TrabajoPedro Marrugo BelloAún no hay calificaciones
- Formulario Primera y Segunda Ley de La Termo.Documento5 páginasFormulario Primera y Segunda Ley de La Termo.Iris109Aún no hay calificaciones
- Clase 5-1 - Ejercicios 1ra LeyDocumento5 páginasClase 5-1 - Ejercicios 1ra LeyIvanović De La VegaAún no hay calificaciones
- Parcial 2 Teórico - 201720Documento3 páginasParcial 2 Teórico - 201720Pablo MartinezAún no hay calificaciones
- Transferencia de Calor, G.5Documento15 páginasTransferencia de Calor, G.5DIANA ROSA SOTO MEZARINOAún no hay calificaciones
- Analisis Energético de Volumenes de ControlDocumento3 páginasAnalisis Energético de Volumenes de ControlJose AlonzoAún no hay calificaciones
- Formulario TermoDocumento1 páginaFormulario Termoindirats torresAún no hay calificaciones
- Micro II - CroaciaDocumento2 páginasMicro II - CroaciaCatalina Ruiz GilAún no hay calificaciones
- Clase 7 G2Documento21 páginasClase 7 G2SEBASTIÁN ALEJANDRO ANABALÓN GÓMEZAún no hay calificaciones
- MicroeconomíaDocumento2 páginasMicroeconomíaDahomy Garcia Gonzalez0% (1)
- Momento LinealDocumento7 páginasMomento LinealJhoan SebastianAún no hay calificaciones
- Solución Ejercicio 2Documento7 páginasSolución Ejercicio 2Mauricio Nakamura CortezAún no hay calificaciones
- 1er Parcial OP1Documento14 páginas1er Parcial OP1kevinAún no hay calificaciones
- Termodinamica Semana 4 Comportamiento de Gas IdealDocumento15 páginasTermodinamica Semana 4 Comportamiento de Gas IdealDaymer Ramirez FloresAún no hay calificaciones
- Tarea n3 Icp316 - Shirley Gabriela Saavedra TrigoDocumento6 páginasTarea n3 Icp316 - Shirley Gabriela Saavedra TrigoGabriela SaavedraAún no hay calificaciones
- Estatica IntensivoDocumento28 páginasEstatica IntensivoTito VillafaneAún no hay calificaciones
- CARGA AXIAL - Elementos Estáticamente Indeterminados. Esfuerzos TérmicosDocumento42 páginasCARGA AXIAL - Elementos Estáticamente Indeterminados. Esfuerzos TérmicosAngello FrankzuatAún no hay calificaciones
- Formulario de FísicaDocumento4 páginasFormulario de FísicaMichael EstradaAún no hay calificaciones
- TermodinamicaDocumento21 páginasTermodinamicaEnrique EsquivelAún no hay calificaciones
- Diseno de Reactores No IsotermicosDocumento3 páginasDiseno de Reactores No IsotermicosMaría FaríaAún no hay calificaciones
- Procesos Termodinámicos-2023Documento23 páginasProcesos Termodinámicos-2023Diego PariAún no hay calificaciones
- Aplicaciones de Las Ecuaciones DiferencialesDocumento5 páginasAplicaciones de Las Ecuaciones Diferencialeszyzz zeballosAún no hay calificaciones
- 4to Tutorial - Diseño de ReactoresDocumento15 páginas4to Tutorial - Diseño de ReactoresPiero HerreraAún no hay calificaciones
- Cap 3.1 - Procesos Con Gases IdealesDocumento6 páginasCap 3.1 - Procesos Con Gases IdealesBryan RiveraAún no hay calificaciones
- DESARROLLO DE ECUACIONES Tds - VerticalDocumento7 páginasDESARROLLO DE ECUACIONES Tds - Verticalruben varelaAún no hay calificaciones
- MEC299 Sesión1.4 2023 1Documento26 páginasMEC299 Sesión1.4 2023 1franklin atamariAún no hay calificaciones
- Gases Ideales 2022-1Documento26 páginasGases Ideales 2022-1Marco PeraltaAún no hay calificaciones
- Parcial Segundo Corte Diseño Grupo CDocumento2 páginasParcial Segundo Corte Diseño Grupo Cmaria diazAún no hay calificaciones
- PP Cap 2 Termodinamica TecnicaDocumento21 páginasPP Cap 2 Termodinamica TecnicaVANIA VARGAS VELASQUEZAún no hay calificaciones
- Formu QF I V2Documento6 páginasFormu QF I V2Nico Benito FernándezAún no hay calificaciones
- Circuitos RCDocumento5 páginasCircuitos RCGerman ManriqueAún no hay calificaciones
- Trabajo de Frontera MóvilDocumento17 páginasTrabajo de Frontera MóvilJoel ImacaAún no hay calificaciones
- Segunda Ley de La TermodinámicaDocumento18 páginasSegunda Ley de La TermodinámicaLuis martinez estradaAún no hay calificaciones
- 9 Motores Termicos 2016Documento15 páginas9 Motores Termicos 2016Óscar GándaraAún no hay calificaciones
- 7 Exergia 2016Documento4 páginas7 Exergia 2016Óscar GándaraAún no hay calificaciones
- 6 Entropia 2016Documento12 páginas6 Entropia 2016Óscar GándaraAún no hay calificaciones
- 5 Principio 2 2016Documento9 páginas5 Principio 2 2016Óscar GándaraAún no hay calificaciones
- Caso Quickfix AutopartesDocumento4 páginasCaso Quickfix AutopartesAlexa Bustamante De la CruzAún no hay calificaciones
- Temas EucaristicoDocumento17 páginasTemas EucaristicoLeopoldo M SoledispaAún no hay calificaciones
- Historia Del Dinero (Clase 2)Documento32 páginasHistoria Del Dinero (Clase 2)Velvet EscobarAún no hay calificaciones
- Ensayo Guiado Sobre Película Margin CallDocumento3 páginasEnsayo Guiado Sobre Película Margin CallEvelyn Asicona100% (1)
- Catalogo General TeleH ESPDocumento2 páginasCatalogo General TeleH ESPjudarangocaAún no hay calificaciones
- El Perfil Del Docente de Educación Inicial PDFDocumento3 páginasEl Perfil Del Docente de Educación Inicial PDFaracelys88% (25)
- Cita 1Documento8 páginasCita 1MILER LÓPEZ ROJASAún no hay calificaciones
- Requerimientos UniformesDocumento15 páginasRequerimientos UniformesAlfonso SarmientoAún no hay calificaciones
- DCORECION GARECAdosDocumento140 páginasDCORECION GARECAdosVivian MadridAún no hay calificaciones
- Principios de La Mente MillonariaDocumento15 páginasPrincipios de La Mente MillonariaasdafAún no hay calificaciones
- Periculum Est DubitabilisDocumento4 páginasPericulum Est DubitabilisJimmy Salas RojasAún no hay calificaciones
- Informe de Prorroga de PlazosDocumento12 páginasInforme de Prorroga de PlazoscortezchamorrolizAún no hay calificaciones
- Rl-180709 Mba G - Tieb Secc.ADocumento12 páginasRl-180709 Mba G - Tieb Secc.AWilly1Aún no hay calificaciones
- Tabla de La Verdad RayDocumento7 páginasTabla de La Verdad Rayrayfred valeroAún no hay calificaciones
- Acordeon Estudio de CasoDocumento2 páginasAcordeon Estudio de CasoDaniel BernalAún no hay calificaciones
- Navidad Del Mes de DiciembreDocumento3 páginasNavidad Del Mes de DiciembreJavier MirandaAún no hay calificaciones
- Diseño Puente Tipo LosaDocumento29 páginasDiseño Puente Tipo LosaMaco MiguelAún no hay calificaciones
- Técnicas de Modificación de ConductaDocumento6 páginasTécnicas de Modificación de Conductawilliams machaca0% (1)
- Tarjeta de Guía MayorDocumento3 páginasTarjeta de Guía MayorKarglem David Torres MartínezAún no hay calificaciones
- Veinte Departamentos Afectados Por Noche Extremadamente Fría.Documento8 páginasVeinte Departamentos Afectados Por Noche Extremadamente Fría.NÚCLEO NOTICIASAún no hay calificaciones
- Punto de EquilibrioDocumento27 páginasPunto de EquilibrioArfot Silva SilvestreAún no hay calificaciones
- Conducta AdaptativaDocumento3 páginasConducta AdaptativaThania Gaete MuñozAún no hay calificaciones
- Historia BíblicaDocumento2 páginasHistoria BíblicaRemedios VillcaAún no hay calificaciones
- Asfixia Por SumersionDocumento13 páginasAsfixia Por SumersionMichelle FrutosAún no hay calificaciones
- Instrucción A Lean Manufacturing: Prof. Carlos Grajeda RDocumento41 páginasInstrucción A Lean Manufacturing: Prof. Carlos Grajeda REsteban Riveros RodriguezAún no hay calificaciones
- Pautas de Estres Corticoterapia SeguraDocumento2 páginasPautas de Estres Corticoterapia SeguraGina SpecialeAún no hay calificaciones
- Presentación BibliotecaDocumento10 páginasPresentación BibliotecaTatiana Castillo GAún no hay calificaciones
- 2DO SEMANA 14 EXPANSION EUROIPEA Rev PoloDocumento7 páginas2DO SEMANA 14 EXPANSION EUROIPEA Rev PoloCielo GallegosAún no hay calificaciones
- Diagramas Esfuerzo Deformacion Del Acero-Aluminio-Cobre-Bronze-PolimerosDocumento7 páginasDiagramas Esfuerzo Deformacion Del Acero-Aluminio-Cobre-Bronze-PolimerosJOSE FERNANDO GAMEZ GUERREROAún no hay calificaciones
- Biodigestor PDFDocumento3 páginasBiodigestor PDFÁlvaro SHAún no hay calificaciones