Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe #6
Cargado por
yulitza sanchezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe #6
Cargado por
yulitza sanchezCopyright:
Formatos disponibles
INFORME N°6 REACTIVO LIMITE
Sanchez G, Yulitza, A; Salazar C Narly, V; Toledo S. Lina, M & Ule, M Laura V
Agroecología Universidad de la Amazonia
24 noviembre 2022
RESUMEN
Aplicar los principios generales que rigen las transformaciones químicas, mediante la reacción entre
el BaCl2 (ac) + Na2CO3 (ac) BaCO3 (s) + 2 NaCl (ac), determinando a su vez la cantidad de
precipitado formado de BaCO3 (s) como uno de los productos principales de la reacción. Para
realizar este estudio fue necesario tener los siguientes materiales: Un vaso de precipitado de 100
mls, embudo de vidrio, Erlenmeyer de 125 mls, probeta de 100 mls, vidrio reloj, un círculo de papel
filtro, bureta con soporte universal, pipeteador, pipeta volumétrica de 20 mls y 5 mls, reactivos
(BaCl2 (ac) ,Na2CO3 (ac) ),etc. Lo que queríamos hallar era la reacción que se producía, quién era
el reactivo límite y luego realizar algunos cálculos (% rendimiento, % error) con los resultados
obtenidos en la experimentación. Lo que obtuvimos fue muy bueno ya que él % rendimiento nos
dio en un punto donde debería estar, además con los datos que recolectamos en la práctica pudimos
realizar los cálculos que nos pedían en la tabla.
Palabras claves: Reacción, reactivo limite, transformación de la materia.
INTRODUCCIÓN Iriondo. (2013) en consecuencia, algunos
reactivos se consumen totalmente, mientras
El reactivo limitante es el reactivo que, en
que otros son recuperados al finalizar la
una reacción química determinada, da a
reacción. El reactivo que se consume en
conocer o limita, la cantidad de producto
primer lugar es llamado reactivo limitante, ya
formado, y provoca una concentración
que la cantidad de éste determina la cantidad
específica o limitante. Cuando una ecuación
total del producto formado. Cuando este
está balanceada, la estequiometria se emplea
reactivo se consume, la reacción se detiene.
para saber la cantidad de materia (mol) de un
El o los reactivos que se consumen
producto obtenido a partir de un número
parcialmente son los reactivos en exceso
conocido de moles de un reactivo. La relación
Pastrana, M. R., & Anabitarte, R. M. (2010).
de cantidad de materia (mol) entre el reactivo
y producto se obtiene de la ecuación Según Milla González, M. (2013) la cantidad
balanceada María, A. A. N., Gagey, C., de producto que se obtiene cuando reacciona
Lacarra, H. R., Doce, L. F., Astarita, A., todo el reactivo limitante se denomina
Badino, M., Marotta, P., Trebucq, L., Yerba, rendimiento teórico de la reacción. El
A., &; Gorosito, J. (2019). concepto de reactivo limitante permite a los
químicos asegurarse de que un reactivo, el
Generalmente cuando se efectúa una reacción
más costoso, sea completamente consumido
química los reactivos no se encuentran en
en el transcurso de una reacción,
cantidades estequiométricamente exactas, es
aprovechándose así al máximo. Una manera
decir, en las proporciones que indica su
de resolver el problema de cuál es el reactivo
ecuación balanceada. Según J. Martínez y C.
limitante es: calcular la cantidad de producto otras sustancias puras Capitulo 3. (2021).
que se formará para cada una de las Existen grandes variedades de ejemplos
cantidades que hay de reactivos en la cotidianos de estos fenómenos o reacciones
reacción. El reactivo limitante será aquel que químicas, entre ellos la conocida oxidación de
produce la menor cantidad de producto. un trozo de hierro cuando se expone al aire,
en este caso el hierro y el oxígeno han
MARCO REFERENCIAL
reaccionado (los llamamos entonces
REACTIVO LIMITE reactivos) para transformarse en óxido férrico
(producto). Para representar este fenómeno
El reactivo limitante es el reactivo que, en hacemos uso de la llamada ecuación química,
una reacción química determinada, da a que es un formalismo en el cual se colocan
conocer o limita, la cantidad de producto los reactivos a la izquierda y los productos a
formado, y provoca una concentración la derecha, separados por una flecha que
específica o limitante. Cuando una ecuación representa la transformación. Los reactivos y
está balanceada, la estequiometria se emplea productos se representan por sus fórmulas
para saber la cantidad de materia (mol) de un moleculares, habitualmente acompañados por
producto obtenido a partir de un número sus estados de agregación 06-Garritz. (2006).
conocido de moles de un reactivo. La relación >.
de cantidad de materia (mol) entre el reactivo
y producto se obtiene de la ecuación RENDIMIENTO
balanceada María, A. A. N., Gagey, C.,
Normalmente en las reacciones químicas no
Lacarra, H. R., Doce, L. F., Astarita, A.,
se obtiene toda la cantidad de producto que se
Badino, M., Marotta, P., Trebucq, L., Yerba,
podría obtener, debido a pérdidas diversas.
A., & Gorosito, J. (2019).
Por ello se define el % de rendimiento. Una
Según FÍSICA Y QUÍMICA generalmente reacción ideal tendrá un rendimiento del 100
cuando se efectúa una reacción química los %, en las reacciones reales el rendimiento
reactivos no se encuentran en cantidades será inferior Fernando Escudero Ramos.
estequiométricamente exactas, es decir, en las (2016).
proporciones que indica su ecuación
balanceada. En consecuencia, algunos
reactivos se consumen totalmente, mientras
que otros son recuperados al finalizar la
reacción. El reactivo que se consume en
primer lugar es llamado reactivo limitante, ya
que la cantidad de éste determina la cantidad RENDIMIENTO DE UNA REACCIÓN,
total del producto formado. Cuando este TEÓRICA, REAL Y PORCENTUAL
reactivo se consume, la reacción se detiene, el
o los reactivos que se consumen parcialmente Según Antonia Del Carmen, Q., & León,
son los reactivos en exceso. P. (2016) en química, el rendimiento de
reacción es la cantidad de producto producido
REACCIONES ESTEQUIOMÉTRICAS por una reacción química. Hay tres tipos de
rendimiento relacionado con el estudio
Es conocido que las sustancias puras pueden
cuantitativo de las reacciones químicas, las
combinarse entre sí mediante lo que
cuales son:
llamamos un fenómeno químico, para formar
• Rendimiento teórico.
• Rendimiento real o experimental. MATERIALES Y EQUIPOS
UTILIZADOS
• Rendimiento porcentual.
Materiales
El rendimiento teórico es la máxima cantidad
de producto que puede producirse en una Un Beaker de 50 mls
reacción. El rendimiento real es la cantidad Un embudo de vidrio tallo corto
de producto realmente obtenida de una Un Erlenmeyer de 125 mls
reacción. El rendimiento porcentual Una bureta con soporte universal
determina la eficiencia de la reacción. Sin Un círculo de papel filtro
embargo, no todas las reacciones son al 100%
Un vidrio reloj
efectivas. Para expresar la eficiencia de una
Reactivos
reacción, se emplea la proporción entre el
rendimiento real y el rendimiento teórico 250 mls de BaCl2 en disolución
multiplicada por 100 Miguel Segura acuosa (1ml = 25 mg)
Matarredona (2021). 250 mls de Na2CO3 en disolución
acuosa (1 ml = 25 mg)
a) Rendimiento teórico. Es aquel que, por la
estequiometría, tendríamos que obtener de
acuerdo con la reacción balanceada. Se dice
que este rendimiento es lo máximo que METODOLOGÍA
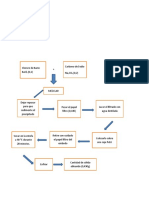
podemos obtener. Realizamos las respectivas mediciones en las
pipetas volumétricas (12 ml de BaCl2 (ac) y
b) Rendimiento real. Como en muchas de ml de Na2CO3 (ac)), luego vertimos en el
las mediciones o predicción, no siempre Erlenmeyer lo ml de Na2SO3 y transferimos
sucede lo que “debería”. Este rendimiento es los ml de BaCl2 (ac) a la probeta y después a
lo que verdaderamente obtenemos en la una bureta con soporte universal. vertimos
experimentación. Generalmente es menor al lentamente los ml de BaCl2 (ac) al
rendimiento teórico. Erlenmeyer donde se encontraba el otro
reactivo, a continuación, realizamos el
c) Rendimiento porcentual. Es el proceso de separación de filtración por
rendimiento real entre el rendimiento teórico gravedad donde vertimos el contenido del
multiplicado por 100. Erlenmeyer a un embudo con papel filtro
(aquí quedaba el BaCO3 (s)) que pasaba al
vaso de precipitado (aquí quedo 2 NaCl (ac)).
Luego utilizamos el vidrio reloj y encima del
colocamos el papel filtro con el BaCO3 (s)) y
lo introducimos en la estufa o incubadora a
80°C, aproximadamente 1 hora, por último,
realizamos los cálculos pedidos en la tabla.
RESULTADOS
Tabla 1 de resultados
Mezcla mls de BaCl2 mls de Na2CO3(ac) ml Na2CO3 ml BaCl2 Moles Moles Moles de
(ac) 1 ml = 25 mg Na2CO3 BaCl2 BacO3
1 ml =25 mg
2 12 3 0,003 L 0,012 L 0,00075 0,003 0,00075
3 12 4 0,004 L 0,012 L 0,001 0,003 0,001
5 12 6 0,006 L 0,012 L 0,0015 0,003 0,0015
7 12 8 0,008 L 0,012 L 0,003 0,003 0,0002
8 12 9 0,009 L 0,012 L 0,0025 0,003 0,00225
DISCUSIÓN
CONCLUSIÓN
Se obtuvo el conocimiento de como diferenciar y extraer resultados para conocer el reactivo
limite, el rendimiento de la reacción y otros valores necesarios de dicha reacción.
REFERENCIAS
Antonia Del Carmen, Q., & León, P. (2016). Rendimiento de una reacción, teórica, real y
porcentual. http://www.cedmm.org/quimica2/paginap.htm
Capítulo 3. (2021). CAPÍTULO 3 Estequiometría Relaciones estequiométricas.
Física & Química. (2017). FÍSICA Y QUÍMICA 247.
Fernando Escudero Ramos. (2016). Tema 3 QUIMICA (2017).
Garritz. (2006). Estequiometría.
J. Martínez y C. Iriondo. (2013). TEMA 2. LAS REACCIONES QUÍMICAS.
María, A. A. N., Gagey, C., Lacarra, H. R., Doce, L. F., Astarita, A., Badino, M., Marotta,
P., Trebucq, L., Yerba, A., & Gorosito, J. (2019). QUÍMICA GENERAL Docentes
Integrantes del Curso.
Milla González, M. (2013). Obtención de superfosfato. Efecto del reactivo limitante.
Miguel Segura Matarredona. (2021). rendimiento de una reacción química.
Pastrana, M. R., & Anabitarte, R. M. (2010). Los reactivos limitantes mediante
organizadores gráficos. In XXIV Encuentro de Didáctica de las Ciencias Experimentales:
24 EDCCEE: 21 al 23 de julio de 2010, Baeza (Jaén) (p. 24). Servicio de Publicaciones.
ANEXOS
También podría gustarte
- Farmacometría:Curvas dosis-respuesta de tipo gradual. Volumen 1De EverandFarmacometría:Curvas dosis-respuesta de tipo gradual. Volumen 1Aún no hay calificaciones
- ESTEQUIOMETRIADocumento2 páginasESTEQUIOMETRIAKey AngielAún no hay calificaciones
- EstequiometríaDocumento2 páginasEstequiometríaDiego Fernando Ardila ArizaAún no hay calificaciones
- Quimica Inorganica - EstequiometríaDocumento25 páginasQuimica Inorganica - EstequiometríaReyes Rodríguez MelanieAún no hay calificaciones
- Reactivo Limitante Quimica GeneralDocumento13 páginasReactivo Limitante Quimica Generalnilvia marcaAún no hay calificaciones
- Rendimiento de ReaccionesDocumento5 páginasRendimiento de ReaccionesLuïz A. Pinto Jr.Aún no hay calificaciones
- Informe Practica 6Documento3 páginasInforme Practica 6YULY ESTEFANY MEDINA AQUITEAún no hay calificaciones
- Practica 4Documento10 páginasPractica 4Jesús De la R.OAún no hay calificaciones
- INFORME DE LABORATORIO Practica 5 Estequiometria 3 PDFDocumento15 páginasINFORME DE LABORATORIO Practica 5 Estequiometria 3 PDFLeidy CorreaAún no hay calificaciones
- Copia de Rendimient PDFDocumento6 páginasCopia de Rendimient PDFMontse BarbosaAún no hay calificaciones
- P Ractica 4: Estequiometr Ia: Academia de Qu ImicaDocumento5 páginasP Ractica 4: Estequiometr Ia: Academia de Qu ImicaAlissonAún no hay calificaciones
- Informe 3 Estequiometria IDocumento18 páginasInforme 3 Estequiometria Iyauri230100% (1)
- Cálculos EstequiométricosDocumento2 páginasCálculos Estequiométricoscarocamacho957321100% (2)
- Vicente Angamarca Camila Anahi - IC-06 - FORO 10 - QuimicaDocumento5 páginasVicente Angamarca Camila Anahi - IC-06 - FORO 10 - QuimicaCami Anahi VicenteAún no hay calificaciones
- EstequiometriaDocumento17 páginasEstequiometriaJulianaOréAún no hay calificaciones
- Síntesis Del Sulfato de BarioDocumento19 páginasSíntesis Del Sulfato de BarioFlyLove50% (2)
- PRACTICA 4 Química GeneralDocumento8 páginasPRACTICA 4 Química GeneralFlores JoanAún no hay calificaciones
- Practica 3Documento8 páginasPractica 3Freddy Rolando Tejena LucasAún no hay calificaciones
- Lab 4Documento10 páginasLab 4Johhn MendozAún no hay calificaciones
- Reactivo LimitanteDocumento3 páginasReactivo LimitanteJuanMiAún no hay calificaciones
- Reactivo LimiteDocumento5 páginasReactivo LimiteAngela Pinzón100% (1)
- Practica EstequiometríaDocumento3 páginasPractica EstequiometríaLUIS MATEO HINCAPIÉ MARTÍNEZAún no hay calificaciones
- Reactivo Limitante y Reactivo en ExcesoDocumento2 páginasReactivo Limitante y Reactivo en ExcesoDenis ChavezAún no hay calificaciones
- Guia Rendimiento de ReaccionesDocumento5 páginasGuia Rendimiento de ReaccionesAna Kairina Pineda PintoAún no hay calificaciones
- Practica 7. Reacciones QuímicasDocumento18 páginasPractica 7. Reacciones QuímicasMendoza Galicia Fernando EmmanuelAún no hay calificaciones
- GraDocumento4 páginasGraJuan Felipe Escobar QuirozAún no hay calificaciones
- Reactivo LimiteDocumento4 páginasReactivo LimiteCristian ClarosAún no hay calificaciones
- Estequiometria de Una ReaccionDocumento8 páginasEstequiometria de Una ReaccionJose GamerAún no hay calificaciones
- Química General: Sesión 26Documento15 páginasQuímica General: Sesión 26FLORES PUSE LENNY ORLANDO ANTONIOAún no hay calificaciones
- Reactivo Limitante y RendimientoDocumento9 páginasReactivo Limitante y RendimientoGuillermo Arturo Estrada ValenciaAún no hay calificaciones
- Materiales y MétodosDocumento13 páginasMateriales y Métodoslorena sanchezAún no hay calificaciones
- Practica Nº4Documento5 páginasPractica Nº4Carlos Manrrique TaboadaAún no hay calificaciones
- Reactivo LimiteDocumento4 páginasReactivo LimiteYinethAún no hay calificaciones
- Reactivo Limitante - Wikipedia, La Enciclopedia Libre PDFDocumento10 páginasReactivo Limitante - Wikipedia, La Enciclopedia Libre PDFGabo VelasquezAún no hay calificaciones
- Reacciones QuímicasDocumento7 páginasReacciones QuímicasEduardo J Romero PAún no hay calificaciones
- Prácticas de EstequiometríaDocumento4 páginasPrácticas de Estequiometríacamilo Acosta mejiaAún no hay calificaciones
- Informe 11 - Quimica GeneralDocumento11 páginasInforme 11 - Quimica GeneralGeralAún no hay calificaciones
- IntroducciónDocumento2 páginasIntroducciónMario YassAún no hay calificaciones
- PRACTICA 7 EstequiometriaDocumento10 páginasPRACTICA 7 EstequiometriaRick SánchezAún no hay calificaciones
- 4 Laboratorio (ESTEQUIOMETRIA)Documento27 páginas4 Laboratorio (ESTEQUIOMETRIA)Junior YupanquiAún no hay calificaciones
- Guia de Lab - Laboratorio N°4 - DQUI1012Documento9 páginasGuia de Lab - Laboratorio N°4 - DQUI1012Bayron BarriaAún no hay calificaciones
- ESTEQUIOMETRIADocumento44 páginasESTEQUIOMETRIAalexAún no hay calificaciones
- Reporte Post-Laboratorio. Práctica 7.Documento5 páginasReporte Post-Laboratorio. Práctica 7.KarenAún no hay calificaciones
- Laboratorio #2Documento6 páginasLaboratorio #2Soledad BarretoAún no hay calificaciones
- Guía 4 QQ Reactivo Limitante Simulación PDFDocumento10 páginasGuía 4 QQ Reactivo Limitante Simulación PDFAlex Fu100% (1)
- Laboratorio de Química Analítica 4Documento10 páginasLaboratorio de Química Analítica 4Juancho MoralesAún no hay calificaciones
- Practica N °2Documento6 páginasPractica N °2mijaheel ferrufinoAún no hay calificaciones
- Practica 9Documento18 páginasPractica 9mzarsAún no hay calificaciones
- 1 Meido Reactivo Limite y LimitanteDocumento6 páginas1 Meido Reactivo Limite y LimitanteMarcela Emilia Burgos Miranda0% (1)
- Practica de Laboratorio de Quimica Nº5 (2023-1)Documento4 páginasPractica de Laboratorio de Quimica Nº5 (2023-1)Mayra Yashir Angel BarretoAún no hay calificaciones
- Balance de Materia en Estado Con Reacciones QuimicasDocumento31 páginasBalance de Materia en Estado Con Reacciones QuimicasGianella Montoya ReinosoAún no hay calificaciones
- Guía 4. EstequiometríaDocumento9 páginasGuía 4. Estequiometríajesney morenoAún no hay calificaciones
- Unidad V - EstequiometriaDocumento14 páginasUnidad V - EstequiometriaAnonymous 76pMqBUeAún no hay calificaciones
- Informe de Laboratorio AnaliticaDocumento3 páginasInforme de Laboratorio AnaliticaDanna Paola DoradoAún no hay calificaciones
- Informe de Laboratorio N°6Documento28 páginasInforme de Laboratorio N°6Cristian Suarez0% (1)
- Tarea EstequiometríaDocumento2 páginasTarea EstequiometríaMiguel BedoyaAún no hay calificaciones
- Conceptos Basicos de Balance de Materia y EnergiaDocumento12 páginasConceptos Basicos de Balance de Materia y EnergiaENYA JAYDY BALCAZAR ORTIZAún no hay calificaciones
- Clase 8 EstequiometriaDocumento12 páginasClase 8 EstequiometriaGianluca Di MassaAún no hay calificaciones
- Laboratorio EstequiometriaDocumento6 páginasLaboratorio EstequiometriatefibenaAún no hay calificaciones
- INFORME PrevioDocumento8 páginasINFORME Previosantiago malamboAún no hay calificaciones
- Estequiometría y Leyes Ponderales: Equipo de Educación en Química VerdeDocumento39 páginasEstequiometría y Leyes Ponderales: Equipo de Educación en Química VerdeMaxXDuwu26Aún no hay calificaciones
- Manual de Quimica General 104Documento89 páginasManual de Quimica General 104angelroseteAún no hay calificaciones
- Solucionario Unidad 1 QuimicaDocumento12 páginasSolucionario Unidad 1 Quimicafuensanta celdranAún no hay calificaciones
- Balance de MateriaDocumento6 páginasBalance de MateriaMiguel Angel ucharicoAún no hay calificaciones
- MA465 - S10 - S25 - CT09 - Estequiometria 2Documento15 páginasMA465 - S10 - S25 - CT09 - Estequiometria 2Bianca Ruiz SaenzAún no hay calificaciones
- Lab 10. Sintesis de La Anilina A P-NitroanilinaDocumento5 páginasLab 10. Sintesis de La Anilina A P-NitroanilinaJulieth BarriosAún no hay calificaciones
- Wuolah Free Efecto PlantillaDocumento13 páginasWuolah Free Efecto PlantillaLEYRE SÁNCHEZ GONZÁLEZAún no hay calificaciones
- Ejercicio Quim1Documento2 páginasEjercicio Quim1Osmar Alejandro Betancourt AvelloAún no hay calificaciones
- 2A - Lab05 - B - Reporte de Laboratorio - 2020 - 02 - SOLUCIONDocumento6 páginas2A - Lab05 - B - Reporte de Laboratorio - 2020 - 02 - SOLUCIONMafer Mabel GalarzaAún no hay calificaciones
- Manual 2019 (LABORATORIO)Documento120 páginasManual 2019 (LABORATORIO)Jonathan SanchezAún no hay calificaciones
- Stequiometria de Formacion Del Oxalato de CalcioDocumento8 páginasStequiometria de Formacion Del Oxalato de CalcioCesar Augusto LosadaAún no hay calificaciones
- Practica 4Documento5 páginasPractica 4λυισ ζερνανδοAún no hay calificaciones
- EstequiometríaDocumento10 páginasEstequiometríajorgeAún no hay calificaciones
- Informe N4Documento3 páginasInforme N4Carlos Jose EstevesAún no hay calificaciones
- Guia Lab QMC 100 (2-2023)Documento69 páginasGuia Lab QMC 100 (2-2023)Jhonny samuel Llanque huarachiAún no hay calificaciones
- Lab II de Quimica Informe 4 EstequiometrDocumento3 páginasLab II de Quimica Informe 4 EstequiometrSalomé AriasAún no hay calificaciones
- A Partir de La Masa Del Precipitado Obtenido Determinar La Cantidad de Cada Uno de Los Reactivos de La MezclaDocumento6 páginasA Partir de La Masa Del Precipitado Obtenido Determinar La Cantidad de Cada Uno de Los Reactivos de La MezclaArley Paz100% (2)
- Cálculo Del Rendimiento de CO2 Edrian Alcivar MedrandaDocumento5 páginasCálculo Del Rendimiento de CO2 Edrian Alcivar MedrandaalcivaredrianAún no hay calificaciones
- Práctica #12 Reactivo LimitanteDocumento7 páginasPráctica #12 Reactivo LimitanteCamila CincoAún no hay calificaciones
- Informe Punto 4 y 6 de QuimicaDocumento9 páginasInforme Punto 4 y 6 de Quimicadiana vernazaAún no hay calificaciones
- Anexo - Tarea 4Documento16 páginasAnexo - Tarea 4Maicol HuertasAún no hay calificaciones
- Unidad 3 1Documento49 páginasUnidad 3 1api-37271430% (1)
- Experiencia Laboratorio 1 III° Medio EstequiometriaDocumento5 páginasExperiencia Laboratorio 1 III° Medio EstequiometriaIan BlaessingerAún no hay calificaciones
- Quimica 2Documento24 páginasQuimica 2Isaac GómezAún no hay calificaciones
- s13s1 Tarea Calculos EstequiometricosDocumento5 páginass13s1 Tarea Calculos Estequiometricossusey madelit apaza mamaniAún no hay calificaciones
- 09-28-2019 214110 PM SEMANA 6. Rendimiento de Una Reaccion QuimicaDocumento3 páginas09-28-2019 214110 PM SEMANA 6. Rendimiento de Una Reaccion Quimicadarwin henry inoñan guevaraAún no hay calificaciones
- Rendimiento de La AcetanilidaDocumento1 páginaRendimiento de La AcetanilidaJulio IbarraAún no hay calificaciones
- BBME U3 Evidencia Nayeli UriosteguiDocumento5 páginasBBME U3 Evidencia Nayeli UriosteguiNayeliAún no hay calificaciones
- Informe de Obtencion de AceiteDocumento8 páginasInforme de Obtencion de AceiteEsther ValeriaAún no hay calificaciones