0% encontró este documento útil (0 votos)
67 vistas20 páginasEquilibrio Químico y Teorías Ácido-Base
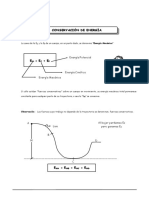
Este documento resume los conceptos clave del equilibrio químico, incluyendo que se establece cuando las velocidades de reacción directa e inversa son iguales, manteniendo constantes las concentraciones de reactivos y productos. También explica cómo calcular la constante de equilibrio Keq y cómo se ve afectada por variables como la temperatura, presión y concentración inicial. Finalmente, resume las teorías ácido-base de Arrhenius, Bronsted-Lowry y Lewis, y cómo clasificar ácidos y bases como fuertes o débiles.
Cargado por
Georgina RizzottoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
67 vistas20 páginasEquilibrio Químico y Teorías Ácido-Base
Este documento resume los conceptos clave del equilibrio químico, incluyendo que se establece cuando las velocidades de reacción directa e inversa son iguales, manteniendo constantes las concentraciones de reactivos y productos. También explica cómo calcular la constante de equilibrio Keq y cómo se ve afectada por variables como la temperatura, presión y concentración inicial. Finalmente, resume las teorías ácido-base de Arrhenius, Bronsted-Lowry y Lewis, y cómo clasificar ácidos y bases como fuertes o débiles.
Cargado por
Georgina RizzottoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd