Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Volumetría de Formación Complejos
Cargado por
CAROLINA TORRESDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Volumetría de Formación Complejos
Cargado por
CAROLINA TORRESCopyright:
Formatos disponibles
VOLUMETRÍA DE FORMACIÓN COMPLEJOS
Ingrid Betancourt (1926081), Juliana Guengue (1942006), Carolina Torres (1942670)
Departamento de Química, Facultad de Ciencias Naturales y Exactas Universidad del
Resumen
Por medio de una valoración complexométrica se determinó el porcentaje de Ca en una caliza,
se realizaron dos valoraciones con 0. 00962𝑀 de EDTA estandarizado en donde, para la
primera muestra se requirió un volumen de 8,9 mL y para la segunda un volumen de 9,2 mL, lo
cual arrojó un porcentaje de 𝐶𝑎𝑂 en la muestra de 48,02% para la 1 valoración y de 49,64 % de
𝐶𝑎𝑂 para la segunda, con un % de error del 14.3% el cual pudo deberse a que en la digestión de
la muestra problema no se eliminaron completamente los posibles iones interferentes.
Datos, Cálculos y Resultados
Se determinó el % de Ca en una caliza por
medio de una valoración complexométrica ,
para llevar esto a cabo primero se pesó
0.5001 g de muestra y se estandarizó la
solución de EDTA con patrón primario
𝐶𝑎𝐶𝑂3 0.005M obteniendo el siguiente
resultado:
0.005 𝑚𝑜𝑙 𝐶𝑎𝐶𝑂3 1 𝑚𝑜𝑙 𝐸𝐷𝑇𝐴
10𝑚𝐿 𝐶𝑎𝐶𝑂3 × ×
1000 𝑚𝐿 𝐶𝑎𝐶𝑂3 1 𝑚𝑜𝑙 𝐶𝑎𝐶𝑂3
1 1000𝑚𝐿
× 5.2 𝑚𝐿 𝐸𝐷𝑇𝐴
× 1𝐿
= 0. 00962𝑀 𝐸𝐷𝑇𝐴
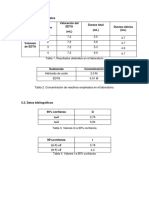
Con los siguientes datos se determinó el Prueba Q
promedio, desviación estándar y prueba Q 𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑜 =
|𝑟𝑒𝑠𝑢𝑙𝑡𝑎𝑑𝑜 𝑠𝑜𝑠𝑝𝑒𝑐ℎ𝑜𝑠𝑜−𝑟𝑒𝑠𝑢𝑙𝑡𝑎𝑑𝑜 𝑚á𝑠 𝑝𝑟ó𝑥𝑖𝑚𝑜|
𝑟𝑎𝑛𝑔𝑜 𝑑𝑒 𝑟𝑒𝑠𝑢𝑙𝑡𝑎𝑑𝑜𝑠
para los valores de estandarización que se |0.00794−0.00833|
𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑜 = = 0. 159
obtuvo en cada grupo de laboratorio: 0.0104−0.00794
Tabla 1. Resultados de la estandarización Se planteó las hipótesis:
de EDTA en los grupos de laboratorio.
𝐻𝑂 = 𝑁𝑜 ℎ𝑎𝑦 𝑣𝑎𝑙𝑜𝑟𝑒𝑠 𝑎𝑡í𝑝𝑖𝑐𝑜𝑠
𝐻𝐴 = 𝑆𝑖 ℎ𝑎𝑦 𝑢𝑛 𝑣𝑎𝑙𝑜𝑟 𝑎𝑡í𝑝𝑖𝑐𝑜
Obteniendo que: Posteriormente se procedió a determinar el
𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑜 < 𝑄𝑐𝑟í𝑡𝑖𝑐𝑜 % de 𝐶𝑎𝑂 en la muestra con el siguiente
0.159 0.574 procedimiento:
Por lo tanto Se aceptó la 𝐻𝑂 y se rechazó la Para la muestra 1:
𝐻𝐴, concluyendo que el valor de 0.00794 M 0.00962 𝑚𝑜𝑙 𝐸𝐷𝑇𝐴 1 𝑚𝑜𝑙 𝐶𝑎
8. 9𝑚𝐿 × 1000𝑚𝐿
× 1 𝑚𝑜𝑙 𝐸𝐷𝑇𝐴
no es un valor atípico.
1 𝑚𝑜𝑙 𝐶𝑎𝑂 56.1 𝑔 𝐶𝑎𝑂 250 𝑚𝐿
Finalmente se realizaron dos valoraciones 1 𝑚𝑜𝑙 𝐶𝑎
× 1 𝑚𝑜𝑙 𝐶𝑎𝑂
× 5 𝑚𝐿 𝑠𝑜𝑙 𝑝𝑟𝑜𝑏𝑙𝑒𝑚𝑎
con 0. 00962𝑀 de EDTA estandarizado y se 100
× 0.5001 𝑔 𝑚𝑢𝑒𝑠𝑡𝑟𝑎
= 48. 02% 𝐶𝑎𝑂
requirió un volumen de 8.9 mL de EDTA
para la primera valoración y 9.2 mL para la
Para la muestra 2:
segunda titulación, empleando murexida
como indicador hasta lograr el cambio de 0.00962 𝑚𝑜𝑙 𝐸𝐷𝑇𝐴 1 𝑚𝑜𝑙 𝐶𝑎
viraje de color rosa a púrpura.(Ver figura 9. 2𝑚𝐿 × 1000𝑚𝐿
× 1 𝑚𝑜𝑙 𝐸𝐷𝑇𝐴
1).
1 𝑚𝑜𝑙 𝐶𝑎𝑂 56.1 𝑔 𝐶𝑎𝑂 250 𝑚𝐿
1 𝑚𝑜𝑙 𝐶𝑎
× 1 𝑚𝑜𝑙 𝐶𝑎𝑂
× 5 𝑚𝐿 𝑠𝑜𝑙 𝑝𝑟𝑜𝑏𝑙𝑒𝑚𝑎
100
× 0.5001 𝑔 𝑚𝑢𝑒𝑠𝑡𝑟𝑎
= 49. 64% 𝐶𝑎𝑂
Luego se realizó un promedio de los
volúmenes obtenidos en las dos
valoraciones que fueron 8.9 mL y 9.2 mL
respectivamente, donde nos arrojó el
siguiente resultado 9.0 mL.
Por último se halló el porcentaje de error
con un valor teórico de 10.5 mL con la
siguiente ecuación:
[𝑣𝑎𝑙𝑜𝑟 𝑒𝑠𝑝𝑒𝑟𝑎𝑑𝑜− 𝑉𝑎𝑙𝑜𝑟 𝑟𝑒𝑎𝑙 ]
% 𝑒𝑟𝑟𝑜𝑟 = 𝑣𝑎𝑙𝑜𝑟 𝑟𝑒𝑎𝑙
× 100
|9.0−10.5|
% 𝑒𝑟𝑟𝑜𝑟 = 10.5
× 100 = 14. 3%
Discusión
Esta práctica se enfoca en la determinación
de Ca en caliza, roca sedimentaria
compuesta en mayor proporción por
carbonato de calcio 𝐶𝑎𝐶𝑂3 . Donde se
procede a tratar la muestra agregando
Figura 1. Titulación de solución problema
𝑁𝐻4𝐶𝑙 y 𝑁𝐻3 para precipitar el hierro,
con EDTA.
posteriormente se toma una alícuota de la
solución problema y se lleva a un pH básico
con NaOH, ya que estas valoraciones
complexométricas deben estar a pH
+ En esta práctica la murexida fue el indicador
regulado,al valorar 𝐶𝑎 en la solución
2+
problema debe estar mínimo a un pH adecuado para valorar los iones 𝐶𝑎 ,ya que
5 forma un complejo de color rosa, menos
alrededor de 8.
Para evitar la interferencia de otros cationes estable que el Ca-EDTA, por lo que al valorar
o asegurar el comportamiento satisfactorio con EDTA, los iones Ca2+ son sustraídos del
del indicador,en esta práctica se realizó las indicador produciendo el viraje de rosado a
titulaciones con ácido purpura.
etilendiaminotetraacético (EDTA) como
valorante.
Figura 4. Estructura del indicador Murexida
Una vez realizada la valoración con EDTA de
la solución problema se calculó un
porcentaje de error de 14.3% y esto pudo
deberse a que al momento de realizar la
digestión de la muestra problema, no se
Figura 2. Estructura química de EDTA
eliminaron completamente los posibles
iones interferentes.
Debido a que EDTA funciona como
Otra posible causa es que al momento de
compuesto valorante para la cuantificación
2+ realizar la valoración no se hizo una
de 𝐶𝑎 en la muestra por la afinidad que agitación constante produciendo así un
tiene el EDTA con los iones metálicos como falso viraje.
se observa en la figura 3:
Preguntas
¿Qué es un indicador metalocrómico?
Los indicadores metalocrómicos o
complexométricos son colorantes que
forman en presencia de iones metálicos
complejos débiles coloreados, con un color
diferente al del indicador no complejado,
estos resultan especialmente útiles en las
valoraciones complexométricas para indicar
el momento exacto en que todos los iones
Figura 3.Afinidad del EDTA por los iones metálicos de la disolución son secuestrados
metálicos en función del pH por un agente quelante. Tales indicadores
son también llamados por esta razón en un pH básico para así evitar
2 interferencia y obtener un buen
indicadores complexométricos.
comportamiento con el indicador.
¿Cuál es la estructura del complejo
Ca-EDTA? ● Se logró cuantificar el porcentaje de
calcio en la solución problema
formando un complejo metálico con
EDTA, este proceso es muy utilizado
debido a que el EDTA reacciona con
+
los iones de 𝐶𝑎 formando así
complejos más estables debido a su
propiedad de ligando multidentado.
● En las valoraciones
complexométricas con EDTA es muy
importante agitar continuamente la
3
Figura 5. Estructura del complejo Ca-EDTA. solución a analizar y después de
observar el cambio de coloración
¿Es posible utilizar el indicador negro de dejar reposar por un corto tiempo,
eriocromo T en una titulaciòn para de lo contrario se pueden registrar
cuantificar calcio? Si la respuesta es falsos virajes.
afirmativa, muestre los cuidados que deben Bibliografía
tenerse, sino explique las razones
1. https://dspace.unitru.edu.pe/bits
No es posible la cuantificación de calcio tream/handle/UNITRU/11550/G
utilizando negro de eriocromo T (EBT) alvezCubas_J.pdf?sequence=1&is
como indicador, pues la constante de Allowed=y
estabilidad del complejo Ca-EBT es muy 2. Análisis químico; Herbert A.
baja al ser comparada con la del Ca-EDTA, Laitinen; Walter E. Harris;
esto genera un viraje impreciso y el punto editorial reverté; Barcelona;
final se adelanta al punto de equivalencia, 1982; 211.
por otro lado, sí es un buen indicador para 3. https://es.wikipedia.org/wiki/%
la determinación conjunta de Calcio y C3%81cido_etilendiaminotetraac
Magnesio, debido a que la constante de %C3%A9tico
estabilidad del complejo Mg-EBT es menor 4. http://www.escritoscientificos.es
pero no muy alejada de las constantes /trab21a40/durezagua/pagina09
condicionales de formación de los .htm
complejos Mg-EDTA y Ca-EDTA, lo que hace 5. http://ubicua.cua.uam.mx/plugin
que este indicador sea idoneo para esa file.php/83420/mod_resource/co
4
situación. ntent/1/Fundamentos%20de%2
0Qu%C3%ADmica%20Anal%C3
Conclusiones %ADtica.pdf
● Para las valoraciones con EDTA
siempre se debe tener las soluciones
1
ANEXO.
También podría gustarte
- Determinacion de EtanolDocumento13 páginasDeterminacion de EtanolnataAún no hay calificaciones
- Semana 11 T Student EstadistikDocumento8 páginasSemana 11 T Student EstadistikNathaly Lizbeth Lizano Seminario100% (2)
- Integrales ImpropiasDocumento3 páginasIntegrales ImpropiasDiego Rojas100% (3)
- Enamorado de Una Stripper - Flor M UrdanetaDocumento92 páginasEnamorado de Una Stripper - Flor M UrdanetaNATHALY ANDREA CAMPOS GARRIDO0% (1)
- Infra R RojoDocumento6 páginasInfra R RojoJonatan DavidAún no hay calificaciones
- ComplejometríaDocumento4 páginasComplejometríaCAROLINA TORRESAún no hay calificaciones
- Ejercicios EstadisticaDocumento72 páginasEjercicios EstadisticaIngrid EspinozaAún no hay calificaciones
- Practica 2 Determinacion de La Dureza Del AguaDocumento4 páginasPractica 2 Determinacion de La Dureza Del AguaEsteban UrestiAún no hay calificaciones
- Reporte ProteínasDocumento11 páginasReporte ProteínasYamilet MenfozaAún no hay calificaciones
- Informe de Laboratorio N°01Documento15 páginasInforme de Laboratorio N°01YANIDED MILAGROS GENESIS VALLADOLID GIRONAún no hay calificaciones
- CLASE 1.5 Quimica AnalíticaDocumento31 páginasCLASE 1.5 Quimica AnalíticaalanvfotografiasAún no hay calificaciones
- Análisis Volumétrico de ClorurosDocumento6 páginasAnálisis Volumétrico de ClorurosCAROLINA TORRESAún no hay calificaciones
- Practica 3 AiDocumento7 páginasPractica 3 AiBrian Negrete sanchezAún no hay calificaciones
- MicrokjeldahlDocumento5 páginasMicrokjeldahlCAROLINA TORRESAún no hay calificaciones
- Informe N°3 AnalíticaDocumento11 páginasInforme N°3 AnalíticaCONSTANZA TRONCOSO MILLAAún no hay calificaciones
- Determinación de La Dureza Del AguaDocumento9 páginasDeterminación de La Dureza Del AguaAnonymous 28dbytAún no hay calificaciones
- 1 Estandarizacion Potenciometrica de AcDocumento14 páginas1 Estandarizacion Potenciometrica de AcCarolinaQuimbayaAún no hay calificaciones
- UV Listo ZMDocumento9 páginasUV Listo ZMharold diazAún no hay calificaciones
- Tarea Semana 3 Análisis InstrumentalDocumento6 páginasTarea Semana 3 Análisis InstrumentalJuan GilAún no hay calificaciones
- Determinacion de ClorurosDocumento4 páginasDeterminacion de Clorurosmayra potes100% (1)
- 10-Inf. Cromatografía de GasesDocumento6 páginas10-Inf. Cromatografía de GasesRandolsStivenReinelLopezAún no hay calificaciones
- Practica AlcalimetriaDocumento6 páginasPractica AlcalimetriaLuciana Fernanda Padilla ClavijoAún no hay calificaciones
- Informe 6Documento12 páginasInforme 6Duvan IbarguenAún no hay calificaciones
- Informe #4Documento13 páginasInforme #4alejandra alapeAún no hay calificaciones
- Informe 01 - GravimetríaDocumento4 páginasInforme 01 - GravimetríaManuela VanegasAún no hay calificaciones
- Determinación de Acetaminofén en Un Fármaco Por Espectrofotometría de Absorción UltravioletaDocumento9 páginasDeterminación de Acetaminofén en Un Fármaco Por Espectrofotometría de Absorción UltravioletaJimmy AcAún no hay calificaciones
- Practica 3 Lucy Acetaminofen en TabletasDocumento10 páginasPractica 3 Lucy Acetaminofen en TabletasKEYLA VANESSA MORALES RODRIGUEZ ESTUDIANTEAún no hay calificaciones
- Determinacion de Acetaminofen en Un Jarabe InformeDocumento6 páginasDeterminacion de Acetaminofen en Un Jarabe InformeJeffer ZuñiigaAún no hay calificaciones
- Valoración YodométricaDocumento5 páginasValoración YodométricaCAROLINA TORRESAún no hay calificaciones
- Cuestionario 2 Análisis de ExperimentosDocumento6 páginasCuestionario 2 Análisis de ExperimentosAlexis GOAún no hay calificaciones
- Informe 3Documento7 páginasInforme 3Diana Estefania Quillupangui ChAún no hay calificaciones
- Espectrometría de Absorción Atómica - LaboratorioDocumento10 páginasEspectrometría de Absorción Atómica - LaboratorioJairo CalizayaAún no hay calificaciones
- Reporte3acidoacetilsalicilico M.Olivares S.SalasDocumento6 páginasReporte3acidoacetilsalicilico M.Olivares S.Salasscarlett salasAún no hay calificaciones
- Practica 2 Determinación de CafeínaDocumento10 páginasPractica 2 Determinación de CafeínaTania Robles100% (2)
- Informe 03 Analisis InstrumentalDocumento5 páginasInforme 03 Analisis InstrumentalJorge Luis CastilloAún no hay calificaciones
- Análisis de Jugos y Pulpas de FrutasDocumento4 páginasAnálisis de Jugos y Pulpas de FrutasGERALDYN ORTIZ REYESAún no hay calificaciones
- Prueba de Hipótesis para Observaciones PareadasDocumento2 páginasPrueba de Hipótesis para Observaciones PareadasNelvi Contreras GarcíaAún no hay calificaciones
- Resolucao Mecanica Vetorial para Engenheiros 9ed Cap 6 10 EstaticaDocumento4 páginasResolucao Mecanica Vetorial para Engenheiros 9ed Cap 6 10 EstaticaCarolina RivasAún no hay calificaciones
- Unidad 3 Tarea 4 Análisis Instrumental de Compuestos CoordinadosDocumento12 páginasUnidad 3 Tarea 4 Análisis Instrumental de Compuestos CoordinadosJose MendozaAún no hay calificaciones
- Modelos de RegresiónDocumento22 páginasModelos de RegresiónMiguel Angel Rivera RuizAún no hay calificaciones
- Informe 1 Tratamiento Estadístico de DatosDocumento5 páginasInforme 1 Tratamiento Estadístico de DatosCAROLINA TORRESAún no hay calificaciones
- Ejemplos de Prueba de HipótesisDocumento10 páginasEjemplos de Prueba de HipótesisJuan DavidAún no hay calificaciones
- Informe 4 IR. Espinosa y Medina.Documento11 páginasInforme 4 IR. Espinosa y Medina.DANIELA ESPINOSA RAMOSAún no hay calificaciones
- Tratamiento de MuestraDocumento30 páginasTratamiento de MuestraAntonio Irvin Laura QuispeAún no hay calificaciones
- Práctica 4: Determinación de Carbonatos y BicarbonatosDocumento9 páginasPráctica 4: Determinación de Carbonatos y BicarbonatosGabriela CoyAún no hay calificaciones
- Informe 3Documento5 páginasInforme 3CRISTIAN LEONARDO ROZO GONZALEZAún no hay calificaciones
- Determinación de Acetaminofén en Un Fármaco Por Espectrofotometria de Absorción UltravioletaDocumento9 páginasDeterminación de Acetaminofén en Un Fármaco Por Espectrofotometria de Absorción UltravioletaJheins Yulieth Paja Trujillo100% (1)
- Practico Nº1 Precision ExactitudDocumento3 páginasPractico Nº1 Precision Exactitudgabriel viruez yepezAún no hay calificaciones
- Informe 7Documento6 páginasInforme 7julianaAún no hay calificaciones
- Analisis de ClorurosDocumento7 páginasAnalisis de ClorurosAngie AyalaAún no hay calificaciones
- Tratamiento Estadístico de DatosDocumento5 páginasTratamiento Estadístico de DatosCAROLINA TORRESAún no hay calificaciones
- Determinación de Calcio QADocumento5 páginasDeterminación de Calcio QARafael GonzálezAún no hay calificaciones
- Universidad Central Del Ecuador (Imforme 4)Documento16 páginasUniversidad Central Del Ecuador (Imforme 4)Victor Hugo Flores YandunAún no hay calificaciones
- Valoración Con IndicadoresDocumento5 páginasValoración Con IndicadoresSantiago CalderónAún no hay calificaciones
- Práctica 2. EstandarizaciónDocumento11 páginasPráctica 2. EstandarizaciónMARIA DEL MAR LOPEZ LONDOÑOAún no hay calificaciones
- Actividad 2 DiseñoDocumento7 páginasActividad 2 Diseñoariel yana morgaAún no hay calificaciones
- Resueltos Segundo Regulatorio BioestadisticaDocumento15 páginasResueltos Segundo Regulatorio BioestadisticaLorena AlvarezAún no hay calificaciones
- Tarea 3Documento10 páginasTarea 3Angel Neira MarceloAún no hay calificaciones
- ADA4EQ5Documento43 páginasADA4EQ5Maricarmen ChanAún no hay calificaciones
- Inferencial 2Documento22 páginasInferencial 2Paúl Erick Cabana LobonAún no hay calificaciones
- Ejemplario: Ecuaciones Diferenciales OrdinariasDe EverandEjemplario: Ecuaciones Diferenciales OrdinariasAún no hay calificaciones
- Tratamiento Estadístico de DatosDocumento5 páginasTratamiento Estadístico de DatosCAROLINA TORRESAún no hay calificaciones
- INFORME 5 Efecto QuelatoDocumento8 páginasINFORME 5 Efecto QuelatoCAROLINA TORRESAún no hay calificaciones
- Informe 2 Recristalización y Subimación Del Ácido BenzoicoDocumento4 páginasInforme 2 Recristalización y Subimación Del Ácido BenzoicoCAROLINA TORRESAún no hay calificaciones
- Informe 3 Sintesis y Carcaterización Trisoxalato Cromato de PotasioDocumento8 páginasInforme 3 Sintesis y Carcaterización Trisoxalato Cromato de PotasioCAROLINA TORRESAún no hay calificaciones
- Informe Ley PeriodicaDocumento6 páginasInforme Ley PeriodicaCAROLINA TORRESAún no hay calificaciones
- Informe RecristalizaciónDocumento7 páginasInforme RecristalizaciónCAROLINA TORRESAún no hay calificaciones
- MicrokjeldahlDocumento5 páginasMicrokjeldahlCAROLINA TORRESAún no hay calificaciones
- Informe Soluciones Reguladoras Betancourt Guengue TorresDocumento9 páginasInforme Soluciones Reguladoras Betancourt Guengue TorresCAROLINA TORRESAún no hay calificaciones
- Valoración YodométricaDocumento5 páginasValoración YodométricaCAROLINA TORRESAún no hay calificaciones
- Determinación GravimétricaDocumento4 páginasDeterminación GravimétricaCAROLINA TORRESAún no hay calificaciones
- Informe 1 Tratamiento Estadístico de DatosDocumento5 páginasInforme 1 Tratamiento Estadístico de DatosCAROLINA TORRESAún no hay calificaciones
- Análisis Volumétrico de ClorurosDocumento6 páginasAnálisis Volumétrico de ClorurosCAROLINA TORRESAún no hay calificaciones
- Alteraciones Agudas de Las Transaminasas y ColestasisDocumento13 páginasAlteraciones Agudas de Las Transaminasas y ColestasisAdrian CrespoAún no hay calificaciones
- Analogia de QuintoDocumento9 páginasAnalogia de QuintoZaida ZegarraAún no hay calificaciones
- CENIZODocumento18 páginasCENIZOJosé Luis FernándezAún no hay calificaciones
- Catalogo Motores TrifasicosDocumento14 páginasCatalogo Motores TrifasicosJorge Luis Camacho FalconAún no hay calificaciones
- P.6.Sistema de Alarmas Contraintrusi N GUARDAL VIVIENDADocumento3 páginasP.6.Sistema de Alarmas Contraintrusi N GUARDAL VIVIENDAagmorillaAún no hay calificaciones
- Ge Aksa Encapsulado e Insonorizado de 59.2 KW Stand by - Gei 0603-21-KdDocumento11 páginasGe Aksa Encapsulado e Insonorizado de 59.2 KW Stand by - Gei 0603-21-KdIvan ZuritaAún no hay calificaciones
- T. Ansiedad GeneralizadaDocumento2 páginasT. Ansiedad GeneralizadaBIBIANA DEL PILAR PIMIENTO ESCALANTEAún no hay calificaciones
- Refractometria Inf.7 FinalDocumento44 páginasRefractometria Inf.7 FinalMaJuTorresRimeyAún no hay calificaciones
- Clasificacion de Ciencias y Enfoques (Final)Documento4 páginasClasificacion de Ciencias y Enfoques (Final)Eduardo HAún no hay calificaciones
- ESP - Geomembrana MacLine SDH (MILS)Documento1 páginaESP - Geomembrana MacLine SDH (MILS)Carlos Alfaro GuerraAún no hay calificaciones
- s2 Reino MóneraDocumento3 páginass2 Reino MóneraSamuel Cruzado100% (1)
- Reacción de PrecipitaciónDocumento17 páginasReacción de PrecipitaciónDiego Lopez ClevesAún no hay calificaciones
- Densidad - Guión para Elaborar Los Informes de PrácticasDocumento14 páginasDensidad - Guión para Elaborar Los Informes de PrácticasApril MooreAún no hay calificaciones
- Trabajo de InvestigacionDocumento37 páginasTrabajo de InvestigacionLeslyAgredaNavarroAún no hay calificaciones
- Problema FlexionDocumento4 páginasProblema FlexionSandro AroAún no hay calificaciones
- Importancia de La RespiraciónDocumento2 páginasImportancia de La RespiraciónSebastian SuazaAún no hay calificaciones
- Las Técnicas de Comunicación VisualDocumento19 páginasLas Técnicas de Comunicación VisualMoni SanmedAún no hay calificaciones
- Control Social Y Redes SocialesDocumento33 páginasControl Social Y Redes SocialesPatriciaEspinosaAún no hay calificaciones
- Estudio Oceanográfico de La Playa Cedeño FinalDocumento32 páginasEstudio Oceanográfico de La Playa Cedeño FinalCindy RuizAún no hay calificaciones
- MonIRQ4. Baterías CSTRDocumento2 páginasMonIRQ4. Baterías CSTRAaron CarvajalAún no hay calificaciones
- Homilía Lunes Santo 6 de Abril de 2020Documento2 páginasHomilía Lunes Santo 6 de Abril de 2020Alexander Alvarado MalaverAún no hay calificaciones
- Lab 3 - CONSTRUCCION DEL VECTORÍMETRODocumento4 páginasLab 3 - CONSTRUCCION DEL VECTORÍMETRORuth Maldonado100% (2)
- Metodología para El Desarrollo de La Resistencia en EscolaresDocumento6 páginasMetodología para El Desarrollo de La Resistencia en EscolaresEverth OvandoAún no hay calificaciones
- AntecedentesDocumento5 páginasAntecedentesAna Aracelli LázaroAún no hay calificaciones
- Caso Clinico PrevenimssDocumento11 páginasCaso Clinico PrevenimssManlio Fabio Felix100% (1)
- Electricidad - Soluciones TPMDocumento2 páginasElectricidad - Soluciones TPMElvira FreitesAún no hay calificaciones
- Capítulo 5Documento8 páginasCapítulo 5AdonisAún no hay calificaciones
- Practica de Sensibilidad + Casos ClinicosDocumento12 páginasPractica de Sensibilidad + Casos Clinicosalison.barreraAún no hay calificaciones