Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cap-8-Kubby (Resumen)
Cargado por
Alarcon Osorio Cristhian AlfredoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cap-8-Kubby (Resumen)
Cargado por
Alarcon Osorio Cristhian AlfredoCopyright:
Formatos disponibles
lOMoARcPSD|7564891
CAP 8 Kuby
Fisiologia Humana (Universidad Autónoma de Chihuahua)
StuDocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
CAPITULO 8. COMPLEJO MAYOR DE HISTOCOMPATIBILIDAD Y
PRESENTACION DE ANTIGENO
En contraste con anticuerpos o receptores de células B, que
pueden reconocer antígenos directamente, los receptores de células T solo
reconocen fragmentos de antígeno posicionados sobre la superficie de otras
células, mantenidos dentro del surco de la molécula del complejo mayor de
histocompatibilidad (MHC). Estos fragmentos son generados dentro de la
célula después de digestión del antígeno y el complejo del péptido antigénico
más la molécula de MHC a continuación aparece sobre la superficie.
Hay 2 clases principales de moléculas de MHC: la clase I y la clase II,
que difieren en estructura, en su expresión en diferentes células y en la
fuente de antígenos que presentan a las células T. Las de clase I están
presentes en todas las células nucleadas, y se especializan en presentar
antígenos que se originan a partir del citosol (intracelulares), como proteínas
virales. Estas son presentadas a células T CD8. Las moléculas de clase II son
expresadas por células presentadoras de antígenos (APC), y se especializan en
presentar antígenos que han sido fagocitados en espacios extracelulares que
han sido fagocitados (hongos, bacterias). Esta molécula es presentada a
células T CD4.
ESTRUCTURA Y FUNCION DE MOLECULAS DE MHC
Las moléculas de MHC de clase I y II son glicoproteínas unidas a
membrana que funcionan como moléculas presentadoras de antígeno
altamente especializadas, con surcos que forman complejos
extraordinariamente estables con ligandos peptídicos, y los despliegan sobre
la superficie celular para reconocimiento por células T por medio de unión al
TCR. En cambio, las moléculas de MHC III son un grupo de proteínas que no
comparten similitud estructural o funcional con las clases I y II, y algunas
participan en otros aspectos de la respuesta inmunitaria.
La molécula de clase I está formada por una cadena α de 45 kDa y una
de β2-microglobulina de 12 kDa. La cadena α está organizada hacia 3
dominios externos (α1, α2, α3), un dominio transmembrana seguido de un
tramo corto de aminoácidos hidrofílicos, y un segmento de anclaje
citoplasmático. La β2-microglobulina tiene tamaño y organización similares al
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
dominio α3, esta molécula no contiene una región transmembrana y está
unida de manera no covalente a la cadena α. La estructura forma un surco
profundo de unión a péptido y puede unirse a un péptido de 8 a 10
aminoácidos.
El dominio α3 y la β2-microglobulina se clasifican como miembros de la
superfamilia de inmunoglobulinas por su gran parecido estructural con los
dominios de inmunoglobulina. Las 3 moléculas (cadena α, β2-microglobulina
y un péptido) son esenciales para el plegamiento y la expresión apropiados
del complejo MHC-péptido sobre la superficie celular.
Las moléculas de clase II contienen 2 cadenas diferentes, una α de 33
kDa y una β de 28 kDa, que se asocian por medio de interacciones no
covalentes. Cada cadena contiene 2 dominios externos (α1 y α2 – β1 y β2).
Los dominios α2 y β2 proximales también se clasifican en la familia de las
inmunoglobulinas. Los dominios α1 y β1 forman el surco de unión a péptido
para antígeno procesado. El surco de unión a péptido de clase II, como el de
las moléculas clase I, está compuesto de un piso de 8 cadenas β antiparalelas
y lados de hélices α antiparalelas, donde pueden unirse péptidos de 13 a 18
aminoácidos. La clase I presenta una abertura de tipo más parecido a
receptáculo, mientras que la de clase II posee un surco de extremo abierto
(bolsa abierta).
Se han identificado cientos de variantes alélicas distintas de moléculas
MHC (6 de clase I y 12 o más de clase II). Aun así, este número limitado de
moléculas debe ser capaz de presentar una enorme gama de diferentes
péptidos antigénicos a células T. Estas moléculas no expresan una
especificidad fina, en lugar de ello, una molécula de MHC dada puede unirse
a muchos péptidos diferentes y algunos péptidos pueden unirse a varias
moléculas MHC distintas. Debido a esta especificidad amplia, esta unión se
denomina “promiscua”.
La unión a clase I exige que el péptido contenga residuos de
aminoácido específicos cerca de los N y C terminales; no hay tal
requerimiento para la unión de clase II a péptido.
Los péptidos que se unen a moléculas clase I se derivan de proteínas
intracelulares endógenas que son digeridas en el citosol, a continuación son
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
transportados al retículo endoplásmico donde interactúan con moléculas
MHC I, este proceso se conoce como vía de procesamiento endógeno o
citosólico.
La capacidad de una molécula MHC I para unirse a un espectro diverso
de péptidos se debe a la presencia de los mismos residuos de aminoácido, o
de residuos de aminoácidos similares en posiciones clave a lo largo de los
péptidos. Estos aminoácidos son conocidos como residuos ancla. Las cadenas
laterales de los residuos ancla en el péptido son complementarias con
características de superficie de surco de unión de MHC I.
Todos los péptidos examinados a la fecha que se unen a MHC I
contienen un ancla carboxilo terminal. Estas anclas generalmente son
residuos hidrofóbicos (leucina, isoleucina, etc.), aunque algunos son
aminoácidos cargados. Además del residuo ancla en el carboxilo terminal,
otra ancla suele encontrarse en la segunda posición, o en la segunda y tercera
posición en el extremo amino terminal del péptido. Los principales contactos
entre las moléculas MHC I y los péptidos a los que se unen comprenden el
residuo 2 en el extremo amino terminal, y el residuo 9 en el carboxilo
terminal del péptido. Los aminoácidos en el centro del péptido forman un
arco que se aleja de la molécula de MHC, estando más expuestos y pudiendo
interactuar de modo más directo con el receptor de célula T.
Los péptidos que se unen a moléculas de clase II derivan de proteínas
exógenas (propias o extrañas) que son degradadas dentro de la vía de
procesamiento exógeno, internalizadas por fagocitosis o mediante
endocitosis mediada por receptor. Los péptidos unidos a MHC II mantienen
una elevación relativamente constante sobre el piso del surco de unión. Un
péptido con núcleo central de 13 aminoácidos determina la capacidad de este
para unirse a MHC II. Péptidos más largos pueden ser adaptados en el surco,
pero las características de unión están determinadas por los 13 residuos
centrales.
Los péptidos de unión a clase II carecen de residuos ancla conservados.
En lugar de eso, los enlaces de hidrogeno entre el esqueleto del péptido y la
molécula clase II están distribuidos en todo el sitio de unión en lugar de estar
agrupados predominantemente en los extremos del sitio, como en los de
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
clase I. Los péptidos que se unen a clase II contienen una secuencia interna
de 7 a 10 aminoácidos que proporcionan los principales puntos de contacto.
En general, esta secuencia tiene un residuo aromático o hidrofóbico en el
amino terminal, y otros 3 residuos hidrofóbicos en la porción media del
extremo carboxilo terminal del péptido. Además, más del 30% de los
péptidos eluidos de clase II contiene un residuo prolina en la posición 2 y otra
agrupación de prolina en el extremo carboxilo terminal. Esta flexibilidad
contribuye a la promiscuidad de unión a péptido.
ORGANIZACIÓN GENERAL Y HERENCIA DEL MHC
Si bien la diversidad de receptor de célula B y T es generada por medio
de reordenamiento genómico y edición de gen, las moléculas de MHC han
optado por una combinación de promiscuidad de unión a péptido y la
expresión de varias moléculas de MHC diferentes sobre cada célula. Usando
esta estrategia combinada inteligente, el sistema inmunitario ha adquirido
por evolución una manera de maximizar las oportunidades de que muchas
regiones diferentes, o epítopos, de un antígeno sean reconocidas.
El complejo mayor de histocompatibilidad es un conjunto de genes
dispuesto dentro de un tramo continuo largo de ADN en el cromosoma 6. El
MHC se denomina complejo de antígeno leucocítico humano (HLA). Los genes
que codifican para el MHC están organizados en regiones que codifican para 3
clases de moléculas:
- Genes que codifican para MHC I: codifican para glicoproteínas
expresadas sobre la superficie de casi todas las células nucleadas, su
función es la presentación de antígenos endógenos a células T CD8.
- Genes que codifican para MHC II: codifican para glicoproteínas
expresadas sobre APC, su función es presentar antígenos a células T
CD4.
- Genes que codifican para MHC III: codifican para varias proteínas
diferentes, algunas con funciones inmunitarias, incluso componentes
del sistema de complemento y moléculas involucradas en la
inflamación.
Las moléculas clase I, con loci en A, B y C (HLA A, B, C) se denominan
moléculas clase I clásicas, todas poseen la capacidad funcional de presentar
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
fragmentos de antígeno proteínico a células T. Algunos genes adicionales
dentro de la región de clase I codifican para moléculas clase I no clásicas que
solo son expresadas en tipos de células específicos y tienen funciones más
especializadas. Algunas parecen desempeñar un papel en la discriminación
de lo propio/extraño, un ejemplo es la molécula HLA-G clase I. Estas se hallan
presentes sobre células fetales en la interfaz materno-fetal, y se les atribuye
inhibir el rechazo por células T CD8 maternas al proteger al feto contra
identificación como extraño, lo que puede ocurrir cuando antígenos
derivados del padre empiezan a aparecer en el feto en desarrollo.
Las moléculas de clase II son codificadas por las regiones DP, DQ y DR
(clásicas); estas codifican tanto para la cadena α y β de la MHC II. Al igual que
en la clase I, existen moléculas no clásicas con funciones inmunitarias
especializadas. Por ejemplo, se han identificado los genes que codifican para
DM y DO. Los genes DM codifican para una molécula HLA-DM que facilita la
carga de péptidos antigénicos hacia moléculas de MHC II. Las moléculas DO
solo son expresadas en el timo y sobre células B maduras y sirven como
reguladoras del procesamiento de antígeno clase II.
La región de MHC III codifica para varias moléculas que son cruciales
para la función inmunitaria, pero que tienen poco en común con las
moléculas I y II. Los productos clase III incluyen componentes del
complemento C4, C2 y factor B, así como varias citocinas inflamatorias,
incluso las 2 proteínas factor de necrosis tumoral (TNF-α y TNF-β o
linfotoxina-α). Los polimorfismos dentro del gen que codifica para TNF-α, que
codifica para una citocina involucrada en muchos procesos inmunitarios, han
sido vinculados a susceptibilidad a ciertas enfermedades infecciosas y a
algunas formas de autoinmunidad, incluso enfermedad de Crohn y artritis
reumatoide.
Se dice que cepas endogámicas son singénicas cuando son idénticas en
todos los loci genéticos. 2 cepas son congénicas si son genéticamente
idénticas excepto en una región genética única.
Los genes dentro del locus del MHC muestran una forma de expresión
codominante, lo que significa que los productos del gen tanto maternos como
paternos son expresados al mismo tiempo y en las mismas células. Debido a
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
ello, el producto expresara las proteínas de MHC de ambas cepas
parenterales, por lo que se dice que es histocompatible con ambas cepas.
Esto significa que la descendencia es capaz de aceptar injertos cuya fuente es
uno u otro progenitor, cada uno de los cuales expresara alelos del MHC vistos
como propios. En cambio, ninguno de los progenitores podría recibir injerto
de su descendencia, porque la mitad de las moléculas de MHC serán vistas
como no propias o extrañas. También hay una probabilidad de que los
hermanos hereden los mismos haplotipos paternos y maternos, haciéndolos
histocompatibles entre ellos.
Como resultado de recombinación y otros mecanismos para generar
mutaciones, es raro que cualesquiera 2 individuos no emparentados tengan
grupos idénticos de genes que codifican para HLA. Por ello se hace bastante
difícil el trasplante entre individuos que no son gemelos idénticos. Aun con
coincidencias parciales, es necesario administrar dosis grandes de fármacos
inmunosupresores a fin de inhibir las fuertes respuestas de rechazo que
aparecen luego de un trasplante.
Las moléculas de HLA-A, B o C pueden presentar péptidos a células T
CD8, y las moléculas HLA-DP, DQ o DR pueden presentar péptidos a células T
CD4. Así, se dice que la región del MHC es poligénica porque contiene
múltiples genes con la misma función pero con estructuras un poco
diferentes. La diversidad generada por la combinación de todas estas
moléculas de MHC aumenta el número de diferentes péptidos antigénicos
que pueden ser presentados y, por ende, es ventajoso para el organismo en el
combate a la infección.
La estrategia para generar diversidad dentro de moléculas de MHC y los
receptores de antígeno sobre células T y B no es la misma. Los anticuerpos y
los receptores de células T son generados por varios procesos somáticos,
incluso reordenamiento de gen y la mutación somática de genes
reordenados. Así, la generación de receptores de células T y B es dinámica,
cambia con el tiempo dentro de un individuo. En contraste, las moléculas de
MHC expresadas por un individuo son fijas. Pero la promiscuidad de unión a
antígeno asegura que incluso las proteínas nuevas tengan probabilidades de
contener algunos fragmentos que pueden asociarse con cualquier molécula
de MHC dad. En conjunto, esto acumula una enorme flexibilidad dentro del
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
huésped para responder a cambios ambientales inesperados que podrían
surgir en el futuro.
Cierta evidencia sugiere que una reducción del polimorfismo de MHC
dentro de una especie puede predisponer a esa especie a enfermedad
infecciosa. Esto sugiere que el alto nivel de polimorfismo del MHC que se ha
observado en muchas especies tal vez proporcione una ventaja en cuanto a la
supervivencia al suministrar una amplia gama de moléculas de MHC y, así, un
amplio espectro de antígenos presentables.
Algunos alelos de HLA ocurren a una frecuencia mucho más alta en
personas que sufren ciertas enfermedades que en la población general. Las
enfermedades asociadas con alelos de MHC particulares comprenden
trastornos autoinmunitarios, ciertas enfermedades virales, trastornos del
sistema de complemento, algunos trastornos neurológicos y varias alergias.
Por ejemplo, el alelo HLA-B27 se asocia con espondilitis anquilosante. HLA-
DQB1 con narcolepsia. HLA-DQ2 con enfermedad celiaca. HLA-B57 con un
mayor control viral y una progresión más lenta hacia el SIDA en individuos
infectados por VIH.
FUNCION DEL MHC Y PATRONES DE EXPRESION
Además de combatir la infección, la expresión del MHC en todo el
organismo desempeña un papel clave en el mantenimiento de la homeostasis
y la salud aun en ausencia de antígeno extraño. Hay varias razones por las
cuales una molécula de MHC sobre la superficie de una célula es importante:
- Desplegar clase I propia para demostrar que la célula está sana.
- Desplegar péptido extraño en clase I para mostrar que la célula está
infectada y para unirse a células TC.
- Desplegar un péptido propio en clase I y clase II para probar células T
en desarrollo respecto a autorreactividad (órganos linfoides primarios).
- Desplegar un péptido propio en clase I y II para mantener la tolerancia
a proteínas propias (órganos linfoides secundarios).
- Desplegar un péptido extraño en clase II para mostrar que el cuerpo
está infectado y activar células TH.
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
El trabajo de las moléculas de MHC clase I es reunir y presentar
antígenos que provienen de ubicaciones intracelulares; esta es una forma de
vigilancia continua de lo que sucede dentro de la célula. A menudo, nada más
que procesos celulares normales están ocurriendo en el citoplasma, y en
estos casos las células presentan péptidos propios en el surco de moléculas
MHC I, emitiendo señales de que la célula está sana. La falta de MHC I propio
establece a esa célula como objetivo para muerte por células NK. En este
caso, la célula se llama una célula blanco porque se convierte en un blanco
para lisis por células T citotóxicas.
Las moléculas de MHC II despliegan principalmente péptidos que
provienen de los espacios extracelulares del organismo. Dado que este
muestreo de contenido extracelular no es una forma de vigilancia policial que
todas las células necesitan realizar, solo leucocitos especializados poseen esta
capacidad. Estas células se denominan APC y su trabajo es presentar antígeno
extracelular a células T, y les asigna el trabajo final de coordinar la eliminación
de este invasor extracelular.
Las moléculas de MHC I clásicas son expresadas de manera constitutiva
sobre casi todas las células nucleadas del cuerpo. Con todo, el nivel de
expresión difiere entre diferentes tipos de células; las cifras de mayor
expresión se encuentran en linfocitos; otras células como fibroblastos,
miocitos, hepatocitos y algunas células neurales expresan cifras muy bajas o
indetectables de MHC I. Algunos tipos de células (neuronas, espermatozoides
en ciertas etapas de diferenciación) parecen carecer del todo de moléculas
MHC I. Células no nucleadas, como los eritrocitos, carecen en absoluto de
estas moléculas.
Además de las células infectadas por virus, células propias alteradas,
como células cancerosas, células del organismo en envejecimiento o células
provenientes de un injerto alogénico, también pueden servir como células
blanco debido a su expresión de proteínas MHC extrañas, y pueden ser
lisadas por células T citotóxicas.
Las células que despliegan péptidos asociados con moléculas MHC II a
células TH CD4 se llaman células presentadoras de antígenos y son
principalmente ciertos tipos de leucocitos. Los APC están especializados por
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
su capacidad para avisar al sistema inmunitario de la presencia de un invasor
e impulsar la activación de respuestas de células T. La activación de APC por
lo general ocurre después de una interacción con un agente patógeno y/o por
medio de emisión de señales de citosinas, que a continuación inducen
incrementos importantes de la expresión de MHC II.
Se sabe de 3 tipos de células que son consideradas células
presentadoras de antígenos profesionales (pAPC), las cuales difieren entre sí
por sus mecanismos:
- Células dendríticas: se consideran las más eficaces de las APC. Dado
que estas células expresan de manera constitutiva cifras altas de
moléculas de MHC II y tienen actividad coestimuladora inherente,
pueden activar células T vírgenes.
- Macrófagos: deben ser activadas (TLR) antes de que expresen MHC II o
moléculas de membrana coestimuladoras (CD80/86).
- Células B: expresan de manera constitutiva moléculas MHC II, y poseen
receptores de superficie específicos para antígeno, lo que las hace en
particular eficientes para capturar su antígeno cognado y presentarlo.
Deben ser activadas antes de que expresen las moléculas
coestimuladoras que se requieren para activar células TH vírgenes.
El MHC I es expresado de manera constitutiva por casi todas las células
del organismo, mientras que las de clase II solo es expresada en ciertas
circunstancias, y en un número muy limitado de tipo de células. Las APC en
particular están condicionadas para mostrar respuesta a indicios locales que
llevan a su activación y expresión aumentada de MHC, lo que les permite
armar a otras células del cuerpo para la batalla. Esta activación y armado de
APC deben estar regulados cuidadosamente, para que estas células no dirijan
maniobras agresivas indeseadas contra componentes propios o
acompañantes benignos, como ocurre en afecciones clínicas como
autoinmunidad o alergia.
La presencia de desencadenantes internos o externos, como invasores
intracelulares o citosinas, puede inducir una cascada de transducción de señal
que lleva a cambios de la expresión de gen que codifica para MHC. Por
ejemplo, un activador de la transcripción de MHC II llamado CIITA
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
(transactivador complejo mayor de histocompatibilidad clase II) y otro factor
de transcripción llamado RFX, activan el promotor de genes que codifican
para MHC II. Los defectos de estos factores causan el síndrome del linfocito
desnudo, porque carecen de moléculas MHC II sobre sus células, y sufren
inmunodeficiencia grave.
Algunos virus (citomegalovirus, virus de la hepatitis B y adenovirus 12)
interfieren con la expresión de MHC I, y eviten la detección temprana por
células T CD8. Las cifras disminuidas de expresión de MHC I reducen la
probabilidad de que células infectadas por virus puedan desplegar complejos
peptídicos virales sobre su superficie y hacerse blancos para destrucción
mediada por CTL.
La expresión de MHC está regulada externamente por diversas
citosinas. Entre las principales son los interferones (α, β, γ) y los factores de
necrosis tumoral (TNF-α y linfotoxina-α), cada uno de los cuales aumenta la
expresión de MHC I sobre células. Las células fagocíticas que están
involucradas en respuestas innatas, o células infectadas localmente, son las
primeras en producir estas citosinas reguladoras de MHC. En particular, el
INF-α (producido por una célula después de infección viral o bacteriana) y el
TNF-α (secretado por APC después de activación) suelen ser las primeras
citosinas que desencadenan un evento de regulación ascendente de MHC I.
En las etapas más tardías, el IFN-γ, secretado por células TH activadas,
también contribuye a la expresión aumentada de MHC. La unión de estas
citosinas a sus respectivos receptores induce cascadas de emisión de señales
intracelulares que activan factores de transcripción y alteran patrones de
expresión.
Los corticoesteroides y las prostaglandinas disminuyen la expresión de
moléculas MHC II. Estos compuestos naturales, permeables a membrana se
unen a receptores intracelulares y son algunos de los supresores más
potentes de la inmunidad adaptativa, principalmente con base en su
capacidad para inhibir la expresión de MHC.
El haplotipo de MHC desempeña un fuerte papel en el resultado de
una respuesta inmunitaria, porque estos alelos determinan cuales
fragmentos de proteína serán presentados. La ausencia de una molécula de
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
MHC que pueda unirse a un péptido particular y presentarlo, o la ausencia de
receptores de célula T que puedan reconocer un complejo de moléculas de
MHC-péptido dado, da lugar a capacidad de respuesta inmunitaria disminuida
a una sustancia extraña dada, y puede explicar la relación observada entre el
haplotipo del MHC y la capacidad para mostrar respuesta a antígenos
exógenos particulares.
Las células T, tanto CD4 como CD8, solo pueden reconocer antígeno
cuando es presentado en el surco de una molécula de MHC, y el haplotipo de
MHC de la APC y de la célula T deben concordar; es decir, la célula T CD4 solo
es activada y prolifera en presencia de macrófagos pulsados con antígenos
que comparten alelos de MHC II; y los CD 8 está restringido a MHC I.
El procesamiento de antígeno se requiere para reconocimiento por
células T. Durante un intervalo de 1 a 3 hrs, los APC han captado el antígeno,
lo han procesado hacia fragmentos peptídicos, y han desplazado estos
fragmentos sobre la membrana celular en una forma capaz de activar células
T. La internalización y el procesamiento podrían sortearse si las APC
quedaban expuestas a fragmentos peptídicos ya digeridos en lugar de al
antígeno natural. El procesamiento de antígeno requiere la digestión de la
proteína hacia péptidos que pueden ser reconocidos por células TH
específicos. El procesamiento de antígeno es un proceso metabólico que
digiere proteínas hacia péptidos, que entonces pueden ser desplegados sobre
la superficie celular junto con una molécula de MHC I o II.
El sistema inmunitario usa diferentes vías para eliminar antígenos
intracelulares y extracelulares. Como regla general, los antígenos endógenos
son procesados por vía citosólica o endógena, y presentados sobre la
membrana con MHC I. Los antígenos exógenos típicamente son procesados
en la vía exógena y presentados sobre la membrana con MHC II. Estos son los
principios generales que siguen las 2 vías:
- La presentación por clase I requiere síntesis interna de proteína del
virus, como se muestra por el requisito de que la célula blanco este
infectada por virus vivos, y por la inhibición de presentación por clase I
observada cuando la síntesis de proteína se bloqueó mediante el
inhibidor emetina.
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
- La presentación por clase II puede ocurrir con virus vivos o virus
incompetentes para la replicación; los inhibidores de la síntesis de
proteína no tuvieron efecto, lo que indica que la síntesis de proteína
nueva no es una condición necesaria para la presentación por clase II.
- La presentación por clase II, no así la presentación por clase I, es
inhibida por tratamiento de las células con un agente que bloquea el
procesamiento endocítico dentro de la célula (cloroquina).
Los péptidos presentados por moléculas de MHC I y II son traficados a
través de compartimientos intracelulares separados; las MHC I interactúan
con péptidos derivados de degradación citosólica de proteínas sintetizadas de
manera endógena; las moléculas clase II interactúan con péptidos derivados
de degradación endocítica de antígenos exógenos.
LA VIA ENDOGENA DE PROCESAMIENTO Y PRESENTACION DE ANTIGENO.
En células eucariontes, las concentraciones de proteína están
cuidadosamente reguladas. Cada proteína está sujeta a recambio continuo, y
es degradada a una tasa que por lo general se expresa en términos de su vida
media. La vida media promedio para proteínas celulares es de alrededor de 2
días, pero muchas son degradadas en el transcurso de 10 minutos. La
consecuencia del recambio continuo de proteínas tanto normales como
defectuosas es un aluvión constante de productos de degradación dentro de
una célula. Casi todos serán degradados a los aminoácidos que los
constituyen, y reciclados, pero algunos persisten en el citosol como péptidos.
La célula muestrea estos péptidos y presenta algunos sobre la membrana
plasmática en asociación con MHC I, donde células del sistema inmunitario
pueden muestrear estos péptidos para buscar proteínas extrañas.
Las proteínas intracelulares son degradadas hacia péptidos cortos por
un sistema proteolítico citosólico llamado proteosoma. El proteosoma grande
(20S) está compuesto de 14 subunidades dispuestas en una estructura de
anillos tipo barril. Muchas proteínas son establecidas como objetivo de
proteólisis cuando una proteína (ubiquitina) es fijada a ellas. Estos
conjugados de ubiquitina-proteína entran al complejo del proteosoma, que
consta de la base 20S y un componente regulador 19S fijo. El complejo del
proteosoma divide enlaces peptídicos en un proceso dependiente de ATP.
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
Además del proteosoma 20S, un proteosoma distinto puede encontrarse en
pAPC y en células de tejidos infectados, el cual recibe el nombre de
inmunoproteosoma, y tiene algunos componentes singulares que pueden ser
inducidos por exposición a INF-γ o TNF-α.
El inmunoproteosoma se recambia con mayor rapidez que un
proteosoma estándar, posiblemente porque la magnitud aumentada de su
degradación de proteína en su presencia puede tener consecuencias más allá
del establecimiento de células infectadas como objetivo.
La proteína TAP (transportador asociado con procesamiento de
antígeno), es un heterodímero que abarca la membrana, que consta de 2
proteínas TAP1 y TAP2; es la encargada de transportar péptidos desde el
citoplasma hacia el RER, donde se sintetizan moléculas de MHC I. Estas
proteínas median el transporte de aminoácidos, azucares, iones y péptidos,
dependiente de ATP.
Los péptidos generados en el citosol por el proteosoma son
translocados por la TAP hacia el RER mediante un proceso que requiere la
hidrolisis de ATP. La TAP tiene afinidad por péptidos que contienen 8 a 16
aminoácidos. La longitud optima del péptido para unión a MHC I es de
alrededor 9 aminoácidos, y los péptidos más largos son recortados por
enzimas presentes en el ER, como la ERAP (aminopeptidasa del retículo
endoplásmico). Además, la TAP parece favorecer péptidos con aminoácidos
carboxilo terminal hidrofóbicos o básicos, los residuos ancla preferidos para
MHC I.
El montaje de los componentes hacia un complejo molecular de MHC I
estable que pueda salir del RER requiere la presencia de un péptido en el
surco de unión de la molécula clase I. este proceso involucra varios pasos e
incluye la participación de chaperones moleculares que facilitan el
plegamiento de los polipéptidos. El primer chaperón es la calnexina, una
proteína de membrana residente del ER. ERp57, una proteína que tiene
actividad enzimática, y la calnexina, se asocian con la cadena α clase I y
promueven su plegamiento. Cuando la β2-microglobulina se une a la cadena
α, la calnexina es liberada, y la molécula MHC I se asocia con la chaperona
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
calreticulina y con tapasina. La tapasina acerca mucho el trasportador TAP a la
molécula clase I, y permite que adquiera un péptido antigénico.
La ERAP 1 elimina el residuo amino terminal de péptidos para alcanzar
tamaño óptimo para unión a clase I. Como consecuencia de unión a péptidos
productiva, la molécula clase I despliega estabilidad aumentada, y puede
disociarse del complejo con calreticulina, tapasina y ERp57. La molécula clase
I, a continuación, puede salir del RER y proceder a la superficie por medio del
complejo de Golgi.
LA VIA EXOGENA DE PROCESAMIENTO Y PRESENTACION DE ANTIGENO
Las APC pueden internalizar material particulado mediante fagocitosis
o por medio de endocitosis mediada por receptores. Los macrófagos y las
células dendríticas internalizan antígeno por medio de ambos procesos. Casi
todas las otras APC muestran poca o ninguna actividad fagocítica. Las células
B internalizan antígeno con mucha eficacia por medio de endocitosis mediada
por receptores al usar como receptor su inmunoglobulina de membrana
específica para antígeno.
La vía de procesamiento de antígeno endocítica parece comprender
varios compartimientos cada vez más ácidos, incluso endosomas tempranos
(6 a 6.5), endosomas tardíos o endolisosomas (4.5 a 5) y lisosomas (4.5). El
antígeno internalizado progresa por estos compartimientos, y se encuentra
enzimas hidrolíticas y un pH más bajo en cada compartimento. En el
compartimiento MIIC ocurre la degradación final de la proteína y carga de
péptido hacia proteínas MHC II. Este procesamiento de antígeno puede ser
inhibido por agentes químicos que incrementen el pH de los compartimientos
(cloroquina), así como por inhibidores de proteasa (leupeptina). Finalmente
los compartimentos endocíticos o parte de ellos vuelven a la periferia celular,
donde se fusionan con la membrana plasmática.
Dado que las APC expresan moléculas de MHC tanto para clase I como
para clase II, debe haber algún mecanismo para evitar que las moléculas de
MHC II se unan a los péptidos antigénicos destinados para clase I. Cuando se
sintetizan MHC II dentro del RER, estas cadenas αβ clase II se asocian con una
proteína llamada cadena invariante (Ii, CD74). En ausencia de la cadena
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
invariante, las moléculas de clase II permanecen principalmente en el ER y no
transitan más allá del cis-Golgi.
Conforme la actividad proteolítica aumenta en cada compartimiento
sucesivo, la cadena invariante es gradualmente degrada. Pero un fragmento
corto de la cadena invariante llamado CLIP (péptido de cadena invariante
asociado a clase II) permanece unido a la molécula clase II después de que
casi toda la cadena invariante ha sido dividida. CLIP físicamente ocupa el
surco de unión a péptido de MHC II, lo que evita cualquier unión prematura
de péptido derivado de antígeno.
Se requiere unión a péptido para mantener la estructura y estabilidad
de moléculas de clase II. Una vez que se ha unido un péptido, el complejo de
MHC II-péptido es transportado a la membrana plasmática, donde el pH
neutro permite al complejo adoptar una forma estable, compacta.
HLA-DO actúa como un regulador negativo de unión a antígeno,
modula la función de HLA-DM y cambia el repertorio de péptidos que se unen
de preferencia a moléculas clase II clásicas. Originalmente se observó HLA-DO
solo en células B y en el timo, pero recientemente se ha expandido a células
dendríticas donde se cree que está implicado en el mantenimiento de la
autotolerancia. Las células dendríticas son esenciales en el establecimiento
de la tolerancia de lo propio, así como en la presentación de autoantígenos a
células T autorreactivas. La expresión de DO normal puede desempeñar un
papel importante en la modulación de la conducta de DM para asegurar la
presentación de un repertorio de péptidos propios que estimula la tolerancia
a antígenos propios.
El hecho de si un péptido antigénico se asocia con MHC I o II esta
dictado parcialmente por el modo de entrada hacia la célula, sea exógeno o
endógeno, por el sitio de procesamiento, y por el tipo de célula.
PRESENTACION CRUZADA DE ANTIGENOS EXOGENOS
En algunos casos, las APC desviaran antígeno exógeno obtenido
mediante endocitosis hacia una vía que conduce a carga de MHC I y
presentación de péptido a CTL; en otras palabras, cruce de las 2 vías. El
fenómeno de presentación cruzada requiere que los antígenos internalizados
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
que normalmente serian manejados por la vía exógena que da pie a
presentación por MHC II, de alguno modo quedan redirigidos hacia una vía de
carga de péptido clase I. cuando esta forma de presentación de antígeno lleva
a la activación de respuestas de CTL, se denomina preparación cruzada;
cuando conduce a la inducción de tolerancia en estas células T CD8 se llama
tolerancia cruzada.
Las células dendríticas son las células más eficientes de los
presentadores cruzados. La más potente de las células dendríticas
presentadoras cruzadas parece residir en órganos linfoides secundarios,
donde se cree que reciben antígeno proveniente de fuentes extracelulares
mediante transferencia desde APC que están migrando, o desde células
infectadas moribundas.
Se han propuesto 2 posibles modelos para la manera en que células
dendríticas logran presentación cruzada. El primero plantea la hipótesis de
que las células presentadoras cruzadas poseen maquinaria de procesamiento
de antígeno especial que permite la carga de péptidos derivados de manera
exógena sobre moléculas MHC I. La segunda teoría postula maquinaria de
endocitosis especializada que puede enviar antígeno internalizado
directamente a un orgánulo (fagosoma o endosoma temprano), donde
péptidos que provienen de esos antígenos a continuación son cargados sobre
moléculas MHC I usando maquinaria convencional. Pueden existir múltiples
mecanismos para direccionar péptidos derivados desde el exterior hacia
moléculas clase I.
La capacidad de algunas células dendríticas para presentar de manera
cruzada antígenos plantea una gran ventaja para el huésped. Permite que
estas APC capten virus desde el ambiente extracelular o desde células que
están muriendo, que procesen estos antígenos virales, y que activen TLC que
pueden atacar células infectadas por virus, lo que inhibe la diseminación
adicional de la infección. Entonces, ¿Por qué no todas las APC efectúan
presentación cruzada? La respuesta podría ser que las células presentadoras
cruzadas podrían convertirse con rapidez en blancos de lisis de ellas mismas.
Para ayudar a explicar cómo está regulada la presentación cruzada y se
mantiene la tolerancia, se ha propuesto que las células dendríticas podrían
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
necesitar primero recibir “licencia” antes de que puedan efectuar
presentación cruzada. El tipo de célula que se postula que suministra este
papel de emisión de licencia son las células T CD4 activadas. La manera en
que se cree que funciona esto es que la vía exógena clásica de procesamiento
de antígeno en células dendríticas conduce a presentación de antígeno a
células T CD4 pode medio de MHC II, lo que lleva a la activación de estas
células. A continuación, estas células auxiliares activadas podrían devolver el
favor al inducir moléculas coestimuladoras en la célula dendrítica y mediante
secreción de citocina, lo que proporciona una segunda opinión que,
respectivamente, otorga licencia a la célula dendrítica para presentar
antígenos internalizados por medio de MHC I, y ayuda a activar células T CD8
vírgenes. Este requerimiento para emisión de licencia por una célula TH
podría ayudar a evitar la inducción accidental de CTL contra antígenos no
patogénicos o proteínas propias.
PRESENTACION DE ANTIGENOS NO PEPTIDICOS
Algunos antígenos no proteínicos derivados de agentes patógenos
también son reconocidos por células T. Diversos tipos de células T (que
expresan receptores de célula T γδ, así como αβ) pueden reaccionar contra
antígenos lipídicos, como el ácido micólico, derivado de agentes patógenos
como Mycobacterium tuberculosis. Estos antígenos son presentados por
miembros de la familia CD1 de moléculas clase I no clásicas.
Las moléculas de CD1 comparten similitud estructural con el MHC I
clásico, pero se superponen funcionalmente con el MHC II.
Se ha hallado que muchas estructuras lipídicas o enlazadas a lípidos
diferentes se asocian de modo no covalente con moléculas CD1. En general,
casi todas estas son antígenos glucolípidos o lipoproteína, en los cuales la
porción lipídica se adapta en bolsas profundas dentro del surco de unión a
CD1, y el grupo cabeza hidrofílico permanece expuesto, lo que permite
reconocimiento por células T. Estructuras cristalinas han demostrado que CD1
contiene un surco de unión que es más profundo y más estrecho que las
moléculas MHC clásicas. Estos surcos están revestidos con aminoácidos no
polares, que pueden dar cabida fácilmente a estructuras lipídicas. Algunas de
estas bolsas corresponden a grandes rasgos con las bolsas de unión a
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
lOMoARcPSD|7564891
antígeno de MHC I clásico, y permiten que el antígeno tenga acceso a un
surco profundo a través de una abertura estrecha.
Lípidos propios de cadena corta con afinidad relativamente baja son
cargados sobre moléculas de CD1 en el ER, poco después de la traducción, y
permiten plegamiento apropiado de proteína CD1. Estas moléculas CD1
cargadas con antígeno propio a continuación viajan a la superficie celular,
donde en algunos casos estos antígenos propios de baja afinidad pueden ser
intercambiados por lípidos exógenos. Al igual que con las moléculas de MHC
II, después de endocitosis y movimiento hacia ambientes de pH más bajo, se
cree que las proteínas CD1 intercambian sus parejas, de unión de baja
afinidad, péptido propio, por antígenos lipídicos de alta afinidad, de cadena
larga, derivados de modo exógeno, residentes en fagosomas o en endosomas
tardíos. Estas moléculas de CD1 recién cargadas a continuación vuelven a la
superficie celular para reconocimiento por células T restringidas a CD1.
Descargado por Alarcón Osorio Cristhian Alfredo (cristhianalarcon2002@gmail.com)
También podría gustarte
- CMHDocumento12 páginasCMHKarla CaballeroAún no hay calificaciones
- Capítulo 6 Sistema Del ComplementoDocumento26 páginasCapítulo 6 Sistema Del ComplementoJonatan Pinto100% (1)
- Modelos de MangasDocumento6 páginasModelos de MangasGLORIA MARITSA RAMON ASTOAún no hay calificaciones
- Guia Pinchos La LaurelDocumento80 páginasGuia Pinchos La LaurelasdfasfsAún no hay calificaciones
- Desarrollo de CuellosDocumento2 páginasDesarrollo de CuellosGLORIA MARITSA RAMON ASTOAún no hay calificaciones
- Patrón JubónDocumento18 páginasPatrón JubónMargarita100% (1)
- Astral AmDocumento16 páginasAstral AmClaudia Elena Toledo SerrallongaAún no hay calificaciones
- Modisteria Principios Basicos de Corte PDFDocumento32 páginasModisteria Principios Basicos de Corte PDFjlfigueroag6902Aún no hay calificaciones
- Alta CosturaDocumento6 páginasAlta CosturaGLORIA MARITSA RAMON ASTOAún no hay calificaciones
- Feng Shui ConsejosDocumento11 páginasFeng Shui ConsejosEstefania LaraAún no hay calificaciones
- Histología del tejido conjuntivoDocumento14 páginasHistología del tejido conjuntivoMaría José Inostroza Contreras100% (5)
- Frotis Sanguíneo - Jenny Rivera MezaDocumento9 páginasFrotis Sanguíneo - Jenny Rivera Mezaaprolab2013100% (1)
- Maquina RectaDocumento2 páginasMaquina RectaJose G Bautista TeranAún no hay calificaciones
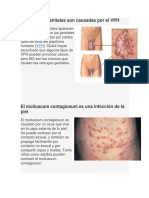
- La Verrugas Genitales Son Causadas Por El VPHDocumento2 páginasLa Verrugas Genitales Son Causadas Por El VPHCyber PlussAún no hay calificaciones
- Estructura y función del receptor de célula B y TCRDocumento9 páginasEstructura y función del receptor de célula B y TCRAnny ZhengAún no hay calificaciones
- El Material Básico para Hacer Un Maquillaje de FantasíaDocumento2 páginasEl Material Básico para Hacer Un Maquillaje de FantasíaAriana Iñiguez LuzónAún no hay calificaciones
- Analisis Microbiologicos de Pastas de Se PDFDocumento60 páginasAnalisis Microbiologicos de Pastas de Se PDFjuangabriel Jimenez SalasAún no hay calificaciones
- Tu Carta Astral Gratis, Astrologia Los ArcanosDocumento8 páginasTu Carta Astral Gratis, Astrologia Los ArcanosFernanda RiveraAún no hay calificaciones
- Miasis PDFDocumento33 páginasMiasis PDFMia Obando Velasquez100% (1)
- Práctica 2. Elaboración de Frotis SanguíneoDocumento9 páginasPráctica 2. Elaboración de Frotis SanguíneoVANESSA YARAVY MURGUIA MEDINA100% (1)
- Eosinofilos en OrinaDocumento1 páginaEosinofilos en Orinael zair100% (1)
- Autoinmunidad: respuesta inmune contra lo propioDocumento38 páginasAutoinmunidad: respuesta inmune contra lo propioVaquero Soleto Maria ReneéAún no hay calificaciones
- L1, Venopunción, Frote Sanguíneo y Tinción Giemsa y WrightDocumento15 páginasL1, Venopunción, Frote Sanguíneo y Tinción Giemsa y Wrightjackeline100% (1)
- PCR Real Tiempo Salmonella AlimentosDocumento24 páginasPCR Real Tiempo Salmonella AlimentosYessica100% (1)
- Diapositivas de EstafilococosDocumento33 páginasDiapositivas de EstafilococosMilagrOs Benites Reyes100% (1)
- ArnDocumento3 páginasArnDaniel Garcia100% (1)
- Manual de Laboratorio de MicologiaDocumento119 páginasManual de Laboratorio de MicologiaJosé Ángel Robles100% (2)
- TincionesDocumento19 páginasTincionesRafael Choque0% (1)
- Generalidades GeneticaDocumento3 páginasGeneralidades GeneticaDra Daniela TorresAún no hay calificaciones
- Seminario 5 Pruebas Cruzadas IncompatiblesDocumento16 páginasSeminario 5 Pruebas Cruzadas IncompatiblescelulasdianaAún no hay calificaciones
- Como Maquillarse Como Jack SparrowDocumento5 páginasComo Maquillarse Como Jack SparrowcomomaquillarseAún no hay calificaciones
- Exudado NasalDocumento2 páginasExudado NasalSarita MedranoAún no hay calificaciones
- 01 Historia de La MicologíaDocumento11 páginas01 Historia de La MicologíaJesus Bautisto Huichi Jara100% (1)
- Inmunología RegueyroDocumento3 páginasInmunología RegueyroKarime Fahme GonzalezAún no hay calificaciones
- Inmunodeficiencias CongénitasDocumento121 páginasInmunodeficiencias CongénitasDaniela GonzalezAún no hay calificaciones
- Proceso de UrocultivoDocumento24 páginasProceso de UrocultivoJudith Yolanda Leon OchoaAún no hay calificaciones
- INFLAMACION y FAGOCITOSISDocumento7 páginasINFLAMACION y FAGOCITOSISYoly Vasquez100% (2)
- CrioglobulinasDocumento15 páginasCrioglobulinasglodovichiAún no hay calificaciones
- Antisépticos y DesinfectantesDocumento24 páginasAntisépticos y DesinfectantesAline González RomoAún no hay calificaciones
- Aislamiento de MicroorganismosDocumento11 páginasAislamiento de Microorganismos.:("*"BLacK BuLLeT"*"):.100% (2)
- Anaerobios No EsporuladosDocumento4 páginasAnaerobios No Esporuladosangelvic73Aún no hay calificaciones
- Generalidades de MicologíaDocumento21 páginasGeneralidades de Micologíamayuchilindrina100% (4)
- CROMOBLASTOMICOSIS PaolaDocumento11 páginasCROMOBLASTOMICOSIS PaolaVanessa RoseroAún no hay calificaciones
- La sangre: funciones, componentes y grupos sanguíneosDocumento18 páginasLa sangre: funciones, componentes y grupos sanguíneosedwinAún no hay calificaciones
- S. LINFATICO CompletoDocumento13 páginasS. LINFATICO CompletoMariel Gonzalez100% (1)
- Trichosporon BeigeliiDocumento11 páginasTrichosporon BeigeliiADRIAN0% (1)
- Glosario de TerminosDocumento13 páginasGlosario de TerminosCarmen M A CavadiaAún no hay calificaciones
- Lesiones Alveolares DifusasDocumento52 páginasLesiones Alveolares DifusasCarlosAntonioMaldonadoAún no hay calificaciones
- Preguntas Formativas Patología Vasos Sanguíneos y PulmónDocumento11 páginasPreguntas Formativas Patología Vasos Sanguíneos y PulmónEveline Pulinario LorenzoAún no hay calificaciones
- Complemento Mapa ConceptualDocumento14 páginasComplemento Mapa ConceptualJDominguezBernalAún no hay calificaciones
- Neisseria, Moraxella y AcinetobacterDocumento30 páginasNeisseria, Moraxella y AcinetobacterCésar MachadoAún no hay calificaciones
- Antigenos Tumorales, Respuesta Inmunitaria Frente A Tumores e InmunoterapiaDocumento5 páginasAntigenos Tumorales, Respuesta Inmunitaria Frente A Tumores e InmunoterapiaIsrael Rene Bonilla MoreiraAún no hay calificaciones
- cUESTIONARIO bACTERIOLOGIADocumento36 páginascUESTIONARIO bACTERIOLOGIAAlex ChicaizaAún no hay calificaciones
- Chopita - Inmunidad MucosasDocumento7 páginasChopita - Inmunidad MucosasMartita JuárezAún no hay calificaciones
- Coloración PAPDocumento24 páginasColoración PAPBrenda Lia CvAún no hay calificaciones
- Parasitos Flagelados - Silvio Torres Bautsia - QBP - 602Documento48 páginasParasitos Flagelados - Silvio Torres Bautsia - QBP - 602Melquiades SebbastiamAún no hay calificaciones
- Estructura y función de las moléculas del complejo mayor de histocompatibilidad (MHCDocumento17 páginasEstructura y función de las moléculas del complejo mayor de histocompatibilidad (MHCLuis DiazzAún no hay calificaciones
- MHC Complejo Mayor HistocompatibilidadDocumento25 páginasMHC Complejo Mayor HistocompatibilidadAli Partiido100% (1)
- Complejo Mayor de Histocompatibilidad MHCDocumento9 páginasComplejo Mayor de Histocompatibilidad MHCAldo AguilarAún no hay calificaciones
- Apuntes de Inmunología - Procesamiento y Presentación de AntígenoDocumento4 páginasApuntes de Inmunología - Procesamiento y Presentación de AntígenoAlienAún no hay calificaciones
- Síndrome MetabólicoDocumento4 páginasSíndrome MetabólicoAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Yaaa Bastaaa x2Documento22 páginasYaaa Bastaaa x2Alarcon Osorio Cristhian AlfredoAún no hay calificaciones
- 6th Central Pay Commission Salary CalculatorDocumento15 páginas6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- DocumentoDocumento3 páginasDocumentoAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Pericarditis Resumen HarrisonDocumento5 páginasPericarditis Resumen HarrisonAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Síndrome Coronario Agudo 230328 234219Documento8 páginasSíndrome Coronario Agudo 230328 234219Alarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Guía de Temas Anatomía 2021Documento3 páginasGuía de Temas Anatomía 2021Alarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Guía BioquiDocumento6 páginasGuía BioquiAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Guía de AnatoDocumento13 páginasGuía de AnatoAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Guía de Temas Anatomía 2021Documento3 páginasGuía de Temas Anatomía 2021Alarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Dermatomas ApunteDocumento1 páginaDermatomas ApunteAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Ejercicio 0.157251248Documento1 páginaEjercicio 0.157251248Alarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Guía de AnatoDocumento13 páginasGuía de AnatoAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Guía BioquiDocumento6 páginasGuía BioquiAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Manual de Laboratorio 2021Documento104 páginasManual de Laboratorio 2021Alarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Cap 1 y 8 de MooreDocumento403 páginasCap 1 y 8 de MooreAlarcon Osorio Cristhian AlfredoAún no hay calificaciones
- Libro de BiologíaDocumento864 páginasLibro de BiologíaAlarcon Osorio Cristhian Alfredo91% (35)
- Semiologia Alvarado 7 Edicion PDFDocumento531 páginasSemiologia Alvarado 7 Edicion PDFLaura Sofia89% (18)
- Examen Latin Selectividad Junio 2019 Enunciado PDFDocumento3 páginasExamen Latin Selectividad Junio 2019 Enunciado PDFsoletebcAún no hay calificaciones
- Calcular La Diferencia Entre Dos Fechas JUDITHDocumento6 páginasCalcular La Diferencia Entre Dos Fechas JUDITHjudithzapataAún no hay calificaciones
- Sesión COM Miercoles 16-11-2022 Leyenda La HuacacchinaDocumento8 páginasSesión COM Miercoles 16-11-2022 Leyenda La HuacacchinaedelmiraAún no hay calificaciones
- Taller Modulo FinancieroDocumento12 páginasTaller Modulo FinancieroádrianAún no hay calificaciones
- Perforadora de Chimenea 3Documento4 páginasPerforadora de Chimenea 3Byron Giácomo Trigoso MarínAún no hay calificaciones
- Hospital 120 CamasDocumento46 páginasHospital 120 CamasJorge SanangoAún no hay calificaciones
- Tarea 3 - Administracion ContemporáneaDocumento5 páginasTarea 3 - Administracion ContemporáneaGiovanny JairAún no hay calificaciones
- Liberacion de HogarDocumento13 páginasLiberacion de Hogarhmartinez_escobarAún no hay calificaciones
- GPC BE No 104 Manejo de Intoxicacion Aguda Por Sustancias Recreativas IGSSDocumento103 páginasGPC BE No 104 Manejo de Intoxicacion Aguda Por Sustancias Recreativas IGSSJose Fuentes100% (1)
- Excavaciones en mecánica de rocas: criterios de excavabilidad aplicados a desmontes en calizas y pizarrasDocumento34 páginasExcavaciones en mecánica de rocas: criterios de excavabilidad aplicados a desmontes en calizas y pizarrasMiguel Bedón GomezAún no hay calificaciones
- Máquina de Turing: Funcionamiento y aplicación en el código EnigmaDocumento4 páginasMáquina de Turing: Funcionamiento y aplicación en el código EnigmaDavid MoralesAún no hay calificaciones
- El Derecho Internacional AmbientalDocumento32 páginasEl Derecho Internacional AmbientalCristian VásquezAún no hay calificaciones
- Partidos Politicos 1821-1870 en GuatemalaDocumento12 páginasPartidos Politicos 1821-1870 en GuatemalaOtonielLopezAún no hay calificaciones
- Zapata - Las Sesenta y Siete Celebres Preguntas Del Teologo EspañolDocumento9 páginasZapata - Las Sesenta y Siete Celebres Preguntas Del Teologo EspañolJuan M Garcia CondeAún no hay calificaciones
- InecuacionesDocumento3 páginasInecuacionesMiraida Millán RodríguezAún no hay calificaciones
- Comparación Metodología Tradicional y Comprensiva en La Práctica Del BaloncestoDocumento16 páginasComparación Metodología Tradicional y Comprensiva en La Práctica Del Baloncestocamilo ramirezAún no hay calificaciones
- Qué Fue Primero La Gallina o El HuevoDocumento2 páginasQué Fue Primero La Gallina o El HuevoJesús GonzalezAún no hay calificaciones
- Argumentacion Juridica TP4, SIGLO 21Documento4 páginasArgumentacion Juridica TP4, SIGLO 21Ayee BravoAún no hay calificaciones
- Bacterias Ii P 2021Documento13 páginasBacterias Ii P 2021Obed GodenAún no hay calificaciones
- El DineroDocumento12 páginasEl Dineroluz angely100% (1)
- 058-Carta Cierre de Vias Feria ParqueDocumento3 páginas058-Carta Cierre de Vias Feria ParqueCarlo ManroAún no hay calificaciones
- Reseña de Elizabeth (1998)Documento4 páginasReseña de Elizabeth (1998)Jorge Luis Herrera0% (1)
- El Justo FloreceraDocumento5 páginasEl Justo FloreceraMiguel CgAún no hay calificaciones
- TAREADocumento6 páginasTAREADenisse MontoyaAún no hay calificaciones
- Unidad 3Documento6 páginasUnidad 3taniaAún no hay calificaciones
- 1.2. Es Tiempo de DecidirDocumento2 páginas1.2. Es Tiempo de DecidirDiego RhAún no hay calificaciones
- TAROT EVOLUTIVO - Primeros Pasos - Diana López IriarteDocumento12 páginasTAROT EVOLUTIVO - Primeros Pasos - Diana López IriarteAngel Jurado100% (4)
- Pasto Jaragua2Documento8 páginasPasto Jaragua2David Martin SykoraAún no hay calificaciones
- 24.2. DPM - Sentencia SincromarcasDocumento10 páginas24.2. DPM - Sentencia SincromarcasSalome Perea IsazaAún no hay calificaciones
- Ejercicio de LocalizacionDocumento9 páginasEjercicio de LocalizacionKevin Stiven Rocha MolinaAún no hay calificaciones
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- TDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosDe EverandTDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosCalificación: 4 de 5 estrellas4/5 (8)
- Muchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)De EverandMuchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)Calificación: 4 de 5 estrellas4/5 (475)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Nuestra mente nos engaña: Sesgos y errores cognitivos que todos cometemosDe EverandNuestra mente nos engaña: Sesgos y errores cognitivos que todos cometemosCalificación: 3.5 de 5 estrellas3.5/5 (6)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Neuropsicología: Los fundamentos de la materiaDe EverandNeuropsicología: Los fundamentos de la materiaCalificación: 5 de 5 estrellas5/5 (1)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- Psicópatas seriales: Un recorrido por su oscura e inquietante naturalezaDe EverandPsicópatas seriales: Un recorrido por su oscura e inquietante naturalezaCalificación: 4 de 5 estrellas4/5 (3)
- Abrázame fuerte: Siete conversaciones para un amor duraderoDe EverandAbrázame fuerte: Siete conversaciones para un amor duraderoManu BerásteguiCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Sana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónDe EverandSana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónCalificación: 5 de 5 estrellas5/5 (4)
- Genética general: Libro de textoDe EverandGenética general: Libro de textoCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- ABC de los procedimientos médicos básicos: Una guía de aprendizaje y enseñanza para profesionales de medicinaDe EverandABC de los procedimientos médicos básicos: Una guía de aprendizaje y enseñanza para profesionales de medicinaCalificación: 4 de 5 estrellas4/5 (4)
- Minerales y vitaminas: Micronutrientes esenciales en la alimentación, nutrición y salud.De EverandMinerales y vitaminas: Micronutrientes esenciales en la alimentación, nutrición y salud.Calificación: 3 de 5 estrellas3/5 (2)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- La Dieta Mediterránea Para Principiantes, Guía Paso A Paso Con Recetas Para Comer Mejor Y Bajar De PesoDe EverandLa Dieta Mediterránea Para Principiantes, Guía Paso A Paso Con Recetas Para Comer Mejor Y Bajar De PesoCalificación: 5 de 5 estrellas5/5 (2)