Documentos de Académico
Documentos de Profesional
Documentos de Cultura
LOPEZ
Cargado por
Armando GemeDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
LOPEZ
Cargado por
Armando GemeCopyright:
Formatos disponibles
ESTREPTOMICINA: INFORME TÉCNICO
NH
Introducción.-
NH C NH2
La estreptomicina fue aislada del
H HN actinomiceto Streptomyces griseus en 1943
H 2N C
NH H por A. Shatz, E. Bugie y S. A. Waksman. Es
OH H un antibiótico aminoglucósido
OH aminociclitol, abreviadamente
OH
aminoglucósido. De las muchas sales de
H
estreptomicina que se sintetizaron y
H ensayaron, el sulfato de estreptomicina es
O la menos dolorosa e irritante cuando se
administra por vía intramuscular; y, en
consecuencia, es la única que sigue
H utilizándose en las preparaciones
O
farmacéuticas.
CHO H
CH 3
Consideraciones históricas
H
OH
sobre los aminoglucósidos.-
O Primera parte.-
H Los actinomicetos son microorganismos del
O suelo que comparten características de
OH
bacterias y hongos. Greig-Smith observó ya
CH 2 en 1917, que actinomicetos obtenidos de
H HN
CH3 muestras del terreno en New South Wales
H H
(Estados Unidos) fabricaban sustancias con
HO OH H características antibióticas (estrictamente:
sustancias capaces de inhibir la
multiplicación de otras bacterias).
Rudolf Lieske comunicó poco tiempo después que algunos actinomicetos causaban la lisis de
Staphylococcus aureus y Streptococcus pyogenes.
Trabajando independientemente, y posiblemente desconocedores de los trabajos de Rudofl
Lieske en Estados Unidos, Andrè Gratia, en el Instituto Pasteur de Bruselas, dieron a
conocer la utilización de sustancias fabricadas por especies de Streptothrix y Actinomyces
para causar la lisis de cultivos bacterianos, y obtener así antígenos fabricados por las
bacterias lisadas. Los “mucolisados” (tal era la denominación) se inyectaron a pacientes para
inducir la formación de anticuerpos frente a las bacterias seleccionadas. Los intentos de
tratar infecciones de esta manera fracasaron.
Maurice Welsch, en el Rockefeller Institute denominó actinomicetina al compuesto principal
del “mucolisado”.
Segunda parte.-
S. A. Waksman obtuvo una sustancia cristalina a partir de Actinomyces antibioticus, a la
que, por eso mismo, denominó actinomicina-A. El producto fue estudiado por laboratorios
Merck, en Rahway. Sin embargo, el antibiótico resultó demasiado tóxico para su empleo en
terapéutica humana.
-1-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
El apoyo de fundaciones (Commonwealth Fund, Mrs. Albert Lasker) permitió a S. A.
Waksman continuar sus investigaciones.
Waksman aisló en 1941 otras dos sustancias con actividad antibiótica: clavacina (patulina) y
fumigatina. Aun cuando su toxicidad era inferior a la actinomicina-A, continuaban siendo
inadecuadas para su aplicación en terapéutica humana. En aquellos años comenzaba a
estudiarse la penicilina (Florey y Chain, en Oxford, UK). La penicilina se mostraba eficaz
solo frente a las bacterias Gram positivas. Y, así, Waksman concentró sus esfuerzos en la
búsqueda de antibióticos eficaces frente a las infecciones causadas por Gram negativos. De
esta línea de investigación surgió primero la estreptotricina. Este antibiótico se mostraba
eficaz frente a las infecciones que no respondían a la penicilina (esto es, infecciones causadas
por Gram negativos). Y, además, parecía tener un patrón de seguridad suficiente para ser
ensayado en humanos. Lamentablemente, a los pocos días de iniciados los tratamientos con
estreptotricina, se ponía de manifiesto una importante toxicidad renal. Y los estudios con
estreptotricina fueron abandonados.
La tenacidad de S. A. Waksman hizo que recondujera sus esfuerzos, a partir de 1943, hacia la
búsqueda de antibióticos para tratar la tuberculosis (un enorme problema médico en aquella
época; no olvidemos que eran los años de la II Guerra Mundial).
El principal problema con que se enfrentaba era que el agente causal de la tuberculosis
(Mycobacterium tuberculosis) crece muy despacio en los medios de cultivo; dando al traste
con gran parte de los protocolos de investigación seguidos hasta entonces. Se eligió otra
especie de Mycobacterium (M. phlei), si bien ésta no era patógena para el hombre. Y así, los
productos que se mostraban potencialmente eficaces en la lisis de los cultivos de M. phlei,
eran ensayados en animales con tuberculosis.
Los actinomicetos, a los que tantos años y esfuerzo había dedicado Waksman, le depararían
el éxito, tan buscado como merecido: en septiembre de 1943 aisló del actinomiceto
Streptomyces griseus un antibiótico con notable eficacia frente a la peste, la brucelosis y
varias formas de disentería bacteriana. A pesar de que sus propiedades físicas eran
semejantes a la estreptotricina, el nuevo antibiótico no mostraba toxicidad renal. Se le
denominó estreptomicina, dilucidándose su estructura química en 1947.
Tercera parte.-
Tras unos primeros ensayos en cobayas tuberculosos, con resultados favorables, se iniciaron
estudios a gran escala en pacientes humanos. Y las primeras conclusiones confirmaron que la
estreptomicina era un excelente antibiótico frente la micobacteria tuberculosa.
Durante muchos años, la estreptomicina fue la primera línea de tratamiento contra la
tuberculosis. Sin embargo, pronto se puso en evidencia que las dosis elevadas dañaban el
nervio auditivo causando sordera. Por suerte, el hallazgo de otros fármacos tuberculostáticos
hizo posible la administración de dosis más bajas de estreptomicina; logrando con ello una
menor incidencia de pérdida auditiva irreversible.
-2-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
Waksman aisló en 1949 otro importante antibiótico partiendo de cepas de Streptomyces
fradiæ: la neomicina. Se trataba de un antibiótico complejo, del que solo la neomicina-B
(ahora denominada simplemente neomicina) llegó a ser útil en terapéutica. La estructura de
la neomicina se desentrañó en 1962, consiguiéndose su síntesis química completa en 1987.
Este mismo antibiótico fue aislado en Francia en 1954, creyéndose que se trataba de un
antibiótico distinto, y denominándose framicetina. Al poco tiempo se descubrió que
framicetina y neomicina-B eran, de hecho, el mismo antibiótico.
Debido a la neurotoxicidad de la neomicina, solo forma parte de preparados galénicos para
uso tópico dermatológico, otológico u oftalmológico.
-3-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
En 1957, Hamao Umezawa, en el Instituto de Química Microbiana, en Tokio (Japón), aisló
otro antibiótico al que llamó kanamicina. En un principio se incluyó en programas de
investigación de antineoplásicos. Más tarde, se aisló la kanamicina-A (el componente
principal del complejo proteico que, de facto, era la kanamicina aislada por Hamao
Umezawa. Su estructura se dilucidó en 1958, lográndose su síntesis química completa
algunos años más tarde. Se reservaba para infecciones causadas por Staphylococcus aureus
resistentes a penicilina; así como otras infecciones graves por Gram negativos resistentes a
gentamicina.
-4-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
La lincomicina se aisló en el año 1962, partiendo de cepas de Streptomyces lincolnensis,
obtenidas de muestras del suelo de Lincoln, Nebraska, Estados Unidos. Su estructura se
desentrañó en 1964; y su síntesis química se consiguió en 1970. Fue pronto superado por un
análogo estructural: clindamicina, menos tóxico y con mucha mejor biodisponibilidad oral.
-5-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
La gentamicina-C1 se aisló de un complejo antibiótico producido por Micromonospora
purpurea (sinónimo: Micromonospora echinospora). El trabajo se llevó a cabo en 1963 por
investigadores de Schering Corporation, en Bloomfield, New Jersey, Estados Unidos. Cuatro
años más tarde (1967) se descifró su estructura química. Fue (y continúa siendo) el
antibiótico aminoglucósido de elección, al que pronto siguieron otros: amikacina, netilmicina
y tobramicina.
ANTIBIÓTICO AMINOGLUCÓSIDO AISLAMIENTO ESTRUCTURA SÍNTESIS QUÍMICA COMPLETA
Estreptomicina 1943 1947 ¿?
Neomicina 1949 1962 1987
Kanamicina 1957 1958 ¿?
Lincomicina 1962 1964 1970
Gentamicina 1963 1967 ¿?
Microorganismos sensibles.-
Micobacterias.-
Mycobacterium tuberculosis, tanto de origen bovino como humano. No obstante, la mayoría
de las micobacterias atípicas son resistentes a la estreptomicina.
La estreptomicina es el único aminoglucósido eficaz frente a Mycobacterium leprae, si bien
se precisan dosis elevadas, habitualmente 150mg/Kg.
Bacterias Gram negativas.-
La estreptomicina es activo frente a gran número de bacterias Gram negativas, tales como
Escherichia coli, Enterobacter spp, Klebsiella spp, Proteus spp, Providencia spp, Serratia
spp, Citrobacter spp, Salmonella spp, Shigella spp, Brucella spp, Neisseria meningitides, N.
gonorrhoeae, Haemophilus influenzae, H. ducreyi, Pasteurella multocida, Campylobacter
spp, Yersina spp (incluyendo Yersina pestis), y Yersina enterocolica.
Los gérmenes anaerobios, tales como Bacteroides fragilis, son resistentes a la
estreptomicina. (ver: “mecanismo de acción”).
Bacterias Gram positivas.-
Algunas cepas de Staphylococcus aureus son sensibles. La resistencia de algunas cepas de
esta bacteria Gram positiva está mediada por plásmidos. Muchos otros cocos Gram positivos,
y bacilos son resistentes.
Streptococci de los grupos A, B y G, Streptococci viridans, y los Streptococci del grupo D no
enterocócicos (vg. Streptococcus boris) se consideran relativamente resistentes a la
estreptomicina (CIMs en el rango 5,0mcg/ml ↔ 250mcg/ml) Esta se considera como
resistencia “de bajo nivel” y este tipo de “resistencia” se supera con la combinación de
[penicilina G + Estreptomicina], asociación no aditiva sino sinérgica. La sinergia se explica
porque la penicilina ejerce un efecto directo sobre el potencial de membrana de la bacteria
que estimula la captación de la estreptomicina; si bien algunas cepas de todos estos
estreptococos se deben considerar resistentes a la estreptomicina, dado que sus
-6-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
CIMs>2000mcg/ml; y en estos casos no tiene sentido la asociación penicilina G +
estreptomicina.
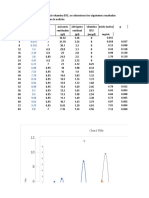
Relación entre las concentraciones en suero y la dosis inyectada.-
concentración en suero
mcg/ml
40 dosis de 1g
30
dosis de 0,5g
20
10
1 2 3 4 5 6 7 8 9
tiempo (horas)
La estreptomicina se absorbe rápidamente tras la inyección intramuscular (IM), lográndose
la concentración máxima al cabo de 1 hora (ver gráfico) Doblando la dosis, se dobla la
concentración máxima, CMÁX. (20mcg/ml tras la dosis de 0,5g; y 40mcg/ml tras la dosis de
1g).
Las concentraciones en suero son detectables 12 horas después de la inyección (tras la dosis
de 0,5g); y 24 horas después tras la dosis de 1g.
La estreptomicina se excreta rápidamente por filtración glomerular. En los pacientes con
función renal normal, la mayor parte de la excreción (hasta un 90%) tiene lugar en las
primeras 12 horas tras la inyección intramuscular. Se logran concentraciones elevadas en la
orina [200mcg/ml → 400mcg/ml], tras una inyección intramuscular de 0,5g.
Cantidades muy pequeñas de estreptomicina (<1% de la dosis total administrada) se excretan
de modo inalterado junto con la bilis, hallándose concentraciones en el rango [10mcg/ml ↔
20mcg/ml].
Entre un 10% y un 30% de la dosis de estreptomicina inyectada no parece ser excretada. Lo
más probable es que se inactive en el organismo, si bien no se han podido detectar
metabolitos.
-7-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
Distribución de la estreptomicina en el organismo.-
La estreptomicina difunde rápidamente en tejidos y fluidos corporales: se distribuye muy
bien en los fluidos ascítico y pleural. Al cabo de entre 4 horas a 6 horas de la inyección, las
concentraciones en los fluidos aberrantes son similares a las concentraciones en suero.
La estreptomicina penetra bien en los abscesos tuberculosos.
No difunde en el fluido cerebroespinal, a menos que las meninges estén inflamadas, pero,
aun en estas condiciones, las concentraciones en el fluido cerebroespinal son mucho más
bajas que las detectadas en suero.
La unión de la estreptomicina a proteínas del plasma es de ~34%.
Posología.-
1g/24 horas [de modo más preciso: 15mg/Kg, día].
Nunca se debe sobrepasar la dosis total diaria de 2g.
En pacientes de >40 años, se recomienda una pauta de administración de 0,5mg ↔ 0,75mg /
24 horas, incluso en pacientes con parámetros de función renal normales.
La vía de administración preferente es la intramuscular (IM) También puede administrarse
intravenosamente (perfusión IV en 30 minutos) La dosis por vía IM y por perfusión IV ha de
ser idéntica.
Concentraciones inhibitorias mínimas.-
Las CIMs de las cepas sensibles de Staphyloccus aureus y otras bacterias Gram negativas se
hallan normalmente en el rango de 1mcg/ml a 8mcg/ml.
Los microorganismos con CIMs>16mcg/ml se deben considerar resistentes.
El CIM habitual de la estreptomicina para Mycobacterium tuberculosis es de 8mcg/ml.
Presentaciones.-
En España se comercializa exclusivamente como medicamentos genéricos (Estreptomicina)
en viales de 1g + ampolla disolvente (con 3ml ó 4ml, según el laboratorio fabricante).
Mecanismo de acción.-
El mecanismo de acción de la estreptomicina es común al del resto de los aminoglucósidos,
razón por la que me extiendo algo en su recordatorio.
De modo general, la estreptomicina (y el resto de los aminoglucósidos) interfieren con la
síntesis proteica bacteriana.
Su acción depende de su capacidad de enlace a una proteína (o varias) de la subunidad
ribosómica 30S (S, de Svedberg) Esta unión da lugar a cambios en la conformación de la
subunidad que dan lugar a una lectura errónea de los codones del ARNM. Como consecuencia
se incorporan aminoácidos erróneos en el péptido en crecimiento, dando lugar a una
proteína defectuosa. Las proteínas alteradas pueden no ser vitales para la viabilidad
bacteriana. Sin embargo, la estreptomicina (y los demás aminoglucósidos) son bactericidas.
¿Cómo se puede explicar esta aparente contradicción? La explicación más plausible es que
estos antibióticos también dan lugar a la producción de proteínas anormales que forman
parte de la estructura de la membrana bacteriana. Cualquier defecto en la permeabilidad de
la membrana bacteriana conduce a la lisis celular, por efecto osmótico, lo que explicaría el
efecto bactericida de los aminoglucósidos sobre los gérmenes sensibles.
-8-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
El transporte de los antibióticos aminoglucosídicos al interior celular es un proceso ligado al
metabolismo aeróbico bacteriano. Es por esta razón por la que los anaerobios son resistentes
a todos los antibióticos aminoglucósidos.
La resistencia bacteriana a los aminoglucósidos puede ser debido a tres causas:
a) Modificación enzimática de los aminoglucósidos, proceso mediado por plásmidos.
b) Mutación de la subunidad ribosómica 30S bacteriana que disminuye la afinidad de
los antibióticos por este complejo proteico.
c) Alteración de las condiciones de permeabilidad de la membrana bacteriana a estos
antibióticos. Esta alteración de la permeabilidad puede ser debido a un cambio de las
condiciones ambientales que hace que bacterias aerobias se adapten a un medio
anaerobio; y la anaerobiosis hace inviable la captación del antibiótico
aminoglucósido.
Toxicidad de la estreptomicina.-
1) Ototoxicidad.
2) Nefrotoxicidad.
3) Hipersensibilidad.
4) Neurotoxicidad.
5) Efectos adversos de tipo hematológico.
Interacciones.-
La heparina inhibe la actividad de los aminoglucósidos. Este hecho tiene trascendencia en
dos aspectos:
a) Los aminoglucósidos no han de guardarse en tubos heparinizados.
b) En los pacientes tratados con heparina, las concentraciones de aminoglucósidos en
suero pueden verse disminuidas en relación a las concentraciones esperadas.
Usos clínicos.-
A. TUBERCULOSIS
B. INFECCIONES POR EL COMPLEJO MYCOBACTERIUM-AVIUM
C. BRUCELOSIS
D. ENDOCARDITIS BACTERIANA
E. TULAREMIA
F. ENFERMEDADES VENÉREAS
G. MICETOMA
Zaragoza, 15 de marzo de 2011
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
-9-
Dr. José Manuel López Tricas
Farmacéutico especialista Farmacia Hospitalaria
Zaragoza
También podría gustarte
- Problemas-Exam-Medio No Acuoso y ElectroquímicaDocumento2 páginasProblemas-Exam-Medio No Acuoso y ElectroquímicaArmando GemeAún no hay calificaciones
- TD BeatrizRioserasDocumento275 páginasTD BeatrizRioserasCarazas LeonardoAún no hay calificaciones
- EjercicioDocumento8 páginasEjercicioArmando GemeAún no hay calificaciones
- ACFrOgCQ72fzDSGZO mSXLUUUqBqqdl3hF9lIV9ubYWrJ2NcHUu - F6Iv3yxdmDeGSvKRTCw9Ym XfxwrnnfUCgi2l6uJl7aZTbGq01tLjQs4wU rW0tXCcuWM1uzYj6b3nC1tC87mmVP6aqw3yjR PDFDocumento6 páginasACFrOgCQ72fzDSGZO mSXLUUUqBqqdl3hF9lIV9ubYWrJ2NcHUu - F6Iv3yxdmDeGSvKRTCw9Ym XfxwrnnfUCgi2l6uJl7aZTbGq01tLjQs4wU rW0tXCcuWM1uzYj6b3nC1tC87mmVP6aqw3yjR PDFArmando GemeAún no hay calificaciones
- Examenunidad VDocumento3 páginasExamenunidad VArmando GemeAún no hay calificaciones
- MóduloDocumento11 páginasMóduloArmando GemeAún no hay calificaciones
- Análisis Critico El Farmacéutico de AuschwitzDocumento2 páginasAnálisis Critico El Farmacéutico de AuschwitzArmando GemeAún no hay calificaciones
- Ejercicio 2Documento8 páginasEjercicio 2Armando GemeAún no hay calificaciones
- 262 723 1 PBDocumento8 páginas262 723 1 PBMario RangelAún no hay calificaciones
- Examenunidad VDocumento3 páginasExamenunidad VArmando GemeAún no hay calificaciones
- 888lab 4 Efectos de La Temperatura en La SolubilidadDocumento8 páginas888lab 4 Efectos de La Temperatura en La Solubilidaddavic29100% (2)
- Etiquetado medicamentos NOM-072-SSA1-2012Documento23 páginasEtiquetado medicamentos NOM-072-SSA1-2012Armando GemeAún no hay calificaciones
- Alumnos Que Presentaran Examen El Dia 17 de Marzo Del 2013Documento3 páginasAlumnos Que Presentaran Examen El Dia 17 de Marzo Del 2013Armando GemeAún no hay calificaciones
- Módulo Vii Los Fármacos Como Modificadores de Funciones BiológicasDocumento7 páginasMódulo Vii Los Fármacos Como Modificadores de Funciones BiológicasArmando GemeAún no hay calificaciones
- ACFrOgCQ72fzDSGZO mSXLUUUqBqqdl3hF9lIV9ubYWrJ2NcHUu - F6Iv3yxdmDeGSvKRTCw9Ym XfxwrnnfUCgi2l6uJl7aZTbGq01tLjQs4wU rW0tXCcuWM1uzYj6b3nC1tC87mmVP6aqw3yjR PDFDocumento6 páginasACFrOgCQ72fzDSGZO mSXLUUUqBqqdl3hF9lIV9ubYWrJ2NcHUu - F6Iv3yxdmDeGSvKRTCw9Ym XfxwrnnfUCgi2l6uJl7aZTbGq01tLjQs4wU rW0tXCcuWM1uzYj6b3nC1tC87mmVP6aqw3yjR PDFArmando GemeAún no hay calificaciones
- Aspectos legales y formulación farmacéuticaDocumento45 páginasAspectos legales y formulación farmacéuticaArmando GemeAún no hay calificaciones
- Cuestionario Técnicas para Caracterización de MaterialesDocumento1 páginaCuestionario Técnicas para Caracterización de MaterialesArmando GemeAún no hay calificaciones
- Nom 059 Ssa1 2015 Equipo3Documento41 páginasNom 059 Ssa1 2015 Equipo3Armando GemeAún no hay calificaciones
- Espectroscopia de MasasDocumento22 páginasEspectroscopia de MasasArmando Geme100% (1)
- Espectroscopía de Resonancia MagnéticaDocumento31 páginasEspectroscopía de Resonancia MagnéticaArmando GemeAún no hay calificaciones
- Norma 072-EtiquetadoDocumento22 páginasNorma 072-EtiquetadoIvonne Toledo de JzcAún no hay calificaciones
- Equipo 5. Espectroscopía RAMANDocumento20 páginasEquipo 5. Espectroscopía RAMANArmando GemeAún no hay calificaciones
- NOM 059 SSA1 2015 - Equipo - 2Documento33 páginasNOM 059 SSA1 2015 - Equipo - 2Armando Geme100% (2)
- CalendarioDocumento4 páginasCalendarioArmando GemeAún no hay calificaciones
- Exposición 2 - SEM y TEMDocumento30 páginasExposición 2 - SEM y TEMArmando Geme100% (1)
- MetronidazolDocumento34 páginasMetronidazolArmando Geme100% (1)
- Portada Interna IndiceDocumento2 páginasPortada Interna IndiceArmando GemeAún no hay calificaciones
- Farmacodinamia General - Alicia E. Consolini y María Inés Ragone PDFDocumento215 páginasFarmacodinamia General - Alicia E. Consolini y María Inés Ragone PDFOscar David Bellido Zarate100% (1)
- Ley General de SaludDocumento51 páginasLey General de SaludArmando GemeAún no hay calificaciones
- Amoxicilina YoselinDocumento5 páginasAmoxicilina Yoselinjcesar calderonDAún no hay calificaciones
- Vademecum LABIOFAM 2010Documento181 páginasVademecum LABIOFAM 2010Gonz EddyAún no hay calificaciones
- Unidad 2 Conrol de MicroorganismosDocumento55 páginasUnidad 2 Conrol de Microorganismosanderling quinteroAún no hay calificaciones
- Aminoglucósidos: antibióticos bactericidas de origen naturalDocumento8 páginasAminoglucósidos: antibióticos bactericidas de origen naturalthreysiAún no hay calificaciones
- Tratamiento de TBCDocumento11 páginasTratamiento de TBCALEXIA FIORELLA MEZA CHUQUIYUREAún no hay calificaciones
- Familia de Los AntibioticosDocumento11 páginasFamilia de Los AntibioticosTaheliAún no hay calificaciones
- Aminoglucósidos veterinariosDocumento39 páginasAminoglucósidos veterinariosGerson Bladimir Escobar GonzálezAún no hay calificaciones
- Crecimiento Bacteriano y Efecto de Los AntibioticosDocumento32 páginasCrecimiento Bacteriano y Efecto de Los AntibioticosAndrea KernycznyAún no hay calificaciones
- Kanaplex FTDocumento1 páginaKanaplex FTcarlos ramirezAún no hay calificaciones
- Antibióticos FarmacoDocumento20 páginasAntibióticos FarmacoKevin Gerald Lobos MuñozAún no hay calificaciones
- Cuadro de AntibioticosDocumento5 páginasCuadro de AntibioticosFernando Valiente De La GalaAún no hay calificaciones
- TBC UltimoDocumento31 páginasTBC UltimoJhonatan Huauya Berrocal100% (1)
- Farmacologia AntibioticosDocumento13 páginasFarmacologia Antibioticosrobinson altamiranoAún no hay calificaciones
- Antibiotic OsDocumento8 páginasAntibiotic OsMedicina OcupacionalAún no hay calificaciones
- Clases de Antibióticos PDFDocumento7 páginasClases de Antibióticos PDFAlexiz Naveda100% (2)
- Farmacología Veterinaria - InformesDocumento11 páginasFarmacología Veterinaria - InformesAndreaPastorGuevaraAún no hay calificaciones
- VademecumDocumento6 páginasVademecumRoosenvelt Abraham Resabala PalmaAún no hay calificaciones
- KANAVICINA DisertaciónDocumento9 páginasKANAVICINA DisertaciónJhonatan Paco TorrezAún no hay calificaciones
- Fármaco Prueba 2Documento55 páginasFármaco Prueba 2Marcela Arriagada GonzálezAún no hay calificaciones
- Vademecum LeydyDocumento24 páginasVademecum LeydyLeydy Jacinta Obando Falcones100% (1)
- AminoglucosidosDocumento3 páginasAminoglucosidosClaudia QuiñonezAún no hay calificaciones
- Kamakosin 10-20170828-111326Documento1 páginaKamakosin 10-20170828-111326Jeaneth PilatuñaAún no hay calificaciones
- Kanamicina: aminoglucósido antibiótico de amplio espectroDocumento4 páginasKanamicina: aminoglucósido antibiótico de amplio espectronancy veronica quiroz ruizAún no hay calificaciones