Documentos de Académico
Documentos de Profesional
Documentos de Cultura
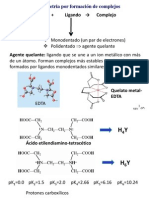
COMPLEJOMETRÍA
Cargado por
Alejandra CorsiDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
COMPLEJOMETRÍA
Cargado por
Alejandra CorsiCopyright:
Formatos disponibles
Tipos de valoraciones complejometricas
Valoración directa:
La mayoría de los metales de la tabla periódica se pueden determinar mediante una
valoración con EDTA. Algunos métodos se basan en indicadores que responden al
analito y otros que se basan en un ion metálico añadido.
Métodos basados en indicadores para el analito: se enumeran casi iones
metálicos que se determinan mediante valoración directa con EDTA usando
indicadores de iones metálicos. Los indicadores que responden directamente al
metal no se pueden usar en todos los casos, ya sea porque no se dispone de
ningún indicador con un intervalo de transición adecuado o porque la reacción
entre el ion metálico y el EDTA es tan lenta que se hace imposible la valoración.
Métodos basados en indicadores para un ion metálico añadido: cuando no se
dispone de un buen indicador directo para el analito, se puede añadir una
pequeña cantidad de un ion metálico para el cual se tiene un indicador
apropiado. El ion metálico debe formar un complejo menos estable que el del
analito. Por ejemplo: los indicadores para el ion calcio por lo general son menos
satisfactorios que los descritos para el ion magnesio. Por lo tanto es común
añadir una pequeña cantidad de de cloruro de magnesio a una solución de
EDTA destinada a la determinación de calcio. En este caso se puede utilizar
negro de ericromo T en la valoración.
Valoración por retroceso:
La valoración por retroceso es útil para la determinación de cationes que forman
complejos estables con el EDTA y para los cuales no se dispone de un indicador
adecuado. Este método también es útil para cationes como Cr(III) y Co(III), que
reaccionan lentamente con el EDTA. A la disolución del analito se le agrega un exceso
medido de la disolución patrón de EDTA. Una vez que se considera terminada la
reacción, se valora por retroceso el exceso de EDTA con una disolución patrón de iones
magnesio o zinc hasta un punto final de negro de ericromo T o calmagita. El éxito de
este procedimiento requiere que los iones magnesio o zinc formen un complejo con el
EDTA menos estable que el correspondiente al analito.
(Kf1) EDTA + M+m EDTA-M+m + EDTA(exc)
(kf2) N+m + EDTA(exc) EDTA-N+m
Kf1 > kf2
Expresión de cálculo:
N eq gr EDTA = n eq gr EDTA-M+m + n eq gr EDTA(exc)
N eq gr EDTA(exc) = n eq gr EDTA- N+m
NxVEDTA= (mM+m)/(PM M+m) + NN+m x Vg
La valoración por retroceso también es útil para analizar muestras que contienen
aniones que de otra manera formarían precipitados con el analito poco solubles en las
condiciones analíticas. En este caso, el exceso de EDTA impide la formación de
precipitados.
Valoración por desplazamiento:
Cuando no se cuenta con el indicador adecuado para el ion metalico que se va a
determinar, se emplean las titulaciones por desplazamiento. En este procedimiento se
adiciona en exceso una solución que contiene el complejo EDTA-N+m, y el ion metálico
digamos M+m, desplaza al N+m del complejo relativamente débil con el EDTA:
Si el analito forma un complejo más estable que el N+m, ocurre la siguiente reacción de
desplazamiento:
MgY-2 + M+2 MY-2 + Mg+2
EDTA-N+m ⇄ EDTA + N+m
EDTA +M+m ⇄ EDTA-M+m
Donde M+m es el catión analito. El N+m liberado, en algunos casos, Mg+2 o Zn+2 , se valora
entonces con una disolución patrón de EDTA.
Lo que se agrega a la solución es un volumen conocido del complejo EDTA-N +m (V1) y de
concentración conocida (C1).
-EDTA-N+m kf1 (para este complejo se tiene un indicador)
-EDTA-M+m kf2 > kf1
Como la kf1 es menor que kf2, el EDTA se libera para formar un complejo con el M +m
Expresión de cálculo:
N° eq gr M+m = Neq EDTA robado = Neq N+m desplazado = Neq EDTA (gastado en la titulación)
Neq M+m = Neq de EDTA (gastado en la titulación)
Valoración indirecta:
Muchas sustancias que no reaccionan con EDTA se pueden determinar vía indirecta.
Por ejemplo:
Determinación de aniones: donde el ion sulfato puede determinarse por
precipitación de exceso de Ba+2 a pH 1. El precipitado de BaSO4, después del
filtrado y lavado se hierve con un exceso de EDTA a pH 10, con lo que se
disuelve y se forma BaY-2.
SO4-2 + Ba+2 –> Ba SO4(s) +Ba+2exc
Ba+2 exc + EDTA EDTA-Ba+2
El precipitado de BaSO4 no se extrae ya que no interfiere en la valoración.
Expresión de cálculo:
N eq gr Ba+2 = n eq gr BaSO4 + n eq gr EDTA-Ba+2
Vagregado x [] Ba+2 = (m SO4-2 )/ (PM/1) + []EDTA x Vg
(m SO4-2 )= N1 x V1 –NEDTA x Vg
(PM/1)
También podría gustarte
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- EDTADocumento6 páginasEDTAAlejandra CorsiAún no hay calificaciones
- Catalago Conagua 2019.Documento116 páginasCatalago Conagua 2019.Ipenza Yagos60% (5)
- Volumetría de Formación de ComplejosDocumento25 páginasVolumetría de Formación de ComplejosConstantino Aquiles100% (1)
- Volhard OriginalDocumento5 páginasVolhard OriginalAlejandra CorsiAún no hay calificaciones
- Valoración Por Complexometria 2020Documento24 páginasValoración Por Complexometria 2020Juan Pablo Sará FoncecaAún no hay calificaciones
- 02 Inspeccion de Materiales Y EquiposDocumento24 páginas02 Inspeccion de Materiales Y Equiposchavico113Aún no hay calificaciones
- Como Actúan Los Indicadores MetalocrómicosDocumento3 páginasComo Actúan Los Indicadores MetalocrómicosAlejandra Corsi100% (2)
- Informe 3 de ElectroDocumento8 páginasInforme 3 de ElectropaulinaAún no hay calificaciones
- Titulaciones ComplejométricasDocumento8 páginasTitulaciones Complejométricasqketza75% (4)
- Complexometría I. Preparación y Valoración de Una Solución de EdtaDocumento8 páginasComplexometría I. Preparación y Valoración de Una Solución de EdtaJenny Rodriguez AguirreAún no hay calificaciones
- PR CTICA 1. - Preparaci N de Una Disoluci N EDTA 0.02 MDocumento3 páginasPR CTICA 1. - Preparaci N de Una Disoluci N EDTA 0.02 MJose Antonio Vargas Gonzalez100% (1)
- Volumetria de ComplejosDocumento29 páginasVolumetria de ComplejosEsthefany Aguilar GomezAún no hay calificaciones
- 10.46 Tipos de Titulaciones EdtaDocumento3 páginas10.46 Tipos de Titulaciones EdtaHernan Benitez0% (1)
- Volumetrias de Precipitacion y ComplejosDocumento19 páginasVolumetrias de Precipitacion y ComplejosGrecia Dayana Ponce ChavezAún no hay calificaciones
- Volumetrias-De-Precipitacion-Y-Complejos 1Documento19 páginasVolumetrias-De-Precipitacion-Y-Complejos 1Jhonatan Rimache Arotoma100% (3)
- Valoración ComplexométricaDocumento4 páginasValoración ComplexométricaJersson HernándezAún no hay calificaciones
- Determinación Del Contenido de Calcio y Magnesio en Una Muestra ProblemaDocumento6 páginasDeterminación Del Contenido de Calcio y Magnesio en Una Muestra ProblemaDavid Colorado Vega67% (3)
- Qa ComplejometriaDocumento20 páginasQa ComplejometriaFreddy MembreñoAún no hay calificaciones
- Volumetría Con Formación de Complejos Determinación de CA en Una CalizaDocumento5 páginasVolumetría Con Formación de Complejos Determinación de CA en Una CalizaJennifer MacaAún no hay calificaciones
- Quimica Analitica Instrumental 6°1 - 6°4 Tema: Volumetría Por Formación de ComplejosDocumento5 páginasQuimica Analitica Instrumental 6°1 - 6°4 Tema: Volumetría Por Formación de ComplejosHelver GalargaAún no hay calificaciones
- Volumetria ComplejosDocumento45 páginasVolumetria ComplejosRomina Espinoza GonzalezAún no hay calificaciones
- Complejometria Parte IIIDocumento22 páginasComplejometria Parte IIIJuan Jose LlamoccaAún no hay calificaciones
- Volumetria de ComplejosDocumento27 páginasVolumetria de ComplejosFrine Ruiz Coronel100% (3)
- Clase012 (ParteII) 2022Documento24 páginasClase012 (ParteII) 2022Giuliana valenzuelaAún no hay calificaciones
- Acidez TesDocumento11 páginasAcidez TesCarlos CajaleonAún no hay calificaciones
- WRL1248.tmpDocumento9 páginasWRL1248.tmpmanuelAún no hay calificaciones
- Volumetría de Formación de ComplejosDocumento4 páginasVolumetría de Formación de ComplejosMajo Tuaso BQAún no hay calificaciones
- Dureza Del Calcio y de Magnesio de Una Muestra de AguaDocumento9 páginasDureza Del Calcio y de Magnesio de Una Muestra de AguaErick Garcia HernandezAún no hay calificaciones
- Tema 11. - Volumetrias de ComplejacionDocumento55 páginasTema 11. - Volumetrias de ComplejacionTopaciaHernandezAún no hay calificaciones
- DETERMINACIÓN DE Ca EN UNA CALIZADocumento4 páginasDETERMINACIÓN DE Ca EN UNA CALIZAMayra A. MoraAún no hay calificaciones
- Determinacion Del Contenido de Calcio y Magnesio en Una Muestra Problema PDFDocumento6 páginasDeterminacion Del Contenido de Calcio y Magnesio en Una Muestra Problema PDFJulio Cesar Concejal VerdeAún no hay calificaciones
- Spractica10 1Documento8 páginasSpractica10 1Solange RiveraAún no hay calificaciones
- Volumetría de Formación D ComplejosDocumento13 páginasVolumetría de Formación D Complejosjavier elias salcedo ramosAún no hay calificaciones
- Analisis Quimico - Treceava SemanaDocumento23 páginasAnalisis Quimico - Treceava SemanaKeny PaezAún no hay calificaciones
- Analisis de AlCaMgDocumento6 páginasAnalisis de AlCaMgAdrianaAún no hay calificaciones
- Volumetría Formación de Complejos Complexometría: Química AnalíticaDocumento13 páginasVolumetría Formación de Complejos Complexometría: Química Analíticajuan pablo pizarroAún no hay calificaciones
- Clase 8 Volumetria Por Formacion de ComplejosDocumento54 páginasClase 8 Volumetria Por Formacion de Complejoscarlosandres32150% (2)
- Pérez Cruz David Emmanuel - Cuestionario Previo - ComplejosDocumento5 páginasPérez Cruz David Emmanuel - Cuestionario Previo - ComplejosDAVID EMMANUEL PEREZ CRUZAún no hay calificaciones
- Diagrama de Flujo de Analitica y CalculosDocumento6 páginasDiagrama de Flujo de Analitica y Calculossamantha importanteAún no hay calificaciones
- Aplicar Los Principios Básicos de Las Volumetrías Complejométricas en La Determinación de La Dureza de Una Muestra de AguaDocumento2 páginasAplicar Los Principios Básicos de Las Volumetrías Complejométricas en La Determinación de La Dureza de Una Muestra de AguaBryan Gabriel Peralta VidalAún no hay calificaciones
- Practica 1 Complexometria Parte 1Documento6 páginasPractica 1 Complexometria Parte 1Erika AlexandraAún no hay calificaciones
- Deber Grupal 1 - Técnicas de Valoración de ComplejosDocumento4 páginasDeber Grupal 1 - Técnicas de Valoración de ComplejosKevin AndrésAún no hay calificaciones
- Qué Es Factor Gravimetrico y Como Se CalculaDocumento5 páginasQué Es Factor Gravimetrico y Como Se CalculaEmilio GutierrezAún no hay calificaciones
- PRACTICA Dureza Del Agua.Documento5 páginasPRACTICA Dureza Del Agua.Hiri Ch M OlAún no hay calificaciones
- A. Precipitación y ComplexometríaDocumento31 páginasA. Precipitación y ComplexometríaMilagros GamarraAún no hay calificaciones
- Marco Teóricos ComplexometriaDocumento3 páginasMarco Teóricos ComplexometriaLuis Rapa100% (1)
- Reporte EdtaDocumento12 páginasReporte EdtaYazmín Luévano'Aún no hay calificaciones
- RedoxycomplejosDocumento11 páginasRedoxycomplejosRojas GustavoAún no hay calificaciones
- 1 Informe EdtaDocumento9 páginas1 Informe EdtaAnita UshiñaAún no hay calificaciones
- 1 Informe EdtaDocumento9 páginas1 Informe EdtaAnita UshiñaAún no hay calificaciones
- CuantiDocumento3 páginasCuantiMarlen Vargas OrtizAún no hay calificaciones
- LabAnalitica N°3 Titulación ComplexometricaDocumento17 páginasLabAnalitica N°3 Titulación ComplexometricaAlejandra Romero100% (2)
- Practica - 7 Volumetria de ComplejosDocumento5 páginasPractica - 7 Volumetria de ComplejosNafracla22Aún no hay calificaciones
- Dureza Del Agua Cuestionario LAB AnaliticaDocumento6 páginasDureza Del Agua Cuestionario LAB AnaliticaMaría José Rivas0% (1)
- TPN7 Complejometria 2023Documento4 páginasTPN7 Complejometria 2023Santiago GowlandAún no hay calificaciones
- Determinación de Calcio y Magnesio PDFDocumento6 páginasDeterminación de Calcio y Magnesio PDFEstefanía SerendipiaAún no hay calificaciones
- Quimica Analitica ComplexDocumento24 páginasQuimica Analitica ComplexGardner1983Aún no hay calificaciones
- Determinación Complejométrica de CalcioDocumento2 páginasDeterminación Complejométrica de Calciolaura zabalaAún no hay calificaciones
- COMPLEXOMETRÍA PARTE I. Preparación y Estandarización de Una SoluciónDocumento6 páginasCOMPLEXOMETRÍA PARTE I. Preparación y Estandarización de Una SoluciónGaby BenavidesAún no hay calificaciones
- Hmartqui - Hmartqui - GUÍA 5. VOLUMETRÍAS-1Documento4 páginasHmartqui - Hmartqui - GUÍA 5. VOLUMETRÍAS-1Susana Castellanos GarzonAún no hay calificaciones
- Dureza Total Del Agua - InformeDocumento8 páginasDureza Total Del Agua - InformeorlandoAún no hay calificaciones
- Titulaciones Complexometricas o Quelatometricas - YodometriaDocumento6 páginasTitulaciones Complexometricas o Quelatometricas - YodometriasergioAún no hay calificaciones
- Resumen Del Análisis ComplejométricosDocumento2 páginasResumen Del Análisis ComplejométricosMiguel RomeroAún no hay calificaciones
- PermanganometriaDocumento3 páginasPermanganometriaAlejandra CorsiAún no hay calificaciones
- Fuentes Ultravioleta-VisibleDocumento3 páginasFuentes Ultravioleta-VisibleAlejandra CorsiAún no hay calificaciones
- Electrodos y RadiacionDocumento6 páginasElectrodos y RadiacionAlejandra CorsiAún no hay calificaciones
- Adaptaciones Curriculares - Exámenes Bgu 1º Bgu Quimica 2023Documento4 páginasAdaptaciones Curriculares - Exámenes Bgu 1º Bgu Quimica 2023maria YanezAún no hay calificaciones
- JCC ExamenDocumento13 páginasJCC ExamenJhony C CarrascoAún no hay calificaciones
- Composta Escolar: Plantel: Cecytec 18 NopalucanDocumento10 páginasComposta Escolar: Plantel: Cecytec 18 NopalucanDaniel OrtegaAún no hay calificaciones
- Titulaciones Conductimetricas Fisico Química IIDocumento4 páginasTitulaciones Conductimetricas Fisico Química IIMarco Ruíz AlonsoAún no hay calificaciones
- Taller de Agua y Sus UsosDocumento4 páginasTaller de Agua y Sus UsosMARCELA VALENTINA FREYLE GONZALEZ (:-)Aún no hay calificaciones
- Guia de LaboratorioDocumento6 páginasGuia de LaboratorioJael MartínezAún no hay calificaciones
- Presupuesto PavimentoDocumento2 páginasPresupuesto PavimentoLEONEL EMERSON NAVARRO CHAGUAAún no hay calificaciones
- Clase 1 Tipos de Sustancias y Uq IDocumento6 páginasClase 1 Tipos de Sustancias y Uq IClaudia LandaburuAún no hay calificaciones
- FlúorDocumento4 páginasFlúorJuan Daniel Gómez HerreraAún no hay calificaciones
- Metodo para La Determinacion de Sedimentos en El Crudo y Los Fuel Oil Por El Metodo de ExtracionDocumento13 páginasMetodo para La Determinacion de Sedimentos en El Crudo y Los Fuel Oil Por El Metodo de ExtracionHernán VegaAún no hay calificaciones
- Maravillas Modernas Tecnologia MedioambientalDocumento6 páginasMaravillas Modernas Tecnologia MedioambientalJoSé LuIs AuquillaAún no hay calificaciones
- Materiales Ferroso No FerrosoDocumento74 páginasMateriales Ferroso No FerrosounivtecAún no hay calificaciones
- Tarea 6 - Montaje Tuberias Conduit de Circuitos Alimentadores y Derivados - ARMASDocumento23 páginasTarea 6 - Montaje Tuberias Conduit de Circuitos Alimentadores y Derivados - ARMASObed Omar Armas ChontayAún no hay calificaciones
- XMXXDocumento23 páginasXMXXRicardo HDZ VQZAún no hay calificaciones
- GUIA DE QUIMICA No 13Documento5 páginasGUIA DE QUIMICA No 13Fernanda ReyesAún no hay calificaciones
- Guia No 03Documento3 páginasGuia No 03Dánica Nicoll Rojas MolinaAún no hay calificaciones
- Ficha de Descripción Macroscópicade Rocas ÍgneasDocumento4 páginasFicha de Descripción Macroscópicade Rocas ÍgneasValeria Chura EstraverAún no hay calificaciones
- Taller de Mineralogía y Petrografía PDFDocumento5 páginasTaller de Mineralogía y Petrografía PDFPorras Fuentes YanitzaAún no hay calificaciones
- SienitaDocumento6 páginasSienitaAndrés perezAún no hay calificaciones
- Fosfato de Zinc y Carboxilato de ZincDocumento21 páginasFosfato de Zinc y Carboxilato de ZincMiguel Angel Fuentes FernandezAún no hay calificaciones
- Losas NervadasDocumento8 páginasLosas NervadasArge SaAún no hay calificaciones
- SVM 240Documento4 páginasSVM 240tapeksAún no hay calificaciones
- Inal CaminosDocumento97 páginasInal CaminosBryan Orna HuereAún no hay calificaciones
- EvaporiticasDocumento17 páginasEvaporiticaspehm1234Aún no hay calificaciones
- Apuntes Elementos de MaquinasDocumento10 páginasApuntes Elementos de MaquinasHanny GonzalezAún no hay calificaciones
- 7603 Mapepur Fire Foam M EsDocumento4 páginas7603 Mapepur Fire Foam M EsJohana GarciaAún no hay calificaciones
- Practica 4 Curvas de CalentamientoDocumento11 páginasPractica 4 Curvas de CalentamientoIleen100% (1)