Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Deber 4 Jaime Pérez Cuestiones Cap1 Silva
Cargado por
jaime perezDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Deber 4 Jaime Pérez Cuestiones Cap1 Silva
Cargado por
jaime perezCopyright:
Formatos disponibles
Universidad central del ecuador
Facultad de ciencias químicas
Carrera de Química (R)
2021-2021
Materia: Química Analítica II
Nombre: Jaime Francisco Pérez González
Tema: Cuestiones del capítulo uno Silva.
1. ¿Cuántas regiones se pueden diferenciar en una reacción química y cómo se denominan?
Sabemos que tenemos dos recciones en una reacción química, la región cinética que
depende del tiempo en el que el sistema al equilibrio, y la región en equilibrio que esta se
forma luego de todos los procesos del sistema hayan alcanzado el equilibrio.
2. Definir velocidad de reacción.
Podemos definir como el número de moles consumidos o formados por unidad de
volumen y unidad de tiempo. Dependiendo de la concentración de las especies
reaccionantes, de las afinidades químicas y de la temperatura.
3. ¿Qué parámetros conforman una ecuación de velocidad?
𝑎𝐴 + 𝑏𝐵 ⇋ 𝑐𝐶 + 𝑑𝐷
𝑑[𝐴] 𝑑[𝐵]
𝑉𝑒𝑙𝑜𝑐𝑖𝑑𝑎𝑑 = = = 𝑘𝑛 [𝐴]𝑎 [𝐵]𝑏
𝑑𝑡 𝑑𝑡
𝑘𝑛 = 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 𝑑𝑒 𝑙𝑎 𝑣𝑒𝑙𝑜𝑐𝑖𝑑𝑎𝑑.
Va a depender mucho de las concentraciones de los reactivos y de los productos, para
poder usar la ecuación descrita los parámetros de variaciones en presión, temperatura y
volumen debe permanecer constantes.
4. ¿Cuándo se alcanza el equilibrio químico desde un punto de vista cinético?
Al comienzo de la reacción, velocidad directa será muy elevada, mientras que la
velocidad inversa será prácticamente cero, pero a medida que transcurre la misma ambas
velocidades tenderán a coincidir llegando un momento en que se igualen, instante en el
que se alcanza el equilibrio químico.
5. Diferenciar entre concentración efectiva y concentración analítica.
La concentración efectiva es aquella concentración de cada ion por lo cual sus
interacciones electrostáticas no son despreciables. La concentración analítica es aquella
concentración independiente de las condiciones experimentales donde se desarrolla el
equilibrio químico.
6. ¿En qué condiciones se puede trabajar con constantes de equilibrio estequiométricas?
Estas constantes estequiométricas corresponden con la ley de acción de masas de
Guldberg y Waage, las cuales son la razón entre las constantes de velocidad de reacción
directa sobre la constante de velocidad de reacción inversa, se pueden usar de moléculas
sin carga y con bajas concentraciones.
7. ¿Qué es la fuerza iónica?
Es una función de la concentración de todos los iones presentes en ella, definida por:
1
𝐼 = ∑ 𝑐𝑖 𝑧𝑖2
2
𝑖
donde ci es la concentración molar de iones presentes en la disolución, zi es la carga de
cada ion, y la suma se refiere a cada una de las especies iónicas presentes en el medio.
8. ¿En qué condiciones experimentales utilizaría la ley límite de Debye-Hückel para el
cálculo de los coeficientes de actividad?
La ley límite de Debye-Hückel permite calcular valores en buena concordancia con
los resultados experimentales, sólo para disoluciones con concentraciones bajas de
electrolito (con valores de 𝐼≤0,01mol L–1).
9. Explicar si son verdaderas o falsas las siguientes afirmaciones. En disoluciones diluidas:
a) Los coeficientes de actividad son siempre inferiores a la unidad (Verdadero)
Sabemos que entre los valores más próximos a la unidad se conocerá con un
comportamiento ideal.
b) Los coeficientes de actividad son siempre distintos de la unidad. (Falso)
En una disolución muy diluida teniendo condiciones de baja fuerza iónica va a ser similar
a un comportamiento ideal. Esto implica que el valor de los coeficientes de actividad es
prácticamente la unidad para las diferentes especies en el sistema
10. ¿Qué es un complejo de coordinación?
Son compuestos formados por un átomo o ión central (generalmente un metal) que posee
orbitales libres para aceptar pares de electrones, rodeado por un grupo de iones o
moléculas neutras, capaces de compartir uno o más pares de electrones, unidos al ion
central por enlace coordinado denominados ligandos.
11. Clasificar los siguientes equilibrios marcando con una X:
Equilibrio Homogéneo Heterogéneo
Extracción líquido- X
líquido
Formación de complejos X
Intercambio iónico X
Autoprotolisis X
Precipitación X
12. ¿Qué característica técnica es fundamental para favorecer el proceso de transferencia de
materia en un equilibrio de distribución líquido-sólido?
Primero el solido va a tener una característica muy adsorbente para que tenga la capacidad
de retener en su superficie competentes en corrientes liquidas o gaseosas, Segundo una
alta área superficial y por su inercia química frente al medio en el que se van a utilizar.
13. ¿Qué diferencias y analogías se pueden establecer entre el balance de cargas y el balance
protónico?
Diferencias: el balance de cargas va a hacer inadecuado en sales, y el balance de protónico
si lo va a hacer.
Analogías: van a presentar un comportamiento igual en las disoluciones simples.
14. Diferenciar los términos de concentración analítica y concentración de equilibrio.
La concentración analítica es independiente del pH mientras que las concentraciones de
equilibrio dependen de él, excepto en el caso de ácidos y bases fuertes.
15. Establecer los balances de masas y cargas de una disolución 0,01 mol L –1 de carbonato
de potasio.
𝐾2 𝐶𝑂3 ⇋ 2𝐾 + + 𝐶𝑂32−
𝐶𝑂32− + 2𝐻2 𝑂 ⇋ 𝐻2 𝐶𝑂3 + 2𝑂𝐻 −
𝐴𝑢𝑡𝑜𝑝𝑟𝑜𝑡ó𝑙𝑖𝑠𝑖𝑠 𝑑𝑒𝑙 𝑎𝑔𝑢𝑎: 𝐻2 𝑂 + 𝐻2 𝑂 ⇋ 𝑂𝐻 − + 𝐻3 𝑂+
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑑𝑒 𝑚𝑎𝑠𝑎𝑠 𝐵𝑀 : 0.01 𝑚𝑜𝑙/𝐿 = 2[𝐾 + ] = [𝐶𝑂32− ] + [𝐻2 𝐶𝑂3 ]
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑑𝑒 𝑐𝑎𝑟𝑔𝑎𝑠 𝐵𝐶 : [𝐾 + ] + [𝐻3 𝑂+ ] = 2[𝐶𝑂32− ] + [𝑂𝐻 − ]
16. Establecer los balances de cargas y de masas al disolver 0,1 moles de hidróxido de bario
en un litro de agua destilada.
𝐵𝑎(𝑂𝐻)2 ⟶ 𝐵𝑎2+ + 2𝑂𝐻 −
𝐴𝑢𝑡𝑜𝑝𝑟𝑜𝑡ó𝑙𝑖𝑠𝑖𝑠 𝑑𝑒𝑙 𝑎𝑔𝑢𝑎: 𝐻2 𝑂 + 𝐻2 𝑂 ⇋ 𝑂𝐻 − + 𝐻3 𝑂+
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑑𝑒 𝑚𝑎𝑠𝑎𝑠 𝐵𝑀 : 0.1 𝑚𝑜𝑙/𝐿 = [𝐵𝑎2+ ]
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑑𝑒 𝑐𝑎𝑟𝑔𝑎𝑠 𝐵𝐶 : 2[𝐵𝑎2+ ] + [𝐻3 𝑂+ ] = [𝑂𝐻 − ]
17. Establecer los balances de cargas y protónico al disolver 0,5 moles de carbonato de
amonio en 500 mL de agua destilada.
(𝑁𝐻4 )2 𝐶𝑂3 ⟶ 𝐶𝑂32− + 2𝑁𝐻4+
𝑁𝐻4+ + 𝐻2 𝑂 ⇋ 𝑁𝐻3 + 𝐻3 𝑂+
𝐶𝑂32− + 2𝐻2 𝑂 ⇋ 𝐻2 𝐶𝑂3 + 2𝑂𝐻 −
𝐴𝑢𝑡𝑜𝑝𝑟𝑜𝑡ó𝑙𝑖𝑠𝑖𝑠 𝑑𝑒𝑙 𝑎𝑔𝑢𝑎: 𝐻2 𝑂 + 𝐻2 𝑂 ⇋ 𝑂𝐻 − + 𝐻3 𝑂+
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑑𝑒 𝑐𝑎𝑟𝑔𝑎𝑠 𝐵𝐶 : [𝑁𝐻4+ ] + [𝐻3 𝑂+ ] = 2[𝐶𝑂32− ] + [𝑂𝐻 − ]
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑝𝑟𝑜𝑡ó𝑛𝑖𝑐𝑜 𝐵𝑃 : [𝑁𝐻3 ] + [𝑂𝐻 − ] = [𝐻3 𝑂+ ] + [𝐻2 𝐶𝑂3 ]
18. Establecer los balances de cargas y protónico de una disolución 0,1 mol L–1 de sulfato de
sodio a pH 5,0 (Ka2 H2SO4 = 10–1,9).
𝑁𝑎2 𝑆𝑂4 ⇋ 2𝑁𝑎+ + 𝑆𝑂42−
𝑆𝑂42−+ 2𝐻2 𝑂 ⇋ 𝐻2 𝑆𝑂4 + 2𝑂𝐻 −
𝐴𝑢𝑡𝑜𝑝𝑟𝑜𝑡ó𝑙𝑖𝑠𝑖𝑠 𝑑𝑒𝑙 𝑎𝑔𝑢𝑎: 𝐻2 𝑂 + 𝐻2 𝑂 ⇋ 𝑂𝐻 − + 𝐻3 𝑂+
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑑𝑒 𝑐𝑎𝑟𝑔𝑎𝑠 𝐵𝐶 : [𝑁𝑎+ ] + [𝐻3 𝑂+ ] = 2[𝑆𝑂42− ] + [𝑂𝐻 − ]
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑝𝑟𝑜𝑡ó𝑛𝑖𝑐𝑜 𝐵𝑃 : [𝑂𝐻 − ] = [𝐻3 𝑂+ ] + [𝐻2 𝑆𝑂4 ]
Bibliografía:
Harris, D. C. (2016). Análisis químico cuantitativo. Barcelona-España: EDITORIAL
REVERTÉ.
Manuel Silva, J. B. (2005). Equilibrios iónicos y sus aplicaciones analíticas. Madrid: Editorial
SINTESIS.
Atkins, P., & Overton, T. (2006). Quimica inorganica . Mexico : Mc Graw Hill.
También podría gustarte
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Transporte de Solutos y Agua en El Asa de HenleDocumento4 páginasTransporte de Solutos y Agua en El Asa de HenlePabloMrchAún no hay calificaciones
- Informe EntalpiaDocumento16 páginasInforme EntalpiaMary_Coll03Aún no hay calificaciones
- Farma 1 Practica 8Documento6 páginasFarma 1 Practica 8Roxana HernandezAún no hay calificaciones
- Isobutanol Casi Final 6Documento17 páginasIsobutanol Casi Final 6Less ÁvilaAún no hay calificaciones
- Practica 6 B RevDocumento12 páginasPractica 6 B RevMelvin RosaAún no hay calificaciones
- Informe Soluciones IdealesDocumento5 páginasInforme Soluciones IdealesJonat ChAún no hay calificaciones
- Trabajo MetodosDocumento19 páginasTrabajo MetodosAna B. GonzálezAún no hay calificaciones
- Informe Practica 2Documento6 páginasInforme Practica 2Abi CorreaAún no hay calificaciones
- Práctica 4. Influencia de La Concentración en La Velocidad de Reacción Empleando Alcohol Etílico y Ácido CrómicoDocumento11 páginasPráctica 4. Influencia de La Concentración en La Velocidad de Reacción Empleando Alcohol Etílico y Ácido CrómicoManuelAún no hay calificaciones
- Volumetria ADocumento29 páginasVolumetria AEISTEINAún no hay calificaciones
- Taller Fisica 1 LaboratorioDocumento9 páginasTaller Fisica 1 LaboratorioJuan Felipe BonillaAún no hay calificaciones
- Practica de Cinetica QuimicaDocumento4 páginasPractica de Cinetica QuimicaFrank LopezAún no hay calificaciones
- PRACTICA15Documento7 páginasPRACTICA15Frida Gtz'Aún no hay calificaciones
- Practica No. 6. Titulación Acido Base 2022-IDocumento16 páginasPractica No. 6. Titulación Acido Base 2022-IDanny Alejandra Torres tellezAún no hay calificaciones
- 1er Informe, Calores de ReacciónDocumento2 páginas1er Informe, Calores de ReacciónEsteban De Jesús CamargoAún no hay calificaciones
- Practica 5Documento5 páginasPractica 5Zeydi GuzmanAún no hay calificaciones
- Taller Disoluciones y DilucionesDocumento1 páginaTaller Disoluciones y DilucionesYenifer Alejandra Diaz Chala0% (1)
- Informe de Laboratorio 6 - Raquejo & VallejoDocumento5 páginasInforme de Laboratorio 6 - Raquejo & VallejoTomas AinstonAún no hay calificaciones
- Esta Di SticaDocumento3 páginasEsta Di SticaRafael Angel Mamani DiazAún no hay calificaciones
- Solubilidad PracticaDocumento8 páginasSolubilidad Practicabrrujita16-75% (4)
- EspectrofotometriaDocumento4 páginasEspectrofotometriabbmonaAún no hay calificaciones
- Reporte de Practica 1Documento4 páginasReporte de Practica 1Jonathan Marquez100% (1)
- Demostracion de Las Leyes Fotometricas y Error Relativo de La ConcentracionDocumento10 páginasDemostracion de Las Leyes Fotometricas y Error Relativo de La ConcentracionAraceliZavalaAún no hay calificaciones
- Practica No. 3 Titulacion PotenciometricDocumento3 páginasPractica No. 3 Titulacion Potenciometricsussel badayAún no hay calificaciones
- (QO3) Práctica 3 - Síntesis de Fenolftaleína (20-20)Documento4 páginas(QO3) Práctica 3 - Síntesis de Fenolftaleína (20-20)Vanessa SamaniegoAún no hay calificaciones
- INFORME-Solucion de Tiosulfato de SodioDocumento8 páginasINFORME-Solucion de Tiosulfato de SodioJosé MolinaAún no hay calificaciones
- Practica No 2 Fluidos No NewtonianosDocumento22 páginasPractica No 2 Fluidos No NewtonianosKarina ClementeAún no hay calificaciones
- Informe N°7Documento8 páginasInforme N°7Richard AluchoAún no hay calificaciones
- Reporte Practica 1Documento5 páginasReporte Practica 1Liz DiazAún no hay calificaciones
- Informe 04 - Análisis QuímicoDocumento15 páginasInforme 04 - Análisis QuímicoRodrigo De La Arena HAún no hay calificaciones
- Equipo1 Practica2difusvidadliquidaDocumento17 páginasEquipo1 Practica2difusvidadliquidaVaaLe GarciiaAún no hay calificaciones
- DISOLUCIONESDocumento44 páginasDISOLUCIONESMagaly BenaventeAún no hay calificaciones
- Guía de LaboratorioDocumento63 páginasGuía de LaboratorioNURY PARRAAún no hay calificaciones
- Ensayo Control 1Documento3 páginasEnsayo Control 1fabiolaAún no hay calificaciones
- Informe 2Documento16 páginasInforme 2Delany BrendaAún no hay calificaciones
- Aislamiento de DNA Del SueloDocumento6 páginasAislamiento de DNA Del Sueloricardo reyesAún no hay calificaciones
- HPLC Del IbuprofenoDocumento18 páginasHPLC Del IbuprofenoCinthya JazminAún no hay calificaciones
- Ejercicios 2Documento10 páginasEjercicios 2Bruce Luis VEGA HASSINGERAún no hay calificaciones
- Practica 10Documento4 páginasPractica 10Oscar AlmazánAún no hay calificaciones
- Complejos de Cobre - Informe Nº2Documento6 páginasComplejos de Cobre - Informe Nº2Tatiana CastañoAún no hay calificaciones
- Filogenia MolecularDocumento33 páginasFilogenia MolecularAnghelloLozanoDíaz100% (1)
- Lógica Química y Reacciones Químicas ComunesDocumento26 páginasLógica Química y Reacciones Químicas ComunesFaviola Garcia Ballona100% (1)
- Curva de Titulación PotenciometricaDocumento2 páginasCurva de Titulación PotenciometricaAlejandro AngaritaAún no hay calificaciones
- Determinación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaDocumento3 páginasDeterminación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaSebas Soto0% (1)
- Diferencias Entre Compuestos Organicos e Inorganicos y Destilacion FraccionadaDocumento4 páginasDiferencias Entre Compuestos Organicos e Inorganicos y Destilacion FraccionadaDarioAún no hay calificaciones
- Quimica Analitica #1Documento13 páginasQuimica Analitica #1Jorge Angulo Gomez0% (1)
- MG TEMA 4movilidad+bacterianaDocumento24 páginasMG TEMA 4movilidad+bacterianaBryan JumboAún no hay calificaciones
- MC Ejp P13Documento3 páginasMC Ejp P13Luis Diego Carreón MoralesAún no hay calificaciones
- 11solubilidad 1Documento21 páginas11solubilidad 1Miguel RomeroAún no hay calificaciones
- Determinación de La Presión de Vapor y Entalpia Del AguaDocumento6 páginasDeterminación de La Presión de Vapor y Entalpia Del AguaJuan Luis Hernandez BrionesAún no hay calificaciones
- Deberes Se Gundo Hemi - Examen - ANOVA-2018-2018Documento1 páginaDeberes Se Gundo Hemi - Examen - ANOVA-2018-2018Dan AgAún no hay calificaciones
- 1° Exa. Ord. Teoría 2QM4 2022-2. 1Documento3 páginas1° Exa. Ord. Teoría 2QM4 2022-2. 1Vazquez Contreras Johana TamaraAún no hay calificaciones
- Practica 5. Determinacion Del Contenido de Azucar de Una Bebida ComercialDocumento3 páginasPractica 5. Determinacion Del Contenido de Azucar de Una Bebida ComercialDaniel FerminAún no hay calificaciones
- Biocatálisis Clase 2 PDFDocumento21 páginasBiocatálisis Clase 2 PDFAlejandraAún no hay calificaciones
- Guia de Laboratorio Alcalinidad Acidez DurezaDocumento3 páginasGuia de Laboratorio Alcalinidad Acidez Durezaheider manuelAún no hay calificaciones
- Determinación de Dureza Total (Calcio y Magnesio) en Muestra de Agua en Una Muestra de Agua Potable 2Documento10 páginasDeterminación de Dureza Total (Calcio y Magnesio) en Muestra de Agua en Una Muestra de Agua Potable 2Fatima ReyesAún no hay calificaciones
- Deber Halogenuros Alquilo PDFDocumento2 páginasDeber Halogenuros Alquilo PDFLuis MontesdeocaAún no hay calificaciones
- Banco de Preguntas de Físico QuímicaDocumento8 páginasBanco de Preguntas de Físico QuímicaMax Salas100% (1)
- Taller de EntradaDocumento7 páginasTaller de EntradaJOSE DAVID MARTINEZ MENCO ESTUDIANTEAún no hay calificaciones
- INF 09-QI2 - Preparación de Tiosulfato de SodioDocumento5 páginasINF 09-QI2 - Preparación de Tiosulfato de Sodiojaime perezAún no hay calificaciones
- Protocolo AntibiogramaDocumento2 páginasProtocolo Antibiogramajaime perezAún no hay calificaciones
- INF 11 - QI2 - Obtención de Boro Por AluminotermiaDocumento3 páginasINF 11 - QI2 - Obtención de Boro Por Aluminotermiajaime perezAún no hay calificaciones
- Protocolo 7 Analisis Microbiologico de Los AlimentosDocumento2 páginasProtocolo 7 Analisis Microbiologico de Los Alimentosjaime perezAún no hay calificaciones
- Protocolo Tecnicas MolecularesDocumento6 páginasProtocolo Tecnicas Molecularesjaime perezAún no hay calificaciones
- Protocolo FermentacionDocumento2 páginasProtocolo Fermentacionjaime perezAún no hay calificaciones
- Obl I Unidad 30-10Documento85 páginasObl I Unidad 30-10jaime perezAún no hay calificaciones
- Consulta y Ejercicios Sobre Los Elementos Del Grupo 16Documento4 páginasConsulta y Ejercicios Sobre Los Elementos Del Grupo 16jaime perezAún no hay calificaciones
- INF 06-QI2 - Estudio de Los Halógenos IIDocumento4 páginasINF 06-QI2 - Estudio de Los Halógenos IIjaime perezAún no hay calificaciones
- INF 08-QI2 - Estudio Del Azufre IIDocumento5 páginasINF 08-QI2 - Estudio Del Azufre IIjaime perezAún no hay calificaciones
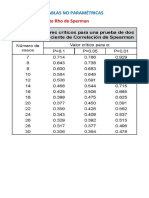
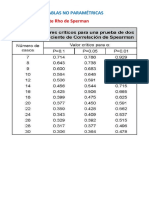
- Clase 16-2 Contraste de Hipótesis No ParamétricasDocumento80 páginasClase 16-2 Contraste de Hipótesis No Paramétricasjaime perezAún no hay calificaciones
- Formato Informe Celdas GalvánicasDocumento7 páginasFormato Informe Celdas Galvánicasjaime perezAún no hay calificaciones
- Consulta y Ejercicios Sobre HidrógenoDocumento4 páginasConsulta y Ejercicios Sobre Hidrógenojaime perezAún no hay calificaciones
- LEC-03 1ra LeyDocumento2 páginasLEC-03 1ra Leyjaime perezAún no hay calificaciones
- Ejercicios Del Grupo 15Documento5 páginasEjercicios Del Grupo 15jaime perezAún no hay calificaciones
- Suplemento: Año I - #4Documento8 páginasSuplemento: Año I - #4jaime perezAún no hay calificaciones
- Pl. Miscelaneas 18Documento36 páginasPl. Miscelaneas 18jaime perezAún no hay calificaciones
- Ejercicio Del Bloque DDocumento2 páginasEjercicio Del Bloque Djaime perezAún no hay calificaciones
- LEC 01 Ley CharlesDocumento2 páginasLEC 01 Ley Charlesjaime perezAún no hay calificaciones
- TablasDocumento10 páginasTablasjaime perezAún no hay calificaciones
- Los Elementos Del Grupo 18Documento8 páginasLos Elementos Del Grupo 18jaime perezAún no hay calificaciones
- Tablas - Sperman - U Mann Whitney-Wilconxon - CompressedDocumento8 páginasTablas - Sperman - U Mann Whitney-Wilconxon - Compressedjaime perezAún no hay calificaciones
- Examendealgebralineal19 130626095949 Phpapp01Documento5 páginasExamendealgebralineal19 130626095949 Phpapp01jaime perezAún no hay calificaciones
- BOCINADocumento5 páginasBOCINALiliana Martínez JiménezAún no hay calificaciones
- Electricidad AutomotrizDocumento53 páginasElectricidad AutomotrizMirian Miluzca Perez Boza100% (2)
- Laboratorio 02 Funciones LogicasDocumento49 páginasLaboratorio 02 Funciones LogicasLuis Enrique Pari Alvarado0% (1)
- 3 Syllabus - CAF - Matemáticas I (Con Marca de Agua)Documento7 páginas3 Syllabus - CAF - Matemáticas I (Con Marca de Agua)Mar ITAún no hay calificaciones
- Informe 5 QuímicaDocumento4 páginasInforme 5 QuímicaALIN ANDER ALCALDE FLORIANAún no hay calificaciones
- Lección 5 - Acero. VigasDocumento19 páginasLección 5 - Acero. VigasIsabel María Becerra MartínezAún no hay calificaciones
- Anualidades Tema IV Matematica FinancieraDocumento27 páginasAnualidades Tema IV Matematica FinancieraJuan CorcegaAún no hay calificaciones
- Aprovechamiento Del Calor ResidualDocumento5 páginasAprovechamiento Del Calor ResidualOficina de ProyectosAún no hay calificaciones
- RuedasDocumento34 páginasRuedasMariano DomingoAún no hay calificaciones
- Horno y Estufa - para DescargarDocumento49 páginasHorno y Estufa - para DescargarJéssica GuamánAún no hay calificaciones
- Estática - EquilibrioDocumento7 páginasEstática - EquilibrioAlejo AlbornozAún no hay calificaciones
- Parcial Física II - Agroindustria (Primer Corte)Documento2 páginasParcial Física II - Agroindustria (Primer Corte)Luisa Fernanda Cetina AriasAún no hay calificaciones
- Propiedades Reológicas de Los MaterialesDocumento5 páginasPropiedades Reológicas de Los MaterialesLuis HernándezAún no hay calificaciones
- Caja CraneanaDocumento2 páginasCaja CraneanamildredAún no hay calificaciones
- Manejo Quirúrgico de La Luxación Acromioclavicular Grado III Con Sistema de Anclaje Doble BotónDocumento5 páginasManejo Quirúrgico de La Luxación Acromioclavicular Grado III Con Sistema de Anclaje Doble BotónAlfonso Molina Oncólogo OrtopedistaAún no hay calificaciones
- Taller de Estadística 1Documento17 páginasTaller de Estadística 1yessika andrea quintero suarezAún no hay calificaciones
- Homologacion ASSET DOC LOC 6836823Documento105 páginasHomologacion ASSET DOC LOC 6836823Ricardo Matías Fernández TapiaAún no hay calificaciones
- Taller Sobre ENZIIMAS.Documento7 páginasTaller Sobre ENZIIMAS.omar correa londoñoAún no hay calificaciones
- Sesión 08Documento15 páginasSesión 08CarolinaAún no hay calificaciones
- Analisis de Muros Anem PDFDocumento5 páginasAnalisis de Muros Anem PDFWilfredo Subero BAún no hay calificaciones
- Trabajo y Energia IVDocumento6 páginasTrabajo y Energia IVrebeca nievesAún no hay calificaciones
- Ejerciciod Modulo 3Documento9 páginasEjerciciod Modulo 3Judith RozentalAún no hay calificaciones
- Transductores y AplicacionesDocumento42 páginasTransductores y AplicacionestonaAún no hay calificaciones
- Calcular y Graficar en El Diagrama de Temperatura Composición para Una Mezcla de Benceno y ToluenoDocumento4 páginasCalcular y Graficar en El Diagrama de Temperatura Composición para Una Mezcla de Benceno y ToluenoFernando GarciaAún no hay calificaciones
- TesisDocumento66 páginasTesisEzraAún no hay calificaciones
- 1.resumen Dios Editado (1) (Recuperado Automáticamente) (Recuperado Automáticamente)Documento275 páginas1.resumen Dios Editado (1) (Recuperado Automáticamente) (Recuperado Automáticamente)Vero Insaurralde VIAún no hay calificaciones
- Informe Corto Máq. de Los Ángeles (Enunciado) (Autoguardado)Documento4 páginasInforme Corto Máq. de Los Ángeles (Enunciado) (Autoguardado)MelanieAlfonsoAún no hay calificaciones
- 2 El Acero PDFDocumento24 páginas2 El Acero PDFRayda Vilcas HuamanAún no hay calificaciones
- Liberacion Instantanea o FlashDocumento3 páginasLiberacion Instantanea o FlashDayanaCamachoAún no hay calificaciones
- Monday Reminder From Astraeus GymDocumento7 páginasMonday Reminder From Astraeus GymDiana Alejandra Bermudez FajardoAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- El psoas: Músculo vital (Color)De EverandEl psoas: Músculo vital (Color)Calificación: 3.5 de 5 estrellas3.5/5 (9)
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDe EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónCalificación: 3.5 de 5 estrellas3.5/5 (2)
- Prácticas de refrigeración y aire acondicionadoDe EverandPrácticas de refrigeración y aire acondicionadoCalificación: 5 de 5 estrellas5/5 (6)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Zang Fu: Revelando la Cara del SíndromeDe EverandZang Fu: Revelando la Cara del SíndromeCalificación: 4.5 de 5 estrellas4.5/5 (2)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Toma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasDe EverandToma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasAún no hay calificaciones
- Ciencia de datos: La serie de conocimientos esenciales de MIT PressDe EverandCiencia de datos: La serie de conocimientos esenciales de MIT PressCalificación: 5 de 5 estrellas5/5 (1)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Guía práctica para la refracción ocularDe EverandGuía práctica para la refracción ocularCalificación: 5 de 5 estrellas5/5 (2)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Lactancia humana y fonoaudiología: Guía para madres lactantesDe EverandLactancia humana y fonoaudiología: Guía para madres lactantesCalificación: 5 de 5 estrellas5/5 (4)