0% encontró este documento útil (0 votos)
628 vistas19 páginasAnálisis de Hierro por Volumetría Redox
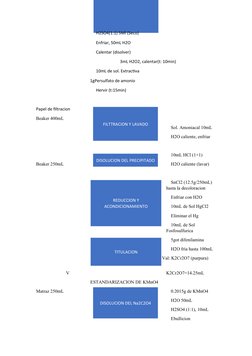
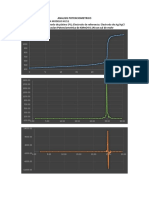
Se determinó la cantidad de hierro en una muestra mediante volumetría redox usando dicromato y permanganato de potasio. Los porcentajes de hierro obtenidos fueron 27.80% con dicromatometría y 32.59% con permanganatometría, lo que indica que esta última fue más exacta. Los valores teóricos fueron 27.54% y 32.52%, obteniéndose errores de 0.93% y 0.20% respectivamente, mostrando que la permanganatometría fue más precisa. No se encontraron errores significat
Cargado por
edgar junior florian mallquiDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
628 vistas19 páginasAnálisis de Hierro por Volumetría Redox
Se determinó la cantidad de hierro en una muestra mediante volumetría redox usando dicromato y permanganato de potasio. Los porcentajes de hierro obtenidos fueron 27.80% con dicromatometría y 32.59% con permanganatometría, lo que indica que esta última fue más exacta. Los valores teóricos fueron 27.54% y 32.52%, obteniéndose errores de 0.93% y 0.20% respectivamente, mostrando que la permanganatometría fue más precisa. No se encontraron errores significat
Cargado por
edgar junior florian mallquiDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd