0% encontró este documento útil (0 votos)
170 vistas40 páginasProteinas I PDF
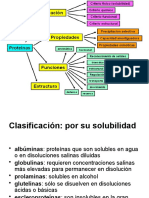
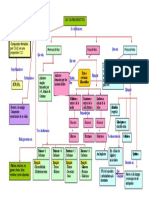
Este documento describe los diferentes niveles de estructura de las proteínas, incluyendo la estructura primaria, secundaria, terciaria y cuaternaria. Se explica que la estructura primaria se refiere a la secuencia lineal de aminoácidos, mientras que la estructura secundaria describe la conformación espacial adoptada por la cadena polipeptídica debido a enlaces no covalentes. Las estructuras secundarias comunes incluyen hélices alfa, hojas beta y giros beta. Finalmente, la estructura terci
Cargado por
jesseniaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
170 vistas40 páginasProteinas I PDF
Este documento describe los diferentes niveles de estructura de las proteínas, incluyendo la estructura primaria, secundaria, terciaria y cuaternaria. Se explica que la estructura primaria se refiere a la secuencia lineal de aminoácidos, mientras que la estructura secundaria describe la conformación espacial adoptada por la cadena polipeptídica debido a enlaces no covalentes. Las estructuras secundarias comunes incluyen hélices alfa, hojas beta y giros beta. Finalmente, la estructura terci
Cargado por
jesseniaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd