Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Prieto2019 en Es PDF
Cargado por
Josselyn Bustillos BuenañoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Prieto2019 en Es PDF
Cargado por
Josselyn Bustillos BuenañoCopyright:
Formatos disponibles
Artículo
Este citar: J. Chem. Ing. Datos 2019, 64, 2504 - 2518 pubs.acs.org/jced
Modelado Equilibrio entre Fases de éteres y alcoholes con GCA-EOS para la evaluación de la
Coblending de biocombustibles avanzados
Mariana Gonza ́ lez Prieto, † Francisco A. Sa ́ Sánchez, † y Selva Pereda *, †, ‡
† Planta Piloto de Ingeniería Química - Departamento de Ingeniería Química, Universidad Nacional del Sur - CONICET, Camino La Carrindanga Km7, 8000B Bahía
Blanca, Argentina
‡ Unidad de Investigación de la termodinámica, la Facultad de Ingeniería de la Universidad de KwaZulu - Natal, Howard campus de la universidad, el rey Jorge V Avenue, Durban 4041,
Sudáfrica
RESUMEN: En este trabajo, extendemos la contribución del grupo con la Asociación ecuación de
Descargado mediante UNIV DE sur de Indiana el 30 de julio de 2019 20:20:51 (UTC). Ver https://pubs.acs.org/sharingguidelines
estado (GCA-EOS) para modelar el comportamiento de fase de mezclas que comprenden éteres y
alcoholes. El modelo de parametrización se realiza mediante unos pocos de vapor binario - conjuntos
de datos de equilibrio líquido de monoéteres lineales. También modelar el comportamiento de
éteres ramificados, usados tradicionalmente como aditivos de combustible, así como la de
poliéteres, que se están proponiendo hoy en día como biocombustibles potenciales. Por lo tanto,
investigamos no sólo el equilibrio de fases, sino también el exceso de entalpías de estos tres tipos
de éteres en mezclas con alcoholes. Finalmente, se muestra que el GCA-EOS es capaz de
predecir el comportamiento de fase de poliéteres, así como el de éteres ramificados, usando una
enfoque de contribución de grupo. Este trabajo es parte de un proyecto más amplio para el desarrollo de un modelo termodinámico robusto y predictivo de procesos y diseño de
para las opciones sobre la forma de compartir artículos publicados legítimamente.
productos en el contexto de la valorización de la biomasa. Además, la parametrización informó aquí tiene como objetivo proporcionar un marco fiable específica fi c para la
descripción de las propiedades termodinámicas de las mezclas de biocombustibles.
1. INTRODUCCIÓN Del mismo modo, co-mezcla en los combustibles diesel es también valiosa, ya que la
adición de alcoholes a un combustible diesel está limitada por su solubilidad mutua; No
Hoy en día, la más común oxigenada aditivos para gasolinas son alcoholes
obstante, puede ser mejorada mediante la adición de biocombustibles a base de éter. 12 Un
(metanol y etanol) y éteres ramificados (metil terc butilo, acetato de terc butilo, terc
ejemplo interesante es la mezcla de dibutiléter + 1-butanol + diesel que representa buenas
amil metil éteres), y, por una parte, rutas sostenibles para sintetizar tanto de
propiedades de combustión y aumenta la e FFI eficiencia de la conversión de combustible. 5 ,
ellos son bien conocidos. Por otro lado, la transición de fi primera generación en
13
biocombustibles avanzados impone el uso de material de alimentación residual
para su producción, además de evidencia de que este último representa un
limpiador y más e FFI propulsión ciente. 1 El diseño de un biocombustible atractiva o una mezcla de los mismos requiere la
capacidad de predecir las propiedades del combustible pertinentes. En particular, la
volatilidad es una propiedad clave a considerar durante la vida útil de combustible: de la
A este respecto, una amplia gama de nuevos biocombustibles y aditivos están en di ff Erent
producción, el transporte, el almacenamiento, el rendimiento en el motor, y las emisiones
etapas de investigación y desarrollo. Entre ellos, los biocombustibles a base de éter
incluso después de la combustión. Por esta razón, hay numerosas pruebas y las normas
están jugando un papel importante. Por ejemplo, varios autores proponen monoéteres
de calidad para evaluar la volatilidad de un combustible: la presión de vapor Reid, la curva
lineales, tales como dimetil éter, y hasta di- norte- butil éter, como el correo ff agentes de
de destilación, y el vapor - relación líquido (temperatura). Por lo tanto, el diseño de mezcla
mezcla ectantes para los combustibles derivados del petróleo. 2 - 5 También, poliéteres
de combustible es una tarea que requiere la capacidad de describir el comportamiento de
como tri (propilenglicol) dimetil éter, maleato de dibutilo, y la mezcla de éter dimetílico de
equilibrio de fase de mezclas de hidrocarburos y compuestos oxigenados con un buen
dietilenglicol y 1,2-dimetoxietano 6 - 9 Se están estudiando como candidatos prometedores
grado de precisión. En este contexto, un modelo termodinámico predictivo es una
para reemplazar los aditivos oxigenados para el combustible diesel.
herramienta valiosa.
En la búsqueda de candidatos atractivos para biocombustibles, la coblending con
dos o más componentes puede mostrar mejores propiedades que el uso de la Antes de la introducción de una revisión de la literatura sobre los modelos
contraparte componente individual. Por ejemplo, la adición de etanol a una gasolina termodinámicos aplica a mezclas de éteres + alcohol, es de destacar que, a lo largo
regular provoca un aumento en la presión de vapor de combustible, mientras que de este manuscrito, en aras de la simplicidad, nos referimos a los éteres más
butanol en cantidades similares reduce la presión de vapor mezcla. 10 Por lo tanto, un comunes por sus acrónimos habituales, que se enumeran en tabla 1 .
co-mezcla de etanol y butanol puede contribuir a controlar la presión de vapor de un
combustible, como Andersen et al. 11 mostrar, una adición vol / vol 30% de una mezcla
de etanol - butanol (50/50 vol / vol) mantiene invariante la presión de vapor de un Recibido: 11 de enero de, 2019
combustible base. Aceptado: 13 de marzo de, 2019
Publicado: 2 de mayo de, 2019
© 2019 American Chemical Society 2504 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
Tabla 1. Los éteres en estudio y los acrónimos utilizados en este trabajo
monoéteres lineales poliéteres lineales monoéteres ramificados
nombre acrónimo nombre acrónimo nombre acrónimo
dimetil éter DME dietilenglicol dimetil éter DEGDME metilo terc butil éter MTBE
éter dietílico DEE trietilenglicol dimetil éter TEGDME terc amil metil éter DOMAR
di- norte- propil éter DPE tetraetilenglicol dimetil éter TeEGDME Etyl terc butil éter ETBE
di- norte- butil éter DBE
metilo norte- butil éter MBE
etilo norte- propil éter EPE
etilo norte- butil éter EBE
El comportamiento de fase de mezclas de alcoholes de éter + ha sido objeto de EOS a las mezclas binarias de lineal, ramificado, y poliéteres con alcoholes
estudios teóricos debido a su complejidad. Característico de estos sistemas es una utilizando un único conjunto de parámetros. Este trabajo es la continuación de un
competencia entre alcohol autoasociación, el éter - alcohol transversal asociación, y artículo anterior, que evaluó el modelado de los datos de presión de vapor de éter
puro y su equilibrio de fases en mezclas con alcanos. 26
la fuerte dipolo - interacciones dipolo. 14 - dieciséis Como se mencionó anteriormente, hay
varios éteres que son objeto de investigación en biocombustibles potenciales. Por
lo tanto, un modelo de contribución de grupo puede acortar el desarrollo de una
herramienta para la evaluación termodinámica cualquier caso. Por ejemplo, por una 2. MODELO TERMODINÁMICO
parte, dos Ramos et al. 17 predecir satisfactoriamente el comportamiento de la La GCA-EOS 27 es una extensión de la GC-EOS 28 a mezclas de asociación.
mezcla binaria DBE + 1-pentanol y el ternario con norte- nonano, usando una La GC-EOS original se basa en la furgoneta generalizada der Waals
versión de contribución de grupos de la estadística que asocia función de partición, combinado con el principio composición local y un
enfoque de contribución de grupo. Hay tres contribuciones a la energía de
Helmholtz en las GCA-EOS:
Florida teoría uid para potenciales de alcance variable (SAFT-VR) y parámetros fi tted
en trabajos anteriores. Por otra parte, Nguyen - Huynh et al. 18 modelar el equilibrio
de fases de mezclas de monoéteres lineales (de DEE a DBE) con 1-alcanoles
R fv
= + club
Automóvil + británico
UN
att Assoc
UN (1)
utilizando el grupo de contribución polar SAFT de cadena perturbado los f ree-volumen o repulsivo contribución ( UN fv) se representa por la ecuación
(GC-PPC-SAFT). Ellos fi t los parámetros del grupo puros utilizando presiones de para esferas duras desarrollados por Carnahan -
vapor puro éter y datos de densidad, así como vapor - Estornino 29 y extendido a mezclas de Mansoori y Leland. 30
Este término se caracteriza por el diámetro crítico de esferas duras ( re C) de
equilibrios líquido (VLE) de datos de dos sistemas binarios clave: DPE + compuestos puros. los atractivo contribución ( UN att) es una furgoneta clásico der Waals
norte- heptano y metil DBE + norte- heptano. Al modelar los sistemas binarios con expresión combinada con una regla dependiente densidad--composición local de la
alcoholes, para reducir el número de parámetros ajustables, se pusieron la energía mezcla, basado en una versión contribución grupo del modelo de dos líquidos (NRTL)
transversal de asociación y de volumen igual a los parámetros de la no aleatoria. 31 Este término se caracteriza por el número de segmentos de superficie
auto-asociación de la alcohol; a partir de entonces, investigan el esquema de de cada grupo ( q yo), Delaware fi define como en UNIFAC, 32 y la energía de superficie ( sol
asociación con dos, uno, y ninguno asociar sitios en la molécula de éter. Los ii), que es dependiente de la temperatura. Thermore Fur-, cada interacción del grupo
autores concluyen que un sitio es el mejor con fi configuración para modelar el VLE binario se caracteriza por un parámetro de interacción ( k ij), que puede ser dependiente
de mezcla + 1-propanol DPE a 323 K. Por último, Lubarsky et al. 19 comparar de la temperatura, y dos factores binarios de amortiguación ( α ij ≠ α Ji). Finalmente, el asociación
GC-PPC-SAFT y modi basado crítico-punto- fi ed perturbado de cadena SAFT término ( UN Assoc) es una versión de contribución de grupos de la ecuación SAFT
(CP-PC-SAFT) (modelo lecular mo-) capacidad predictiva para el comportamiento desarrollado por Chapman et al., 33 y sus parámetros característicos son el volumen
de fase de mezclas que comprenden unos alcanoles, ésteres, éteres, y cetonas. asociación y la energía ( ε ki, lj y κ ki, lj, respectivamente). Los detalles de las ecuaciones
Como era de esperar, encontraron que el modelo molecular tiene un mejor del modelo se incluyen en el Apéndice.
rendimiento para describir el equilibrio de fases dietil éter + 1-butanol, cerca de la
región crítica, mientras que ambos modelos conducen a resultados similares para el
VLE de baja presión de DPE + mezclas de 1-hexanol. Para nuestro conocimiento,
no existen estudios que evalúan el equilibrio de fases de mezclas de compuestos 2.1. Modelo parametrización. La tabla GCA-EOS de parámetros ya incluye
de éter y alcohol en un sentido amplio, es decir, la serie homóloga de ambos el éter 26 y alcohol 20 grupos, así como sus interacciones con los grupos alquilo,
orgánicos. En general, las publicaciones sólo se ocupan de unos pocos sistemas, y ya sea para representar a su propia cadena principal de carbono o sus
no hay estudios que discuten el modelado de poliéteres por la contribución grupo. mezclas con hidrocarburos. Por lo tanto, en este trabajo, los únicos grados de
libertad para modelar mezclas que comprenden éteres y alcoholes son los
parámetros de interacción binaria entre ellos. Para ensamblar éteres lineales y
ramificados, se necesitan los grupos alifáticos, CH 3 / CH 2 y CH 3 ( B) / CH 2 ( B) /
CH 3 CH, respectivamente. Skjold - Jørgensen 28 reportar los parámetros para
Con el objetivo de desarrollar una herramienta para ayudar a la investigación sobre el describir la
diseño de mezclas de combustible y co-mezcla de biocombustibles, aplicamos la
contribución de grupos con la Asociación ecuación de estado (GCA- EOS) para modelar fi dos primeros, mientras que Soria et al. 21 fi t los necesarios para alcanos
el comportamiento de fase de las mezclas binarias que comprenden una amplia variedad ramificados. Por otra parte, los trabajos anteriores 26 , 34 también reportar la
de éteres y alcoholes. Este modelo termodinámico ya se ha aplicado con éxito a mezclas
temperatura pura compuesto crítica y diámetro de éteres y alcoholes para la
que implican fi biocombustibles primera generación (bioetanol 20 - 23
contribución de repulsión del GCA-EOS. En el fi parte primera de este trabajo, 26 que
de fi ne el grupo éter como el átomo de oxígeno limitado por los alquilos vecinos, es
y el biodiesel 24 ) y los biocombustibles avanzados como compuestos de furano-derivado. 25 En decir, CH X OCH y. Por un lado, independientemente del grado de
este trabajo, se especi fi camente extender el GCA-
2505 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
Tabla 2. Parámetros binarios interacción entre éteres y alcoholes para la Contribución atractivo de la ACG-EOS
yo j k ij * k ij ' α ij α Ji de vapor correlacionada - datos de equilibrio líquido
CH 3 OCH 3 CH 3 OH 0,911 0.00 28 dieciséis DME + metanol a 263, 323, y 433 K 36 - 39
C 2 H 5 OH 0,999 0.08 0 6 DME + etanol a 293 y 373 K 40 , 41
CH 2 OH 0,939 0.05 - 20 10 DME + 1-propanol a 323 K 36
CH 3 OCH 2 / CH 3 jefe CH 3 OH 1.015 0 0 0 + Metanol de 1,2-dimetoxietano a 1 bar 42
C 2 H 5 OH 1.0 0 0 0 no correlacionados
CH 2 OH 1.08 0.08 0 0 1,2-dimetoxietano + 1-propanol a 1 bar 42
CH 2 OCH 2 / CH 2 jefe CH 3 OH 1.0 0 0 0 no correlacionados
C 2 H 5 OH 0.97 0 0 0 DPE + etanol a 1 bar 43
CH 2 OH 0.97 0.01 0 0 DPE + 1-propanol a 0,2 bar 44
Tabla 3. Ser y Parámetros Cruz de asociación de la GCA-EOS
ε ki lj, / R κ ki, lj
grupo yo sitio k grupo j sitio l (K) (cm 3 mol - 1) de vapor correlacionada - datos de equilibrio líquido
CH 3 OCH 3 ( -) OH (+) 2018 2.89 DME + metanol a 263, 323, y 433 K, 36 - 39 DME + etanol a 293 y 373 K, 40 , 41 DME + 1-propanol a 323 K 36
COC ( -) OH (+) 2000 1.05 1,2-dimetoxietano + metanol + 1-propanol a 1 bar, 42 DPE + etanol a 1 bar 43 y DPE + 1-propanol a 0,2 bar 44
sustitución, el grupo es de fi definida por una energía de superficie única parámetros que funcionan de manera similar en el resto de los datos de equilibrio.
característica ( sol ii), y distinguimos aquí entre la interacción binaria de un central y
un grupo éter terminal. Por otra parte, la familia homóloga alcohol se describe por Los parámetros de interacción binaria ( k, ij
α ijα), y Jiel
la contribución del grupo, excepto para el metanol y el etanol, que son
parámetros transversal de asociación ( ε ki lj, , κ ki lj, ) entre el alcohol
molecularmente de fi nida, como de costumbre con la fi los miembros primeros de
y grupos éter se regresan simultáneamente por fi datos tting VLE de mezclas
una serie. Es importante destacar que todos los alcoholes son iguales en términos
binarias seleccionadas de éteres con alcoholes. Como se mencionó anteriormente,
de su propia y transversal asociación con otros compuestos; es decir, que
los tres grupos de alcohol (CH 3 OH, C 2 H 5 OH, y CH 2 OH) comparten el mismo
comparten el mismo esquema de asociación (2B: un donador de electrones y un
esquema de asociación y de parámetros. Por lo tanto, su asociación cruzada con el
aceptor de electrones) y los parámetros. 20 Lo mismo vale para la familia éter;
grupo éter se correlaciona fi en primer lugar. Para reducir el número de parámetros
modelamos DME molecularmente; Sin embargo, a pesar de que todos los éteres
comparten el esquema de asociación, DME tiene sus propios parámetros de ajustables, los parámetros de interacción binaria del término atractivo se establecen
asociación. inicialmente a sus valores predeterminados ( k
*= 1, α ijαy sóloJise regresan
k ij'= = =), 0 los parámetros transversal de
ij
La parametrización del modelo se realiza a través de la minimización asociación. Después, se incluyen los parámetros de interacción
de la siguiente función objetivo (DE): binarios, uno por uno, en el siguiente
pasos de correlación. Si el fi tting de un nuevo parámetro de interacción binaria no
NEQ
mejora sustancialmente el rendimiento del modelo, se establece de nuevo a su valor
DE = Σ mieq, 2yo
por defecto. Este procedimiento se repite, hasta que se consiga un resultado
yo= 1 (2)
satisfactorio. Primero nosotros fi t la interacción binaria del grupo éter terminal usando
los datos de equilibrio binarias de alcoholes con 1,2- dimetoxietano, que se ensambla
donde NEQ es el número de puntos de equilibrio, y mi eq, yo es el error entre los datos
con sólo dos grupos terminales. Elegimos este compuesto para minimizar el en Florida
experimentales y calculados de la siguiente manera:
influencia de las parametrizaciones anteriores. En segundo lugar, se utilizan los datos
2 brium equili- binarias de alcoholes con DPE a los parámetros binarios correlato del
ikjjjjjj - PÁGINAS y {zzzzzz
Exp, yo calc, yo grupo éter centro (CH 2 OCH 2). Como se mencionó antes, fi t especí fi parámetros c para
mieq, 2yo = - (2 EP)
yo
DME, como de costumbre para el fi miembro de primera de cualquier serie en los
Exp, yo
modelos de contribución de grupos. Finalmente, desafiados la capacidad predictiva
2 2
ikjjjjjj
T - TT y {zzzzzz ikjjjjjjj - yy y {zzzzzzz del modelo con los datos de equilibrio de fases no utilizados durante la
Exp, yo calc, yo 2 exp, 1 yo calc, 1 yo
+ ( miyo - 1) + WY
y parametrización, incluyendo no sólo los datos de otros monoéteres lineales no
Exp, yo exp, 1 yo correlacionadas, sino también a sistemas con éteres y poliéteres ramificados.
(3)
dónde PAG es la presión, T es la temperatura, y es la fracción molar en la fase de vapor, y
mi yo es una variable auxiliar que establece el tipo de cálculos: 1 para Tx Florida cenizas y 2
para px Florida ceniza. El factor de peso para la composición de vapor, w Y, es fi jado en 0,2 Las tablas 2 y 3 mostrar la fi conjunto nal de los parámetros de interacción binaria
según lo recomendado por Skjold - Jørgensen. 35 En este trabajo, todos los sistemas para el atractivo y de asociación contribución, respectivamente, y los datos
binarios VLE se evaluaron a través del cálculo del punto de burbuja. La función objetivo ( eq utilizados para retroceder cada uno de ellos. Como puede verse, los parámetros no
2 ) Se reduce al mínimo basándose en el Levenberg - algoritmo de Marquardt de fi noche di ff rencia
aleatoriedad son nulos en el caso de los grupos centrales y terminales de éter. Esto
codificado en Fortran77. Además, a lo largo del procedimiento de parametrización, se significa que describen datos binarios solamente VLE de éter + alcoholes no tiene
utilizan los datos de entalpía en exceso para seleccionar entre di ff conjuntos de Erent que corregir la regla de mezcla de la contribución atractivo con un término
composición local. di ff Erent es el caso de DME,
2506 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
Tabla 4. Correlación GCA-EOS y predicción de la VLE un de mezclas binarias de dimetil éter (1) con norte- Alcoholes (2)
alcohol T ( K) PAG ( bar) AARD T o PAG (%) AARD y 1 (%) norte fuente
Correlación
metanol 263, 323, 433 0.5 - 11 2.0 PAG 3.0 62/30 36 - 39
etanol 293, 373 0.06 - 31 3.5 PAG 1.0 28 40 , 41
1-propanol 323 0.12 - 12 1.6 PAG 37 36
Predicción
metanol 254 - 453 0.3 - 22 2.8 PAG 2.4 274 37 - 39 , 45
etanol 323, 353 0.03 - 18 3.7 PAG 0.7 69/32 36 , 40
1-butanol 323 0.05 - 11 2.3 PAG 39 36
un VLE: vapor - equilibrios líquidos, AARD: desviaciones relativas absolutos promedio en PAG presión y T temperatura, NORTE: número de puntos de datos experimentales.
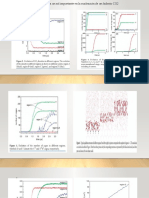
Figura 1. equilibrios de fase de la mezcla binaria DME + metanol. (A) VLE al ( ◆) 293,15, ( ◇) 353,15, ( x) 393,15, ( ■) 433.15, y ( □) 453,15
K. 37 , 38 , 45 ( si) PT proyección de la locus crítico. 38 Símbolos: datos experimentales, de trazos y líneas continuas: correlación y predicción con la EOS GCA-, respectivamente, y líneas de puntos:
presión de vapor de componente puro correlacionada con la GCA-EOS.
Figura 2. DME + ( □) metanol y ( ○) equilibrio de fases etanol a 323 K. (a) VLE. 36 ( b) entalpía exceso. 36 , 37 Símbolos: datos experimentales, de trazos y líneas continuas: Correlación GCA-EOS y de
predicción, respectivamente, líneas de puntos: simulación GCA-EOS de datos usados durante la parametrización para seleccionar el mejor conjunto de parámetros, entre las alternativas viables
para describir los datos VLE.
que sigue el modelo molecularmente, y debemos fi t todos los parámetros de interacción para modelar el VLE de mezclas que comprenden lineal mono- y poliéteres, así
binaria para desarrollar un modelo robusto. como monoéteres ramificados, con alcoholes.
3.1. Linear monoéteres + n-alcoholes mezclas binarias.
3. RESULTADOS Y DISCUSIÓN Tabla 4 informa la exactitud GCA-EOS a modelo DME con alcoholes, junto con el
intervalo de temperatura y la presión cubierto por los datos experimentales, el
Las mezclas binarias éter + alcohol investigados en este trabajo se desvían positivamente
de Raoult ' s ley. Por lo tanto, un modelo de contribución de grupo debe representar tal
número de puntos experimentales, y la fuente de los datos. En ambos casos, la
comportamiento, independientemente de las longitudes de cadena de alquilo de moléculas correlación de datos y predicción, las desviaciones GCA-EOS en la presión de la
tanto el éter y el alcohol, con el mismo conjunto de parámetros, con excepción de DME, burbuja y la composición en fase de vapor son inferiores a 4%. Por ejemplo, Figura
que se modela molecularmente. En esta sección se informa exactitud GCA-EOS 1 representa el comportamiento de fase de DME +
2507 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
Tabla de Correlación 5. GCA-EOS y predicción de Vapor - Liquid Equilibrios de binarios mezclas que comprenden monoéteres lineales (1) con norte- Alcoholes (2)
sistemas binarios T ( K) PAG ( bar) AARD un T o PAG (%) AARD y 1 (%) norte fuente
Correlación
DPE (di- norte- éter) etanol
propilo 347 - 357 1 0.04 T 2.2 15 43
1-propanol 315 - 331 0.2 0.04 T 1.7 20 44
Predicción
DEE (dietil éter) metanol
303 - 338 0.93 - 1 0.5 T 5.5 70/58 46 - 49
298 - 388 0.17 - 9.9 4.5 PAG 4.2 55/10 47 , 50
etanol 342 - 418 2.8 - 9.6 0.4 T 8.6 40 51 si
273 - 323 0.05 - 1.65 8.8 PAG 2.3 76 52 , 53
1-propanol 303,15 0.04 - 0.85 5.5 PAG 24 54
1-butanol 409 - 546 13.6 - 34 0.98 T 5.5 40 55
308 - 391 1 3.5 T dieciséis 36 46 C
DPE (di- norte- éter) metanol
propilo 278 - 323 0.05 - 0.62 1.5 PAG 91 56
etanol 278 - 338 0.02 - 0,72 1.9 PAG 2.1 163/43 56 , 57
1-propanol 278 - 323 0.01 - 0.27 3.7 PAG 0.65 120 58
358 - 380 1 0.05 T 2.4 21 44
1-butanol 278 - 323 0,002 - 0.25 4.2 PAG 144 59
1-pentanol 363 - 411 1 0.18 T 1.6 22 60
1-hexanol 288 - 323 0.01 - 0.24 1.9 PAG 70 61
1-octanol 293 - 323 0,009 - 0.23 2.8 PAG 60 61
DBE (di- norte- butil éter)
metanol 298,15 0.05 - 0.17 5.2 PAG 5.5 17 62
etanol 333 - 338 0.07 - 0.6 3.7 PAG 6.8 39 63 , 64
1-butanol 326 - 415 0.07 - 1.0 0.16 T 3.5 139/42 44 , sesenta y cinco
298,15 0.01 - 0,012 1.2 PAG 1.4 15 62
1-pentanol 367 - 414 0.26 - 1.0 0.32 T 40 66
EPE (acetato de norte- éter) metanol
propilo 310, 330 0.3 - 1.11 2.3 PAG 8.2 26 67 re
EBE (acetato de norte- butil éter)
metanol 315, 335 0.16 - 0.97 2.2 PAG 2.3 30 67
MBE (metil norte- butil éter) metanol
310, 330 0.3 - 1 1.9 PAG 2.7 35 67
etanol 308 - 338 0.13 - 0.97 2.5 PAG 4.5 43 57
un AARD: desviaciones relativas absolutos promedio en PAG presión y T temperatura, NORTE: número de puntos de datos experimentales. si Los datos a presión más alta (9,6 bar) se encuentran dispersos. C Los
datos muestran un comportamiento ideal impar. re Los autores no pueden correlacionar estos datos utilizando NRTL con especi fi c parámetros moleculares, en contraste con sus otros datos propios para EBE y
MBE con metanol.
metanol bajo una amplia gama de temperatura y presión. Como puede verse, + alcoholes mezclas. Además, incluimos aquí el rango de temperatura y presión
la GCA-EOS describe correctamente la dependencia de la temperatura del cubierto por los datos, el número de puntos experimentales, y la fuente de los datos.
comportamiento de fase. Además, por una parte, Figura 1 B ilustra la presión - temperatura
Es importante destacar que, hasta donde sabemos, ninguno de los datos disponibles
( PT) en la literatura fueron excluidos de este análisis. En Tabla 5 , Las filas de color gris
proyección de la DME + mezcla de metanol locus crítico, que se predice sombreado representan los datos experimentales que se encuentran dispersos; Por
con precisión por el GCA-EOS. Por otra parte, Figura 2 muestra que el lo tanto, estos conjuntos de datos no están incluidos en la discusión de la exactitud
GCA-EOS es capaz de describir simultáneamente el equilibrio de fases y del modelo. Por un lado, como puede verse, en el caso de datos correlacionados, las
el exceso de entalpía de mezclas que comprenden DME con metanol y desviaciones medias son
etanol a 323 K.
0,04% de la temperatura de la burbuja y menor que 2,2% en la composición de
A diferencia de DME, el monoéter lineal restante se modelan siguiendo el enfoque fase de vapor. Por otro lado, GCA-EOS desviaciones medias de todos los datos
de contribución de grupo. Tabla 5 informes de la exactitud GCA-EOS para previstos son inferiores a 3,2% y
correlacionar los datos binarios VLE seleccionado y predecir el resto de los datos 0,41% en la presión de la burbuja y la temperatura, respectivamente, y por debajo de
experimentales disponibles de éter 2,9% en el caso de la composición en fase de vapor.
2508 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
Figura 3. mi ff ect de la longitud de cadena en el VLE de mezclas de un monoéter + un alcohol lineal. (A) DPE + alcohol a 323 K: ( ◇) metanol, ( ○)
etanol, ( □) 1-propanol, y (+) 1-butanol. 56 - 59 ( b) Etanol + lineal monoéteres a 338 K: ( □) MBE, ( ◇) DPE, y ( ○) DBE. 57 , 64 Símbolos: datos experimentales, líneas: predicciones
GCA-EOS.
Figura 4. VLE de la mezcla de monoéteres lineales isómeros con metanol al ( ◇) 310 y ( □) 330 K. (a) Metil- norte- butil-éter. (B) etil- norte- propil éter. Símbolos: los datos experimentales, 67 líneas:
predicciones GCA-EOS.
Figura 5. mi ff ect de la longitud de cadena sobre el exceso entalpía de mezclas binarias de un monoéter lineal + un alcohol a 298 K. (a) DEE + ( ◇)
metanol y ( □) etanol. 68 ( b) Metanol + ( ◇) DPE y ( □) DBE. 56 , 68 Símbolos: datos experimentales, líneas: predicciones GCA-EOS.
Desafortunadamente, a excepción de DME, los datos disponibles para otros mezclas de etanol + lineal éter de di ff Erent alquilo cadenas y con di ff posiciones
éteres se limitan a unos pocos isotermas en un estrecho intervalo de temperatura. Erent del grupo éter dentro de la cadena alquilo (MBE, DPE, y DBE).
figura 3 muestra el correo ff ect de la longitud de cadena en el VLE de mezclas de
Además, Figura 4 muestra el comportamiento de fase de metanol con MBE y
un monoéter lineal con un alcohol. Por ejemplo, figura 3 A muestra el
EPE en dos di ff temperaturas Erent e ilustra que el GCA-EOS puede predecir
comportamiento de fase isotérmica de mezclas de DPE con metanol, etanol,
1-propanol, y 1butanol. Similar, figura 3 b ilustra la VLE de binario el equilibrio de fases de éteres asimétricos isoméricas, como
2509 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
La Figura 6. mi ff ect de la longitud de cadena sobre el exceso entalpía de mezclas de monoéteres lineales con alcoholes a 298 K. mezclas de (a) binarias de DPE con ( ◆) 1-octanol, ( x) 1-hexanol, ( ○) 1-pentanol,
( ■) 1-butanol, y ( ◇) 1-propanol. 58 , 69 , 70 ( b) las mezclas binarias de 1-propanol con ( ○) éter dietílico, ( □) di- norte- propil éter, y ( ◇) di- norte- butil-éter. 58 , 68 , 71 Símbolos: los datos experimentales, líneas sólidas:
predicciones GCA-EOS, líneas de puntos: simulación EOS GCA- de datos usados durante la parametrización para seleccionar el mejor conjunto de parámetros, entre las alternativas viables para
describir los datos VLE.
Tabla 6. Correlación GCA-EOS y predicción de Vapor Líquido Equilibrios de binarios de mezclas que contienen poliéteres (1) y alcoholes (2)
sistemas binarios T ( K) PAG ( bar) AARD un T o PAG (%) AARD y 1 (%) norte fuente
Correlación
metanol
1,2-dimetoxietano 338 - 353 1 0.16 T 3.6 20 42
propanol 357 - 370 1 0.12 T 4.5 28 42
Predicción
etanol 1,2-dimetoxietano
351 - 358 1 0,19 T 5.0 33 42
1-butanol 359 - 390 1 0,19 T 3.3 29 42
DEGDME (dietilenglicol dimetil éter) metanol
308 0,004 - 0.28 13 PAG 25 72
1-propanol 308 0,004 - 0.52 7.3 PAG 24 72
TeEGDME (tetraetilenglicol dimetil éter) metanol
473 - 513 2.62 - 8.05 5.2 PAG 0,038 (AAD) 9 73
423 - 503 3.1 - 34.5 5.8 PAG 50 74
293 - 423 0.01 - 10 28 PAG 0,004 (AAD) 178 75
un AARD: desviaciones relativas absolutos promedio en PAG presión o T temperatura. NORTE: número de puntos de datos experimentales, las desviaciones absolutas promedio (AAD) se informa, debido a la baja
volatilidad de TeEGDME.
así como manejar el cambio en la composición azeotrópica como la posición de los aumenta, mientras que los datos experimentales sugieren que no hay casi ningún
cambios de grupo de éter. impacto de la longitud de la cadena alquilo del alcohol. Además, el modelo predice
Además, desafiamos el modelo para describir el exceso de entalpía de las que el máximo de la curva de entalpía en exceso es ligeramente sesgada hacia
mezclas discutidas anteriormente. las figuras 5 y 6 alcohol inferior fracciones molares de alcoholes más pesados, mientras que los
representar el correo ff ect de la longitud de cadena sobre el exceso entalpías de datos también permanecen invariables en ese sentido. A diferencia de, Figura 6 B
mezclas de monoéteres lineales y alcoholes. El modelo es capaz de predecir muestra el opuesto e ff ect en mezclas de 1-propanol con éteres de longitud de
cualitativamente bien el correo ff ect de aumentar el peso molecular de alcohol a partir cadena alquílica variable. En este caso, la entalpía en exceso aumenta con la
de metanol a etanol en mezcla con DEE ( Figura 5 a) y el correo ff ect del peso cadena de alquilo éter, aunque los cálculos del modelo siguen los datos
molecular éter (de DPE a DBE) en mezclas binarias con metanol ( Figura 5 si). Sin experimentales cualitativamente. Con respecto a este correo ff ect de aumentar la
embargo, como se mencionó antes, es importante destacar que la mayoría de los cadena de alquilo, es de destacar que alcano + éter mezclas e ff caz exhibir inferiores
datos experimentales VLE están disponibles en una temperatura y presión de corto entalpías exceso como alquilo grupos se añaden a la mezcla, el comportamiento
alcance, que de alguna manera se debilita el modelo robustez para predecir las que el GCA-EOS describe con precisión. 26 Por lo tanto, una tendencia experimental
propiedades de derivados. Por ejemplo, invariante, como el representado en la Figura 6 una, es di FFI culto a sostener y
también para predecir con un enfoque groupcontribution. Sin embargo,
Figura 6 una ilustra el correo ff ect del peso molecular de alcohol en el exceso
de entalpía de la mezcla con DPE, donde está claro que el modelo predice
una mayor disminución del exceso de entalpía de la mezcla como el peso es importante
molecular del alcohol destacado que estos resultados que se prevé basan en el
2510 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
optimización de los datos VLE en un estrecho intervalo de temperatura, y por lo
tanto todavía hay lugar para mejoras.
3.2. Los poliéteres + n-alcoholes mezclas binarias. Después de modelar
monoéteres lineales, desafiamos el modelo para describir el VLE de mezclas de
poliéteres con alcoholes utilizando el mismo conjunto de parámetros de
interacción binarios. Tabla 6
resume las desviaciones GCA-EOS en la presión de la burbuja y la composición de
fase de vapor, de nuevo, por tanto, los datos experimentales correlacionados y
predichos. El GCA-EOS predice Accu comportamiento rado VLE de
1,2-dimetoxietano y DEGDME con alcoholes, mientras que las desviaciones más
grandes se observan para el sistema binario metanol TeEGDME +, aunque todavía
son resultados satisfactorios, dada la baja volatilidad de TeEGDME.
Figura 7 representa la predicción GCA-EOS del comportamiento VLE
La Figura 9. Isotérmica VLE de la mezcla binaria TeEGDME + metanol al ( x)
373 K y ( △) 423 K (Esteve et al. 75 ), ( ▲) 423 K, ( ◇) 443 K, ( *) 483 K, y (+) 503 K
(Kuczynski et al. 74 ), ( □) 493
K, y ( ○) 513 K (Khosla et al. 73 ). Tenga en cuenta que los datos a 503 K son incompatibles con
los datos en 493 y 513 K. Símbolos: datos experimentales, líneas: predicciones GCA-EOS.
sistema binario en una amplia gama de temperatura, hasta 513 K, donde el
modelo y los datos disponibles muestran discrepancias importantes.
Al igual que en la sección anterior, predecimos el exceso de entalpía de
mezclas de poliéteres con alcoholes utilizando el modelo de parametrización se
presenta en este trabajo. Figura 10 muestra el correo ff ect del peso molecular del
alcohol y el número de átomos de oxígeno en la molécula de poliéter en el exceso
de entalpía de las mezclas. En este caso, los datos experimentales revelan un
La Figura 7. VLE de las mezclas binarias de + alcoholes de 1,2-dimetoxietano a
aumento del exceso de entalpía como el peso molecular de uno de los
presión atmosférica: (+) 1-butanol, ( □) 1-propanol, ( ○)
compuestos aumenta, y las simulaciones modelo siguen este comportamiento
etanol, y ( ◇) metanol. Símbolos: los datos experimentales, 42 discontinuas y sólidas líneas:
cualitativamente. Además, por una parte,
correlación GCA-EOS y predicciones.
Figura 10 A muestra que, para el 1,2-dimetoxietano, el máximo exceso de entalpía
de 1,2-dimetoxietano con di ff alcoholes Erent a presión atmosférica; igualmente, Figura
predicho por el modelo se desplaza a bajar fracciones molares de alcohol, de una
8 hace lo mismo para DEGDME. Además, las limitaciones muestra el modelo
manera similar a otros monoéteres + alcoholes ( Figura 6 un). Por otra parte, Figura
para predecir el VLE de mezclas de TeEGDME + metanol a temperaturas por
10 B muestra que las mezclas con 1-propanol y di ff poliéteres Erent, los cambios
debajo de 423
máximos hacia composiciones de alcohol más grandes, y el GCA-EOS también
K. Es de destacar que los datos disponibles para este espectáculo sistema de
sigue tal comportamiento.
discrepancias entre los di ff Erent autores. Sin embargo,
Figura 9 muestra que GCA-EOS predice cualitativamente bien esta
3.3. Ramificada Éteres + n-alcoholes mezclas binarias. En esta sección se prueba
la capacidad de predicción del modelo con los datos de equilibrio de fases
experimentales de sistemas binarios que comprenden éter ramificado y alcoholes.
Estos son sistemas relevantes debido a su potencial real de éteres ramificados como
aditivos para gasolina, y por lo tanto en las futuras mejorada compañeros de mezclas.
Tabla 7 muestra que las desviaciones de las predicciones GCA-EOS están en el
mismo orden de magnitud como para los éteres lineales, con desviaciones promedio
en la temperatura y presión de 0,19% y
3,2%, respectivamente, mientras que la desviación en la composición de éter en la
fase de vapor es ~ 4,5%. Las desviaciones más grandes en la fase de vapor
corresponden a mezclas que implican MTBE, debido a las discrepancias cerca de
la composición azeotrópica en sistemas con metanol o etanol. las figuras 11 y 12 representar
el correo ff ect del peso molecular de alcohol en el VLE isobárica y isotérmica de
mezclas con éteres ramificados. Figura 11 a, b ilustra el comportamiento del
modelo para predecir VLE de MTBE y TAME con alcoholes (en metanol hasta
1-butanol), respectivamente. El GCA-EOS describe satisfactoriamente la
transición entre mezclas que representan el comportamiento azeotrópica a un
Figura 8. la presión de la burbuja de mezclas de DEGDME con alcoholes a 308 K: ( □) metanol comportamiento casi ideal, ya que el peso molecular del alcohol
y ( ◇) 1-propanol. Símbolos: los datos experimentales, 72 líneas: predicciones GCA-EOS.
2511 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
La Figura 10. mi ff ect de la longitud de cadena sobre el exceso entalpía de mezclas de poliéteres con alcoholes a 298 K. mezclas de (a) binarias de 1,2-dimetoxietano con ( x) 1-octanol, ( ◆) 1-hexanol,
( △) 1-pentanol, ( □) 1-butanol, y ( ◇) 1-propanol. 76 ( b) las mezclas binarias de 1-propanol con ( ○) TeEGDME, ( □) DEGDME, y ( ◇) 1,2-dimetoxietano. 68 , 76 , 77 Símbolos: los datos experimentales, líneas
sólidas: predicciones GCA-EOS, líneas de puntos: simulación GCA-EOS de datos usados durante la parametrización para seleccionar el mejor conjunto de parámetros, entre las alternativas
viables para describir los datos VLE.
Tabla 7. GCA-EOS Predicción de VLE un de mezclas binarias que contienen Ramificada monoéteres (1) con alcoholes (2)
sistemas binarios T ( K) PAG ( bar) AARD T o PAG (%) AARD y 1 (%) norte fuente
Metilo terc butil éter (MTBE) metanol
308 - 337 0,53, 1 0.25 T 8.0 178 78 - 81
313 - 364 0.35 - 3.6 3.0 PAG 7.3 166/40 67 , 79 , 82 , 83
etanol 308 - 351 0.5 - 1 0.2 T 6.1 169 78 , 81 , 84 , 85
313 0.18 - 0.56 3.1 PAG 8.4 33 86
1-propanol 313 0.07 - 0.59 4.4 PAG 7.1 65/33 81 , 87
328 - 370 1 0.18 T 2.5 30 88
1-butanol 313,15 0.03 - 0.59 5.2 PAG 4.2 33 81
329 - 386 1 0.21 T 1.7 19 89
1-hexanol 298 - 338 0,001 - 1.36 3.8 PAG 56 90
terc amil metil éter (TAME) metanol
288 - 343 0.06 - 1.3 3.4 PAG 5.5 167 79 , 91 , 92
363,31 1.12 - 2.7 1.8 PAG 29 82
332 - 359 0.86 - 1 0,19 T 5.7 92 78 , 93 - 96
etanol 323 - 413 0.3 - 7.4 2.46 PAG 2.6 81 91 , 97
334 - 413 0.3 - 1 0.11 T 2.6 92 78 , 98
1-propanol 323, 333 0.12 - 0.43 5.2 PAG 3.0 54 91
313,15 0.07 - 0,19 5.6 PAG 26 99
358 - 368 1 0.12 T 2.5 19 88
1-butanol 360 - 388 1 0.17 T 2.3 18 100
323, 333 0.06 - 0.41 3.62 PAG 2.2 54 91
Etilo terc butil éter (ETBE) metanol
322 - 343 0,93, 069 0.09 T 1.4 44 101
331 - 346 1 0.09 T 32 102
328, 333 0.69 - 1.09 2.3 PAG 3.4 32 103 , 104
etanol 313, 333 0,19 - 1.59 1.7 PAG 1.6 79 103 , 105
298 - 363 0.08 - 1.7 2.6 PAG 228 106
345 - 352 1 0.11 T 3.1 20 107
1-propanol 333,15 0.21 - 0.66 4.5 PAG 2.4 23 103
325 - 368 0.49 - 0.93 0.27 T 0.65 63 108
1-butanol 333,15 0.10 - 0.66 3.15 PAG 2.3 20 103
un VLE: vapor - equilibrios líquidos, AARD: desviaciones relativas absolutos promedio en PAG presión y T temperatura, NORTE: número de puntos de datos experimentales.
aumenta. Además, Figura 12 representa la VLE isotérmica de ETBE con los mismos con alcoholes, como se informa en la literatura. En caso de que se requiere una mejor
alcoholes, que es seguido con precisión por el GCA-EOS. Por último, el nuevo descripción, más datos de di ff tipo Erent y bajo una gama más amplia de temperatura
conjunto de parámetros es incapaz de predecir el exceso de entalpías de mezclas que se necesita para fi t los parámetros del modelo.
de éteres ramificados
2512 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
La Figura 11. VLE de las mezclas binarias de un éter ramificados con alcoholes a presión atmosférica: ( △) 1-butanol, ( ○) 1-propanol, ( □) etanol, y ( ◇) metanol. (A) TAME 78 , 88 , 100 ( b) MTBE. 81
, 88 , 89 Símbolos: datos experimentales, líneas: predicciones GCA-EOS.
conjunto de parámetros del modelo es capaz de predecir el comportamiento de fase de
poliéteres con alcoholes, así como la de éteres ramificados. En este análisis, DME no
se tiene en cuenta, ya que se modela molecularmente, como de costumbre con el fi los
miembros primeros de cualquier familia orgánica. También, desafiamos la GCA-EOS
para predecir el exceso de entalpías de mezclas de los diversos tipos de éteres con
alcoholes utilizando el mismo conjunto de parámetros. A pesar de las desviaciones
importantes, la GCA-EOS describe cualitativamente el exceso de entalpía de mezclas
de mono- y poliéteres con alcoholes.
■ APÉNDICE: modelar el GCA-EOS
El modelo GCA-EOS tiene tres contribuciones a la energía de Helmholtz residual.
La contribución volumen libre está representado por el prolongado Carnahan - Estornino
29 ecuación para mezclas de esferas duras desarrollados por Mansoori y Leland: 30
λ 2λ3
fv
UN λ 1λ 2 3 2
= 3 (Y - + 1) (Y -- Y ln) Y + n YEn
RT λ
32
La Figura 12. VLE de las mezclas binarias de ETBE + alcoholes a 333 K: ( ◇) metanol, ( □)
(A.1)
etanol, ( ○) 1-propanol, y ( △) 1-butanol. Símbolos: los datos experimentales, 103 , 105 líneas:
predicciones GCA-EOS. con
- 1
ikjjjj πλ y {zzzz
Y =- 1
4. CONCLUSIONES 6 3V (A.2)
alcoholes de bajo peso molecular y éteres ramificados son bien conocidos como
NC
aditivos para combustibles. Por otra parte, en los últimos años, varios autores subrayan
el potencial de otros derivados, como alcoholes de alto peso molecular y poliéteres, λ k= Σ Dakota
i ik k =
del (Norte 1, 2, 3)
como agentes para la gasolina y combustible diesel mezclado. Además, su mezcla yo= 1 (A.3)
como aditivos, llamado co-mezcla, es una alternativa interesante para explorar la
dónde norte yo es el número de moles de componente yo, NC representa el número de
mejora de las propiedades del combustible. Aunque cooperación de mezcla es un área
componentes, V representa el volumen total, R
poco desarrollada hasta el momento, se espera que surjan en el futuro para promover el
representa la constante universal de los gases, T es la temperatura, y re yo es el
uso de nuevos biocombustibles. El diseño de mezcla de combustible / biocombustible
diámetro de esferas duras por mol de especies yo. La siguiente expresión generalizada
requiere modelos termodinámicos robustos y predictivos, capaces de predecir precisa el
da la dependencia de la temperatura del diámetro de esferas duras:
equilibrio de fases de mezclas que comprenden moléculas de organo-oxi- genated
complejos.
ÄÇÅÅÅÅÅÅÅÅÅ
ikjjj- TT
C yo
y {zzzÉÖÑÑÑÑÑÑÑÑÑ
reyo = 1.065 655 1re0.12exp
C yo
- 2
3 (A.4)
Este trabajo es la segunda parte de la extensión GCA-EOS para modelar las series
orgánicos de éteres. En el fi parte primera, que modelar su mezcla con hidrocarburos, dónde re C yo y T C yo son, diámetro de esferas duras respectivamente, la crítica y
y, en esta continuación, evaluamos sus mezclas con alcoholes. El GCA-EOS es capaz temperatura crítica del componente yo. La contribución atracción por la energía
de predecir el comportamiento de fase de 30 sistemas binarios, la mayoría de ellos residual de Helmholtz, UN att,
cuantitativamente, basado en la correlación de datos experimentales de cuatro representa las fuerzas de dispersión entre grupos funcionales. Es un van der Waals
mezclas binarias de éteres lineales. Además, con el mismo expresión combinada con una regla de mezcla-composición local de dependiente de la
densidad sobre la base de una contribución grupo
2513 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
versión del modelo NRTL. 31 La van der Waals expresión para la energía dónde sol ii * es la energía de la atracción, y k ij * es la interacción
atractiva Helmholtz es igual a - un · norte · ρ, siendo un
parámetro a la temperatura de referencia T yo* y TT ( * + *)/2 ,
el parámetro de energía, norte el número de moles, y ρ la densidad en moles. Para un yo j
componente puro, un se calcula como sigue: respectivamente. Finalmente, el término asociación, 27 UN Assoc, es una versión de
contribución de grupos de la ecuación SAFT de Chapman et al .: 33
z qg
un =
22 (A.5)
ÄÇÅÅÅÅÅÅÅÅÅÅÅ ÉÖÑÑÑÑÑÑÑÑÑÑÑ
Assoc NGA
dónde sol es la energía atractiva característica por segmento, y ARTE
yo
ikjjj X ki y {zzz METRO
Σ Σ norte
* yo
= yo
En X ki
- +
q es el número de segmentos de superficie como de fi nida en el método UNIFAC. 32 Las 2 2
yo= 1 = 1
kM (A.15)
interacciones se supone que tener lugar a través de la superficie, y el número de
coordinación ( z) se fija igual a 10 como de costumbre. 32 En GCA-EOS la extensión a En esta ecuación NGA representa el número de asociar grupos funcionales, norte
mezclas se realiza utilizando el modelo NRTL pero usando fracciones superficiales
yo* indica el número total de moles de grupo asociar i, X ki es la fracción de grupo
locales como en UNIQUAC 109 en lugar de fracciones molares locales:
yo sitio a través de no unida k, y METRO yo es el número de sitios que asocian
en grupo yo. El número total de moles de grupo asociar yo se calcula a partir
z 2 mix
att qg̃ del número mi
UN 2
=- ν * de los grupos que asocian yo presente
RT RTV (A.6)
en la molécula metro y la cantidad total de moles de la especie m (n metro):
dónde q es el número total de segmentos de superficie, y sol mezcla es la energía mezcla NC
característica de atracción por segmentos totales, calculado como sigue: *=
norte
yo Σν * norte
mi m
=
metro 1 (A.16)
ng ng θτj ji ji sol
La fracción de los grupos yo sitio a través de no unida k se determina por la
sol
mezcla
= Σ Σθ ij ng expresión:
yo= 1 = 1
Σ
k = 1
θ kτki (A.7)
-
y ikjjjjjjj NGA j
n *j XΔ lj lj ki y {zzzzzzz
ΣΣ
,1
X ki =+ 1
NC ng V
j = =1 lM 1 (A.17)
q = ΣΣ ν nqi ij j
yo= =1 j 1 (A.8) donde la suma incluye todos los grupos que asocian NGA y
METRO j sitios. X ki depende de la fuerza de asociación, Δ:ki lj.
dónde ij ν es el número de grupos de tipo j en la molécula yo; q j
ÄÇÅÅÅÅÅÅÅÅÅ ÉÖÑÑÑÑÑÑÑÑÑ
representa el número de segmentos de superficie asignado al grupo j, ikjjjε ki lj, y {zzz
θ j representa la fracción de superficie de grupo j Δ ki= lj. κ ki lj. Exp - 1
RT (A.18)
NC
1
θj == Σ nqi νij j La fuerza de asociación entre el sitio k del grupo yo y el sitio l del grupo j depende
q (A.9) de la temperatura T y de los parámetros de asociación κ ki, JL y ε ki, JL, que representan
yo 1
el volumen y la energía de asociación, respectivamente.
ikjjjjjj qgΔ y {zzzzzz
Ji
τ Ji = Exp α Ji
RTV (A.10)
■ INFORMACIÓN DEL AUTOR
Autor correspondiente
Δ=
sol- sol sol
Ji Ji ii (A.11) * Email: spereda@plapiqui.edu.ar .
sol Ji es la energía de atracción entre grupos yo y j, y α Ji es el parámetro no ORCID
aleatoriedad. Es de destacar que, en ausencia de aleatoriedad ( α ij = 0), eq Selva Pereda: 0000-0002-2320-4298
A.7 da la regla de mezcla cuadrática clásica. La energía atractiva, sol ij, se
notas
calcula a partir de la energía entre segmentos como grupo a través de la
Los autores declaran no competir fi interés financiero.
siguiente regla de combinación:
sol = kgg (k = k Ji )
■ EXPRESIONES DE GRATITUD
ij ij jj ii ij
(A.12) Los autores reconocen la fi el apoyo financiero otorgado por el Consejo
Nacional de Investigaciones Cienti ́ fi cas y Te ́ cnicas
con la siguiente dependencia de la temperatura para los parámetros de la energía y de (PIP 112 2015 010 856), el Secretari ́ una de Ciencia, Tecnologi ́ un
interacción: e Innovacio ́ n Productiva (PICT 2016 hasta 0907), y la Universidad Nacional
ÄÇÅÅÅÅÅÅÅÅÅÅÅ del Sur (PGI 24 / M153).
ikjjjjj y {zzzzz ikjjjjjT y {zzzzzÉÖÑÑÑÑÑÑÑÑÑÑÑ
= * sol
+' - + 1"
■
sol 1 sol T sol En
ii ii ii *
T yo
ii
T yo* LISTA DE SÍMBOLOS
(A.13)
UN la energía libre de Helmholtz.
y
AAD ( Z) desviación absoluta media en la variable Z:
ÄÇÅÅÅÅÅÅÅÅÅÅÅÅ
ikjjjjjj y {zzzzzzÉÖÑÑÑÑÑÑÑÑÑÑÑÑ N
2 TTT 1
k ij
= * k+ij ' 1 k ij
En
* + * Σ| Z Exp, yo
- Z calc, yo|
yo j (A.14) norte
i
2514 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
AARD ( Z)% desviación relativa media en la variable Z: (7) Li, D .; et al. Las mediciones en Presión de vapor y la conductividad térmica
para pseudo-binario Sistemas de combustible de hidrocarburo con etileno y éter
1 Z - ZZcalc, dimetílico de éteres. Energy Fuels 2009,
Σ
Exp, yo yo
23, 794 - 798.
norte Exp, yo
iN
(8) Smith, BL; Ott, LS; Bruno, TJ composición explícita curvas de destilación de
re yo mi ff reflexivo diámetro de la esfera duro del componente yo. combustible diesel con glicol de éter y glicol éster oxigenados: Análisis de combustible
re C yo mi ff reflexivo diámetro de la esfera duro del componente yo Metrología Para habilitar Disminución de las emisiones de partículas. Reinar. Sci. Technol. 2008,
evaluada en T C. 42, 7682 - 7689. (9) Bruno, TJ; Lovestead, TM; Riggs, JR; Jorgenson, EL; Huber, ML
sol yo energía Grupo por segmento de superficie de grupo yo. Comparación de combustible Diesel oxigenados Los aditivos a la curva de destilación
H entalpía molar Método Composición-explícita. Parte 1: Los compuestos lineales con uno a tres átomos de
oxígeno. Energy Fuels 2011, 25,
k ij parámetro de interacción entre los grupos yo y j.
METRO yo número total de sitios que asocian en grupo yo.
2493 - 2507.
Número de componentes en la mezcla. GN
CAROLINA DEL NORTE
(10) Christensen, E .; Yanowitz, J .; Ratcliff, M .; McCormick, RL renovables efectos de
Número de grupos atractivas en la mezcla. NGA
mezcla oxigenados en las propiedades de la gasolina. Energy Fuels 2011, 25, 4723 - 4733.
Número de asociar grupos en la mezcla.
PAG Presión.
(11) Andersen, VF; Anderson, JE; Wallington, TJ; Mueller, S.
qj Número de segmentos de superficie de grupo j.
UN.; Nielsen, las presiones de vapor de alcohol DO - Mezclas de gasolina. Energy Fuels 2010, 24, 3647
R Constante universal de gas. - 3654. (12) Go ́
Rk van der Waals reducir el volumen del componente k. rski, K .; Przedlacki, M. Evaluación de la influencia de la adición de éter dietílico
T Temperatura. (DEE) sobre las propiedades fisicoquímicas seleccionados de Diesel Oil and período de
T C yo Temperatura crítica de componente yo. retardo de encendido. Energy Fuels 2014, 28,
V Volumen total de la mezcla. 2608 - 2616. (13)
wy Ponderación factor para la composición de la fase vapor en función Alonso-Trista ́ n, C .; Segovia, JJ; Chamorro, CR; Martín, M.
objetivo. C.; villaman ̃ un ́ n, MA Fase propiedades de equilibrio de la Ternario
X ki Fracción de los sitios no enlazados de la asociación de tipo k Mezcla dibutiléter + tolueno + heptano a 313,15 K. Equilib fluido de fase. 2012, 317, 84
en grupo yo. - 88. (14) Gonza ́
X yo composición molar en fase líquida de componente lez, JA; Mozo, I .; García de la Fuente, I .; Cobos, JC; Riesco, N.
Termodinámica de (1-Alkanol + lineal monoéter) Systems. J. Chem. Thermodyn. 2008,
yo.
40, 1495 - 1508. (15) Gonza ́
y yo composición molar en fase de vapor de componente
lez, JA; Mediavilla, A .; De La Fuente, IG; Cobos, JC Termodinámica
yo.
de 1 alcanol + lineales de poliéter mezclas. J. Chem. Thermodyn. 2013, 59, 195 - 208.
z Número de coordinación.
■ símbolos griegos
(16) Rezanova, EN; Kammerer, K .; Lichtenthaler, RN exceso Propiedades
de alcanol binario + diisopropiléter (DIPE) o + dibutiléter (DBE) las mezclas y
α ij parámetro no aleatoriedad entre los grupos yo y j. la aplicación de la solución real Asociada modelo ampliado. J. Chem. Ing.
ε ki, lj Energía de la asociación entre el sitio k del grupo yo y el sitio l Datos 1999, 44, 1235 -
del grupo j. 1239.
(17) dos Ramos, MC; McCabe, C. en la predicción de Ternario Comportamiento
κ ki, lj Volumen de la asociación entre el sitio k del grupo yo y el sitio l
mezcla de fase desde el enfoque GC-SAFT-VR: 1-pentanol + dibutiléter + norte- Nonano.
del grupo j.
Equilib fluido de fase. 2011,
ν ijNúmero de grupos j en el compuesto yo.
302, 161 - 168.
ν ij* Número de grupos que asocian j en el compuesto yo. (18) NguyenHuynh, D .; Passarello, JP; de Hemptinne, JC; Tobaly, P. Extensión de
φ yo Coe fugacidad FFI ciente de compuesto yo. Polar GC-SAFT a sistemas que contienen algunos compuestos oxigenados:
Aplicación a éteres, aldehídos y cetonas. Equilib fluido de fase. 2011, 307, 142 - 159.
■ Referencias (19) Lubarsky, H .; Polishuk, I .; NguyenHuynh, D. Aplicación de GC-PPC-SAFT y
CP-PC-SAFT para predecir termodinámico propiedades de las mezclas de Weakly-
(1) Leitner, W .; Klankermayer, J .; Pischinger, S .; Pitsch, H .; Kohse- Ho ̈ inghaus, K. y No Asociado oxigenada compuestos. J. Supercrit. fluidos 2016, 115, sesenta y cinco - 78.
biocombustibles avanzados y más allá: Química Soluciones para la propulsión y la (20) Soria, TM; sa ́
producción. Angew. Chem., Int. Ed. 2017, 56,
5412 - 5452.
Sánchez, FA; Pereda, S .; Bottini, SB Modelado
(2) Arcoumanis, C .; Bae, C .; Crookes, R .; Kinoshita, E. El potencial de Di-metil éter (DME)
Alcohol + agua + mezclas de hidrocarburos con la contribución del grupo con la
como combustible alternativo para los motores de encendido por compresión: A Review. Combustible
Asociación ecuación de estado GCA-EOS. Equilib fluido de fase. 2010, 296, 116 - 124.
2008, 87, 1014 - 1030. (3) Gangwar, JN; Saraswati, S. Estabilidad de Dual (Diesel-alcohol) y
triplicado (Diesel-alcoholes-éteres) de combustible mezclas. Los biocombustibles 2018,
(21) Soria, TM; Andreatta, AE; Pereda, S .; Bottini, SB modelización
termodinámica de la fase Equilibrios en Biorrefinerías. Equilib fluido de fase. 2011, 302,
7269, 1 - 9.
1 - 9. (22) Soria, TM; sa ́
(4) Marsh, KN; Niamskul, P .; Gmehling, J .; Bo ̈ lts, R. Revisión de las mediciones de
Sánchez, FA; Pereda, S .; Bottini, SB Modelado
propiedades termofísicas de mezclas que contienen MTBE, TAME, y otros éteres con
el comportamiento de fase de cíclico compuestos en mezclas de agua, alcoholes e
disolventes no polares. Equilib fluido de fase. 1999, 156, 207 - 227.
hidrocarburos. Equilib fluido de fase. 2014, 361, 116 - 129. (23) Sa ́
(5) Harvey, BG; Meylemans, HA El papel de butanol en el desarrollo de Sánchez, FA; Pereda, S .; Brignole, EA GCA-EOS: Modelo de
tecnologías sostenibles de combustible. J. Chem. Technol. Biotechnol. 2011, 86, 2 - 9. Contribución Un grupo SAFT • Extensión a mezclas que contienen hidrocarburos
aromáticos y asociar compuestos. Equilib fluido de fase. 2011, 306, 112 - 123.
(6) Ott, LS; Smith, BL; Bruno, TJ curvas de destilación composición explícita de mezclas de
combustible diesel con derivados de biomasa Glycol Ester oxigenados: una herramienta de (24) Cotabarren, NS; Hegel, PE; Pereda, S. Termodinámica Modelo para el
diseño de combustible para las emisiones de partículas disminuye. Energy Fuels 2008, 22, 2518 - proceso de diseño, simulación y optimización de la producción de biodiesel. Equilib
2526. fluido de fase. 2014, 362, 108 - 112.
2515 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
(25) Gonza ́ lez Prieto, M .; sa ́ Sánchez, FA; Pereda, S. termodinámico Éter dimetílico, dióxido de carbono + Dimetil Éter + metanol y nitrógeno +
Modelo de procesamiento de la biomasa de la presión intensificada Technologies. J. Supercrit. Dimetil Éter + metanol. J. Chem. Ing. Datos 2001, 46,
fluidos 2015, 96, 53 - 67. (26) Prieto, MG; sa ́ 640 - 646.
Sánchez, FA; Pereda, Contribución S. Un grupo (46) Gao, D .; Zhang, H .; Zhu, D .; Sun, H .; Chen, H .; Shi, J .; Lu ̈ cking, P .;
Ecuación de Estado de Bioré fi refinerías. GCA-EOS Extensión de Combustibles Bioether y sus Invierno, B .; Zhan, Y. Correlación y Predicción para isobárico Vapor-Líquido
mezclas con NORTE- Alcanos. Aceptado para publicación en equilibrios del sistema ternario + 1Butanol éter dietílico + metanol y la sistemas
J. Chem. Ing. Datos. binarios Constituyentes en
(27) Gros, HP; Bottini, SB; Brignole, EA Un grupo de ecuaciones Contribución de 101.325 kPa. Ind. Eng. Chem. Res. 2012, 51, 567 - 575. (47) Gmehling, J .; Onken,
Estado para la asociación de mezclas. Equilib fluido de fase. 1996, 116, 537 - 544. U .; Schulte, HW Vapor-Líquido Equilibrios para el Binary Sistemas de éter
dietílico-Halotano (1,1,1Trifluoro-2-bromo-2-cloroetano), halotano-metanol, y
(28) Skjold-Jørgensen, Contribución S. Grupo ecuación de estado (GC-EOS): Un éter dietílico-metanol. J. Chem. Ing. Datos 1980, 25, 29 - 32. (48) Goloborodkina,
método predictivo de fase de equilibrio cálculos más amplias gamas de RV; Beregovykh, VV; Babich, SV; Timofeev, VS; Lvov, SV Gas-Liquid equilibrio
temperatura y presiones de hasta 30 MPa. en éter dietílico acetona, éter dietílico - hexano, éter dietílico - Sistemas de
Ind. Eng. Chem. Res. 1988, 27, 110 - 118. metanol a presión atmosférica. Khim Farm. Z h. 1981, 15, 79 - 83. (49) Pettit, JH
(29) Carnahan, NF; Starling, KE ecuación de estado para Nonattracting mínimo de ebullición-Puntos y vapor de composiciones.
esferas rígidas. J. Chem. Phys. 1969, 51, 635 - 636. (30) Mansoori, GA; Carnahan,
NF; Starling, KE; Leland, TW equilibrio termodinámico propiedades de la
mezcla de Hard Esferas. J. Chem. Phys. 1971, 54, 1523 - 1525. J. Phys. Chem. 1899, 3, 349 - 363.
(50) Srivastava, R .; Natarajan, G .; Smith, BD total Presión de Vapor-Líquido
(31) Renon, H .; Prausnitz, JM composiciones locales en termodinámicos datos de equilibrio para binarios Sistemas de éter dietílico con acetona, acetonitrilo
Funciones El exceso de líquidos mezclas. AIChE J. y metanol. J. Chem. Ing. Datos 1986,
1968, 14, 135 - 144. 31, 89 - 93.
(32) Fredenslund, A .; Gmehling, J .; Rasmussen, P. Vapor-Líquido Equilibrios
(51) Moeller, WP; Englund, SW; Tsui, TK; Othmer, DF Las composiciones de vapores de
Usando UNIFAC. Un grupo de cotización Método. Equilib fluido de fase. 1977, 1, 27 - 64.
ebullición Soluciones - Equilibrios bajo presión de Sistemas: acetato de éter-alcohol etílico
y acetato de EtherWater-alcohol etílico. Ind. Eng. Chem. 1951, 43, 711 - 717. (52) Nagai, Y .;
(33) Chapman, WG; Gubbins, KE; Jackson, G .; Radosz, M. SAFT: Ecuación-de-Estado
Isii, Estudios N. de la volatilidad de los combustibles que contienen alcohol etílico II. A
Solución Modelo para la asociación de Fluidos. Equilib fluido de fase. 1989, 52, 31 - 38. (34)
partir del cálculo de temperatura no inferior a un motor cuando se utiliza alcohol etílico-éter
Gonza ́
etílico mezclas como combustible. Kogyo Kagaku Zasshi 1935, 38, 86 - 91.
lez Prieto, M .; sa ́ Sánchez, FA; Pereda, S. Multifase
Modelado con equilibrios GCA-EOS. Parte II: dióxido de carbono con la serie
homóloga de Alcoholes. J. Chem. Ing. Datos 2018, 63, 920 -
(53) Gordon, AR; et al. Equilibrio líquido-vapor para el sistema
934.
etanol-dietil-éter. Lata. Res. J. si 1946, 24 ( 5), 263. (54) Bittrich, VH-J .; Eckert,
(35) Skjold-Jørgensen, Cálculos S. Gas solubilidad. II. La aplicación de un nuevo grupo
R. Das Dampf / gripe ̈ ssigkkeit Gleichgewicht Bina ̈
de aportación ecuación de estado. Equilib fluido de fase.
RER Mischungen Mit NORTE- Propanol. Z. Phys. Chem.
1984, dieciséis, 317 - 351.
(Muenchen, Ger.) 1994, 185, 207 - 221. (55) Kay, WB; Donham, WE líquido-vapor
(36) Park, S .; Han, K .; Gmehling, J. Vapor - Liquid Equilibrios y H mi
Equilibrios en el Iso-Butanol + NORTE- Butanol, metanol + NORTE- Butanol y éter
para binarios Sistemas de dimetil éter (DME) con C 1 - C 4 Alkan-1ols en 323,15 K y
dietílico
Liquid - Liquid Equilibrios para sistema ternario de DME + metanol + agua en 313,15
+ N-butanol Systems. Chem. Ing. Sci. 1955, 4, 1 - 16. (56) Garriga, R .;
K. J. Chem. Ing. Datos 2007, 52, sa ́
Sánchez, F .; Educación
rez, P .;física
Gracia,
́ las presiones de vapor M.
230 - 234.
a las ocho temperaturas entre 278,15 y 323,15 K y exceso molar de entalpías y
(37) Kim, SA; Yim, JH; Byun, SA; Lim, JS isotérmica vapor-líquido
volúmenes a T = 298,15 K de ( NORTE- Propiléter + metanol). J. Chem. Thermodyn. 1997,
Equilibrios para el sistema binario de dimetil éter (CH 3 OCH 3) + El metanol
29, 649 - 659. (57) Hofman, T .; Sporzyn ́ esquiar, A .; Vamos ³ don, A. Vapor-Líquido
(CH 3 OH). Corea J. Chem. Ing. 2011,
Equilibrios en etanol + (butil metil éter o dipropil éter) Sistemas en 308,15, 323,15,
28, 2324 - 2328.
y 338,15 K. J. Chem. Ing. Datos 2000, 45,
(38) Chang, E .; Calado, JC; Streett, WB Vapor-Líquido equilibrio en el
sistema éter dimetílico / metanol de 0 a 180
169 - 172. (58) Garriga, R .;
° C y a presiones de 6,7 MPa. J. Chem. Ing. Datos mil novecientos ochenta y dos, 27, 293 -
sa ́ rez,física
Sánchez, F .; Educación P .; ́ Gracia, M. isotérmica
298.
Vapor-Líquido Equilibrium a las ocho temperaturas y Funciones El exceso a 298,15 K de
(39) Holldorff, H .; Knapp, H. Binary Vapor-Líquido-Líquido Equilibrium de
Di- NORTE- Propiléter con 1-propanol o 2-propanol. Equilib fluido de fase. 1997, 138, 131 - 144.
dimetil éter - Agua y Mutual solubilidades de cloruro de metilo y agua:
(59) Garriga, R .; Educación física ́
Resultados experimentales y reducción de datos. Equilib fluido de fase. 1988, 44, 195
- 209. (40) Elbaccouch, MM; Elliott, RJ alta Presión de Vapor-Líquido Equilibrium rez, P .; Gracia, M. presiones de vapor en Eight
para Dimetil Éter + etanol y el éter dimetílico + etanol + agua. J. Chem. Ing. Datos 2000, Las temperaturas de mezclas de Di- NORTE- Propiléter + etanol, o + 1Butanol -
45, 1080 - 1087. (41) Dahlhoff, G .; Pfennig, A .; Hammer, H .; Van Oorschot, M. descripción termodinámica de mezclas de Di- NORTE-
Vapor-Líquido Equilibrios en cuaternarios mezclas de éter dimetílico + n-butano Propiléter + alcanol De acuerdo con el modelo ERAS. Ber. BunsenGes. 1997, 101, 1466
+ etanol + agua. J. Chem. Ing. Datos 2000, 45, 887 - 892. (42) Cabezas, JL; beltra ́ - 1473. (60) Lladosa, E .; Monto ́
n, JB; Burguet, MC; Mun ̃ oz, R. al vapor
Liquid equilibrios en el sistema ternario dipropil éter + 1-Propanol
n, S .; Coca, J. isobárico Vapor-Líquido + 1-pentanol y el Binary Sistemas dipropil éter + 1-pentanol, 1Propanol +
Datos Equllibrium para el Binary Sistemas de 1,2-dimetoxietano + alcoholes. J. Chem. 1-pentanol a 101,3 kPa. Equilib fluido de fase. 2006, 247,
Ing. Datos 1991, 36, 184 - 188. (43) Ernst, P. Diplomarbeit Dortmund. En Datos de la 175 - 181.
Serie Química DECHEMA; DECHEMA: Frankfurt, Alemania, 1975; Vol. 1, p 285. (44) (61) Garriga, R .; Martínez, S .; Educación física ́ rez, P .; Gracia, M. Vapor
Lladosa, E .; Monto ́ Las presiones a varias temperaturas entre 288,15 y 323,15 K de Di- NORTE- Propiléter
n, JB; Burguet, MC; Mun ̃ oz, R. isobárica con 1-hexanol o 1-octanol. Aplicación del modelo ERAS. Equilib fluido de fase. 1998, 147,
Vapor - Liquid Equilibrios para el Binary Sistemas 1-propilo Alcohol + dipropil éter 195 - 206. (62) Lepori, L .; Matteoli, E .; Bernazzani, L .; Ceccanti, N .; Conti, G .;
y 1-Butyl Alcohol + dibutil éter a 20 y 101,3 kPa. Equilib fluido de fase. 2006, 247, 47 Gianni, P .; Mollica, V .; Púa ̀
- 53. , MR isotérmica de vapor / líquido
(45) Teodorescu, M .; Rasmussen, P.-alta presión de vapor - Liquid equilibrios en Equilibrios de mezclas binarias con dibutil éter a 298,15 K. Phys. Chem. Chem.
los sistemas de Nitrógeno + dimetil éter, metanol + Phys. 2000, 2, 4837 - 4842.
2516 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
(63) Han, KJ; Hwang, IC; Parque, SJ; Parque, IH isotérmica del vapor - líquido en éter o terc Amil-metil-éter, y el butano o 2-metilpropeno en 363 K. J. Phys.-Chem.
equilibrio a 333,15 K, densidad y índice de refracción a 298,15 K para la mezcla Datos 1996, 2, 135. (83) Lee, J.-D .; Lee, T.-J .; Park, S.-J. Dilución infinita
ternaria de dibutiléter + etanol + Benceno y subsistemas binarios. J. Chem. Ing. coeficientes de actividad y equilibrios líquido-vapor para los sistemas binarios que
Datos 2007, 52 ( 3), 1018 - 1024. contienen MTBE. Corea Chem. Ing. Res. 1995, 33, 527 - 534. (84) Hiaki, T .;
Tatsuhana, K .; Tsuji, T .; Hongo, M. isobárico Vapor -
(64) Gmehling, J. VLE de datos para el diseño de procesos de separación.
AIChE Symp. Ser. 1985, 81, 121 - 129. Liquid Equilibrios de 2-metoxi-2-metilpropano + Etanol + octano y Constituyentes
(65) Greune, G .; Kehlen, H. Fluessigkeits-Dampf-Gleichgewicht von butanol - sistemas binarios a 101,3 kPa. J. Chem. Ing. Datos 1999, 44, 323 - 327. (85) Mejía,
Butylaether - Mischungen. Z. Phys. Chem. 1977, 258, 912 - A .; Segura, H .; Cartes, M. Vapor - Liquid Equilibrios y Interfacial tensiones del
924. sistema Etanol + 2-metoxi-2Methylpropane. J. Chem. Ing. Datos 2010, 55, 428.
(66) Kirss, H .; Kuus, M .; Siimer, E. isobárico Vapor - Liquid equilibrios del (86) Park, S.-J .; Lee, T.-J. Vapor-Líquido Equilibrios y exceso molar Propiedades
sistema ternario dibutiléter + 1-pentanol + Nonano. J. Chem. Ing. Datos 2006, 51, de MTBE + Metanol y + mezclas de etanol. Corea J. Chem. Ing. 1995, 12, 110 - 114.
1887 - 1891. (67) Fa ́ (87) Alonso-Trista ́
rkova ́ , J .; Linek, J .; Wichterle, I. isotérmica Vapor-Líquido
Equilibrios y volúmenes de exceso en el éter Sistemas Metanol-alifáticos. Equilib
fluido de fase. 1995, 109, 53 - 65. (68) Villaman ̃ un ́ n, C .; Montero, EA; villaman ̃ un ́ n, RM;
n, MA; Casanova, C .; Roux, AH; Grolier, J.-P. Chamorro, CR; Segovia, JJ Fase propiedades de equilibrio de binarias y
Calorimétrico Investigación de las interacciones entre el oxígeno y grupos hidroxilo en (Alcohol + ternarias de mezclas que contienen 1,1-dimetiletil metil éter, 1-propanol, y
Ether) a 298,15 K. J. Chem. Thermodyn. mil novecientos ochenta y dos, 14, 251 - 258. (69) En ̃ arrea, J hexano a T = 313,15 K. J. Chem. Ing. Datos
.; Valero, J .; Educación física ́ 2006, 51, 2121 - 2125. (88)
Go ́ mez-Marigliano, AC; Arce, A .; Rodil, E .; Soto, A. isobárico Vapor-Líquido
rez, P .; Gracia, M .; Gutié ́ rrez Losa, C.
Equilibria a 101,32 kPa y densidades, velocidades del sonido, y de refracción Índices
H mi y V mi de Algunos (butanona o dipropiléter + un alcanol) mezclas. J. Chem.
en 298,15 K para MTBE o TAME DIPE o + 1-propanol binarios sistemas. J. Chem. Ing.
Thermodyn. 1988, 20, 193 - 199.
Datos 2010, 55,
(70) Pintos, M .; Bravo, R .; Paz Andrade, MI; Pérez Villar, V. entalpías en exceso de
(N-Alkanol + dipropiléter), ( NORTE- Alkanol + 1,2Diethoxyethane), y ( NORTE- Alkanol +
92 - 97.
(89) Arce, A .; Rodil, E .; Soto, A. destilación extractiva de 2metoxi-2-metilpropano +
2-etoxietanol) a 298,15 K. J. Chem. Thermodyn. mil novecientos ochenta y dos, 14, 951 - 955.
etanol utilizando 1-Butanol como agente de arrastre: Equilibrios y simulación. Lata. J.
(71) Jime ́
Chem. Ing. 1999, 77, 1135 - 1140. (90) de Llano, JJ; Segade, L .; jime ́
nez, E .; Segade, L .; Franjo, C .; Alfiler ̃ eiro, MM; Paz Andrade, MI
nez, E .; Del Río, A .; Renuncio, J.
Experimental y predijo exceso de volúmenes molares y exceso molar Entalpías de
ARKANSAS; Pando, C. Vapor-Líquido Equilibrios para el sistema binario Hexan-1-ol
di-n-butil éter + 1-Propanol + NORTE-
+ terc Butil metil éter (MTBE) a 298,15, 318,15, y 338,15 K. Equilib fluido de fase. 2003,
Octano en 298,15 y 308,15 K. Equilib fluido de fase. 2001, 179, 363 -
208, 115 - 121. (91) Oh, J.-H .; Park, S.-J. Isotérmica Vapor-Líquido Equilibrios de
383.
2metoxi-2-metilbutano (TAME) + NORTE- Alcohol (C 1- C 4) mezclas a
(72) Villaman ̃ un ́ n, MA; Van Ness, HC Liquid - de vapor de equilibrio
y exceso de Gibbs energías de 2,5,8-trioxanonano + Metanol, O + 1-propanol. En
323,15 y 333,15 K. J. Chem. Ing. Datos 1997, 42, 517 - 522. (92) Mo ̈ ssner, F .; Coto,
t. DATOS Ser. Sel. Mezcla de datos. Ser. UN 1985, 32 - 37. (73) Khosla, P .;
B .; Pando, C .; Rubio, RG; Renuncio, JA líquido-vapor de equilibrio de metanol +
Krishnan, C .; Elliott, RJ; Berty, JM binario y multicomponente Vapor-Líquido
1,1-dimetilpropilo metil éter al (288.15, 308.15, y 328.15) K. J. Chem. Ing. Datos 1996,
Equilibrios de Síntesis Gas Componentes, metanol y agua con Tetra éter
41,
dimetílico de etilenglicol (Tetraglima). Chem. Ing. Commun. 1991, 102, 35 - 46. (74)
537 - 542.
Kuczynski, M .; Hart, WT; Westerterp, KR binario VapourLiquid Equilibrios de
(93) Everson, RC; Jansen, W. isobárico Vapor-Líquido Equilibrios de binarias y
metanol con Sulfolane. Tetraetilenglicol dimetil éter y 18-Crown-6. Chem. Ing.
ternarias mezclas de pesado Éteres, isoamilenos, y alcoholes. 1. El Terciario
Proceso. 1986, 20, 60. (75) Esteve, X .; Chaudhari, SK; Coronas, A. Vapor-Líquido
amil-metil-éter, 2-metil-1-buteno, y metanol. J. Chem. Ing. Datos 2001, 46, 243 - 246.
Equilibrios para Metanol + Tetraethtlene éter dimetílico. J. Chem. Ing. Datos 1995, 40,
(94) Rihko-Struckmann, LK; Linnekoski, JA; Krause, AOI; Pavlov, OS vapor - Líquido
1252 - 1256. (76) Cobos, JC; villaman ̃ una, MA; Casanova, C. El exceso de
y Reacción Química Equilibrios en la síntesis de 2-metoxi-2-metilbutano
entalpías de ( NORTE- Alkanol + 2,5-Dioxahexane) a 298,15 K. J. Chem.
(TAME). J. Chem. Ing. Datos
Thermodyn. 1984, dieciséis, 861 - 864.
2000, 45 ( 6), 1030 - 1035. (95) C ̌ ervenkova
́ , YO.; Boublik, las presiones de vapor T., índices de refracción,
y densidades en 20,0 ° C, y Vapor-Líquido equilibrio a 101.325 kPa, en el Metil
(77) de Ruiz Holgado, MEF; Fernández, J .; Paz Andrade, MI; Arancibia, Sistema de éter-metanol tercamílico. J. Chem. Ing. Datos 1984, 29, 425 - 427.
EL exceso molar entalpías de mezclas de derivados metílicos de
Polietilenglicol con 1-Alkanol a 298,15 K y (96) Reichl, A .; Daiminger, U .; Schmidt, A .; Davies, M .; Hoffmann,
101,3 kPa. Lata. J. Chem. 2002, 80, 462 - 466. U .; Brinkmeier, C .; Reder, C .; Marquardt, Flujo A Acumulación de reciclaje W. Aún
(78) Arce, A .; Martínez-Ageitos, J .; Soto, Mediciones A. VLE de mezclas para la determinación experimental de vapor - líquida equilibrios en los sistemas
binarias de metanol, etanol, 2-metoxi-2-metilpropano, y 2-metoxi-2-metil-butano reactivos. Equilib fluido de fase. 1998, 153, 113 - 134. (97) Narasigadu, C .; Naidoo, P
a 101,32 kPa. J. Chem. Ing. Datos .; Coquelet, C .; Richon, D .; Ramjugernath D. A Novel estático Analítica Aparato
1996, 41, 718 - 723. para mediciones de fase de equilibrio. Equilib fluido de fase. 2013, 338, 188 - 196. (98)
(79) Toghiani, RK; Toghiani, H .; Venkateswarlu, G. Vapor-Líquido Equilibrios de Mejía, A .; Segura, H .; Cartes, M. Vapor - Liquid Equilibrios y Interfacial tensiones
metilo terc Butil éter y metanol + terc Amilo metil éter + metanol. Equilib fluido de del sistema Etanol + 2-metoxi-2Methylbutane. J. Chem. Ing. Datos 2011, 56, 3142 - 3148.
fase. 1996, 122, 157 - 168. (80) Aim, K .; Ciprian, M. Las presiones de vapor, índice (99) Alonso, C .; Montero, EA; Chamorro, CR; Segovia, JJ; Martín, MC; villaman ̃ un ́
de refracción a
20.0 ° C, y Vapor-Líquido equilibrio a 101.325 kPa en el Metil
terc Sistema de éter-metanol butilo. J. Chem. Ing. Datos 1980, 25, n, MA Vapor-Líquido Equilibrium de
100 - 103. Octano-aditivos potenciadores en las gasolinas: 5. presión total de datos y GE para
(81) Park, S.-J .; Han, K.-J .; Gmehling, J. Vapor - Liquid Equilibrios y propiedades de binarias y ternarias de mezclas que contienen 1,1-dimetilpropilo metil éter (TAME),
exceso de Metil terc Butil éter (MTBE) que contengan sistemas binarios. Equilib fluido 1-propanol y n-hexano a 313,15 K. Equilib fluido de fase. 2003, 212, 81 - 95.
de fase. 2002, 200, 399 - 409. (82) Fischer, K .; Parque, SJ; Gmehling, J. Vapor-Líquido
Equilibrios para sistemas binarios que contienen metanol o etanol, terc butil metil (100) Arce, A .; Rodil, E .; Soto, Determinación A. Experimental de la
Vapor-Líquido equilibrio a 101,32 kPa de la sistema ternario 1-
2517 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
Diario de la Química e Ingeniería de Datos Artículo
Butanol + metanol + TAME. J. Chem. Ing. Datos 2000, 45, 1112 -
1115.
(101) Wisniak, J .; Aharon, L .; Nagar, Y .; Segura, H .; Reich, R. Efecto de la presión
en el líquido-vapor Equilibrios del Sistema de metanol + Acetato de 1,1-dimetiletilo
éter. Phys. Chem. Liq. 2001, 39, 723 - 737. (102) Arce, A .; Martínez-Ageitos, J .; Rodil, E
.; Soto, A. isobárico Vapor-Líquido Equilibria a 101,32 kPa y densidades, velocidades
de sonido, y de refracción Índices en 298,15 K de terc Butil etil éter + metanol o
Sistemas + etanol. ELDATA Int. Electrón. J. Phys.-Chem. Datos 1998, 4, 135 - 148.
(103) Oh, J.-H .; Park, S.-J. Isotérmica Vapor-Líquido Equilibrios en
333,15 K y volumen molar de exceso en 298,15 K de acetato de terc Butil éter (ETBE)
+ Alcoh-1-ol (C1-C4) mezclas. J. Chem. Ing. Datos
1998, 43, 1009 - 1013.
(104) Ohta, T .; Takemura, M .; Yamada, T. (vapor + líquido) Equilibrios en
(Metanol + Etil terc Butil éter) y (Metanol + Etil terc Butil éter + tolueno) a T = 328,15
K. J. Chem. Thermodyn. 2002, 34, 711 - 716.
(105) Kammerer, K .; Schnabel, S .; Silkenba ̈ umer, D .; Lichtenthaler,
RN Vapor-Líquido Equilibrios de binarios de mezclas que contienen un alcohol y un éter
ramificado. Resultados experimentales y el modelado.
Equilib fluido de fase. 1999, 162, 289 - 301.
(106) Rarey, J .; Horstmann, S .; Gmehling, J. Vapor - Liquid Equilibrios y
Presión de Vapor de datos para la Ethyl Sistemas terc
Butil éter + etanol y acetato de terc Butil éter + Agua. J. Chem. Ing. Datos 1999, 44, 532
- 538. (107) Yang, B .; Wang, H. vapor - Liquid Equilibrium para mezclas de agua,
alcoholes y éteres. J. Chem. Ing. Datos 2002, 47, 1324 -
1329.
(108) Mejía, A .; Segura, H .; Cartes, M .; Bustos, P. líquido-vapor de equilibrio,
densidades y interfaciales tensiones para la Ethyl Sistema
1,1-dimetiletil éter (ETBE) + Propan-1-ol. Equilib fluido de fase.
2007, 255, 121 - 130.
(109) Abrams, DS; Prausnitz, JM termodinámica estadística de mezclas líquidas: una
nueva expresión para el exceso de energía de Gibbs total o parcialmente los sistemas
miscibles. AIChE J. 1975, 21, 116 - 128.
2518 DOI: 10.1021 / acs.jced.9b00030
J. Chem. Ing. Datos 2019, 64, 2504 - 2518
También podría gustarte
- Novel Brassinosteroid-Modified Polyethylene Glycol Micelles ForDocumento8 páginasNovel Brassinosteroid-Modified Polyethylene Glycol Micelles ForMario CanteroAún no hay calificaciones
- Fumaric Acid-1.en - EsDocumento8 páginasFumaric Acid-1.en - EsDanna DalbaAún no hay calificaciones
- Kikuchi2019 en EsDocumento6 páginasKikuchi2019 en EsGerson trejo sanchezAún no hay calificaciones
- Estudio Hidrológico CajamarcaDocumento97 páginasEstudio Hidrológico CajamarcaK'anchaq RamArAún no hay calificaciones
- Fundamentos de Ecología y Medio AmbienteDocumento1 páginaFundamentos de Ecología y Medio AmbienteEMILIO NARCISO CADENA MARTINEZAún no hay calificaciones
- Matriz de Requisitos Legales 2021Documento17 páginasMatriz de Requisitos Legales 2021Vanessa TrujilloAún no hay calificaciones
- Paper 1 Conductimetría (1) .En - EsDocumento9 páginasPaper 1 Conductimetría (1) .En - EsJohn ArceAún no hay calificaciones
- Formato Cumplimiento de Objetivos Especificos (2018 I)Documento2 páginasFormato Cumplimiento de Objetivos Especificos (2018 I)Heyner Angulo PalacioAún no hay calificaciones
- Estudio de Caso de PectinaDocumento2 páginasEstudio de Caso de PectinaAmy MartinezAún no hay calificaciones
- Plan de Negocios "Mejoramiento de La Matriz - Energética Del País A Través de La Empresa Gasoductos - deDocumento1 páginaPlan de Negocios "Mejoramiento de La Matriz - Energética Del País A Través de La Empresa Gasoductos - deponcepadillafrankanthonyAún no hay calificaciones
- Poster YoelDocumento1 páginaPoster YoelYoel Alfonso AcostaAún no hay calificaciones
- Ficha de Registro Productos NuevoDocumento2 páginasFicha de Registro Productos NuevoJosue CondoriAún no hay calificaciones
- ElectroDocumento1 páginaElectroEfrain HernandezAún no hay calificaciones
- GUIADOCENTE - 4 Basque Culinay CenterDocumento61 páginasGUIADOCENTE - 4 Basque Culinay CenterValdes Alexan DreAún no hay calificaciones
- Acta-Avanzado - 2019 - Rica Playa 4toDocumento2 páginasActa-Avanzado - 2019 - Rica Playa 4toWalner Johan Carrillo BarrientosAún no hay calificaciones
- Tarea 2 - 25 Articulos Cientificos. Romero MendozaDocumento8 páginasTarea 2 - 25 Articulos Cientificos. Romero MendozaLIMAAún no hay calificaciones
- Matriz SgaDocumento1 páginaMatriz Sgaleidy perezAún no hay calificaciones
- Fabricantes Reclaman A Tecnólogos y Gobiernos Estandarizar Los Cargadores de Buses Eléctricos - Portal MovilidadDocumento7 páginasFabricantes Reclaman A Tecnólogos y Gobiernos Estandarizar Los Cargadores de Buses Eléctricos - Portal Movilidadanderson850kldrnAún no hay calificaciones
- Practica 3. Preparación de Soluciones Buffer y Sus Aplicaciones Bioquímicas PDFDocumento11 páginasPractica 3. Preparación de Soluciones Buffer y Sus Aplicaciones Bioquímicas PDFMariana Escobar LaskarAún no hay calificaciones
- Materia Nociones - U Argentina - LL20231115 - para DistribuciónDocumento14 páginasMateria Nociones - U Argentina - LL20231115 - para DistribuciónlulibrochieroAún no hay calificaciones
- Cuadros ExcelDocumento20 páginasCuadros ExcelArlyn EduardoAún no hay calificaciones
- Comparative Study of Equations of State For The deDocumento14 páginasComparative Study of Equations of State For The deJean Carlos Jimenez HuillcaAún no hay calificaciones
- Design, Synthesis, and Insecticidal Activity of Novel DoramectinDocumento10 páginasDesign, Synthesis, and Insecticidal Activity of Novel DoramectinMario CanteroAún no hay calificaciones
- PosterDocumento1 páginaPosterdiegobermudezseAún no hay calificaciones
- Poster Articulo SeminarioDocumento1 páginaPoster Articulo SeminarioelizabethAún no hay calificaciones
- Diseño de Una Biorrefineria Sostenible para La Produccion de Acido Lactico A Partir de Melaza de Caña de AzucarDocumento18 páginasDiseño de Una Biorrefineria Sostenible para La Produccion de Acido Lactico A Partir de Melaza de Caña de AzucarWendyAún no hay calificaciones
- Identificación y Cuantificación Rápida de Microplásticos en El Medio Ambiente Mediante Imágenes Químicas Infrarrojas Hiperespectrales Basadas en Láser Quantum Cascade - En.esDocumento11 páginasIdentificación y Cuantificación Rápida de Microplásticos en El Medio Ambiente Mediante Imágenes Químicas Infrarrojas Hiperespectrales Basadas en Láser Quantum Cascade - En.esJOAN PABLO GARNICA ZAPATAAún no hay calificaciones
- Definiciones Operacionales y Criterios de Programación 2021 Salud BucalDocumento2 páginasDefiniciones Operacionales y Criterios de Programación 2021 Salud BucalESTOMAUNTAún no hay calificaciones
- Notas Generales / General Notes Identificación Del Servicio/Service Codes Abreviaturas Miscelaneas/Miscellaneous AbbreviationDocumento1 páginaNotas Generales / General Notes Identificación Del Servicio/Service Codes Abreviaturas Miscelaneas/Miscellaneous AbbreviationDaniel AcostaAún no hay calificaciones
- EF - Impactoambiental - Grupo 13Documento8 páginasEF - Impactoambiental - Grupo 13STEFFEN CHRISTOFER AIQUIPA BLASAún no hay calificaciones
- Acta Ceba 2019Documento8 páginasActa Ceba 2019Anonymous 2FAvpUpAún no hay calificaciones
- Boletín20 ConsumoenergéticoDocumento4 páginasBoletín20 ConsumoenergéticoBrandon AmoresAún no hay calificaciones
- Poster Digital Iicta 2016Documento1 páginaPoster Digital Iicta 2016Luis LchAún no hay calificaciones
- Biodisel IrDocumento7 páginasBiodisel IrYina Paola Estrada OtaloraAún no hay calificaciones
- TFG Ainhoa Gredilla PDFDocumento47 páginasTFG Ainhoa Gredilla PDFdaniel peishAún no hay calificaciones
- Evaluación Del Perfil de Velocidad para Estratos de Suelo BlandoDocumento1 páginaEvaluación Del Perfil de Velocidad para Estratos de Suelo BlandoPaul GálvezAún no hay calificaciones
- Matriz de Impacto 2023 ModificacionesDocumento3 páginasMatriz de Impacto 2023 ModificacionesDhariplayAún no hay calificaciones
- Tema 9. Ejemplo de Evaluación de Los Procesos Químicos Industriales - IPP 21 - 22Documento48 páginasTema 9. Ejemplo de Evaluación de Los Procesos Químicos Industriales - IPP 21 - 22sonsolesAún no hay calificaciones
- Origins, Current Status and Future Challenges of Green Chemistry - En.esDocumento9 páginasOrigins, Current Status and Future Challenges of Green Chemistry - En.esLorena MartinezAún no hay calificaciones
- Cinética Estocástica y Equilibrio de Nanocon Fi Reacciones NedDocumento8 páginasCinética Estocástica y Equilibrio de Nanocon Fi Reacciones NedJESSIKA PAOLA COELLO CASAAún no hay calificaciones
- 00 Formato de Caso Clinico PerdiatriuaDocumento7 páginas00 Formato de Caso Clinico PerdiatriuaRoberto Carlos Loco TonyAún no hay calificaciones
- Levantamiento de CarreteraDocumento39 páginasLevantamiento de CarreteraDante Alvarez CunyaAún no hay calificaciones
- Analisis Periodico de Agregados Arena, Piedra, AguaDocumento9 páginasAnalisis Periodico de Agregados Arena, Piedra, AguaJhonAún no hay calificaciones
- Seminario PHBDocumento50 páginasSeminario PHBMaria Emilia VazquezAún no hay calificaciones
- Lista de Cotejo para BiocombustiblesDocumento1 páginaLista de Cotejo para BiocombustiblesALKZ PerezAún no hay calificaciones
- Ejemplo 03Documento14 páginasEjemplo 03jrojassaaAún no hay calificaciones
- Estimación Teórica Del Efecto de La Temperatura en La Densidad, Viscosidad, Poder Calorífico, Capacidad Calorífica y Gravedad API de BiocombustiblesDocumento10 páginasEstimación Teórica Del Efecto de La Temperatura en La Densidad, Viscosidad, Poder Calorífico, Capacidad Calorífica y Gravedad API de BiocombustiblesDiego PullesAún no hay calificaciones
- 01-04 Marco de AnálisisDocumento14 páginas01-04 Marco de AnálisisYessica VillarragaAún no hay calificaciones
- Equipo de Proceso / Process Equipment: Simbología de Equipos Diagrama de Tubería e InstrumentaciónDocumento1 páginaEquipo de Proceso / Process Equipment: Simbología de Equipos Diagrama de Tubería e InstrumentaciónDaniel AcostaAún no hay calificaciones
- Normativa: MarbellaDocumento35 páginasNormativa: MarbellamirkokkkkkAún no hay calificaciones
- Acta Inter. 3ºDocumento2 páginasActa Inter. 3ºMiguel Cuellar GallardoAún no hay calificaciones
- 1.-Plano de UbicacionDocumento1 página1.-Plano de UbicacionАскон Вальдивия Карлос МарианоAún no hay calificaciones
- Español - Extracción de Compuestos Valiosos Cáscaras de CítricosDocumento18 páginasEspañol - Extracción de Compuestos Valiosos Cáscaras de CítricosJuan EstebanAún no hay calificaciones
- Proyecto 2 Planta de Poder de Ciclo CombinadoDocumento6 páginasProyecto 2 Planta de Poder de Ciclo Combinadocarlos garciaAún no hay calificaciones
- GIGAMAPDocumento2 páginasGIGAMAPcamiloAún no hay calificaciones
- 4.4.6 Evaluación de Desarrollos Tecnologicos de Punta para Eliminacion de Residuos Solidos Urbanos. 4. 4.6.1 OBJETIVOS Objetivo GeneralDocumento22 páginas4.4.6 Evaluación de Desarrollos Tecnologicos de Punta para Eliminacion de Residuos Solidos Urbanos. 4. 4.6.1 OBJETIVOS Objetivo GeneralSMS TRANS BERCAMAún no hay calificaciones
- Cambio de Media BayoxideDocumento4 páginasCambio de Media BayoxideHenry TapiaAún no hay calificaciones
- Matriz Del Pograma de Ahorro y Uso Eficiente de Agua 2019-2020Documento42 páginasMatriz Del Pograma de Ahorro y Uso Eficiente de Agua 2019-2020Vanessa SanchezAún no hay calificaciones
- Kbie 11 01 1704536 PDFDocumento9 páginasKbie 11 01 1704536 PDFmayumi marcaAún no hay calificaciones
- Modelamiento logístico para la producción sostenible de biocombustiblesDe EverandModelamiento logístico para la producción sostenible de biocombustiblesCalificación: 4 de 5 estrellas4/5 (1)
- 10.-Ejercicio 7.52Documento3 páginas10.-Ejercicio 7.52Josselyn Bustillos BuenañoAún no hay calificaciones
- Inyeccion ContinuaDocumento10 páginasInyeccion Continuajota_ovaAún no hay calificaciones
- Equilibrio de Fases PDFDocumento3 páginasEquilibrio de Fases PDFJosselyn Bustillos BuenañoAún no hay calificaciones
- TablasDocumento3 páginasTablasJosselyn Bustillos BuenañoAún no hay calificaciones
- Ejercicio 7.60Documento3 páginasEjercicio 7.60Josselyn Bustillos BuenañoAún no hay calificaciones
- Catalogo Juegos Infantiles y Biosaludables 2016-2017Documento33 páginasCatalogo Juegos Infantiles y Biosaludables 2016-2017Josselyn Bustillos BuenañoAún no hay calificaciones
- Difusion en SolidosDocumento31 páginasDifusion en SolidosCarlos CoronadoAún no hay calificaciones
- Expo ArticuloDocumento3 páginasExpo ArticuloJosselyn Bustillos BuenañoAún no hay calificaciones
- Difusión de Tinta en Agar AgarDocumento4 páginasDifusión de Tinta en Agar AgarJosselyn Bustillos BuenañoAún no hay calificaciones
- Consulta AletasDocumento2 páginasConsulta AletasJosselyn Bustillos BuenañoAún no hay calificaciones
- 48 PDFDocumento85 páginas48 PDFAlberto PorrasAún no hay calificaciones
- LAMMPSDocumento2 páginasLAMMPSJosselyn Bustillos BuenañoAún no hay calificaciones
- 48 PDFDocumento85 páginas48 PDFAlberto PorrasAún no hay calificaciones
- Recursossantiago PDFDocumento6 páginasRecursossantiago PDFPaola Denise RiquelmeAún no hay calificaciones
- Graficas para Analisis de Reacciones No CatalizadasDocumento1 páginaGraficas para Analisis de Reacciones No CatalizadasJosselyn Bustillos BuenañoAún no hay calificaciones
- NayeDocumento1 páginaNayeJosselyn Bustillos BuenañoAún no hay calificaciones
- Laboratorio de Quimica - Osmosis PDFDocumento8 páginasLaboratorio de Quimica - Osmosis PDFJosselyn Bustillos BuenañoAún no hay calificaciones
- Dialnet Esterificacion 4902598 PDFDocumento8 páginasDialnet Esterificacion 4902598 PDFBianca LeyvaAún no hay calificaciones
- BolIBM 18 PDFDocumento56 páginasBolIBM 18 PDFJosselyn Bustillos BuenañoAún no hay calificaciones
- Prieto2019 en Es PDFDocumento15 páginasPrieto2019 en Es PDFJosselyn Bustillos BuenañoAún no hay calificaciones
- LessonPlanDiffusion 122115sm - En.esDocumento9 páginasLessonPlanDiffusion 122115sm - En.esJosselyn Bustillos BuenañoAún no hay calificaciones
- Esterificacion de Los Acidos Grasos Libres Del AceiteDocumento5 páginasEsterificacion de Los Acidos Grasos Libres Del AceiteAna Paula Castañeda CachayAún no hay calificaciones
- Curvas de Reaccion en Funcion de La VelocidadDocumento2 páginasCurvas de Reaccion en Funcion de La VelocidadJosselyn Bustillos BuenañoAún no hay calificaciones
- BolIBM 18 PDFDocumento56 páginasBolIBM 18 PDFJosselyn Bustillos BuenañoAún no hay calificaciones
- Cromo Exavalente Por EspectrofotometriaDocumento5 páginasCromo Exavalente Por EspectrofotometriaPatty BqqAún no hay calificaciones
- 1325-Texto Del Artículo-1907-1-10-20170927Documento10 páginas1325-Texto Del Artículo-1907-1-10-20170927Josselyn Bustillos BuenañoAún no hay calificaciones
- BettyDocumento5 páginasBettyMaria Quequejana MamaniAún no hay calificaciones
- Recursossantiago PDFDocumento6 páginasRecursossantiago PDFPaola Denise RiquelmeAún no hay calificaciones
- Contenido de AsignaturaDocumento7 páginasContenido de AsignaturaJosselyn Bustillos BuenañoAún no hay calificaciones
- Faustino Flores Danna ItzelDocumento8 páginasFaustino Flores Danna ItzelDanna Itzel Faustino FloresAún no hay calificaciones
- Regla de Las FasesDocumento49 páginasRegla de Las FasesNestor RodasAún no hay calificaciones
- Modulo Unidad 1 2022-1Documento68 páginasModulo Unidad 1 2022-1Paula PlataAún no hay calificaciones
- TesisDocumento77 páginasTesisministerio juventud100% (1)
- Ley de Gay LussacDocumento9 páginasLey de Gay LussacRodrigo CatotaAún no hay calificaciones
- Diapositivas RedoxDocumento37 páginasDiapositivas RedoxLUIS CARLOS ROMERO ZAPATAAún no hay calificaciones
- Cromatografía de GasesDocumento5 páginasCromatografía de GasesRobert Nezih Cruz MejíaAún no hay calificaciones
- Trabajo de TermodinamicaDocumento21 páginasTrabajo de TermodinamicaDario Orlando Olaya BalarezoAún no hay calificaciones
- Conceptos Basicos U3Documento5 páginasConceptos Basicos U3Daniela FernandezAún no hay calificaciones
- Reporte Práctica 4Documento11 páginasReporte Práctica 4Miriam Hernández JaramilloAún no hay calificaciones
- Práctica 2Documento12 páginasPráctica 2Danilo SolanoAún no hay calificaciones
- Problemas de Q 2º BachDocumento9 páginasProblemas de Q 2º BachEdgar Condori SarmientoAún no hay calificaciones
- RCA Potrerillos PDFDocumento42 páginasRCA Potrerillos PDFLouis BujandaAún no hay calificaciones
- QUÍMICA Configuración ElectrónicaDocumento2 páginasQUÍMICA Configuración ElectrónicaJUAN EDUARDO NAVARRO LA ROSAAún no hay calificaciones
- Quimicagral Ibim 2012 121202113934 Phpapp01Documento30 páginasQuimicagral Ibim 2012 121202113934 Phpapp01juan pabloAún no hay calificaciones
- Meteorologia Informe 2Documento18 páginasMeteorologia Informe 2Nicolai Hinostroza ContrerasAún no hay calificaciones
- Mecanismos para Reacciones Polares y Radicales LibresDocumento7 páginasMecanismos para Reacciones Polares y Radicales LibresjavenacostaAún no hay calificaciones
- Informe Analisis de CationesDocumento12 páginasInforme Analisis de CationesYersonChavezCochachinAún no hay calificaciones
- Mangueras y Tuberias Pe80 Pe100Documento2 páginasMangueras y Tuberias Pe80 Pe100Julio Miguel Palomino BerrocalAún no hay calificaciones
- Energia Fisica de 6 ToDocumento1 páginaEnergia Fisica de 6 Tojorge ortizAún no hay calificaciones
- Microscopia de FluorescenciaDocumento3 páginasMicroscopia de FluorescenciaSilvia DGAún no hay calificaciones
- Informe 6Documento11 páginasInforme 6Danilo GuerraAún no hay calificaciones
- Operaciones Unitarias IDocumento5 páginasOperaciones Unitarias IAlejandro Mtz HdzAún no hay calificaciones
- Espectoscoía de Resonancia Paramagnética ElectrónicaDocumento3 páginasEspectoscoía de Resonancia Paramagnética ElectrónicaYean RivasAún no hay calificaciones
- Aplicaciones de Sistemas ColoidalesDocumento8 páginasAplicaciones de Sistemas ColoidalesJoaquínA.GallardoAún no hay calificaciones
- Practica-De-Tensión-Superficial ZavaDocumento10 páginasPractica-De-Tensión-Superficial ZavaCristian ZavaletaAún no hay calificaciones
- Reporte Práctica 9 - Lab de FQ IIDocumento7 páginasReporte Práctica 9 - Lab de FQ IIALEJANDRA LUCERO MEJ�A CRUZAún no hay calificaciones
- Alquinos MonografíaDocumento12 páginasAlquinos MonografíaJINX XNIJAún no hay calificaciones
- Problem A RioDocumento8 páginasProblem A RioMarleny Garcia LucasAún no hay calificaciones
- EnzimasDocumento5 páginasEnzimasnataliaAún no hay calificaciones