0% encontró este documento útil (0 votos)
80 vistas33 páginasFundamentos de Termodinámica y Energía
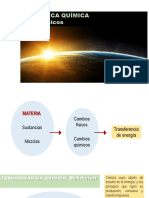
El documento trata sobre conceptos básicos de termodinámica. Explica que la termodinámica estudia las transformaciones energéticas entre un sistema y su entorno, como el trabajo y el calor. Define los conceptos clave de sistema, entorno, estado cerrado, abierto y aislado de un sistema. Describe el trabajo, el calor y sus unidades, y cómo afectan la energía interna de un sistema. Además, introduce la primera ley de la termodinámica sobre la conservación de la energía interna de un sistema aislado.
Cargado por
ArielDeCandiaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
80 vistas33 páginasFundamentos de Termodinámica y Energía
El documento trata sobre conceptos básicos de termodinámica. Explica que la termodinámica estudia las transformaciones energéticas entre un sistema y su entorno, como el trabajo y el calor. Define los conceptos clave de sistema, entorno, estado cerrado, abierto y aislado de un sistema. Describe el trabajo, el calor y sus unidades, y cómo afectan la energía interna de un sistema. Además, introduce la primera ley de la termodinámica sobre la conservación de la energía interna de un sistema aislado.
Cargado por
ArielDeCandiaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd