Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Introducción Amilasa
Cargado por
kine 2017Descripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Introducción Amilasa
Cargado por
kine 2017Copyright:
Formatos disponibles
Introducción.
“El descubrimiento de Eduard Buchner en 1897 de que los extractos de levadura pueden
fermentar el azúcar a alcohol demostró que las moléculas que intervienen en la fermentación
pueden continuar funcionando cuando se separan de la estructuras de las células vivas. Frederick
W. Kühne denomino estas moléculas enzimas”. (1)
Las enzimas son proteínas o biocatalizadores que regulan reacciones químicas en las células de dos
formas, disminuyendo la energía de activación y aumentan la velocidad de reacción, cada enzima
es altamente específica para la reacción que cataliza. Esta especificidad está determinada por el
sitio activo de la enzima (en donde se hallan los grupos químicos responsables de la catálisis). Las
enzimas comparten su función con una molécula llamada sustrato la cual después de reaccionar y
formar el complejo enzima-sustrato se convertirá en el producto de la reacción, también dispone
de co-factores (co-reactivos, co-sustratos) para cumplir su función catalítica. “Las enzimas son
proteínas cuya acción biológica consiste en la catálisis de las reacciones del metabolismo, las
cuales transcurrirán muy lentamente sin su intervención.”(2).
La cinética enzimática es el estudio por el cual se pueden analizar o determinar la actividad de la
enzima para la formación de productos a través de las reacciones de acoplamiento enzima-
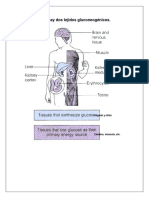
sustrato. El siguiente trabajo práctico se estudiará la cinética enzimática de la alfa amilasa fungal,
estas enzimas son las que catalizan la hidrólisis de enlaces glucosídicos α-1,4 de polisacáridos
como el almidón y el glicógeno, para producir maltosa y glucosa, oligosacáridos de diferentes
tamaños y cadenas más o menos ramificadas llamadas dextrinas límite. Es la principal amilasa que
se encuentra en humanos y otros mamíferos, también se encuentra presente en semillas que
contienen almidón como reserva alimenticia y también en hongos. La α-amilasa es más
prominente en el jugo pancreático y saliva en humanos, los cuales poseen cada uno su propia
isoenzima de α-amilasa humana. Son de gran importancia en la industria alimenticia, textil,
papelera y farmacológica, y aunque las fuentes productoras de α-amilasas incluyen plantas,
animales y microorganismos, son las enzimas microbianas las que encuentran mayor demanda en
aplicaciones industriales. Tradicionalmente la producción de α-amilasas se ha llevado a cabo
mediante procesos de fermentación líquida sumergida (FLS) debido al mayor control de factores
ambientales como temperatura y pH para condiciones donde se alcanza su máxima actividad y
para analizar su comportamiento sobre concentraciones crecientes de su sustrato el almidón, en
el siguiente practico se determina la actividad enzimática por generación de azucares reductores
(glucosa principalmente) que en altas temperaturas reducirán al reactivo acido 3,5 dinitrosalicilico
(DNS) a 3 amino 5 nitro-salicilato.
1) Lehninger. Principios de bioquímica. 4ª Edición. Omega; 2005
2) Montero C. Manual de técnicas de histoquimica basica. 1st ed. San luis: Editorial
Universitaria Potosina; 1997.
También podría gustarte
- Taller de Aminoácidos y CarbohidratosDocumento12 páginasTaller de Aminoácidos y Carbohidratosmaria camilaAún no hay calificaciones
- Carbohidratos y Proteinas-MonografiaDocumento59 páginasCarbohidratos y Proteinas-MonografiaJhardy LucianoAún no hay calificaciones
- Examen Parcial - Química de Los AlimentosDocumento3 páginasExamen Parcial - Química de Los AlimentosMarco Fabio Rodriguez ArayaAún no hay calificaciones
- Metabolismo Glucosa 1Documento56 páginasMetabolismo Glucosa 1Moonie QuiñonesAún no hay calificaciones
- Carbohidratos, Azucares, Almidon, Celulosa y GomasDocumento7 páginasCarbohidratos, Azucares, Almidon, Celulosa y GomasFabianaAún no hay calificaciones
- Lo Básico de Los Nutrimentos - Angel Esteban Torres ZapataDocumento137 páginasLo Básico de Los Nutrimentos - Angel Esteban Torres ZapataGael Dario Pat Junco100% (1)
- Metabolismo de CarbohidratosDocumento66 páginasMetabolismo de CarbohidratosFernanda LandetaAún no hay calificaciones
- Motilidad DigestivaDocumento16 páginasMotilidad DigestivatrumandemontesAún no hay calificaciones
- 01-Sistema Urinario PDFDocumento31 páginas01-Sistema Urinario PDFSharid tamayo tamayoAún no hay calificaciones
- Metabolismo Glucidico y Su Regulacion en El Hombre. Estudio Analitico y Su Interpretacion. Diabetes.Documento15 páginasMetabolismo Glucidico y Su Regulacion en El Hombre. Estudio Analitico y Su Interpretacion. Diabetes.Cristian AgostiniAún no hay calificaciones
- Metabolismo y Respiración Celular. NúcleoDocumento39 páginasMetabolismo y Respiración Celular. NúcleoAdriana Arianny Diaz CastañedaAún no hay calificaciones
- Gluconeogénesis y Control de La Glucosa SanguíneaDocumento16 páginasGluconeogénesis y Control de La Glucosa SanguíneaYan Yeberson Chamba ContrerasAún no hay calificaciones
- Hormesis PDFDocumento7 páginasHormesis PDFTomás JordánAún no hay calificaciones
- CarbohidratosDocumento8 páginasCarbohidratosHugo Glez PradoAún no hay calificaciones
- Taller de Biologia Membrana CelularDocumento7 páginasTaller de Biologia Membrana CelularAnita Lucia Melo DíazAún no hay calificaciones
- EPJ Sierra de Tamaulipas PDFDocumento90 páginasEPJ Sierra de Tamaulipas PDFArboré ForestalAún no hay calificaciones
- Alimentos FuncionalesDocumento169 páginasAlimentos FuncionalesYovany Cano100% (1)
- Respiración BacterianaDocumento33 páginasRespiración BacterianaCUENCA CHIRINOS RODRIGOAún no hay calificaciones
- Productos Finales MetabolismoDocumento12 páginasProductos Finales MetabolismoAlexandra DakotaAún no hay calificaciones
- Clase 8 Respiración CelularDocumento13 páginasClase 8 Respiración CelularDaniel Vega VegaAún no hay calificaciones
- Características Del Ser HumanoDocumento2 páginasCaracterísticas Del Ser HumanoHarlen AstridAún no hay calificaciones
- Balance Del Agua e Ingestión de Agua, Excreción Del Agua, Requerimientos de AguaDocumento4 páginasBalance Del Agua e Ingestión de Agua, Excreción Del Agua, Requerimientos de AguaAngelli Jervis CseAún no hay calificaciones
- Formacion y Transporte de AmoniacoDocumento4 páginasFormacion y Transporte de AmoniacoMariela MaldonadoAún no hay calificaciones
- 2 Digestión de LípidosDocumento16 páginas2 Digestión de LípidosEros RamazottiAún no hay calificaciones
- Ciclo de KrebsDocumento9 páginasCiclo de Krebsapi-235957287Aún no hay calificaciones
- Funcion de Bioelementos SecundariosDocumento4 páginasFuncion de Bioelementos SecundariosJessica Alvarado Hernandez33% (3)
- Aditivos AlimentariosDocumento18 páginasAditivos AlimentariosMargoth SarayasiAún no hay calificaciones
- Funcion de Los CarbohidratosDocumento2 páginasFuncion de Los CarbohidratosEddie PospoyAún no hay calificaciones
- Que Son Los AminoacidosDocumento5 páginasQue Son Los AminoacidosRocio Rodriguez ChavezAún no hay calificaciones
- ConclusionDocumento1 páginaConclusionCarlos Magdiel Abreu MendozaAún no hay calificaciones
- Síntesis de Triglicéridos y Fosfolipidos ANGIEDocumento18 páginasSíntesis de Triglicéridos y Fosfolipidos ANGIEElvis Churacutipa MarcaAún no hay calificaciones
- Funciones e Importancia Biológica de Los CarbohidratosDocumento4 páginasFunciones e Importancia Biológica de Los Carbohidratoselvinaguilar59100% (1)
- Proteinas Virtual 2022Documento44 páginasProteinas Virtual 2022Nicol LopezAún no hay calificaciones
- Reflexiones de Rutas MetabolicasDocumento6 páginasReflexiones de Rutas MetabolicasingpablosolisAún no hay calificaciones
- Metabolismo Del Colesterol PDFDocumento9 páginasMetabolismo Del Colesterol PDFRuben Nuñez Quesada100% (2)
- Óxido Nítrico SintasaDocumento4 páginasÓxido Nítrico SintasaKarina ParkAún no hay calificaciones
- Bioquimica LípidosDocumento53 páginasBioquimica LípidosRita PonceAún no hay calificaciones
- CARBOHIDRATOSDocumento24 páginasCARBOHIDRATOSNancy Martinez CastilloAún no hay calificaciones
- Instrucciones de Aplicación para QueratinaDocumento2 páginasInstrucciones de Aplicación para QueratinaJudith TorresAún no hay calificaciones
- Vías Metabolicas Del Metabolismo Del NitrogenoDocumento46 páginasVías Metabolicas Del Metabolismo Del NitrogenoEymy Janet Noriega CedilloAún no hay calificaciones
- Rutas MetabolicasDocumento33 páginasRutas MetabolicasJamie Jayjay Martinez100% (2)
- 8 Metabolismo de Los LipidosDocumento7 páginas8 Metabolismo de Los LipidosMervin Arauz HoyosAún no hay calificaciones
- UNIDAD 2-3 Macro y Micronutrientes (2) - 2019Documento21 páginasUNIDAD 2-3 Macro y Micronutrientes (2) - 2019pablo perezAún no hay calificaciones
- GlucolisisDocumento10 páginasGlucolisisNicolas Sebastian GomezAún no hay calificaciones
- Ley de Hardy WeinbergDocumento21 páginasLey de Hardy WeinbergromelAún no hay calificaciones
- Digestion y AbsorcionDocumento27 páginasDigestion y AbsorcionYuleysiCarolinaSalasAndara100% (1)
- Regulación Hormonal Glucolisis y GlucogénesisDocumento6 páginasRegulación Hormonal Glucolisis y GlucogénesisereAún no hay calificaciones
- Bioquimica y Su PerspectivaDocumento5 páginasBioquimica y Su PerspectivaAngel ZaragozaAún no hay calificaciones
- Hidratos de CarbonoDocumento74 páginasHidratos de CarbonoJosué Varillas SuárezAún no hay calificaciones
- Qué Son Los MacronutrientesDocumento5 páginasQué Son Los MacronutrientesDanny Cuyuch AcabalAún no hay calificaciones
- Fermentacion AlcoholicaDocumento8 páginasFermentacion AlcoholicaElian Josue MontalvoAún no hay calificaciones
- Degradacion ProteinasDocumento7 páginasDegradacion ProteinasEsme Monroy100% (1)
- Biotecnologia Aplicada A La Alimentacion y Salud HumanaDocumento12 páginasBiotecnologia Aplicada A La Alimentacion y Salud HumanaJESÚS ERNESTO GARCÍA SÁENZAún no hay calificaciones
- Poniendo en Valor Nuestras Costumbres, Salinas de NagualapaDocumento57 páginasPoniendo en Valor Nuestras Costumbres, Salinas de NagualapaDavid Alonso PérezAún no hay calificaciones
- Módulo 3. BIOMOLÉCULAS PROTEÍNAS, ENZIMAS Y ÁCIDOS NUCLEICOSDocumento23 páginasMódulo 3. BIOMOLÉCULAS PROTEÍNAS, ENZIMAS Y ÁCIDOS NUCLEICOSCarlos MegoAún no hay calificaciones
- Presentacion Enzimas 1 Generalidades, Nomenclatura y ClasificacionDocumento58 páginasPresentacion Enzimas 1 Generalidades, Nomenclatura y ClasificacionMariana Maya GuerreroAún no hay calificaciones
- Descomposicion de Alimentos Causada Por Enzimas Microbianas Tecnologia Organica IIDocumento2 páginasDescomposicion de Alimentos Causada Por Enzimas Microbianas Tecnologia Organica IIKatherine Elizabeth Castro Infante50% (4)
- Ensayo ArgumentativoDocumento8 páginasEnsayo ArgumentativoJoshua RodriguezAún no hay calificaciones
- Interacción Fármaco-NutrienteDocumento5 páginasInteracción Fármaco-NutrienteHéctor Martinez Aparicio100% (1)
- Metabolismo de Las ProteínasDocumento40 páginasMetabolismo de Las ProteínasFrank Sánchez Estela100% (1)
- Destrezas de salud e higiene de la vida diaria Gr. 6-12: Spanish VersionDe EverandDestrezas de salud e higiene de la vida diaria Gr. 6-12: Spanish VersionAún no hay calificaciones
- Clase 03. Biomoléculas Orgánicas IiDocumento19 páginasClase 03. Biomoléculas Orgánicas IijazminAún no hay calificaciones
- Taller Sintesis de Proteinas IIIDocumento3 páginasTaller Sintesis de Proteinas IIILina Luz Perez Medrano33% (3)
- 1 Sangre GeneralidadesDocumento58 páginas1 Sangre GeneralidadesMilton Johnson Herrera MuchaAún no hay calificaciones
- Factor V Leiden y Mutación de La Protrombina G20210A en Pacientes Con Trombosis Venosa y Arterial AMRDocumento27 páginasFactor V Leiden y Mutación de La Protrombina G20210A en Pacientes Con Trombosis Venosa y Arterial AMRAlejandra MongeAún no hay calificaciones
- Triangulacion Lipidos 7.2 y 7.3Documento45 páginasTriangulacion Lipidos 7.2 y 7.3Vanna VerarutAún no hay calificaciones
- Pared Celular Gram NegativasDocumento5 páginasPared Celular Gram NegativasWilliam SalasAún no hay calificaciones
- Resumen NutrientesDocumento11 páginasResumen NutrientesMaria Jose FloresAún no hay calificaciones
- InmunidadDocumento10 páginasInmunidadMirielis LoreAún no hay calificaciones
- Procesos de Transcripcion y TraduccionDocumento13 páginasProcesos de Transcripcion y TraduccionJahir Leonardo T GaleasAún no hay calificaciones
- Composición Química de CacaoDocumento10 páginasComposición Química de CacaoLeydi Acosta ortizAún no hay calificaciones
- EtiquetaDocumento185 páginasEtiquetaMegan Daniela RamírezAún no hay calificaciones
- Unidad 4. EnzimasDocumento5 páginasUnidad 4. EnzimasIanireAún no hay calificaciones
- Ex PosicionDocumento15 páginasEx PosicionAmabileAún no hay calificaciones
- Cap 7Documento38 páginasCap 7Anonymous TN4XtXvAún no hay calificaciones
- Rangos Funcionales Enero 2021Documento2 páginasRangos Funcionales Enero 2021camiAún no hay calificaciones
- Actividad4 LUFDocumento5 páginasActividad4 LUFNina CárdenasAún no hay calificaciones
- Actividad de Aprendizaje Lípidos CompletaDocumento10 páginasActividad de Aprendizaje Lípidos CompletaMaria SariaAún no hay calificaciones
- COCONADocumento2 páginasCOCONAAnonymous vKHtq6Mr1tAún no hay calificaciones
- 7 Señalizacion Celuar Parte IDocumento43 páginas7 Señalizacion Celuar Parte IAngelica Leal duarteAún no hay calificaciones
- CARBOHIDRATOSDocumento17 páginasCARBOHIDRATOSJoseph Edy Condori HuancaAún no hay calificaciones
- Alimentos U2Documento12 páginasAlimentos U2Rosario JessAún no hay calificaciones
- Trab Eq #3 Und 1 Quimica Aa3-T1 2020 1Documento15 páginasTrab Eq #3 Und 1 Quimica Aa3-T1 2020 1Aldair BermeoAún no hay calificaciones
- VitaminasDocumento22 páginasVitaminasSebastian VillacresAún no hay calificaciones
- 6 - Beta OxidacionDocumento10 páginas6 - Beta OxidacionValeria GrandeAún no hay calificaciones
- Capítulo 24 y 25 HarperDocumento2 páginasCapítulo 24 y 25 HarperSol MenaAún no hay calificaciones
- Comunicacion Intercelular y Transporte en MembranasDocumento42 páginasComunicacion Intercelular y Transporte en MembranasCelestinaq21Aún no hay calificaciones
- Infografia 4 Sanchez Marceliano SofiaDocumento1 páginaInfografia 4 Sanchez Marceliano SofiaSofia Alexandra Sánchez MarcelianoAún no hay calificaciones
- Repaso 2° Bloque de Inmunología PARTE 2Documento16 páginasRepaso 2° Bloque de Inmunología PARTE 2Max HmzAún no hay calificaciones
- Digestion y Absorcion de Lipidos y Acidos GrasosDocumento8 páginasDigestion y Absorcion de Lipidos y Acidos GrasosCristhian David Caveduque VivancoAún no hay calificaciones