0% encontró este documento útil (0 votos)
45 vistas12 páginasPatologias Neurologicas
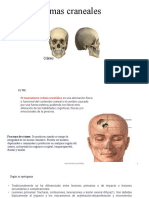
El traumatismo craneoencefálico (TCE) es una de las principales causas de morbilidad y mortalidad en personas de 1 a 44 años en EE. UU., con causas comunes como caídas y accidentes de tráfico. Se clasifica en función de las fuerzas que lo provocan y puede resultar en diversas lesiones, como hematomas y contusiones. La enfermedad de Parkinson, un trastorno neurodegenerativo, se caracteriza por temblores y alteraciones del movimiento, siendo multifactorial en su etiología y con un curso progresivo que afecta la calidad de vida del paciente.
Cargado por
Luz RuizDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
45 vistas12 páginasPatologias Neurologicas
El traumatismo craneoencefálico (TCE) es una de las principales causas de morbilidad y mortalidad en personas de 1 a 44 años en EE. UU., con causas comunes como caídas y accidentes de tráfico. Se clasifica en función de las fuerzas que lo provocan y puede resultar en diversas lesiones, como hematomas y contusiones. La enfermedad de Parkinson, un trastorno neurodegenerativo, se caracteriza por temblores y alteraciones del movimiento, siendo multifactorial en su etiología y con un curso progresivo que afecta la calidad de vida del paciente.
Cargado por
Luz RuizDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd