0% encontró este documento útil (0 votos)
1K vistas12 páginasSíntesis de Anilina a partir de Nitrobenceno
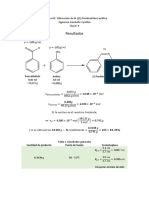
El documento describe un procedimiento para sintetizar anilina a partir de nitrobenceno. La síntesis involucra tres pasos: 1) Se mezcla nitrobenceno con limaduras de estaño y ácido clorhídrico concentrado. 2) La mezcla se calienta a ebullición para reducir el nitrobenceno a anilina. 3) La anilina resultante se neutraliza con una solución de hidróxido de sodio para liberarla en forma de hidrocloruro de anilina. El objetivo es obtener anilina de al
Cargado por
Ricky YupanquiDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
1K vistas12 páginasSíntesis de Anilina a partir de Nitrobenceno
El documento describe un procedimiento para sintetizar anilina a partir de nitrobenceno. La síntesis involucra tres pasos: 1) Se mezcla nitrobenceno con limaduras de estaño y ácido clorhídrico concentrado. 2) La mezcla se calienta a ebullición para reducir el nitrobenceno a anilina. 3) La anilina resultante se neutraliza con una solución de hidróxido de sodio para liberarla en forma de hidrocloruro de anilina. El objetivo es obtener anilina de al
Cargado por
Ricky YupanquiDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd