Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Gases Reales
Cargado por
Diianiitha BaEzaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Gases Reales
Cargado por
Diianiitha BaEzaCopyright:
Formatos disponibles
Gases reales
La ecuacin de estado de un gas ideal est basada en la hiptesis de que las interacciones
entre las molculas de un gas a densidad muy baja son despreciables. Adems, en estas
condiciones, las molculas que constituyen el gas se consideran partculas puntuales. En el
modelo de gas ideal, las sustancias siempre se encuentran en estado gaseoso.
Sin embargo, el comportamiento de una sustancia real es mucho ms complejo. sta puede
experimentar lo que se denomina un cambio de fase o cambio de estado.
Cuando a una sustancia se le suministra o extrae una cierta cantidad de calor, a nivel
microscpico las interacciones entre sus molculas cambian y, dependiendo de su estado
termodinmico, puede encontrarse en estado slido, lquido o vapor, o en una combinacin
de estos estados.
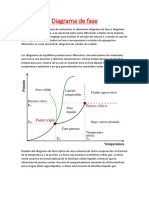
Las isotermas de un gas real tienen una forma ms compleja que las isotermas de un gas
ideal (hiprbolas), ya que deben dar cuenta de los cambios de fase que puede experimentar.
En la figura inferior se han representado las denominadas isotermas de Andrews. Dichas
isotermas fueron medidas experimentalmente, y representan la presin en funcin del
volumen a distintas temperaturas.
La isoterma representada en rojo se denomina isoterma crtica (y su temperatura,
latemperatura crtica). Esta isoterma separa dos comportamientos: cuando una sustancia
se encuentra a una temperatura superior a su temperatura crtica, siempre est en estado
gaseoso, por muy alta que sea la presin. Por el contrario, cuando est a una temperatura
inferior a la crtica, puede estar en estado slido, lquido o vapor (en la grfica se han
representado solamente las zonas de lquido y vapor).
Los puntos representados con las letras A y B corresponden respectivamente a los estados
denominados vapor saturado y lquido saturado. Ambos estn sobre una curva
(representada en lnea punteada) denominada curva de saturacin. Por debajo de ella,
todos los estados son una mezcla de lquido y vapor.
En la figura tambin se observa que la zona de las isotermas que se encuentra por debajo de
la curva de saturacin es una recta horizontal. Por tanto, cuando el cambio de fase lquido
- vapor se produce a presin constante, se produce tambin a temperatura constante.
Para que una sustancia cambie de fase, es necesario suministrale o extraerle una cierta
cantidad de calor. Si el cambio de fase se produce a presin constante, este calor no se
traduce en un incremento de temperatura, y se denomina calor latente.
Ecuacin de estado de van der Waals
No existe una nica ecuacin de estado que describa el comportamiento de todas las
sustancias reales para todas las condiciones de presin y temperatura. A lo largo del tiempo
se han propuesto distintas ecuaciones de estado, siendo la ms sencilla la de van der Waals,
por la que recibi el premio Nobel de Fsica en 1910.
La ecuacin de van der Waals es una modificacin de la ecuacin de estado de un gas ideal
en la que se tiene en cuenta tanto el volumen de las molculas como las interacciones entre
ellas. Tiene la forma:
Las constantes a y b dependen del gas cuyo comportamiento se est describiendo. En la
siguiente animacin se han representado las isotermas de la ecuacin de van der Waals para
el oxgeno (en rojo) junto con las isotermas de un gas ideal (en azul).
Como puede observarse, para valores altos de la temperatura y para valores bajos de la
presin ambas ecuaciones dan el mismo comportamiento. Por otra parte, la ecuacin de van
der Waals describe la zona de las isotermas que corresponden al estado lquido (zona de la
izquierda de pendiente elevada), mientras que no funcionan para la zona de las isotermas
(recta horizontal de las isotermas de Andrews) que se encuentra por debajo de la curva de
saturacin. La isoterma crtica del oxgeno corresponde a una temperatura de
aproximadamente -118C.
Pgina realizada por Teresa Martn Blas y Ana Serrano Fernndez - Universidad Politcnica
de Madrid (UPM) - Espaa.
También podría gustarte
- Gases RealesDocumento3 páginasGases RealesSmith LazoAún no hay calificaciones
- Tarea 4Documento5 páginasTarea 4Angel GabrielAún no hay calificaciones
- Isotermas de AndrewsDocumento4 páginasIsotermas de AndrewsRaiLeon100% (2)
- Ecuación de Estado Del Gas IdealDocumento3 páginasEcuación de Estado Del Gas IdealLisandro FloresAún no hay calificaciones
- Term0dinamica GasesDocumento6 páginasTerm0dinamica GasesYojhan YandelAún no hay calificaciones
- Johannes Van Der Waals.Documento3 páginasJohannes Van Der Waals.ORTIZ MORALES MARIANAAún no hay calificaciones
- Gases IdealesDocumento6 páginasGases IdealesAndrea CastellanosAún no hay calificaciones
- Gases RealesDocumento14 páginasGases RealesJim Tico GutiérrezAún no hay calificaciones
- Gases RealesDocumento26 páginasGases RealesYiruma Monte de JupiterAún no hay calificaciones
- Termodinamica, GasesDocumento89 páginasTermodinamica, GaseskeilerAún no hay calificaciones
- Informe de GasesDocumento14 páginasInforme de GasesCarlos Borja ChurampiAún no hay calificaciones
- Gases Reales y Cambios de FaseDocumento2 páginasGases Reales y Cambios de FaseJuan Pablo Gonzalez0% (1)
- Gases RealesDocumento14 páginasGases RealesOsvaldo Herrera Palomares100% (1)
- Cómo Son Las Leyes de Vander WalsDocumento3 páginasCómo Son Las Leyes de Vander WalsUziel CayllahuaAún no hay calificaciones
- Proceso de Sustancias RealesDocumento22 páginasProceso de Sustancias RealesJair OñateAún no hay calificaciones
- Fenomeno Crit - Grupo 5Documento24 páginasFenomeno Crit - Grupo 5Marcelo TorresAún no hay calificaciones
- Entalpía Entropía FasesDocumento3 páginasEntalpía Entropía FasesMauricio Avila100% (1)
- Influencia de La Temperatura en La Presion de Vapor 1Documento13 páginasInfluencia de La Temperatura en La Presion de Vapor 1Sandy Vanessa CardenasAún no hay calificaciones
- Antecedentes TermoDocumento14 páginasAntecedentes TermoErik GutiérrezAún no hay calificaciones
- Termodinamica2 Final PDFDocumento6 páginasTermodinamica2 Final PDFHl ObAún no hay calificaciones
- Teoria Cinetica de Los GasesDocumento39 páginasTeoria Cinetica de Los GasesEstanislao Aqquepucho SolisAún no hay calificaciones
- GasesDocumento31 páginasGasesGivion WeaverAún no hay calificaciones
- FisicaI 3º ParteDocumento199 páginasFisicaI 3º ParteAnabel AcostaAún no hay calificaciones
- Tabla de ConversionesDocumento7 páginasTabla de ConversionesGonzalo Perez0% (1)
- Bases Biofisicas de La RespiracionDocumento19 páginasBases Biofisicas de La RespiracionMarcelo MorenoAún no hay calificaciones
- Unidad III 3.1 3.2 Mecanica de Fluidos y TermodinamicaDocumento5 páginasUnidad III 3.1 3.2 Mecanica de Fluidos y Termodinamicaoliverio cruzAún no hay calificaciones
- Laboratorio 1 - Leyes de Los GasesDocumento10 páginasLaboratorio 1 - Leyes de Los GasesRafael Gustavo Alfaro AlemanAún no hay calificaciones
- Ecuacion de Estado - TermodinamicaDocumento3 páginasEcuacion de Estado - TermodinamicaReynaldo José Blanco SparksAún no hay calificaciones
- DiagramasDocumento7 páginasDiagramasESTHER ISABEL CEBALLOS PORTILLOAún no hay calificaciones
- Gases Reales y Ecuación de Van Der WaalsDocumento9 páginasGases Reales y Ecuación de Van Der WaalsCamila PachecoAún no hay calificaciones
- Presion de Vapor-IntroduccionDocumento6 páginasPresion de Vapor-IntroduccionRubi Nieto UgarteAún no hay calificaciones
- Dossier para Las OlimpiadasDocumento12 páginasDossier para Las OlimpiadasCyn ParedesAún no hay calificaciones
- Ley de Gases IdealesDocumento18 páginasLey de Gases IdealesJear ArenasAún no hay calificaciones
- Modelo de Gas Ideal y Sus Limitaciones y Transferncia de CalorDocumento5 páginasModelo de Gas Ideal y Sus Limitaciones y Transferncia de CalorKellyCamachoAún no hay calificaciones
- Ecuacion de EstadoDocumento6 páginasEcuacion de Estadogabriela amangandiAún no hay calificaciones
- Ley General Del Estado GaseosoDocumento9 páginasLey General Del Estado GaseosoAleejandraa LhAún no hay calificaciones
- Ecuacion de Estado Cap 1Documento4 páginasEcuacion de Estado Cap 1Jose ChAún no hay calificaciones
- INTRODUCCIONDocumento29 páginasINTRODUCCIONALEJANDRAROCABADOAún no hay calificaciones
- Diagrama de FaseDocumento5 páginasDiagrama de FaseKevin Perez YalleAún no hay calificaciones
- Gas IdealDocumento13 páginasGas IdealFernandoAún no hay calificaciones
- Sustancias Puras VariablesDocumento6 páginasSustancias Puras VariablesNacho CortezAún no hay calificaciones
- Termodinamica II Tarea 1Documento6 páginasTermodinamica II Tarea 1Alvaro Wara SuárezAún no hay calificaciones
- Cuestionario Previo TERMODINAMICADocumento8 páginasCuestionario Previo TERMODINAMICARodrigo Osorio50% (2)
- Deberes Quimica IndustrialDocumento6 páginasDeberes Quimica IndustrialJoe HualpaAún no hay calificaciones
- Guía de Fundamentos de Laboratorio de Gases Version 1.2Documento12 páginasGuía de Fundamentos de Laboratorio de Gases Version 1.2July GodoyAún no hay calificaciones
- Gases Reales PresentacionDocumento48 páginasGases Reales PresentacionEdwinAún no hay calificaciones
- Lab.Nº 2 - 90 GDocumento13 páginasLab.Nº 2 - 90 GOscar F. C ReAún no hay calificaciones
- Gas Ideal-Gas RealDocumento7 páginasGas Ideal-Gas RealJessi Cam-Eli100% (1)
- Expo Grupo 1Documento33 páginasExpo Grupo 1Christian AcostaAún no hay calificaciones
- Mecanica de Fluidos Ecuacion de EstadoDocumento3 páginasMecanica de Fluidos Ecuacion de EstadoAngelica Carolina Vasquez YepezAún no hay calificaciones
- LEY de GAY-charles-bolle y EcuacionDocumento8 páginasLEY de GAY-charles-bolle y EcuacionAlicia G. MndzAún no hay calificaciones
- Proceso IsotérmicoDocumento7 páginasProceso IsotérmicoMaritto Garciia0% (1)
- Comportamiento de Los GasesDocumento25 páginasComportamiento de Los GasesElsa Marzana SanizoAún no hay calificaciones
- Comportamiento de Los GasesDocumento25 páginasComportamiento de Los GasesERIKA LOZADA RUSSELAún no hay calificaciones
- A - Estado GaseosoDocumento15 páginasA - Estado GaseosoRamy LudueñaAún no hay calificaciones
- U1 l2 Gongora GonzalezDocumento7 páginasU1 l2 Gongora GonzalezAlfredo Gonzalez MateoAún no hay calificaciones
- Informe #1Documento12 páginasInforme #1rodrigocalcina47Aún no hay calificaciones
- Propiedades Moleculares de La MateriaDocumento5 páginasPropiedades Moleculares de La MateriaSulmira BarjaAún no hay calificaciones
- Ley de Los Gases RealesDocumento2 páginasLey de Los Gases RealesDaleska C. GalarzaAún no hay calificaciones
- Equipos Eléctricos en Áreas Peligrosas - WikipediaDocumento14 páginasEquipos Eléctricos en Áreas Peligrosas - Wikipedialequesada6Aún no hay calificaciones
- Copia de TEORIAS DEL ORIGEN DE LA TIERRADocumento8 páginasCopia de TEORIAS DEL ORIGEN DE LA TIERRAByron ArguetaAún no hay calificaciones
- PAPIDocumento33 páginasPAPIGenaro Hugo Lopez Zagala50% (2)
- Incendio 1Documento19 páginasIncendio 1Martin Chimenti - ARO SAAún no hay calificaciones
- Trabajo Grupal 01Documento30 páginasTrabajo Grupal 01Gonzalo Willians ParedesAún no hay calificaciones
- Diferencias Entre Un Motor Diésel y Uno A GasolinaDocumento5 páginasDiferencias Entre Un Motor Diésel y Uno A GasolinaBironMendoza100% (1)
- Instrucciones de Manteniento.2014 PDFDocumento13 páginasInstrucciones de Manteniento.2014 PDFRuben SepulvedaAún no hay calificaciones
- Los Estándares de Calidad AmbientalDocumento4 páginasLos Estándares de Calidad AmbientalKeeninBryanLeonZevallosAún no hay calificaciones
- Mantenimiento Luminaria Administrativo HBDocumento1 páginaMantenimiento Luminaria Administrativo HBoscar manosalvaAún no hay calificaciones
- Karmont-Quienes Somos 3Documento3 páginasKarmont-Quienes Somos 3eduardohe_ingAún no hay calificaciones
- Consulta Historia de La Ceramica en EcuadorDocumento3 páginasConsulta Historia de La Ceramica en EcuadorSelena Jimenez RamirezAún no hay calificaciones
- RadionucleidosDocumento20 páginasRadionucleidosRICARDO ANDRE BETETA PACHECOAún no hay calificaciones
- Unidad 1. Conduccion en Estado EstableDocumento44 páginasUnidad 1. Conduccion en Estado EstableJesús Juárez100% (1)
- Aqua Jaker - Sistemas Contra IncendioDocumento10 páginasAqua Jaker - Sistemas Contra IncendioEdgar JacquesAún no hay calificaciones
- Curso ASME B31 y B31.4Documento19 páginasCurso ASME B31 y B31.4Frank DiazAún no hay calificaciones
- Inspección General PDT 09.Documento6 páginasInspección General PDT 09.Jennifher MaldonadoAún no hay calificaciones
- MN204 - Examen Final Julio22Documento5 páginasMN204 - Examen Final Julio22JroamsfmAún no hay calificaciones
- VM ArellanoDocumento9 páginasVM ArellanoFranciscaAún no hay calificaciones
- Universidad Militar Nueva Granada: Investigación de OperacionesDocumento11 páginasUniversidad Militar Nueva Granada: Investigación de OperacionesKtherin Johana SierraAún no hay calificaciones
- Altos Explosivos - Agentes de VoladuraDocumento49 páginasAltos Explosivos - Agentes de VoladuramarcoAún no hay calificaciones
- Inspeccion Preoperacional Maquinas-EquiposDocumento48 páginasInspeccion Preoperacional Maquinas-EquiposMADELEINE RODRIGUEZ PESTAÑAAún no hay calificaciones
- Dokumen - Tips Check List Grupo ElectrogenoDocumento2 páginasDokumen - Tips Check List Grupo ElectrogenoNelson Rodriguez ZuñigaAún no hay calificaciones
- Iperc Cambio de InplementosDocumento2 páginasIperc Cambio de InplementosJulio caja valdezAún no hay calificaciones
- Monografia Energia SolarDocumento26 páginasMonografia Energia SolarElio Lazo ChayanAún no hay calificaciones
- Operaciones Que Se Ejecutan en Un Pozo Petrolero.Documento3 páginasOperaciones Que Se Ejecutan en Un Pozo Petrolero.Anuar Olivares RubalcavaAún no hay calificaciones
- ChernobylDocumento3 páginasChernobylOscar RiveraAún no hay calificaciones
- Práctica Dirigida de Fluidos Reales 2Documento3 páginasPráctica Dirigida de Fluidos Reales 2Carlos Rivera Condori0% (1)
- Investigacion Motor 1 p62Documento21 páginasInvestigacion Motor 1 p62Jorge Alberto Moran SilvaAún no hay calificaciones
- FT-R1700G-2019Documento28 páginasFT-R1700G-2019Cesar Miguel Gallardo TorrelAún no hay calificaciones
- Partes de Un Hot TapDocumento17 páginasPartes de Un Hot TapVictor LopezAún no hay calificaciones