Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cuestionario Dra. Nigd
Cargado por
Christiansito AndresitoDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cuestionario Dra. Nigd
Cargado por
Christiansito AndresitoCopyright:
Formatos disponibles
CUESTIONARIO DE QUIMICA ANALITICA
PARA EL EXAMEN PRINCIPAL
DOCENTE: M. Sc. Dra Nelly Guananga D
SEMESTRE: Segundo de la Escuela de Ingeniera en Industrias Pecuarias.
1. Coloque segn corresponda el compuesto y su peso equivalente.
Na
2
CO
3 ---------------
H
2
SO
4
--------- Fe
2
O
3 --------------
Al(OH)
3--------------
a) 26 b) 53.3 c) 53 d) 49
2. Seale cuales soluciones acuosas de los siguientes compuestos son cidas A, neutras N
o bsicas B:
H2S-------------- PH3-------- BaI----------- BaSnBr------- Ca(OH)2--------
3. Si Q>K
c
la reaccin se desplaza hacia : productos, reactivos X
Porque?..... aumentando las concentraciones de los reactivos y disminuyendo la de
los productos hasta que Q se iguale con Kc.
4. Indique 2 requisitos para ser considerado patrn primario:
Concentracin conocida pureza, alta velocidad de reaccin con el analito, alto peso molecular.
5. Como se calcula la mediana de una serie par de datos:
6. Indique el cambio de color de los indicadores que utilizamos para valorar
el cido clorhdrico con carbonato de sodio:
Con fenoftaleina, de rosa a incoloro
Con anaranjado de metilo, de amarillo a rojo.
7. Se utilizan 8,2 ml de HCl 1,3 N para titular 10mL de NaOH. Cul es la
concentracin del NaOH?
a. 1,1 N . b. 0,80 N. c. 0,1 M d. 0,169 N..
8. Determine el estado de oxidacin del azufre en cada una de las siguientes
entidades qumicas:
(a) H2S _-2____
(b) S8 __0___
(c) SCl2 __+2___
(d) Na2SO3 __+4___
(e)
__+6___
9. Cul es la molaridad de una disolucin que se prepar disolviendo 23.4 g
de sulfato de sodio, Na
2
SO
4
, en suficiente agua para formar 125 mL de
disolucin?
a. 1,78 M b. 1,32 M c. 0,32 M d. 1,02 M
moles de Na
2
SO
4
= (23.4 g Na
2
SO
4
)
L disln = (125 mL ) (
= 0,125 L
Por lo tanto Molaridad es:
Molaridad =
10. Cuntos mililitros de H
2
SO
4
3.0 M se requiere para preparar 450 mL de
H2SO4 0.10 M?
Calculamos:
de H
2
SO
4
= (0.450 L
sln
)
= 0,045 moles H
2
SO
4
Calculamos el volumen de disolucin concentrada que contiene 0.045 mol H
2
SO
4
:
L sln conc = (0.045 mol H
2
SO
4
)
= 0,015 L sln
11. Si 150 g del anticongelante etilenglicol (C
2
H
6
O
2
) se disuelven en 1300 g
H
2
O, K
eb
del agua 0,52
0
C/m Cul es la temperatura de ebullicin de la
solucin?
T
eb
= T
eb sln
T
eb ste
= K
eb
m T
eb sln
= K
eb
m + T
eb ste
T
eb sln
= 0,52
0
C/m*
m + 100
0
C
T
eb sln
= 100,96
0
C.
12. Una solucin de 80 mg de un azcar se disuelve en agua hasta 550 ml. Se
encontr que a 35
C es 154
mmHg
. Cul es el peso molecular (PM) del
carbohidrato?
1,54
mmHg
R= 0,082 at L/ K mol
M =
= MRT
8,3 x10
-5
moles/l =
2,026 x19
-3
= M (0,082 atm L/Kmol) (298 K)
= 4,565 moles azcar 2,026 x19
-3
= M 24,436
PM=
= 0,017x10
5
g/mol 8,3 x 10
-5
moles/L= M
PM del carbohidrato = 17000 g/mol
13. Calcular el punto de congelacin de una solucin de 100g de
anticongelante etilenglicol C
2
H
6
O
2
en 900 g de agua (K
f
= 1.86
0
C/molal)
T
fsln
= T
f ste
T
f sln
= K
f
m PM
etileng
= 62 g/mol
Tf sln = Kf m + T
fste
= 1,86 C/molal
= - 3,33
14. La presin de vapor del agua pura a 25
C es 23,8
mm Hg
Que cantidad de
sustancia de peso molecular 198 g/mol hay que agregarle a 300 ml de agua
para que la presin de vapor del solvente disminuya 0,7 mm Hg?
Pv = Pv
ste -
Pv
sln
= Pv
ste
X
sto
X
sto.
=
23,8
mmHg
0,031
3,22x 10
-3
=
(1)
En ciertos libros se encuentra que anulan las moles de soluto en el denominador, es decir: (moles sto
+ 0,013 moles agua) 0,013; esto es en consideracin de que la cantidad de soluto es demasiado
pequea respecto a las moles del solvente (solo en estos casos); queda entonces: 3,22 x10
-3
x 0,013
= 4,186 x10
-5
= moles sto. Obviamente el proceso de despejar en la formula (1) da una cantidad
exacta.
23,8
mmHg
- 0,7
mmHg
= 23,1
mm
Hg
0.3 L
3,22x 10
-3
(moles sto+ 0,013 moles agua) = moles sto
3,22x10
-3
moles sto + 4,18 x10
-5
moles agua= moles sto
3,22x10
-3
moles sto- moles sto= - 4,18x10
-5
moles agua
-3,22x10
-3
moles sto+ (1) moles sto= 4,18x10
-5
moles agua
0,99678 moles de sto =4,18 x 10
-5
moles de agua
Moles de sto=4,19 x10
-5
4,19x10
-5
mol sto
=8,3 x 10
-3
g sto
15. La presin de vapor del agua a 20C es P
vH2O
= 17,5
mmHg
. Al disolver
isotrmicamente una cierta masa de glucosa en agua a esa temperatura, la
presin de vapor de la solucin desciende a 15,4 torr. Calcular la fraccin
molar de la glucosa en esa solucin.
Pv = Pv
ste -
Pv
sln
= Pv
ste
X
sto.
15,4 torr
sln
17,5 mmHg
agua
16. Que concentracin molal de sacarosa en agua se necesita para elevar su
punto de ebullicin en 1.3C (Keb = 0.52
C/molal y temperatura de
ebullicin del agua 100
C).
Teb = T
eb sln
Teb
ste
= K
eb
m
= m m= 2,5
17. La cantidad de energa calorfica de una sustancia es la ., en
una reaccin exotrmica esta energa es menor en los productos respecto
a los reactantes.
a. Entalpia de formacin.
b. Energa de activacin.
c. Afinidad electrnica.
d. Entalpia.
18. Cuantas miligramos de soluto estn contenidos en 0.1020 L de solucin de
cloruro de mercurio (II) 0.0643 M
Masa soluto= X
mg
M=
V= 0,1020 L [HgCl
2
] = 0,0643 M
0,0643
19. Si una lata de cerveza tiene 5.2% (v/v) de etanol. Calcule el volumen de
etanol en la lata de 10 mL.
%ETOH = 5,2 v/v
20. Un tanque de 25,00 L contiene una disolucin de concentracin 0.20 ppm
de As. Si la gravedad especifica (Gs) de la solucin es 1.0, calcule la masa
de As g presente en la disolucin. (Gs = Ws/v / Ww/v a 4C)
Gs=
0,20 ppm
25 Lx 1,0 = 0,005 g de As
21. Cuantos mg de sacarosa estan contenidos en 24,0 mL de una solucion de
sacarosa 0,150 M. (PM
sacarosa
= 342 g/mol)
M=
M=
M= 0,15
0,0036 moles sacarosa
22. Una muestra de 1.20 gramos de un compuesto covalente desconocido se
disuelve en 50.0 gramos de benceno. La disolucin se congela a 4.92
0
C.
Calcule la masa molar del compuesto. El punto de congelacin del benceno
puro es de 5.48C y Kf =5.12
o
C/m.
Tf = 5.48
o
C - 4.92
o
C = 0.56
o
C m =
Masa molar=
23. Se prepara una muestra de 50.00 mL de una solucin acuosa que contiene
1.08 g de una protena del plasma sanguneo, seroalbmina humana. La
disolucin tiene una presin osmtica de 5.85 mmHg a 298 K. Cul es el
peso de la masa molar (peso molecular g/mol) de la albmina?
=5,85
mmHg
PM =
24. Una reaccin endotrmica tiene: H < 0 H > 0
25. Calcular la concentracin molar de Hidrxido de sodio al 50.0% (%p/p) que tiene
un peso especfico de 1.52?
[NaOH] = M?
= 1,52 g/mL
PM= 40 g/mol
1,52
26. Que molaridad tiene una solucin que contiene 67,4 g de cloruro de sodio (NaCl)
por litro?
M=
27. Qu masa de nitrato de plata se debe pesar para preparar 500 mL de solucin
0.0650 M. (PM AgNO
3
=170 g/mol)
5,5 g AgNO
3
28. Una solucin 1,7 Molar de nitrito de sodio (NaNO
2
), cuntos gramos de soluto
por litro contiene?
1075,2 g/L NaNO
2
29. El suero sanguneo humano contiene en promedio 18 mg de K
+
por cada 100 mL.
Calcular la concentracin molar del potasio en el suero.
0,004615
AgNO
3
= 4,615x10
-3
AgNO
3
30. Qu cantidad de carbonato de sodio NaHCO
3 (peso m=84,0 g/mol)
es necesaria
para preparar tres cuartos de litro de solucin 2,5 M?
masa= 0,750 L
31. Cul es la Normalidad de una solucin que contiene 35 g de NaCN (PM= 49
g/mol en 350 mL de solucin?
La frmula de la N utiliza los equivalentes de la substancia, en este caso NaCN, es una sal con un
solo atomo del metal, y cuya valencia es 1, de manera que en 1mol de NaCN hay 1 eq de NaCN.
N=
= 2,04 mol/L
32. Para la reaccin en equilibrio:
Cul de los siguientes cambios no alterar su equilibrio?
A. adicin de N
2
B. adicin de H
2
C. aumento de presin
. V. % = PM. M.100 (alternativa)
D. adicin de un catalizador
33. Indique los diferentes tipos de reaccin en los que se basan las
valoraciones volumtricas:
34. Elija la respuesta correcta: 13,5 ppm de NaOH en medio litro de agua
contiene:
a. 0,675 g NaOH
b. 6,75x 10
-3
g NaOH
c. 67,5 x 10
-2
g NaOH
d. 67,5 g NaOH
35. Como se conoce el hierro al exponerse a la intemperie forma el xido de
hierro: 2 Fe + 3 O
2
= 2 Fe
2
O
3
, es decir sufre corrosin. Cul es el cambio
qumico que se da y cuantos electrones intervienen.
a. El hierro se reduce y gana 3 electrones.
b. El hierro se oxida y pierde 3 electrones.
c. El hierro se reduce y pierde 3 electrones
d. El hierro se oxida y gana 3 electrones
36. Se conoce que el punto de ebullicin es una propiedad intensiva, al
graficar el punto de ebullicin (Tb) de diferentes masas de un mismo
lquido, la grfica que se obtiene es:
A.. B.. C.. D..
37. Tenemos mezclas homogneas en 4 vasos con diferentes cantidades de soluto X
y agua:
VASO Volumen de agua (mL) Masa de X adicionada
1 20 5
2 60 15
3 80 20
4 20 10
De acuerdo a los datos, es vlido afirmar que la concentracin es
A. mayor en el vaso 3
B. igual en los cuatro vasos
C. menor en el vaso 1
D. mayor en el vaso 2
38. En la tabla se indica la presin de vapor (Pv) de tres soluciones de
tetracloruro de carbono (CCl4) y benceno (C6H6) de diferentes fracciones
molares a 50C.
SOLUCION X
CCl4
Pv(mm Hg)
1 0,1 274
2 0,5 290
3 0,9 306
Las grficas representan la variacin de la fraccin molar del (X
CCL4
) y la Pv de
las soluciones, cul de ellas corresponde a los datos:
A.. B.. C.. D..
39. Indique que proceso se da en la reaccin: Cl Cl
-
:
a. El cloro se oxida, pierde electrones y aumenta el nmero de oxidacin.
b. El cloro se reduce, gana electrones y disminuye el nmero de oxidacin.
c. El cloro se reduce, pierde electrones y aumenta el nmero de oxidacin.
d. El cloro se oxida, gana electrones y aumenta el nmero de oxidacin.
40. Seleccione la secuencia general que debe realizarse para la igualacin de
ecuaciones:
a. Igualacin de cargas, identificacin de las semireacciones, igualacin de masas,
escribir la ecuacin completa, balance del nmero de electrones perdidos y
ganados, y verificar la igualacin.
b. Igualacin de masas, escribir la ecuacin completa, balance del nmero de
electrones perdidos y ganados; igualacin de cargas, y verificar la igualacin.
c. Igualacin de masas, igualacin de cargas, identificacin de las semireacciones,
balance del nmero de electrones perdidos y ganados, escribir la ecuacin
completa y verificar la igualacin.
d. Igualacin de cargas, igualacin de masas, balance del nmero de electrones
perdidos y ganados, identificacin de las semireacciones, escribir la ecuacin
completa y verificar la igualacin.
41. En la reaccin: F
2(g)
+ 2NO
(g)
2FNO
(g)
, la presin total de la mezcla es 340
mmHg, y la presin parcial del flor P
1
= 143 mm Hg. Cul es la fraccin molar del
F
2
?
340
mmHg
P
1
= X
1
Pt
143
mmHg
42. Si 20 gramos de NO se disocian en N
2
y O
2,
al alcanzar el equilibrio solo quedan
5,4 g de NO, cual es el porcentaje de disociacin?
a. =0,73%
b. = 73%
c. = 43%
d. =7,3%
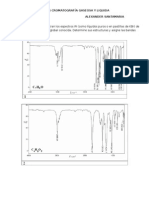
43. En el cromatograma se muestran los recorridos de dos substancias, si h
1
=4cm y
h
2
=8 cm, y el recorrido del solvente D= 10 cm, R
f1
y R
f2
son:
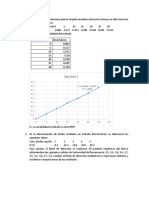
44. En 10 mL de gaseosa se determin que hay 10,34 g de azcar (sucrosa), segn la
curva de calibracin cul es el % de azcar en esta bebida,
45. En la siguiente tabla complete los ejemplos de disoluciones.
Estado de la
disolucion
Estado del
disolvente
Estado del
soluto
Ejemplo
Gas Gas Gas Aire
Liquido Liquido Gas
Liquido Liquido Liquido
Liquido Liquido Solido
Solido Solido Gas
Solido Solido Liquido
Solido Solido Solido
46. Se determin que una muestra de 2.5 g de aguas freticas contena 5.4 g de Zn
2+
.
Calcule la concentracin de Zn2+ en ppm.
ppm=
x 10
6
=
47. Calcule la molalidad de una disolucin que se prepar disolviendo 36.5 g de
naftaleno (C
12
H
8
) en 425 g de tolueno (C7H8).
1,000
1,010
1,020
1,030
1,040
1,050
1,060
1,070
1,080
0 5 10 15 20 25
D
E
N
S
I
D
A
D
% SUCROSA
CURVA DE CALIBRACION
densidad vs % sucrosa
a. 0,4 y o,8
b. 2,5 y 1,25
c. 0,25 y 0,5
d. 0,04 y 0,08
a. 5%
b. 10,5%
c. 16%
d. 18%
m=
48. Una disolucin de HCl contiene 36% en masa de HCl. Calcule la fraccin molar de
HCl en la disolucin.
moles HCl = 36 g HCl
moles H
2
O = 64 g H
2
O
X
HCl
=
49. Una disolucin de HCl contiene 40% en masa de HCl. Calcule la molalidad del HCl
en la disolucin.
molalidad =
50. La densidad de una disolucin que contiene 3,5. g de tolueno (C
7
H
8
) y 135 g de
benceno es de 0,895 g/mL, calcule la molaridad de la disolucin.
moles C
7
H
8
= 3,5 g C
7
H
8
mL dsln= 138,5
mL dsln
Molaridad (M) =
También podría gustarte
- U2 EjerciciosDocumento28 páginasU2 Ejerciciosbyron100% (1)
- Equilibrio químico y solubilidadDocumento5 páginasEquilibrio químico y solubilidadMariana TreviñoAún no hay calificaciones
- PRÁCTICA Nro 1 Corrección Del Punto de Ebullición en Función de La TemperaturaDocumento5 páginasPRÁCTICA Nro 1 Corrección Del Punto de Ebullición en Función de La TemperaturaBelén TapiaAún no hay calificaciones
- Marcha Azucares Reductores en RonesDocumento4 páginasMarcha Azucares Reductores en RonesRenato CameyAún no hay calificaciones
- Taller 4 Aplicaciones de Las Valoraciones Acido-S BaseDocumento1 páginaTaller 4 Aplicaciones de Las Valoraciones Acido-S BaseCarolina posadaAún no hay calificaciones
- Seminario 4 GRUPO 6Documento18 páginasSeminario 4 GRUPO 6Pamela MamaniAún no hay calificaciones
- Taller Estequiometría en GeneralDocumento3 páginasTaller Estequiometría en GeneralnataliaAún no hay calificaciones
- Teoria Analitica IDocumento28 páginasTeoria Analitica IAle JoAún no hay calificaciones
- Equilibrio químico Gibbs potenciales reaccionesDocumento15 páginasEquilibrio químico Gibbs potenciales reaccionesPascual Jose HerreraAún no hay calificaciones
- Ejercicio de IR y CromatografiaDocumento13 páginasEjercicio de IR y CromatografiaKelly CamargoAún no hay calificaciones
- Complejo MetalicoDocumento4 páginasComplejo MetalicoRobin JoshuaAún no hay calificaciones
- Equilibrio de Solubilidad, Ejercicios Resueltos2016Documento19 páginasEquilibrio de Solubilidad, Ejercicios Resueltos2016holaAún no hay calificaciones
- Volumetrias de Precipitacion (UNE)Documento22 páginasVolumetrias de Precipitacion (UNE)GERMÁN COLQUE YAIBONAAún no hay calificaciones
- Informe de Laboratorio N°3Documento17 páginasInforme de Laboratorio N°3Teo ZapataAún no hay calificaciones
- Taller #2 Quimica AnaliticaDocumento4 páginasTaller #2 Quimica AnaliticaSergio TeranAún no hay calificaciones
- Análisis de plata y berilio mediante absorción atómica y fluorometríaDocumento2 páginasAnálisis de plata y berilio mediante absorción atómica y fluorometríaNatasha VargasAún no hay calificaciones
- Taller Mod4 ChangDocumento6 páginasTaller Mod4 ChangCarlos Eduardo Perez RestrepoAún no hay calificaciones
- Informe 3. Ácido PolipróticoDocumento5 páginasInforme 3. Ácido PolipróticoAnthony correaAún no hay calificaciones
- 2010 - PROBLEMAS CLASE 2010 Página WebDocumento7 páginas2010 - PROBLEMAS CLASE 2010 Página Webph0714Aún no hay calificaciones
- Practicas Bioquímica 2014B FPV PDFDocumento60 páginasPracticas Bioquímica 2014B FPV PDFMiguel Garcia AguirreAún no hay calificaciones
- Informe #8Documento4 páginasInforme #8Mateo Martínez ValenciaAún no hay calificaciones
- Preparación de AlumbreDocumento8 páginasPreparación de AlumbreKATHERINE LISET ORTIZ PATERNINA ESTUDIANTE ACTIVO100% (1)
- Taller 2323Documento5 páginasTaller 2323Stiven ManriqueAún no hay calificaciones
- 2014guia de Problemas Nº1 PDFDocumento3 páginas2014guia de Problemas Nº1 PDFDiego TorresAún no hay calificaciones
- Sol Ex P Cq312 19-2Documento3 páginasSol Ex P Cq312 19-2Elvis RenzoAún no hay calificaciones
- Practica 1 Orgánica 2Documento4 páginasPractica 1 Orgánica 2Daniela PullaAún no hay calificaciones
- Informe 3 KpsDocumento5 páginasInforme 3 KpsJunior RiosAún no hay calificaciones
- Sesión 21. EstequiometríaDocumento2 páginasSesión 21. EstequiometríaLorena García AvelinoAún no hay calificaciones
- 2019 Problemas Curvas de Titulacion ACIDO BASEDocumento10 páginas2019 Problemas Curvas de Titulacion ACIDO BASEGray D L LeoAún no hay calificaciones
- GUÍA No. 06 OBTENCIÓN DEL DIOXALATO CUPRATO DE POTASIODocumento6 páginasGUÍA No. 06 OBTENCIÓN DEL DIOXALATO CUPRATO DE POTASIOYamilex FrancisAún no hay calificaciones
- Tema 3 Problemas 20 21 Acido BaseDocumento4 páginasTema 3 Problemas 20 21 Acido BaseCHOLOSIMEONEAún no hay calificaciones
- pH de una disolución tampón de ácido acético y acetato de sodio cumple con tener menos de y resumir de manera concisa y optimizada para el contenido del párrafo/ejemplo destacadoDocumento18 páginaspH de una disolución tampón de ácido acético y acetato de sodio cumple con tener menos de y resumir de manera concisa y optimizada para el contenido del párrafo/ejemplo destacadoGabriel García MoralesAún no hay calificaciones
- Analisis Elemental Cualitativo Omarambi 2011Documento15 páginasAnalisis Elemental Cualitativo Omarambi 2011Oscar G. Marambio100% (1)
- Motor StirlingDocumento5 páginasMotor StirlingAndres RamirezAún no hay calificaciones
- Procedimiento titulación EDTA complejos calcio magnesioDocumento3 páginasProcedimiento titulación EDTA complejos calcio magnesiostefanymor10Aún no hay calificaciones
- Preguntas Reporte de Laboratorio #5 - 6Documento1 páginaPreguntas Reporte de Laboratorio #5 - 6Matius RSAún no hay calificaciones
- Desea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasDocumento1 páginaDesea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasBrando Kevin Palomino MorenoAún no hay calificaciones
- TALLER GRAVIMETRIA RVFDocumento4 páginasTALLER GRAVIMETRIA RVFDiana SotoAún no hay calificaciones
- Laboratorio No 10 Analitica II Completo YodometriaDocumento13 páginasLaboratorio No 10 Analitica II Completo YodometriaLaura PerdomoAún no hay calificaciones
- Obtenciòn de Carbonato de Plomo y CobreDocumento6 páginasObtenciòn de Carbonato de Plomo y CobreDaniel Gomez Galindo100% (1)
- Formación y estabilidad de compuestos de coordinaciónDocumento13 páginasFormación y estabilidad de compuestos de coordinaciónandrea yuilanaAún no hay calificaciones
- Guia RedoxDocumento3 páginasGuia RedoxMatii VegaAún no hay calificaciones
- 50,0 ML de Naoh 0,100 M A 25 ML de Una Mezcla de Ácido Perclórico 0,0400 M Y Ácido Salicílico 0,050) 0 M (Pka1 2,97 Pka2 13,74) - PH - LogDocumento6 páginas50,0 ML de Naoh 0,100 M A 25 ML de Una Mezcla de Ácido Perclórico 0,0400 M Y Ácido Salicílico 0,050) 0 M (Pka1 2,97 Pka2 13,74) - PH - LogLavanda SalviaAún no hay calificaciones
- Resolucion Guia 4Documento15 páginasResolucion Guia 4CamilaAmapolaGonzalezAún no hay calificaciones
- Titulaciones ArgentométricasDocumento4 páginasTitulaciones Argentométricasnata fallaAún no hay calificaciones
- Informe II OrganicaII Sintesis Del Acido M NitrobenzoicoDocumento9 páginasInforme II OrganicaII Sintesis Del Acido M NitrobenzoicoMishell BenavidesAún no hay calificaciones
- Sintesis ClorociclohexanoDocumento4 páginasSintesis ClorociclohexanoAntonio Cortez D Lara XD100% (1)
- Volumétrico por precipitaciónDocumento6 páginasVolumétrico por precipitaciónDaniel Tancara QuispeAún no hay calificaciones
- Exposición de Q.analíticaDocumento7 páginasExposición de Q.analíticaANGIE PAOLA PERTUZ GUERREROAún no hay calificaciones
- Práctica No 2 Celdas GalvanicasDocumento7 páginasPráctica No 2 Celdas GalvanicasJean Carlos Gomez OrdoñezAún no hay calificaciones
- 11 EjerciciosDocumento1 página11 EjerciciosALEJANDRA JIMENEZ0% (1)
- Dureza Del AguaDocumento10 páginasDureza Del AguaBerenice PérezAún no hay calificaciones
- QAI Tarea No 1Documento1 páginaQAI Tarea No 1Anthony HurtadoAún no hay calificaciones
- Deshidratación CiclohexanolDocumento5 páginasDeshidratación CiclohexanolDiana Laura Bautista MontejoAún no hay calificaciones
- Aplicación Analítica de La IodimetríaDocumento4 páginasAplicación Analítica de La IodimetríaEvelyn Paguay Carrillo100% (1)
- Guía: GravimetríaDocumento4 páginasGuía: GravimetríaRulos QueteimportaAún no hay calificaciones
- Determinacion Del Naoh y Na2co3Documento14 páginasDeterminacion Del Naoh y Na2co3Carla Flores DiasAún no hay calificaciones
- Propiedades-Coligativas-Ejercicios TerminadoDocumento19 páginasPropiedades-Coligativas-Ejercicios TerminadonayelisAún no hay calificaciones
- Ejercicios Unidad 6Documento5 páginasEjercicios Unidad 6Javier HerreraAún no hay calificaciones
- TALLER No 4. DISOLUCIONESDocumento5 páginasTALLER No 4. DISOLUCIONESJHON JANIER VERA AROCA0% (1)
- LABORALDocumento1 páginaLABORALChristiansito AndresitoAún no hay calificaciones
- Reporte de Actividades SICOA - 13 - Reunión de Revisón ModificadoDocumento4 páginasReporte de Actividades SICOA - 13 - Reunión de Revisón ModificadoChristiansito AndresitoAún no hay calificaciones
- Subir Tema y Subtemas de InvestigaciónDocumento2 páginasSubir Tema y Subtemas de InvestigaciónChristiansito AndresitoAún no hay calificaciones
- Reporte de Actividad 08-08-2021 ModificadoDocumento3 páginasReporte de Actividad 08-08-2021 ModificadoChristiansito AndresitoAún no hay calificaciones
- Rodriguez Christian Andres - CompressedDocumento4 páginasRodriguez Christian Andres - CompressedChristiansito AndresitoAún no hay calificaciones
- Secaira Mery Cuaderno de Campo.Documento27 páginasSecaira Mery Cuaderno de Campo.Christiansito AndresitoAún no hay calificaciones
- Los Bienes Arqueológicos y Cultura Material de GuanoDocumento11 páginasLos Bienes Arqueológicos y Cultura Material de GuanoChristiansito AndresitoAún no hay calificaciones
- Posiciones Sobre La ÉticaDocumento3 páginasPosiciones Sobre La ÉticaChristiansito AndresitoAún no hay calificaciones
- Posiciones Sobre La ÉticaDocumento3 páginasPosiciones Sobre La ÉticaChristiansito AndresitoAún no hay calificaciones
- Los Bienes Arqueológicos y Cultura Material de GuanoDocumento11 páginasLos Bienes Arqueológicos y Cultura Material de GuanoChristiansito AndresitoAún no hay calificaciones
- FORMATO Solicitud Certificado VinculaciónDocumento2 páginasFORMATO Solicitud Certificado VinculaciónChristiansito AndresitoAún no hay calificaciones
- Octavo SemestreDocumento1 páginaOctavo SemestreChristiansito AndresitoAún no hay calificaciones
- Los Tres Mulatos de EsmeraldasDocumento21 páginasLos Tres Mulatos de EsmeraldasChristiansito AndresitoAún no hay calificaciones
- Secaira Mery Cuaderno de Campo.Documento27 páginasSecaira Mery Cuaderno de Campo.Christiansito AndresitoAún no hay calificaciones
- Vicente Guerrero - Kelvin Favian - Tarea 2 - Legislación EscolarDocumento3 páginasVicente Guerrero - Kelvin Favian - Tarea 2 - Legislación EscolarChristiansito AndresitoAún no hay calificaciones
- Saludos Coordiales Ganadores Radio Super Dia Viernes 5 de NoviembreDocumento1 páginaSaludos Coordiales Ganadores Radio Super Dia Viernes 5 de NoviembreChristiansito AndresitoAún no hay calificaciones
- Rodriguez CT 2Documento2 páginasRodriguez CT 2Christiansito AndresitoAún no hay calificaciones
- El MemristorDocumento21 páginasEl MemristorChristiansito AndresitoAún no hay calificaciones
- RodriguezYepez - ChristianAndres - Tarea 1Documento4 páginasRodriguezYepez - ChristianAndres - Tarea 1Christiansito AndresitoAún no hay calificaciones
- Proposiciones Rodriguez ChristianDocumento3 páginasProposiciones Rodriguez ChristianChristiansito AndresitoAún no hay calificaciones
- EJERCICIO 1 Rodriguez Christian Transformacion A Logica SimbolicaDocumento1 páginaEJERCICIO 1 Rodriguez Christian Transformacion A Logica SimbolicaChristiansito AndresitoAún no hay calificaciones
- Primer DeberDocumento2 páginasPrimer DeberChristiansito AndresitoAún no hay calificaciones
- Christian Rodriguez - La Iglesia y El EstadoDocumento3 páginasChristian Rodriguez - La Iglesia y El EstadoChristiansito AndresitoAún no hay calificaciones
- Historia Lógica Matemática - Rodriguez - ChristianDocumento2 páginasHistoria Lógica Matemática - Rodriguez - ChristianChristiansito AndresitoAún no hay calificaciones
- Calendario Copa Socialitos 2021Documento1 páginaCalendario Copa Socialitos 2021Christiansito AndresitoAún no hay calificaciones
- Bitacora 20 y 21julioDocumento3 páginasBitacora 20 y 21julioChristiansito AndresitoAún no hay calificaciones
- EJERCICIO 1 Transformacion A Logica SimbolicaDocumento1 páginaEJERCICIO 1 Transformacion A Logica SimbolicaChristiansito AndresitoAún no hay calificaciones
- Rúbrica Revisión de Investigación Propuesta Rodriguez ChristianDocumento2 páginasRúbrica Revisión de Investigación Propuesta Rodriguez ChristianChristiansito AndresitoAún no hay calificaciones
- 27 Y28 JulioDocumento4 páginas27 Y28 JulioChristiansito AndresitoAún no hay calificaciones
- Clase 3 de Agosto y 4 de AgostoDocumento4 páginasClase 3 de Agosto y 4 de AgostoChristiansito AndresitoAún no hay calificaciones