Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Termo PDF
Cargado por
mario alexisTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Termo PDF
Cargado por
mario alexisCopyright:
Formatos disponibles
NOTAS DEL CURSO
TERMODINMICA PARA INGENIERA
Oscar A. Jaramillo Salgado
UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
Centro de Investigacin en Energa
Departamento de Sistemas Energticos
Coordinacin de Concentracin Solar
Privada Xochicalco S/N. Temixco, Morelos Mxico. 62850.
Mayo 3, 2008
Contenido
I LA PRIMERA LEY DE LA TERMODINMICA 5
1 Introduccin a la termodinmica 5
1.1 Qu se entiende por termodinmica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5
1.2 Deniciones e ideas fundamentales de la termodinmica . . . . . . . . . . . . . . . . . . . . . . . . . . 6
1.2.1 El modelo del Medio Continuo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6
1.2.2 El concepto de Sistema . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6
1.2.3 El concepto de Estado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7
1.2.4 El concepto del Equilibrio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
1.2.5 El concepto de Proceso . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
1.2.6 Procesos de Cuasi-Equilibrio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
1.2.7 Ecuaciones de Estado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
1.3 Cambio de estado de un sistema debido a Calor y Trabajo . . . . . . . . . . . . . . . . . . . . . . . . . 11
1.3.1 Calor . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11
1.3.2 Ley Cero de la termodinmica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12
1.3.3 Trabajo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12
1.3.4 Trabajo y Calor -Cul es cul? . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
1.3.5 Los puntos complicados del captulo 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
2 La primera ley de la termodinmica: Conservacin de la Energa 16
2.1 Primera Ley de la Termodinmica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16
2.2 Corolario de la Primera Ley . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19
2.3 Ejemplos de aplicacin de la Primera Ley, una propiedad llamada Entalpa . . . . . . . . . . . . . . . 19
2.3.1 Estrangulamiento de un gas, proceso adiabtico permanente (gas uyendo a travs de una vlvula
u otra restriccin) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19
2.3.2 Expansin cuasi-esttica de un gas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20
2.3.3 Llenado de un tanque en estado transitorio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
2.3.4 La primera ley en trminos de entalpa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
2.4 El calor especco: la relacin entre el cambio de temperatura y el calor . . . . . . . . . . . . . . . . . 22
2.4.1 El calor especco de un gas ideal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23
2.4.2 Procesos adiabtico reversibles para un gas ideal . . . . . . . . . . . . . . . . . . . . . . . . . . 25
2.5 Volumen de Control . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
2.5.1 Conservacin de la masa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
2.5.2 Conservacin de la energa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
1
2.5.3 Temperatura de estancamiento y entalpa de estancamiento . . . . . . . . . . . . . . . . . . . . 28
2.5.4 Ejemplo de una turbina de gas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
2.6 Los puntos complicados del captulo 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
2.7 Temperatura crtica y presin crtica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
2.8 Diagramas de fase . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3 La primera ley aplicada a los ciclos en ingeniera termodinmica 34
3.1 Algunas propiedades de los ciclos en ingeniera; trabajo y eciencia . . . . . . . . . . . . . . . . . . . . 35
3.2 Representacin generalizada de ciclos termodinmicos . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3.3 El ciclo de Carnot . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3.4 Refrigeradores y bombas de calor . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3.5 El motor de combustin interna (ciclo de Otto) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3.5.1 Eciencia de un ciclo de Otto ideal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3.5.2 Trabajo de una mquina, ndice o razn de trabajo por unidad de ujo de entalpa . . . . . . . 42
3.6 Ciclo Diesel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3.7 Ciclo de Brayton: El ciclo ideal para las mquinas de turbina de gas . . . . . . . . . . . . . . . . . . . 44
3.7.1 Trabajo y eciencia del ciclo Brayton . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.7.2 Tecnologa y termodinmica de la turbina de gas . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.8 Los puntos complicados del captulo 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
II LA SEGUNDA LEY DE LA TERMODINMICA 49
4 Antecedentes de la segunda ley de la termodinmica 49
4.1 Reversibilidad e irreversibilidad en procesos naturales . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
4.2 Diferencia entre la expansin libre de un gas y la expansin isotrmica reversible . . . . . . . . . . . . 51
4.3 Caractersticas de procesos reversibles . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53
4.4 Los puntos complicados del captulo 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
5 La segunda ley de la termodinmica 56
5.1 Concepto y enunciados de La Segunda Ley de la Termodinmica (porqu necesitamos la segunda ley?) 56
5.2 Axiomas de las leyes de la termodinmica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
5.2.1 Introduccin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
5.2.2 Ley de Cero . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
5.2.3 Primera ley . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
5.2.4 Segunda ley . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
5.2.5 Procesos reversibles . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
5.3 Combinado la Primera Ley y la Segunda Ley de la termodinmica . . . . . . . . . . . . . . . . . . . . 60
5.4 Relaciones de Maxwell . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
5.5 Cambios de la entropa en un gas ideal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
5.6 La ecuacin de Clausius-Clapeyron . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
5.7 Clculo del cambio de la entropa en algunos procesos bsicos . . . . . . . . . . . . . . . . . . . . . . . 64
5.8 Los puntos complicados del captulo 5 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
6 Usos de la segunda ley 69
6.1 Limitaciones en el trabajo que puede proveer una mquina trmica . . . . . . . . . . . . . . . . . . . . 69
6.2 La escala termodinmica de la temperatura . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
6.3 Representacin de procesos termodinmicos en coordenadas T s . . . . . . . . . . . . . . . . . . . . 72
6.4 El ciclo Brayton en coordenadas T s . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
6.5 La irreversibilidad, el cambio de la entropa y la prdida de trabajo . . . . . . . . . . . . . . . . . . . . 74
6.6 Entropa y energa no disponible (disponibilidad) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
6.7 Algunos comentarios sobre entropa y procesos reversibles e irreversibles . . . . . . . . . . . . . . . . . 78
6.7.1 Entropa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
6.7.2 Procesos reversibles e irreversibles . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 79
6.7.3 Ejemplos de procesos reversibles e irreversibles . . . . . . . . . . . . . . . . . . . . . . . . . . . 79
6.8 La Segunda Ley para sistemas abiertos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80
6.9 Efecto del desvo del comportamiento ideal, (comportamiento real del ciclo) . . . . . . . . . . . . . . . 81
2
6.9.1 Parmetros que reejan eleccin en el diseo . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82
6.9.2 Parmetros que reejan la capacidad de disear y llevar a cabo componentes ecientes . . . . . 83
6.10 Eciencia de ciclos por Segunda Ley de la Termodinmica . . . . . . . . . . . . . . . . . . . . . . . . . 83
Lista de Figuras
1 Sistema, medio, frontera y universo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7
2 Sistema aislado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7
3 Sistema cerrado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8
4 Sistema abierto . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8
5 Volumen de Control y Supercie de Control . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
6 Equilibrio mecnico y trmico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
7 Coordenadas termodinmicas e isolneas para un gas ideal. . . . . . . . . . . . . . . . . . . . . . . . . . 11
8 Representacin esquemtica de la Ley Cero de la Termodinmica . . . . . . . . . . . . . . . . . . . . . 13
9 Trabjo como mecanismo de transferencia de energa . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14
10 Trabajo elctrico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14
11 Resistencia calentando agua . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
12 Incremento de la energa interna como consecuencia de la trasnferencia de calor. . . . . . . . . . . . . 18
13 Proceso adiabtico y permanente de un gas que pasa a travs de una vlvula. . . . . . . . . . . . . . . 20
14 Equivalncencia del sistema mediante pistones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20
15 Volumen de control y sistema para ujo que pasa a travs de un dispositivo de propulsin. . . . . . . . 26
16 Volumen de control para reconocer el ujo msico. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
17 Esqumas de volumen de control para la ecuacon de la energa. . . . . . . . . . . . . . . . . . . . . . . 27
18 Lneas de ujo y regin de estancamiento. Un volumen de control se puede especicar entre las lneas
punteadas y los punetos 1 y 2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
19 Turbina Pratt and Whitney 4084 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
20 Mezcla saturada lquido-vapor . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
21 Diagrama de fase . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
22 Diagrama de fase a una atmosfera de presin. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
23 Ejemplos de connversin de trabajo a calor. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
24 Expansin Isotrmica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36
25 Generalizacin de una mquina trmica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
26 Ciclo de Carnot . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
27 Trabajo y trasferencia de calor en un ciclo de Carnot entre dos reservorios decalor donde T
2
> T
1
. . . 39
28 Operacin de un refrigerador de Carnot . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
29 Ciclo idel de Otto . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
30 Esquema del ciclo Otto real . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
31 Pistn y valvulas en una mquina de combustin de cuatro tiempos . . . . . . . . . . . . . . . . . . . 41
32 Eciencia thermica del ciclo Otto ideal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
33 Ciclo ideal Diesel. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
34 Ciclo ideal Brayton . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
35 Conguracin de ciclo Brayton abierto . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
36 Conguracin ciclo Brayton cerrado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
37 Eciencia y trabajo de dos ciclos Brayton. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
38 Rueda con paletas en el estado inical y nal. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
39 Expansin libre de un gas ideal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51
40 Expansin contra un piston . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51
41 Restitucin de la expansin libre a su condicin inicial. . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
42 Trabajo e intercambio de calor en el proceso isotrmico reversible de compresin. . . . . . . . . . . . . 52
43 Conversin del 100% de trabajo en calor. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
44 Trabajo y trasnferecia de calor en la expansin isotrmica reversible. . . . . . . . . . . . . . . . . . . . 53
45 Un pistn que soporta unas pesas. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
46 Para obtener el mximo de trabajo se requiere que el proceso sea reversible. . . . . . . . . . . . . . . . 54
47 Transferencia de calor en una diferencia nita . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
48 Rueda con paletas en el estado inical y nal. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
3
49 Nicolas Sadi Carnot (1796-1832), ingeniero y ocial en el ejrcito francs. El trabajo de Carnot es ms
notable porque fue hecho sin la ventaja de la primera ley, que no fue descubierta hasta 30 aos ms tarde 57
50 Mquina trmica que viola la Segunda Ley [Kelvin-Plank] . . . . . . . . . . . . . . . . . . . . . . . . . 57
51 Para T
1
< T
2
, esto resulta imposible (Clausius). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
52 Calor transferido desde/hacia el recervorio de calor . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
53 Transferencia de calor entre dos reservorios . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
54 Trabajo de un solo depsito del calor. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
55 Los bloques igualan su temeperatura. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
56 Los reservorios usados para restablecer el estado inicial . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
57 Mquina de Carnot . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
58 Arreglo de mquinas trmicas para mostrar la escala termodinmica de temperatura. . . . . . . . . . . 71
59 Ciclo de Carnot en coordenadas T s. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
60 El ciclo ideal de Brayton . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
61 Cambio reversible (R) y cambio irreversible (I) entre los estados A y B . . . . . . . . . . . . . . . . . . 74
62 Ciclo de turbina de gas (Brayton) que muestra el efecto del alejamiento del comportamiento ideal en el
compresor y la turbina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
63 Potencia y eciencia adimensionales para una turbina no-ideal de gas . . . . . . . . . . . . . . . . . . . 83
64 Diagrama T s de un ciclo idela de Brayton. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 84
65 Diagrama P v de un ciclo idela de Brayton. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 84
Lista de Tablas
1 Temperatura y presin crtica y punto de ebullici de gases comunes. . . . . . . . . . . . . . . . . . . 33
Introduccin
Este curso de Termodinmica est dirigido a estudiantes de ingeniera. El contenido de este curso intenta hecer
un resumen de algunos libros comnmente empleados en la enseanza de la termodinmica clsica en ingeniera. As,
estas primeras notas tratan a manera de repaso los conceptos que dan sustento a la termodinmica clsica.
Es muy importante indicar que gran parte de estas notas han sido tomadas y traducidas libremente del curso de
Termodinmica desarrollado por:
Professor Ian A. Waitz <<http://mit.edu/aeroastro/people/waitz >>
Professor Edward Greitzer <<http://web.mit.edu/aeroastro/people/greitzer.html >>
Professor Zoltan Spakovszky <<http://mit.edu/aeroastro/people/waitz >>
quienes son investigadores del Department of Aeronautics and Astronautics, del Massachusetts Institute of
Technology.
As, una parte signicativa de este curso ha sido tomado, reproducido y traducido de la pgina
Thermodynamics
http://web.mit.edu/16.unied/www/FALL/thermodynamics/index.html
con la aceptacin del profesor Ian A. Waitz a quien agradezco profundamente.
Referencias
A continuacin se listan algunas obras que servirn de apoyo al estudiante para el desarrollo del curso. La lista
se indica por orden de importancia, por lo que es recomendable considerar tener a mano al menos los tres primeros
libros.
Thermodynamics: An Engineering Approach with Student Resource DVD. Yunus A. Cengel and
Michael A. Boles. McGraw-Hill Science/Engineering/Math; 6th edition (September 22, 2006).
Fundamentals of Engineering Thermodynamics. Michael J. Moran and Howard N. Shapiro. Wiley; 5th
edition (June 11, 2003).
Advanced Thermodynamics Engineering (Computational Mechanics and Applied Analysis Series) Kalyan
Annamalai and Ishwar K. Puri. CRC (August 31, 2001).
Advanced Engineering Thermodynamics. Adrian Bejan. Wiley; 3rd edition (August 18, 2006).
4
Fundamentals of Thermodynamics. Richard E. Sonntag, Claus Borgnakke, and Gordon J. Van Wylen. Wiley;
6th edition (August 26, 2002).
Termodinmica. Abbott, M.M., Vanness, H.C., 2a. ed.McGraw-Hill.Mxico:(1991).
Understanding Thermodynamics.H.C. Van Ness. Dover Publications; Dover 3rd edition (January 1, 1983).
Thermodynamics, H. B. Callen. John Wiley & Sons, Inc. (1970).
Algunas ligas en internet interesantes
De la Mquina de Vapor al Cero Absoluto (Calor y Entropa); Leopoldo Garca-Coln S.
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/05/htm/maqvapor.htm
Applied Thermodynamics
http://www.taftan.com/thermodynamics/
Termodinmica
http://soko.com.ar/Fisica/Termodinamica.htm
Termodinmica
http://www1.uprh.edu/inieves/macrotema/termodinamica.htm
Apuntes de termodinmica elemental; E. Barrull:
http://www.biopsychology.org/apuntes/termodin/termodin.htm
Parte I
LA PRIMERA LEY DE LA TERMODINMICA
1 Introduccin a la termodinmica
Si buscamos una denicin sencilla de termodinmica podemos encontrar que la termodinmica es la rama de la
fsica que estudia la energa, la transformacin entre sus distintas manifestaciones, como el calor, y su capacidad
para producir un trabajo. La termodinmica est ntimamente relacionada con la mecnica estadstica, de la cual se
pueden derivar numerosas relaciones termodinmicas. Es importante tener en mente que la termodinmica estudia los
sistemas fsicos a nivel macroscpico, mientras que la mecnica estadstica suele hacer una descripcin microscpica
de los mismos.
1.1 Qu se entiende por termodinmica
Debe quedar claro que la termodinmica es una ciencia y, quiz la herramienta ms importante en la ingeniera, ya
que se encarga de describir los procesos que implican cambios en temperatura, la transformacin de la energa, y las
relaciones entre el calor y el trabajo.
La termodinmica es una ciencia factual que se encarga de estudiar hechos o acontecimientos auxilindose de la
observacin y la experimentacin por lo que tiene que apelar al examen de la evidencia emprica para comprobarlos.
As, la termodinmica puede ser vista como la generalizacin de una enorme cantidad de evidencia emprica.
Esta ciencia es extremadamente general: no hay hiptesis hechas referentes a la estructura y al tipo de materia de
la cual nos ocupamos. Tal vez una de las razones por las que la termodinmica es tan difcil de estudiar sea que la
teora empleada para describir los fenmenos es muy general y que puede ser aplicable a sistemas de estructura muy
elaborada con todas las formas de propiedades mecnicas, elctricas y trmicas complejas.
En el estudio termodinmico es comn idealizar los sistemas para que sus propiedades mecnicas y elctricas sean
lo ms triviales posibles. Cuando el contenido esencial de la termodinmica se ha desarrollado, es una cuestin simple
extender el anlisis a sistemas con estructuras mecnicas y elctricas relativamente complejas. La cuestin esencial es
sealar que las restricciones en los tipos de sistemas considerados no son limitaciones bsicas sobre la generalidad de
la teora termodinmica, y slo se adoptan meramente para la simplicacin expositiva.
Quiz la complicacin principal del anlisis termodinmico como herramienta en ingeniera se deba a que es prctica
comn restringir los estudios a sistemas simples, denidos como sistemas que son macroscpicamente homogneos,
isotrpicos, y desprovistos de carga elctrica, que son lo sucientemente grandes para que los efectos de frontera puedan
ser ignorados, y que no se encuentran bajo la accin de campos elctricos, magnticos o gravitacionales. Nada ms
lejos de la realidad.
5
Bsicamente la termodinmica en la ingeniera se enfoca en la produccin de trabajo, a menudo bajo la forma de
energa cintica a partir de calor como resultado de los procesos de la combustin, aunque no siempre es este el caso.
ACTIVIDADES
Qu es termodinmica?
Por qu es importante su estudio?
Por qu es tan complicado su estudio?
1.2 Deniciones e ideas fundamentales de la termodinmica
Como todas las ciencias, la termodinmica involucra el modelado matemtico del mundo real. Para que las deducciones
matemticas sean consistentes, necesitamos deniciones exactas de los conceptos bsicos. Lo que sigue es una discusin
de algunos de los conceptos que necesitaremos. Se recomienda revisar la bibliografa recomendada para ampliar el
contenido de las siguientes secciones, en particular se pueden consultar los primeros captulos de los libros [[1]-[3]]
1.2.1 El modelo del Medio Continuo
La materia se puede describir a nivel molecular (o microscpico) usando las herramientas de la mecnica estadstica
y de la teora cintica. Para la ingeniera basta conocer la informacin como un promedio, es decir, una descripcin
macroscpica y no una descripcin microscpica. Existen dos razones para tal situacin. Primero, una descripcin
microscpica de un dispositivo en ingeniera puede acarrear demasiada informacin para ser procesada, tomemos
como ejemplo 1 mm
3
de aire a temperatura y presin estndar el cual contiene 10
16
molculas y cada una de ellas
presenta una posicin y una velocidad asociada. En segundo lugar, y ms importante, las posiciones y las velocidades
microscpicas resultan generalmente intiles para determinar cmo los sistemas macroscpicos actuarn o reaccionarn
a menos claro que se integre su efecto total.
La mayor parte de los problemas en ingeniera estn relacionados con dimensiones fsicas y en la mayora de los
casos se presume un medio continuo donde las variaciones de las propiedades fsicas que constituyen el medio son tan
suaves, que se puede utilizar el clculo diferencial para el anlisis. Se puede decir que el trmino medio continuo se
usa tanto para designar un modelo matemtico, como cualquier porcin de material cuyo comportamiento se puede
describir adecuadamente por ese modelo. Existen tres grandes grupos de medios continuos: Mecnica del slido rgido,
Mecnica de slidos deformables, Mecnica de uidos, (que distingue a su vez entre: Fluidos compresibles y Fluidos
incompresibles).
Cabe sealar que la termodinmica clsica se reere solamente a modelos de medio continuo.
1.2.2 El concepto de Sistema
Como denicin de sistema se puede decir que es un conjunto de elementos con relaciones de interaccin e interdepen-
dencia que le coneren entidad propia al formar un todo unicado.
Un sistema puede ser cualquier objeto, cualquier cantidad de materia, cualquier regin del espacio, etc., seleccionado
para estudiarlo y aislarlo (mentalmente) de todo lo dems. As todo lo que lo rodea es entonces el entorno o el medio
donde se encuentra el sistema.[1]
El sistema y su entorno forman el universo, como se muestra en la gura (1)
La envoltura imaginaria que encierra un sistema y lo separa de sus inmediaciones (entorno) se llama frontera del
sistema y puede pensarse que tiene propiedades especiales que sirven para: a) aislar el sistema de su entorno o para b)
permitir la interaccin de un modo especco entre el sistema y su ambiente. Es muy importante denir la frontera del
sistema como una supercie y no otro sistema, debe quedar claro que el espesor de una supercie es matemticamente
cero por lo que la frontera no puede contener materia u ocupar algn lugar en el espacio. El valor de una propiedad
que es medida en el punto exacto de la frontera debe ser por tanto el valor del sistema as como del entorno, ya que
despus de todo el sistema y el entorno estn en contacto en ese punto.
Los sistemas termodinmicos se pueden clasicar como: aislados, cerrados y abiertos
El sistema aislado es el sistema que no puede intercambiar materia ni energa con su entorno y este es un modelo
imaginario cuya frontera o lmite del sistema impide cualquier tipo de intercambio como se muestra en la gura (2)
El sistema cerrado es el sistema que slo puede intercambiar energa con su entorno, pero no materia, es decir,
aquel cuya frontera admite nicamente el intercambio de energa como se muestra en la gura (3).
En la gura (4) se muestra lo que se denomina sistema abierto que es el sistema que puede intercambiar materia
y energa con su entorno.
Al trabajar con dispositivos tales como motores es a menudo til denir el sistema dentro de un volumen identicable
ya sea jo o deformable donde se presentan tanto ujo de entrada como ujo de salida. Esto se llama un volumen de
control como se muestra en la gura (5)
6
Figure 1: Sistema, medio, frontera y universo
Figure 2: Sistema aislado
Un sistema termodinmico es un sistema macroscpico, es decir, un sistema cuyo detalle de sus caractersticas
microscpicas (comprendida la posicin y la velocidad de las partculas en cada instante) es inaccesible y donde slo
son accesibles sus caractersticas estadsticas.
1.2.3 El concepto de Estado
La condicin o existencia de un sistema termodinmico en un punto particular y en un determinado instante de
tiempo se describe por un conjunto interrelacionado de cantidades suscepetibles de ser medidas llamadas propiedades
termodinmicas. Nos referimos a la condicin descrita por dichas propiedades como Estado.
Un punto importante que requiere ser resaltado es que no todas las cantidades (valores numricos) que el ingeniero,
el fsico o alguien ms, puede calcular o medir en conexin con cierto sistema son propiedades termodinmicas. Las
propiedades termodinmicas son slo aquellas cantidades cuyos valores numricos no dependen de la historia del
sistema, es decir, son independientes de la ruta seguida entre dos diferentes estados. Las cantidades como presin y
temperatura son propiedades termodinmicas ya que sus valores dependen estrictamente de la condicin instantnea
durante la cual son medidos. Como ejemplo de cantidades que NO son propiedades termodinmicas son trabajo, calor,
transferencia de masa, transferencia de entropa, generacin de entropa, prdida de trabajo disponible, prdida de
exerga y muchas otras.
Las propiedades termodinmicas cuyos valores dependen del tamao del sistema son llamadas propiedades extensi-
7
Figure 3: Sistema cerrado
Figure 4: Sistema abierto
vas (v.g. volumen, entropa, energa interna). Las propiedades denominadas propiedades intensivas son aquellas que
no dependen del tamao del sistema (v. g. presin, temperatura).
Es claro entonces que las propiedades extensivas son aditivas, as, si el sistema se divide en un nmero de subsis-
temas, el valor de la propiedad para el sistema entero es igual a la suma de los valores de los subsistemas. El volumen
es pues una propiedad extensiva.
Por otro lado las propiedades intensivas no dependen de la cantidad presente de materia y stas no pueden ser
obtenidas como la suma de todos los subsistemas, como es el caso de la temperatura.
La coleccin de todas las propiedades intensivas de un sistema constituye un Estado Intensivo
Una cierta Fase de un sistema es la coleccin de todas las partes del sistema que tienen el mismo estado intensivo
y los mismos valores por unidad de masa de las propiedades extensivas. Por ejemplo, el punto triple del agua donde
coexisten tres estados de agregacin molecular, liquido slido y gas (agua, hielo y vapor) presenta la misma fase, por
que sus propiedades por unidad de masa son las mismas para los tres estados de agregacin molecular. En el caso de
un sistema bifsico, trifsico, o multifsico es posible asociar a cada estado de agregacin molecular las propiedades
intesivas que lo describen. Como ejemplo la mezcla vapor, vapor-agua, y agua de un generador de vapor es un sistema
multifsico donde a cada estado de agregacin molecular le corresponde una fase.
Las propiedades especcas son propiedades extensivas por unidad de masa y comnmente se denotan por letras
minsculas. Por ejemplo el volumen especco v es:
v =
V
m
(1)
donde V es el volumen y m es la masa del sistema.
De esta manera la propiedades especcas son intensivas porque no dependen del tamao del sistema.
Las propiedades de un sistema simple son uniformes en todas partes. Sin embargo, las propiedades de un sistema
pueden variar de un punto a otro punto. Generalmente podemos analizar un sistema subdividindolo (ya sea conceptual
8
Figure 5: Volumen de Control y Supercie de Control
o en la prctica) en un nmero de sistemas simples en los cuales las propiedades se asumen como uniformes.
Es muy importante observar que las propiedades termodinmicas describen un estado solamente cuando el sistema
est en equilibrio. Sin embargo cualquier sistema que muestre un conjunto de variables identicables tiene un estado
termodinmico, ya sea que est o no en equilibrio [1] y [3].
1.2.4 El concepto del Equilibrio
Un sistema est en equilibrio termodinmico cuando no se observa ningn cambio en sus propiedades termodinmicas
a lo largo del tiempo. Los estados de equilibrio son, por denicin, estados independientes del tiempo (ver gura 6).
Un sistema en equilibrio termodinmico satisface:
1. equilibrio mecnico (ningunas fuerzas desequilibradas)
2. equilibrio trmico (ningunas diferencias de la temperatura)
3. equilibrio qumico.
Figure 6: Equilibrio mecnico y trmico
Un estado de no equilibrio es un estado con intercambios netos de masa o energa y sus parmetros caractersticos
dependen en general de la posicin y del tiempo. Si no dependen del tiempo, pero necesitan la intervencin del entorno
9
para mantener sus valores se dice que se trata de un estado estacionario fuera del equilibrio.
1.2.5 El concepto de Proceso
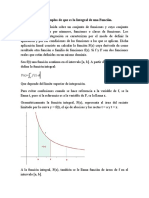
El concepto de proceso se reere al cambio de estado desde un estado inicial hasta un estado nal . Conocer el proceso
signica conocer no slo los estados nal e inicial sino las interacciones experimentadas por el sistema mientras est
en comunicacin con su medio o entorno (v. g. transferencia de trabajo, transferencia de calor, transferencia de masa,
transferencia de entropa) [4]
La trayectoria o ruta del proceso es la historia o la sucesin de estados que ha seguido o recorrido el sistema desde
el estado inicial hasta el estado nal.
Un ciclo termodinmico es un proceso especial en el cual el estado inicial coincide con el estado nal. Aunque un
sistema ha vuelto a su estado original y ha terminado un ciclo, el estado de los alrededores pudo haber cambiado.
1.2.6 Procesos de Cuasi-Equilibrio
Ocurre una transformacin en el sistema si, como mnimo, cambia de valor una variable de estado del sistema a lo
largo del tiempo. Si el estado nal es muy prximo al estado inicial, la transformacin es innitesimal.
En el estudio termodinmico a menudo estamos interesados en planear procesos entre estados a travs de coorde-
nadas termodinmicas, es decir como una sucesin de estados.
Sin embargo, las propiedades que denen solamente un estado cuando el sistema est en equilibrio. Si un proceso
implica fuerzas nitas, desequilibradas, el sistema puede pasar a travs de estados fuera del equilibrio que no podemos
tratar.
Sin embargo, una idealizacin extremadamente til es que solamente existen fuerzas alejadas del equilibrio que son
innitesimales y que permiten ver al proceso como si ocurriera en una sucesin o serie de estados de cuasi-equilibrio.
Para que esto sea verdad el proceso debe ser lento en lo referente al tiempo necesario para que el sistema llegue al
equilibrio internamente. Por ejemplo, para un gas en condiciones de inters para nosotros, una molcula dada puede
experimentar cerca de 10
10
colisiones moleculares por segundo, de modo que, si diez colisiones son necesarias para
llegar al equilibrio, el tiempo de equilibrio es del orden de 10
9
segundos. Este tiempo es muy pequeo comparado con
la escala de tiempo asociada a las propiedades de ujo de uido (es decir, el tiempo necesario para que una partcula
uida tenga interaccin signicativa a lo largo de una longitud caracterstica de inters en un dispositivo en ingeniera).
Se tienen tambin una gama grande de parmetros donde este tiempo caracterstico de equilibrio es muy pequeo, por
lo tanto, es una aproximacin muy buena para observar los procesos termodinmicos como la sucesin de estados del
equilibrio [5].
Las gura (7) muestra tres diagramas con el uso de coordenadas termodinmicas donde se dibujan isolneas (lneas
a lo largo de las cuales una propiedad es constante). Estos diagramas incluyen lneas constantes de la temperatura
(isotermas) en el diagrama p v. Lneas constantes del volumen (isocoras) en el diagrama T p. Lneas de presin
constantes, (isobaras) en el diagrama.T v Todas ellas para un gas ideal.
Las sustancias verdaderas pueden tener cambios de fase (agua a vapor de agua, o agua a hielo, por ejemplo), las
cuales podemos tambin trazar en coordenadas termodinmicos.
1.2.7 Ecuaciones de Estado
Es un hecho experimental que dos propiedades son necesarias para denir el estado de cualquier sustancia pura en
equilibrio o que experimenta un proceso permanente o causi-permanente [5]. As para un gas compresible simple como
aire,
P = P (v, T) , o bien v = v(P, T), o bien T = T (P, v) (2)
donde T es la temperatura, P la presin y v es el volumen por unidad de masa (el inverso de la densidad 1/).En pocas
palabras, si conocemos dos de las propiedades termodinmicas cuales fueran, la tercera est denida. Cualesquiera de
estos es equivalente a la ecuacin,
f (P, v, T) = 0 (3)
tal que esta es conocida como Ecuacin de Estado.
La ecuacin de estado de un gas ideal, la cual es una muy buena aproximacin de un gas real en condiciones que
son tpicamente de inters en ingeniera, es
Pv = RT (4)
donde v es el volumen por mol del gas y R es la constante universal de los gases 8.314510 J mol
1
K
1
.
10
Figure 7: Coordenadas termodinmicas e isolneas para un gas ideal.
Una forma ms comn utilizada en mecnica de uidos es aquella que se obtiene al dividir por el peso molecular
M:
Pv = RT, o bien, P = RT (5)
donde R es R/M, la cual presenta diferentes valores para los distintos gases debido a los diferentes pesos moleculares.
Por ejemplo, para aire a condiciones normales .R = 0.287 kJ kg
1
K
1
1.3 Cambio de estado de un sistema debido a Calor y Trabajo
Los cambios de estado en un sistema son producidos por interacciones con el entorno o medio a travs del calor y del
trabajo, que son dos distintos modos de la transferencia de energa. Durante estas interacciones es necesario considerar
equilibrio termodinmico (un proceso esttico o cuasiesttico) para que las ecuaciones sean validas al relacionar una
con otra las propiedades del sistema.
1.3.1 Calor
El calor es una forma de transferencia de energa debido nicamente a la diferencia de temperatura.
1. La transferencia de calor puede alterar el estado del sistema;
11
2. Los cuerpos no contienen calor; el calor es energa en transito y se identica mientras sta pasa a travs de
los lmites del sistema;
3. La cantidad de calor necesaria para ir de un estado a otro es dependiente de la trayectoria;
4. Los procesos adibticos son aquellos en los que no se transere calor.
La convencin de signos utilizada para una cantidad de calor Q es opuesta a la que se utiliza para el trabajo. El
calor aadido a un sistema se da con un nmero positivo, en tanto que el calor extrado de un sistema se da con un
nmero negativo.
Un depsito de calor, aunque mal empleado el trmino pues el calor no se deposita o almacena ya que siempre
est en trnsito, es un cuerpo capaz de absorber o desprender cantidades ilimitadas de calor sin ningn cambio de
temperatura. La atmsfera y los ocanos se aproximan a lo que son los depsitos de calor, por lo general utilizados
como sumideros de calor. Un horno y un reactor nuclear en funcionamiento continuo son equivalentes a los depsitos
de calor.
1.3.2 Ley Cero de la termodinmica
Con el material que hemos discutido hasta ahora, estamos preparados para describir la Ley de Cero de la Termod-
inmica. Como los otras leyes de la termodinmica que veremos, la Ley de Cero se basa en la observacin y en su
comprobacin experimental. Consideremos dos observaciones como punto de partida:
1. Si dos cuerpos estn en contacto trmico por un tiempo los sucientemente largo, ningn cambio futuro
observable toma lugar y se dice que el equilibrio trmico prevalece.
2. Dos sistemas que estn individualmente en equilibrio trmico con un tercero, estos dos estn en equilibrio
trmico uno con el otro; los tres sistemas tienen el mismo valor de la propiedad llamada temperatura.
Estas ideas que relacionan la temperatura y del equilibrio trmico se expresan formalmente en la Ley Cero de la
Termodinmica:
Ley Cero: Existe para cada sistema termodinmico en equilibrio una propiedad llamada temperatura. La igualdad
de la temperatura es una condicin necesaria y suciente para el equilibrio trmico.
La Ley Cero dene as una propiedad (temperatura) y describe su comportamiento.
Es importante observar que esta ley es verdadera sin importar cmo medimos la propiedad temperatura.
Si bien las escalas de temperaturas empricas y la temperatura termodinmica son discutidas ms adelante, pre-
sentamos las dos escalas absolutas utilizadas actualmente. La escala Kelvin
K = 273.15 +
C (6)
donde
C son los grados centgrados y la escala Rankine
R = 459 +
F (7)
donde
F son los grados Fahrenheit
La escala de temperaturas ser discutida posteriormente.
La Ley del Cero se representa esquemticamente en la gura (8)
1.3.3 Trabajo
Como se indic, el calor es una manera de transferencia de energa en un sistema en virtud solamente de la diferencia
de temperatura. Cualquier otro mecanismo de transferencia de energa en un sistema se llama trabajo.
El trabajo en termodinmica siempre representa un intercambio de energa entre un sistema y su entorno, y presenta
dimensiones de energa
Cuando un sistema sufre una transformacin, este puede provocar cambios en su entorno. Si tales cambios implican
el desplazamiento (variacin) de las fuerzas que ejerce el entorno sobre el sistema, o ms precisamente sobre la frontera
entre el sistema y el entorno, entonces se ha produccin un trabajo. Dependiendo del origen fsico de las fuerzas
aplicadas al sistema se distinguen diferentes formas de trabajo realizado. Podemos tener trabajo de movimiento
reciproco (v. g. en un pistn-cilindro, levantando un peso), trabajo elctrico y magntico (v. g. un motor elctrico),
trabajo qumico, trabajo de la tensin supercial, el trabajo elstico, etc.
Por convencin se considera que el trabajo realizado por el sistema es positivo y el trabajo efectuado sobre el
sistema es negativo.
El trabajo mecnico ocurre cuando una fuerza que acta sobre el sistema lo mueve una cierta distancia. Tal como
en mecnica este trabajo se dene por la integral
W =
Z
Fdl (8)
12
Figure 8: Representacin esquemtica de la Ley Cero de la Termodinmica
donde F es la componente de la fuerza que acta en la direccin del desplazamiento dl. En forma diferencial esta
ecuacin se escribe:
W = Fdl (9)
donde W representa una cantidad diferencial de trabajo.
En termodinmica, a menudo se encuentra trabajo efectuado por una fuerza distribuida sobre un rea, por ejemplo,
por una presin P que acta a travs de un volumen V , como en el caso de una presin de uido ejercida sobre un
pistn. En esta situacin, el trabajo diferencial se expresa ms convenientemente como
W = PdV (10)
donde P es la presin externa ejercida sobre el sistema [1].
Se puede pensar que el trabajo mecnico se realiza a travs del desplazamiento de una masa.
La gura (9) muestra un sistema formado por un recipiente lleno de agua, un termmetro y una rueda de paletas.
Este sistema puede interaccionar con el sistema ms sencillo
0
compuesto por una masa y la aceleracin gravitacional
de la Tierra dando por resultado el peso w Los dos sistemas interaccionan puesto que el peso al caer hace que la rueda
gire y agite el agua. Esta interaccin es adiabtica, ya que la nica conexin entre los dos sistemas es la cuerda, que
slo transmite una cantidad despreciable de calor. El parmetro externo que describe el sistema
0
es la distancia s
que recorre el peso.. Si el peso w desciende una distancia s sin variacin de velocidad, la energa media del sistema
0
se reduce en una cantidad ws, que es la disminucin de la energa potencial del peso. Esto resulta del trabajo
realizado sobre l por la gravedad (el peso desciende normalmente con velocidad constante, puesto que alcanza muy
rpidamente su velocidad lmite. Si la velocidad del peso estuviese cambiando, la variacin de la energa media de
0
vendra dada por la variacin de la suma de las energas cintica y potencial del peso). Como el sistema combinado
formado por y
0
est aislado, la energa media del sistema debe aumentar entonces en el proceso en una cantidad
ws; es decir, el peso que cae,
0
, realiza un trabajo ws sobre el sistema aislado adiabticamente, .
Cuando el trabajo se debe al desplazamiento de las fuerzas de presin exteriores que conllevan un cambio en el
volumen del sistema se llama trabajo de expansin y se expresa por
W = PdV (11)
[Con medios elctricos es posible realizar trabajo de modo ms conveniente y medirlo a su vez con ms exactitud (el
trabajo es realmente mecnico al nal, pero intervienen en l fuerzas elctricas). La gura(10) muestra un dispositivo
de este tipo, completamente anlogo al de la gura (9). Aqu el sistema se compone de un recipiente lleno de
agua, un termmetro y una resistencia elctrica. A la resistencia puede conectarse una batera de fem conocida V
mediante unos conductores lo sucientemente nos para mantener el sistema trmicamente aislado de la batera. La
carga q que puede proporcionar la batera es su parmetro externo. Cuando la batera suministra una carga q que
pasa a travs de la resistencia, el trabajo realizado por la batera sobre en este proceso es simplemente V q. La
13
Figure 9: Trabjo como mecanismo de transferencia de energa
resistencia juega aqu un papel completamente anlogo a la rueda de paletas del ejemplo anterior, de modo que ambos
son simplemente aparatos adecuados sobre los que puede realizarse el trabajo.
Figure 10: Trabajo elctrico
Si consideramos una sustancia compresible simple, por ejemplo, un gas (el sistema), ejerciendo una fuerza en los
alrededores va un pistn, que se mueve con una cierta distancia dl. El trabajo hecho en los alrededores W
alr
es
dW
alr
= Fuerza dl
=
Fuerza
rea
rea dl
= Presin (rea dl)
= Presin dVolumen
= P
x
dV (12)
por lo tanto:
W
alr
=
Z
V2
V1
P
x
dV (13)
La presin externa se puede relacionar solamente con la presin de sistema si P
x
P
sis
Para que esto ocurra, no
debe existir ninguna fuerza de friccin, y el proceso debe ser bastante lento de modo que las diferencias de la presin
debido a las aceleraciones no sean signicativas. Es decir requerimos un proceso cuasiesttico p
x
p
s
. Al considerar
14
P
x
= P
sis
dp podemos escribir
W
alr
=
Z
V
2
V1
P
x
dV = (P
sis
dP) dV =
Z
V
2
V1
(P
sis
dV dPV P) (14)
Por lo tanto, cuando dp es pequeo el proceso es cuasiesttico,
W =
Z
V2
V1
P
sis
dV
y el trabajo hecho por el sistema es igual que el trabajo hecho en los alrededores. Bajo estas condiciones, decimos
que el proceso es reversible. Cabe sealar que un proceso es reversible si su direccin puede invertirse en cualquier
punto mediante un cambio innitesimal en las condiciones externas. Para los procesos reversibles es posible basar los
clculos en las propiedades del sistema (con independencia de los del entorno). En los procesos reversibles, el sistema
nunca se desplaza ms que diferencialmente de su equilibrio interno o de su equilibrio con su entorno.
Las condiciones para la reversibilidad son
1. Si se invierte el proceso, el sistema y los alrededores sern vueltos a los estados originales.
2. Para invertir el proceso que necesitamos aplicar solamente un innitesimal dp. Un proceso reversible se puede
alterar en la direccin por los cambios innitesimales en las condiciones externas
Es importante tener en mente que
1. Las propiedades dependen solamente del estado, pero el trabajo es dependiente de la trayectoria (depende de la
trayectoria tomada entre los estados); por lo tanto el trabajo no es una propiedad termodinmica, y por tanto nos es
una variable de estado.
2. Cuando decimos W
12
el trabajo entre los estados 1 y 2, necesitamos especicar la trayectoria.
3. Para los procesos irreversibles, no podemos utilizar
R
PdV y el trabajo debe un dato del problema o debe ser
encontrado por algn otro mtodo.
1.3.4 Trabajo y Calor -Cul es cul?
El calor, al igual que el trabajo, se considera en termodinmica como energa en trnsito a travs de la frontera que
separa a un sistema de su entorno. Sin embargo, a diferencia del trabajo, la transferencia de calor se origina por una
diferencia de temperatura entre el sistema y su entorno y el simple contacto es el nico requisito para que el calor
sea transferido por conduccin. No se considera el calor que se almacena en un sistema. Debe quedar claro que las
unidades de calor son las de trabajo y energa
Entre trabajo y calor podemos tener uno, el otro, o ambos: depende de qu traspase el lmite o la frontera del
sistema (as cmo denimos nuestro sistema). Por ejemplo si consideramos un resistor que est calentando un volumen
de agua. como se muestra en la gura (11).
Figure 11: Resistencia calentando agua
1. Si el agua es el sistema, entonces es el estado del sistema cambiar por la transferencia de calor suministrada
por el resistor.
2. Si el sistema es el agua y el resistor combinados, entonces el sistema cambiar por el trabajo elctrico.
1.3.5 Los puntos complicados del captulo 1
En relacin con las propiedades termodinmicas, comnmente existe confusin sobre cul propiedad es extensiva y
cul es intensiva. Por ejemplo, la energa, el volumen, la entalpa son propiedades extensivas. El valor de dichas
propiedades no slo depende de la temperatura o de la presin, sino tambin de la masa del sistema. Consideremos
15
la energa interna de una masa de dos kilogramos de aire que resulta ser dos veces la energa interna de solo un
kilogramo de aire. Si consideramos ahora por separado medio kilogramo de aire y kilogramo y medio de aire, ambos
con presiones y temperaturas iguales, al unirlos en un solo sistema el volumen y la energa interna se sumarn ya que
son propiedades extensivas, mientras que la temperatura y la presin se mantendrn sin cambio (ya que no se pueden
sumar) para describir al nuevo sistema que est compuesto por los dos kilogramos de aire.
Muy a menudo resulta til trabajar en trminos de propiedades que no dependan de la masa o extensin del
sistema, y para este propsito utilizamos propiedades pacicas como: el volumen especco, la energa especca, la
entalpa especca, etc., que son los valores del volumen, de la energa, y de la entalpa por unidad de masa. Para un
sistema de masa m las relaciones entre las propiedades especicas y las propiedades extensivas son V = mv, U = mu,
H = mh, para el volumen, la energa interna y la entalpa, respectivamente.
Otro punto importante de este captulo es saber Cundo se ha realizado trabajo?. Podemos pensar en lo siguiente,
toda aquella transferencia de energa que no ha sido provocada por diferencia de temperatura es a lo que llamamos
trabajo en termodinmica. Puede resultar un poco ambigua esta respuesta, pero es muy til al momento de analizar
un sistema y llevar a cabo un balance de energa y masa.
ACTIVIDADES
Explica el concepto de temperatura
Cmo se mide la temperatura y qu mide?
Cul es el principio bsico de funcionamiento de un termmetro de mercurio?
Indica y explica en trminos generales el funcionamiento de otros dos tipos de termmetros
Realiza un esquema comparativo entre la escala Celcius, Fahrenheit y Kelvin.
En cualquier texto de fsica aparece el equivalente mecnico del calor (1 cal = 4,186 J) que J. Joule logr medir.
Pero Qu experimento realiz para tal efecto?. Se recomienda visitar la pgina:
http://www.sc.ehu.es/sbweb/sica/estadistica/otros/joule/joule.htm
2 La primera ley de la termodinmica: Conservacin de la Energa
En las secciones anteriores hemos hablado de calor y trabajo, y cmo estos mecanismos pueden provocar cambios en el
estado de un sistema. En las siguientes secciones presentamos La Primera Ley de la Termodinmica para cuanticar
esos cambios.
2.1 Primera Ley de la Termodinmica
Comencemos con una propiedad de llamada Energa. El trmino energa tiene diversas acepciones y deniciones,
relacionadas con la idea de una capacidad para realizar trabajo, transformar, poner en movimiento.
Todos los cuerpos, pueden poseer energa debido a su movimiento, a su composicin qumica, a su posicin, a su
temperatura, a su masa y a algunas otras propiedades.
Es muy difcil dar una denicin concreta y contundente de energa, ya que la energa no es un ente fsico real, ni
una "sustancia intangible" sino slo un nmero escalar que se le asigna al estado del sistema fsico, es decir, la energa
es una herramienta o abstraccin matemtica de una propiedad de los sistemas. Podemos medir las interacciones en
el cambio de energa de un sistema, como su velocidad, su temperatura, su carga elctrica. Debe quedar claro que
la energa es una propiedad y sus diferentes manifestaciones es lo que comnmente llamamos diferentes formas de
energa. Es un error, tal vez con poca importancia pero muy recurrente, hablar de energas, como ejemplo Energas
Renovables, ya que slo existe el concepto energa (de manera singular) lo correcto ser Fuentes Renovables de Energa.
El uso de la magnitud energa en trminos prcticos se justica porque es mucho ms fcil trabajar con magnitudes
escalares, como lo es la energa, que con magnitudes vectoriales como la velocidad y la posicin. As, se puede
describir completamente la dinmica de un sistema en funcin de las energas cintica, potencial y de otros tipos de
sus componentes.
En la prctica, en las situaciones no-relativistas, se tiende, en primera aproximacin (normalmente muy buena), a
descomponer la energa total en una suma de trminos que se llaman las diferentes formas de la energa.
La energa potencial y la energa cintica son dos elementos a considerar, tanto en la mecnica como en la ter-
modinmica. Estas formas de energa se originan por la posicin y el movimiento de un sistema en conjunto, y se
conocen como la energa externa del sistema. Sin duda, un tema muy importante en la termodinmica es analizar
la energa interior de la materia, energa asociada con el estado interno de un sistema que se llama energa interna.
Cuando se especica un nmero suciente de coordenadas termodinmicas, como por ejemplo, temperatura y presin,
se determina el estado interno de un sistema y se ja su energa interna [1].
16
En general (para un sistema no-relativista), la energa total, E
T
, de un sistema puede descomponerse en la energa
inherente de la masa E
m
, la energa cintica E
k
, la energa potencial E
p
, y la energa interna U, esto es,
E
T
= E
m
+E
k
+E
p
+U (15)
donde:
E
m
= mc
2
(16)
E
k
=
1
2
mv
2
(17)
la energa potencial E
p
depende de los campos externos a los que est sometido el sistema y est dada como funcin de
la posicin. La energa interna U que considera la energa de las partculas que constituyen el sistema y sus interacciones
a corta distancia. En realidad, esta descomposicin permite distinguir entre las formas de energa mecnica (E
m
, E
k
y Ep) y una forma de energa termodinmica (U) que tiene sentido para un sistema estadstico constituido por un
gran nmero de partculas.
El cambio de energa total del sistema puede descomponerse en
E = E
k
+E
p
+U (18)
donde E
k
y E
p
representan el cambio de su energa externa (cintica y potencial respectivamente), y U representa
el cambio de su energa interna, dada por la energa cintica y potencial de las molculas, tomos y partculas
subatmicas que constituyen el sistema.[1].
Como se indic, la energa interna de un sistema U, tiene la forma de energa cintica y potencial de las molculas,
tomos y partculas subatmicas que constituyen el sistema, es decir,
U = E
kint
+E
pint
(19)
donde la energa cintica interna es la suma de la energa cintica de todas las partculas del sistema,
E
kint
=
X
j
1
2
m
j
v
2
j
(20)
y la energa potencial interna es la suma de la energa potencial debida a la interaccin de todas las partculas entre
si,
E
pint
=
X
ij
E
pij
(21)
Pero qu hay respecto a la medicin de la energa. Slo las diferencias de energa, en lugar de los valores absolutos
de energa, tienen signicado fsico, tanto a nivel atmico como en sistemas macroscpicos. Convencionalmente se
adopta algn estado particular de un sistema como estado de referencia, la energa del cual se asigna arbitrariamente
a cero. La energa de un sistema en cualquier otro estado, relativa a la energa del sistema en el estado de referencia,
se llama la energa termodinmica del sistema en ese estado y se denota por el smbolo U. [6].
Con base en la observacin se llega a las siguientes aseveraciones
1. Existe para cada sistema una propiedad llamada energa E. La energa del sistema se puede considerar como la
suma de la energa interna U, de energa cintica E
k
, de energa potencial E
p
, y de energa qumica E
ch
.
a). As como la Ley de Cero deni la propiedad temperatura la Primera Ley dene la propiedad llamada
energa.
b). En termodinmica, comparado con lo que comnmente se discute en los curso de fsica o dinmica, se utilizan
los trminos energa interna y la energa qumica para describir el sistema en estudio. Cabe sealar que este curso
deja de lado la energa qumica pero no descuidaremos la energa interna. En la gura (??) se muestra el movimiento
aleatorio o desorganizado de las molculas de un sistema. Puesto que el movimiento molecular es sobre todo una
funcin de la temperatura, la energa interna es a veces llamada energa trmica.
La energa interna por unidad de masa u, es una funcin del estado del sistema. As
u = u(p, T)
u = u(p, v) (22)
u = u(v, T)
17
Figure 12: Incremento de la energa interna como consecuencia de la trasnferencia de calor.
Recordemos que para sustancias puras el estado entero del sistema est especicado si se consideran dos propiedades.
2. El cambio en energa de un sistema es igual a la diferencia entre el calor Q agregado al sistema y el trabajo W
hecho por el sistema,
E = QW (las unidades son Joules, J ) (23)
donde E es la energa del sistema, Q es el calor suministrado al sistema, y W es el trabajo hecho por el sistema,
recordemos que
E
T
= U +E
k
+E
p
+... +... (24)
a). Al igula que la Ley Cero, La primera Ley describe el comportamiento de esta nueva propiedad, la energa [5].
b). La ecuacin (23) tambin se puede escribir con base en unidad por masa, tal que
e = q w [J kg
1
] (25)
c). En muchas situaciones la energa potencial, la energa cintica, y la energa qumica del sistema son constantes,
entonces
E = U (26)
y por tanto podemos escribir
U = QW
u = q w (27)
d). Se observa que Q y W no son funciones de estado, slo U, que es consecuencia del movimiento molecular y que
depende del estado del sistema. La energa interna U no depende de la ruta o trayectoria que sigui el sistema entre
el estado inicial y el estado nal. Se debe tener en mente que U es independiente de la ruta o trayectoria mientras
que Q y W no los son.
Esta diferencia se enfatiza matemticamente escribiendo
dU = QW
du = q w (28)
donde el smbolo se utiliza para denotar que estos son diferenciales inexactas pues dependen de la trayectoria. Para
la diferencial dU esta representa un cambio innitesimal en el valor de U y la integracin da una diferencia entre dos
valores tal que
Z
U
2
U
1
dU = U
2
U
1
= U (29)
mientras que denota una cantidad innitesimal y la integracin da una cantidad nita tal que
Z
Q = Q (30)
y
Z
W = W (31)
5. En la convencin de signos
18
Q se dene como positivo si se transere hacia el sistema, si el calor se transere del sistema hacia los alrededores
Q es negativa
W se dene como positivo si el trabajo es hecho por el sistema, mientras que si el trabajo se hace sobre el sistema
W ( desde el medio hacia el sistema) se dene como negativo.
6. En los procesos cuasi-estticos podemos substituir
W = P
sis
dV
dU = QPdV
du = q Pdv
7. La Primera Ley de la Termodinmica impide la existencia de movimientos perpetuos de primera especie, es
decir, aquellos que se alimentan de la energa que ellos mismos producen, sin necesidad de ningn aporte exterior.
La Primera Ley de la Termodinmica identica el calor como una forma de energa. Esta idea, que hoy nos parece
elemental, tard mucho en abrirse camino y no fue formulada hasta la dcada de 1840, gracias a las investigaciones de
Mayer y de Joule principalmente. Anteriormente, se pensaba que el calor era una sustancia indestructible y sin peso
(el calrico) que no tena nada que ver con la energa.
ACTIVIDADES
Cules son las convenciones de signo para el trabajo y el calor en la primera ley?
Por qu se denen as estas convenciones?
Cundo ocurre que E U?
Ejemplica un movil perpetuo de primera especie y explica por que viola la primera ley de la termodinmica.
2.2 Corolario de la Primera Ley
El trabajo realizado en cualquier proceso adiabtico (Q = 0) es una funcin de estado. Podemos escribir la primera
ley, jando el trmino de transferencia de calor igual con cero, tal que
U = W (32)
Puesto que U depende solamente del cambio de estado, W se puede encontrar como una funcin de estado para
este caso particular.
Para un proceso cclico la transferencia de calor y el trabajo son numricamente iguales ya que
U
final
= U
inicial
(33)
por lo tanto
U = 0 (34)
y en este caso particular
Q = W
I
Q =
I
W (35)
2.3 Ejemplos de aplicacin de la Primera Ley, una propiedad llamada Entalpa
2.3.1 Estrangulamiento de un gas, proceso adiabtico permanente (gas uyendo a travs de una
vlvula u otra restriccin)
En la gura (13) se muestra un ducto con un gas que uye en la direccin de las echas y que pasa a travs de una
vlvula. Deseamos saber la relacin entre las propiedades agua-sarriba de la vlvula, denotado con el sibndice "1" y
las propiedades aguas-abajo denotas por el subndice "2".
Para analizar esta situacin, comencemos por denir el sistema como una unidad de masa de gas en los siguientes
dos estados (se debe tener en mente que la correcta eleccin del sistema es crtico para solucionar de manera ecaz
el problema). En el estado inicial el gas est inicialmente aguas-arriba de la vlvula y apenas a travs de sta. En
el estado nal el gas est aguas-abajo de la vlvula y apenas a travs de sta. Las guras a la izquierda del gura ()
muestran la conguracin del gas antedicha En trminos de comportamiento del sistema, podemos sustituir el ujo
de uido del sistema por dos pistones que ejercen la misma presin que el uido ejerce, como se indica en la gura ().
19
Figure 13: Proceso adiabtico y permanente de un gas que pasa a travs de una vlvula.
Figure 14: Equivalncencia del sistema mediante pistones
El proceso es adiabtico, y considerando que los cambios en la energa potencial y cintica son insignicantes,
podemos escribir la primera ley como:
U = W (36)
y tratndose de un proceso reversible podemos escribir:
W = P
2
V
2
P
1
V
1
(37)
tal que
U
2
+P
2
V
2
= U
1
+P
1
V
1
(38)
Es decir, el estado inicial y el estado nal del sistema tienen el mismo valor que la cantidad U +PV. Para el caso
estudiado ya que nos ocupamos en un anlisis por unidad de masas, el valor es u + Pv. Esta cantidad es denida
como "Entalpa" y se denota generalmente por "H" y en trminos de propiedades especcas, la entalpa por unidad
de masa es
h = u +Pv = u +P/ (39)
La entalpa es una funcin de estado del sistema y H presenta unidades de energa como Joules o bien h en Joules
por kilogramo.
En trminos simples, podemos pensar en la entalpa como sigue. Cuando evaluamos la energa de un objeto de
volumen V, tenemos que tener presente que el objeto tuvo que "empujar" los alrededores para ocupar su propio espacio.
Con la presin P en el objeto, el trabajo requerido para hcer un lugar para s mismo est dado por PV . .Esto ocurre
para cualquier objeto o sistema y no se puede despreciar (la fuerza de ejercida por la atmsfera en un metro cuadrado
es equivalente al de una masa de 10 toneladas). As, la energa total de un cuerpo es su energa interna ms la energa
adicional que tiene el volumen V a una presin P dada. Llamamos a esta energa total la entalpa H
2.3.2 Expansin cuasi-esttica de un gas
Consideremos ahora un proceso cuasiesttico a presin constante Podemos escribir la primera ley en trminos de los
estados inicial y nal del proceso
Q = (U
2
U
1
) +W (40)
y escribiendo el trabajo en trminos de las propiedades del sistema donde P2 = P1 = P, tal que
Q = (U
2
U
1
) +P (V
2
V
1
) (41)
20
agrupando trminos podemos describir en trminos de la entalpa
Q = U
2
+PV
2
(U
1
+PV
1
)
= H
1
H
2
(42)
2.3.3 Llenado de un tanque en estado transitorio
Otro ejemplo de un proceso de ujo, esta vez para un ujo inestable, es el proceso transitorio de llenar un tanque cuyo
estado inicial est evacuado. Este es llenado con aire como atmsfera circundante, que est a una presin P
0
y una
temperatura T
0
. La conguracin se muestra en la gura ()
A un tiempo dado, la vlvula del tanque se abre y el aire exterior entra al tanque. Observe que en el estado inicial
se tiene al sistema totalmente fuera del tanque, mientras que en el estado nal el sistema est totalmente dentro del
tanque. La energa cintica del estado inicial y del estado nal es insignicante, al igual que el cambio en la energa
potencial, as que la primera ley la escribimos como:
U = W (43)
El trabajo realizado en el sistema, de magnitud P
0
V
0
donde V
0
es el volumen inicial del sistema, as que
U = P
0
V
0
(44)
o en trminos por unidad de masa (U = mu, V
0
= mv
0
, donde m es la masa del sistema)
u = u
final
u
i
= P
0
V
0
(45)
El valor nal de la energa interna es
u
final
= u
i
+P
0
V
0
= h
i
= h
0
(46)
Para un gas ideal con capaciadad calorca especca
u = c
v
T, h = c
p
T (47)
c
v
T
final
= c
p
T
0
(48)
T
final
=
c
p
c
v
T
0
= T
0
(49)
Note que la temperatura nal es mayor que el aire exterior.
Puede ser til recapitular cmo solucionamos este problema. Hay bsicamente cuatro pasos:
1. Denicin de sistema
2. Uso de La Primera Ley
3. El trmino de ecuacin de trabajo PdV
4. Suponiendo el uido como un gas ideal con calores especcos constantes.
De los ejemplos anteriores, as como un gran nmemro de situaciones ms complejas, podemos considerar que la
cantidad h = u +Pv ocurre de manera natural en problemas de ujo del uido. Ya que sta aparece frecuentemente
es comn encontrar valores tabulados como funcin de la temperatura y la presin para varios uidos de trabajo.
21
2.3.4 La primera ley en trminos de entalpa
Comenzamos con la primera ley en forma diferencial
dU = QW (50)
valida para cualquier proceso, despreciando el cambio en la energa cintica E
k
y el de la energa potencial E
p
, y
substituimos PdV para establecer dW cuando se asume un proceso reversible.
dU = QPdV (51)
Un punto complicado, y que ser claricado posteriormente, es que todos los procesos reversibles son cuasiestticos
pero no todos los procesos cuasiestticos son reversibles. [4].
Un proceso sucientemente lento tal que se aplica la ecuacin
W
rev
= PdV (52)
se denomina frecuentemente cuasiesttico, y los estados a largo de su trayectoria de tal proceso son referidos como
estos cuasiestticos.
Si el proceso es sucientemente lento as que ste pude ser visto como una secuencia de estados de equilibrio, entonces
el proceso es reversible. Si por alguna razn, los estados intermedios visitados durante el proceso cuasiesttico no son
mantenidos como estados de equilibrio (i.e. si cada estado no puede ser representado como un punto en el plano
bidimensional como el diagrama P v) entonces el proceso es no reversible y se le denomina proceso irreversible.
La denicin de entalpa
H = U +PV (53)
pude ser diferenciada aplicando la regla de la cadena al termino PV
dH = dU +PdV +V dP (54)
sustituyendo dU = QW tomada de la Primera Ley, obtenemos:
dH = QW +PdV +V dP (55)
valida para cualquier proceso. Por otro lado, para cualquier proceso reversible tal que W = PdV se tiene
dH = Q+V dP (56)
2.4 El calor especco: la relacin entre el cambio de temperatura y el calor
El incremento en la temepratura debido a la transferida de calor depende de la sustancia, en general,
Q = CT (57)
donde C es una constante que depende de la sustancia de que se trate. Podemos determinar dicha constante para
cualquier sustancia si conocemos la cantidad de calor transferido y su cambio de temperatura. Si bien el calor depende
de la trayectoria debemos especicar plenamente el proceso con la nalidad de determinar C.
Para determinar la transferencia de calor en el clculo de C se tienen dos procesos muy tiles: proceso a presin
constante y proceos a volumen constante. Designamos la capacidad calorca a presin constante mediante C
p
, y la
capacidad calorca a volumen constante mediante C
v
o bien como calor especco como c
p
y c
v
(por unidad de masa).
1. El calor especco a volumen constante
Recordemos que si se tienen cualesquiera dos propiedades del sistema, entonces el estado del sistema est determi-
nado completamente. Es decir podemos escribir
u = u(T, v)
u = u(P, v)
u = u(P, T)
(58)
Si consideramos u = u(T, v) y utilizamos la regla de la cadena para describir du con respeco a los cambios de T y
v:
du =
u
T
v
dT +
u
v
T
dv (59)
22
Para un proceso a volumen constante el segundo trmino es cero puesto que no hay cambio en volumen dv = 0,
tal que
du =
u
T
v
dT (60)
Ahora si escribimos la primera ley para un proceso reversible, con dw = Pdv,
du = q Pdv (61)
vemos que el segundo trmino es tambin cero si el proceso es a volumen constante, as
du = q (62)
Al combinar las escuaciones anteriores .(60 y 62) podemos escribir que
q =
u
T
v
dT (63)
y cambiando
u
T
v
=
q
T
v
(64)
En este caso, cualquier aumento de la energa es debido solamente a la transferencia de energa como calor. Podemos
por lo tanto utilizar nuestra denicin del calor especco de la ecuacin (57) para denir el calor especco para un
proceso a volumen constante tal que,
c
v
u
T
v
(65)
Si escribimos h = h(T, P), y consideramos un proceso a presin constante de la , anlogamente podemos obtener
el calor especco a preson constante, as
c
p
h
T
p
(66)
En la obtencin c
v
, consideramos solamente un proceso a volumen constante, por lo tanto el nombre, calor
especco a volumen constante. Sin embargo, es ms til pensar c
p
en trminos de su denicin como cierta derivada
parcial, que es una propiedad termodinmica, ms que una cantidad relacionada con la transferencia de calor en un
proceso especial. De hecho, las derivadas antedichas se denen en cualquier punto de cualquier proceso cuasiesttico
tanto si el proceso es a volumen constante o presin constante. Los nombres calor especco a volumen constante
y calor especco en la presin constante son mal empleados ya que el c
v
y el c
p
son en realidad propiedades
termodinmicas de una sustancia y por la denicin dependen solamente el estado del sistema por loq ue no debera
incluir la palabra "calor". Estas propiedades son extremadamente importantes y sus valores se han determinado
experimentalmente en funcin del estado termodinmico para un nmero enorme de substancias compresibles simples.
Para recapitular:
c
p
h
T
p
y c
v
u
T
v
(67)
o bien
C
p
H
T
p
y C
v
U
T
v
(68)
2.4.1 El calor especco de un gas ideal
La ecuacin estado para un gas ideal es
PV = NRT (69)
donde N es el nmero de moles del gas en el volumen V . El comportamiento del gas ideal representa una aproximacin
extremadamente buena al comportamiento de gases verdaderos para una amplia variedad de usos. Sin embargo, se
debe tener en mente, que describir una sustancia como un gas ideal constituye un modelo de la situacin fsica real, y
que los lmites de la validez del modelo deben estar siempre presentes.
Uno de los aspectos importantes de un gas ideal es que su energa interna depende solamente de su temperatura.
(Par ahora, esto se puede contemplar como otro aspecto del modelaje de sistemas reales que el gas ideal representa,
23
pero se puede demostrar que sta es una consecuencia de la forma de la ecuacin estado.) Ya que u depende solamente
de T de la ecuacin du =
u
T
v
dT +
u
v
T
dv podemos escribir
du =
u
T
v
dT (70)
o bien
du = c
v
(T) dT (71)
donde c
v
(T) indica que el calor especco a volumen constante es slo funcin de la temperatura.
La entalpa al igual que la energa interna slo depende de la temperatura para un gas ideal. Anlogamente se
pude mostrar que
dh =
h
T
p
dT (72)
y por tanto
dh = c
p
(T) dT (73)
Por otro lado, si estamos interesados en cambios nitos de la energa interna o de la entalpa, integramos tal que ,
u
12
=
Z
T
2
T
1
c
v
(T) dT (74)
y
h
12
=
Z
T2
T
1
c
p
(T) dT (75)
Sobre cambios de temperatura pequeos (T 200K) se asume que c
p
y c
v
son constantes. Adems, existe un
amplio rango sobre el cual los calores especcos no varan signicativamente con respecto a temperatura. Es a menudo
til tratarlas como constantes.
du = c
v
dT
u
2
u
1
= c
v
(T
2
T
1
) (76)
y
dh = c
p
dT
h
2
h
1
= c
p
(T
2
T
1
) (77)
Estas ecuaciones son tiles para calcular las diferencias de energa interna o las diferencias de la entalpa, pero se
debe tener claro que su formulacin es solamente si el calor especco es constante.
Podemos relacionar los calores especcos de un gas ideal a la constante de gas real como sigue. Escribimos la
primera ley en trminos de energa interna,
q = du +dW (78)
y asumimos un proceso reversible que escribimos en trminos de la entalpa
q = du +vdP (79)
Igualando las dos primera expresiones de arriba y suponiendo un gas ideal obtenemos que
c
p
dT vdP = c
v
dT+Pdv (80)
que al combinar trminos obtenemos
(c
p
c
v
) dT = d (Pv) (81)
tal que
(c
p
c
v
) =
d (Pv)
dT
(82)
Ya que de la ecuacin de estado tenemos Pv = RT, podemos escribir
c
p
c
v
= R (83)
24
o bien de kmol de gas
C
p
C
v
= R (84)
Una expresin que se utiliza comnmente es la razn entre los calores especcos y que se dena como
=
c
p
c
v
(85)
En general para las sustancias u y h dependen de la presin as como de la temperatura, y las relaciones antedichas
no son aplicables. A este respecto, el gas ideal es un modelo muy especial.
En resumen, los calores especcos son una propiedad termodinmica y se pueden utilizar aunque los procesos no
sean a presin constante o volumen constante. Las relaciones simples entre los cambios en energa (o entalpa) y la
temperatura son una consecuencia del comportamiento para un gas ideal que paccamente depende solamente de la
temperatura, y no son verdades para un substancias ms complejas.
2.4.2 Procesos adiabtico reversibles para un gas ideal
De la primera ley con Q = 0, du = c
v
dT y W
rev
= Pdv
du +Pdv = 0 (86)
y usando la denicin de entalpa
dh = (du +Pdv) +vdP (87)
los trminos entre parntesis son ceo para un proceso adiabtico,as que
c
v
dT = Pdv (88)
c
p
dT = vdP (89)
combinando las ecuaciones antedichas obtenemos
Pdv = vdP o bien
dv
v
=
dP
P
(90)
y al integrar entre los estados 1 y 2 obtenemos
ln
v
2
v
1
= ln
P
2
P
1
(91)
o de manera equivalente
P
2
v
2
P
1
v
1
= 1 (92)
Podemos substituir para P o v en el resultado anterior usando la ley de gas ideal y mostrar que
P
2
P
1
=
T
2
T
1
1
y
T
2
T
1
=
v
2
v
1
1
(93)
Utilizaremos las ecuaciones desarrolladas para relacionas la presin y la temperatura una con otra en procesos adia-
bticos cuasiestticos (por ejemplo, este tipo de proceso es un idealizacin de lo que sucede en compresores y turbinas).
ACTIVIDADES
1. Considere un diagrama P v para un sistema cerrado. Describa las trayectorias o rutas que el sistema seguir si
se expande desde un volumen v
1
hasta un volumen v
2
para proceso isotrmico, un proceso cuasiesttico y un procesa
adiabtico.
2. Para qu proceso el sistema realiza ms trabajo?
3 Para qu proceso hay intercambio de calor? Se agrega o se quita?
4. Es el estado nal del sistema el mismo despus de cada proceso?
5. Obtenga las expresiones para el trabajo realizado por el sistema para cada uno de los procesos antedichos.
25
2.5 Volumen de Control
Las leyes termodinmicas (as como las leyes de Newton) son utilizadas para un sistema, una cantidad especca de
materia. Ms an, en problemas de propulsin y generacin de potencia, estamos interesados en qu sucede en un
volumen dado, por ejemplo en un motor de cohete o un motor de jet a travs de los cuales se tiene una cierta razn
de ujo msico. Podemos tambin estar interesados en el intercambio de calor y trabajo que entra o sale del sistema.
Por tal razn, la forma del volumen del control del sistema para plantear las encuaciones gobernantes resulta de gran
importancia. Una representacin esquemtica de un volumen de control que pasa a travs de una turbina se muestra
en la gura (). Ms que observar una partcula de la masa que se mueve a travs de la turbina, resulta ms conveniente
observar el volumen ocupado por la turbina y denir este como volumen de control. Una vez especicada la forma del
volumen de control se establecen las leyes termodinmicas, como se muestra en la siguientes secciones.
Figure 15: Volumen de control y sistema para ujo que pasa a travs de un dispositivo de propulsin.
2.5.1 Conservacin de la masa
Para el volumen del control mostrado, la razn del cambio de masa dentro del volumen est dada por la diferencia
entre el ujo msico de entrada y el ujo msico de salida. Para un nico ujo que entra al volumen de control y un
nico ujo de salida podemos escribir:
dm
vc
dt
=
m
in
m
out
(94)
Si la masa dentro del volumen de control cambia con el tiempo es porque se agrega o se quita una cierta cantidad de
masa En el caso especial de un ujo constante d/dt = 0, por lo tanto
m
in
m
out
=
m (95)
Figure 16: Volumen de control para reconocer el ujo msico.
2.5.2 Conservacin de la energa
La primera ley de la termodinmica se puede escribir como una razn de cambio con respecto al tiempo, esto es
dE
dt
=
Q
W (96)
donde
Q = lim
dt0
Q
dt
(97)
26
es la razn de transferencia de calor total del sistema y
W = lim
dt0
W
dt
(98)
es la razn de transferencia de trabajo total hecho por el sistema
Para obtener la primera ley como una ecuacin de la razn de cambio con respecto al tiempo en un volumen del
control procedemos como con la ecuacin conservacin de masa. La idea fsica es que cualquier razn de cambio de
energa en el volumen del control se debe al ujo de energa que entra o sale del volumen de control. La transferencia
de calor y el trabajo estn ya incluidos y cualquier otra contribucin se debe nicamente al ujo msico de entrada y
salida que lleva energa con l . La gura (17) muestra dos diagramas de esta idea. As, la expresin que describe la
razn del cambio de energa en el volumen de control es
(Razn del cambio de energa en el V.C.) =
(Razn de calor agregado al V.C)
(Razn de trabajo realizado)
+ (Razn de ujo de energa que entra al V.C.)
(Razn de ujo de energa que sale del V.C.) (99)
Figure 17: Esqumas de volumen de control para la ecuacon de la energa.
El uido que entra y sale presenta una cantidad de energa por unidad de masa dado por
e = u +
c
2
2
+gz (100)
donde c es la velocidad del uido relativa a un sistema de coordenadas, g es la gravedad y z la altura. Cabe mencionar
que se ha despreciando la energa qumica en el ujo. Adems, siempre que el lquido entre o salga del volumen
del control hay un trmino de trabajo asociado con la entrada o la salida. El ujo msico
m
e
que sale empuja los
alrededores del mismo ujo, haciendo trabajo sobre el medio. El ujo msico que entra
m
i
es empujado hacia el
volumen de control por lo que recibe trabajo de los alrededores. La razn del trabajo a la salida est dado por el
producto de la presin y la razn a del ujo de salida, esto es
dW
flujo
= Pvdm
e
(101)
Al incluir todos los posibles ujos de energa (calor, trabajo a travs de un eje (shaft work), trabajo cortante (shear
work), trabajo por un psiton (psiton work)), la primer ley la podemos escribir como
d
dt
X
E
vc
=
X
Q
vc
+
X
W
shaft
+
X
W
shear
+
X
W
piston
+
X
W
flujo
+
X
m
u +
c
2
2
+gz
(102)
donde
P
incluye los signos asociados con la direccin del ujo de energa. Recordemos la convencin de signos, cuando
se agrega calor al sistema entonces asociamos a ste un signo positivo, si se extrae calor o trabajo desde el sistema
entonces el signo es negativo. Observe que esto es consistente con E = QW, donde W es realizado por el sistema
hacia el ambiente, as que el trabajo se dirige hacia afuera del sistema.
27
Para obtener la entalpa podemos combinar la energa interna especca u, en e y el trmino de ujo de trabajo
especco, Pv, tal que la energa total asociada al ujo msico es
e Pv = u +
c
2
2
+gz +Pv = h +
c
2
2
+gz = h
o
(103)
donde h
o
es denominada como metalpa.
As, la primera ley se puede escribir como
d
dt
X
E
vc
=
X
Q
vc
+
X
W
shaft
+
X
W
shear
+
X
W
piston
+
X
mh
o
(104)
Para las aplicaciones de este curso, no consideraremos el trabajo cortante (shear work) ni el trabajo por un pistn
(psiton work), as que podemos escribir
dE
vc
dt
=
Q
vc
W
shaft
+
m
i
h
i
+
c
2
i
2
+gz
i
m
i
h
e
+
c
2
e
2
+gz
e
(105)
Observe como el uso de la entalpa ha simplicado la razn del trmino del trabajo. Al escribir la ecuacin para
el volumen del control hemos considerado solamente un solo caudal que entraba y una que sale, pero esto se podra
generalizar para cualquier nmero de entradas y salidas.
En el caso especial de un ujo en estado estacionario,
d
dt
= 0 y
m
in
m
out
=
m (106)
As, la ecuacin de la energa para ujo estacionario es
Q
vc
W
vc
=
m
h
e
+
c
2
e
2
+gz
e
h
i
+
c
2
i
2
+gz
i
(107)
la cual tiene unidades de potencia en Joules por segundo. Al dividir por el ujo msico
q
vc
w
vc
=
h
e
+
c
2
e
2
+gz
e
h
i
+
c
2
i
2
+gz
i
(108)
la cual presenta unidades de Joules por segundo por kilogramo.
ACTIVIDADES
1. Describa que se entiende y cmo se distinguen trabajo por un eje (shaft work), trabajo cortante (shear work),
trabajo por un pistn (psiton work).
2. Que se un volumen de control?
3. De ejemplos de volumen de control jo, volumen de control que se desplaza con respecto a un marco de referencia
y volumen de control deformable.
2.5.3 Temperatura de estancamiento y entalpa de estancamiento
Supongamos un volumen de control que incluye un conjunto de lneas de corriente que describen el ujo de uido en
la nariz de un obejo puntiagudo como el que se muestra en la gura ()
Las lneas de corriente son permanentes, as que no existe ningn trabajo externo realizado por el ujo de uido
lquido pues uye. Si no hay tampoco calor transferido al ujo (adibtico), entonces la ecuacin de energa del ujo
estacionario es,
c
p
T
2
+
c
2
2
2
= c
p
T
1
+
c
2
1
2
(109)
o bien
T
2
+
c
2
2
2c
p
= T
1
+
c
2
1
2c
p
(110)
La cantidad que se conserva se dene como la temperatura de estancamiento tal que
T
t
= T +
c
2
2c
p
(111)
28
Figure 18: Lneas de ujo y regin de estancamiento. Un volumen de control se puede especicar entre las lneas
punteadas y los punetos 1 y 2.
Con base en la relacin de los calores especcos y la velocidad del sonido a =
RT podemos escribir
T
t
T
= 1 +
1
2
M
2
(112)
donde M = c/a es el nmero de Mach. La temperatura de estancamiento es la temperatura que el lquido alcanzara
si la velocidad del uido fuera llevada a cero por un proceso adibtico permanente sin trabajo externo. Observamos
que para cualquier ujo estacionario y adibtico sin trabajo externo, la temperatura del estancamiento es constante.
Es tambin conveniente denir la entalpa de estancamiento
h
t
= c
p
T +
c
2
2
(113)
con la cual es posible escribir le ecuacin de la energa de una manera ms simple como
q
12
w
s,12
= h
t2
h
t1
(114)
Note que para un proceso cuasiesttico adiabtico
T
1
T
2
=
P
1
P
2
(115)
as que es fcil deducir que
T
t
T
=
P
t
P
(116)
y denimos la relacin que existe entre la presin de estancamiento y la presin esttica como
P
t
P
=
1 +
1
2
M
2
1
(117)
donde la presin de estancamiento es la que alcanzara el ujo si la velocidad es llevada acabo mediante un proceso
cuasiesttico, adiabtico, permanente y sin transferencia de trabajo.
2.5.4 Ejemplo de una turbina de gas
Consideremos por ejemplo la turbina que se muestra en la gura (19). La turbina est diseada para producir cerca
de 84.000 libras-fuerza de empuje en el despegue. La turbina es de doble tobera como se muestra en la gura. Los
alabes y el compresor de presin baja se mantienen en operacin por la turbina de presin baja. El compresor de alta
presin se mantiene en operacin por la turbina de alta presin. Deseamos encontrar el trabajo total del eje necesario
para mantener en operacin el sistema de compresin.
29
Figure 19: Turbina Pratt and Whitney 4084
f
= razn de presin total a travs de los alabes
c
= razn de presin total a travs de los alabes + el compresor
m
fan
= 610 kg s
1
m
core
= 120 kg s
1
T
inlet
= 300 K
Denimos nuestro volumen del control para abarcar el sistema desde la parte frontal de los alabes hasta el compresor
de alta presin con el eje de transmisin que pasa a travs del volumen de control Si suponemos que la transferencia
de calor debido al ujo de gas es despreciable, escribimos la primera ley (ecuacin de la energa del ujo constante)
como:
W
s
=
m(h
t2
h
t1
) (118)
en este problema debemos considerar dos ujos, el ujo en los alabes
m
f
y el ujo interior de la turbina
m
core
W
s
=
m
fan
h
t,fan
+
m
core
h
t,core
=
m
fan
c
p
T
t,fan
+
m
core
T
t,core
(119)
Obtenemos el cambio de temperatura suponiendo un proceso de compresin cuasiesttico y adiabtico tal que
T
2
T
1
=
P
2
P
1
(120)
entonces, podemos conocer
T
t,2
T
t,1
fan
=
1
fan
= 1.1 =T
t,fan
= 30K (121)
T
t,2
T
t,1
core
=
1
core
= 1.1 =T
t,core
= 600K (122)
30
sustituyendo dichos valores en la ecuacin antedicha, junto con el valor de c
p
, obtenemos que
W
s
=
610 kg s
1
1008 J kg
1
K
1
(30 K) +
120 kg s
1
1008 J kg
1
K
1
(600 K)
= 91 10
6
J s
1
W
s
= 91 MW el signo negativo implica trabajo realizado sobre el uido
Observe que 1 hp = 745 W. Si un motor de automvil tienen aproximadamente 110 hp = 8.2 10
4
W, entonces la
energa necesaria para operar el compresor es equivalente a la producida por 1,100 automviles.
2.6 Los puntos complicados del captulo 2
1. Cul es la convencin para trabajo y calor en la primera ley?
El calor es positivo si se otorga al sistema. El trabajo es positivo se este es hecho o realizado por el sistema.
2. Cundo ocurre que E U ?
Cuando los cambios de otros tipos de energa (cintica, potencial, tensin, etc.) se pueden despreciar comparados
con los cambios en la energa interna, entonces se tiene como una buena aproximacin utilizar U como representacin
del cambio total de energa en el sistema.
3. Por qu en el llenado de un tanque la temperatura nal en el tanque es mayor que la temperatura inicial?
Ya que se realiza trabajo sobre el sistema y por tanto cambia la energa interna.
4. Cuando la entalpa inicial es la misma que la entalpa nal?
Las entalpas de estancamiento iniciales y nales son iguales si el ujo es estacionario y si no hay trabajo neto a
travs de un eje y transferencia de calor. Si el cambio en la energa cintica es despreciable, la entalpa inicial y nal
son la misma.
5. Qu es trabajo de eje (shaft work)?
Existen varios
Hay varias forma en un proceso que producen (o absorbe) trabajo de eje o trabajo hecho por una echa. Primero,
todo lo concerniente al proceso es visto en un volumen de control, ms que una masa de control. Segundo, es necesario
que haya un eje o dispositivo equivalente que sea identicado como el que transere el trabajo. Tercero, el trabajo de
eje es
Tercero, el trabajo de eje se encuentra en la frontera del sistema y es el ujo de trabajo hecho o recibido por el
sistema por los ujos de entrada y salida.
6. Qu distingue el trabajo de eje de otros trabajos?
El trmino trabajo de eje implica utilizar la aproximacin del volumen de control. Como lo hemos denido, el
trabajo de eje es todo aquel trabajo asociado con trabajo del ujo (trabajo hecho por las fuerzas de presin). El
signicado general de este tipo de trabajo es el que realiza una maquinaria rotatoria, que llevada por un eje el trabajo
hacia al mundo exterior afuera del volumen del control Podra tambin haber trabajo por la fuerza en la presin,
trabajo realizado por esfuerzos cortantes en las fronteras del volumen de control, pero este rara vez es importante si
la frontera del control es normal a la direccin del ujo.
Si consideramos un sistema (una masa de identidad ja, digamos una burbuja del gas) atravesando algn dispositivo,
despreciando los efectos de otacin, el nico modo del trabajo sera el trabajo para comprimir la burbuja. Esto sera
cierto inclusive si la burbuja pasa a travs de una turbina o un compresor.
7. Qu es un volumen de control?
Un volumen de control es un connamiento que separa una cantidad de materia de sus alrededores o medio
ambiente y nos permite denir un sistema termodinmico. El connamiento no necesariamente tiene que coincidir con
una frontera slida como las paredes del dispositivo. Slo se requiere que el connamiento forme una supercie cerrada
y dicha supercie se tratada matemticamente ya que no contiene materia ni volumen. El volumen de control puede
tener movimiento inclusive ser deformable. Una vez denido el volumen de control podemos suponer caractersticas
que denen sistemas aislados, cerrados o abiertos con fronteras adiabticas (que no permiten la interaccin mediante
efectos no mecnicos como calor) o fronteras diatrmicas (que son aquellas que no son adiabticas)
8. Cul es la diferencia entre entalpa y entalpa de estancamiento?
Como hemos visto la entalpa de un gas se dene como
h = u +Pv = u +p/
y representa tanto la energa interna del estado del sistema como el trabajo hecho en el gas para establecerlo a cierta
presin y densidad. La entalpa de estancamiento de un gas se dene como
h
t
= h +c
2
/2
31
y esta cuantica tanto la entalpa como la energa cintica del gas a ese estado.
2.7 Temperatura crtica y presin crtica
La manera obvia de cambiar a un gas en un lquido es enfriarlo a una temperatura por debajo de su punto de ebullicin.
Hay otra manera de condensar un gas para formar un lquido, sin embargo, implica aumentar la presin en el gas. Los
lquidos hierven a la temperatura a la cual la presin del vapor es igual a la presin del lquido con sus alrededores.
Elevar la presin en un gas por lo tanto aumenta con ecacia el punto de ebullicin del lquido.
Suponga que tenemos vapor de agua (o vapor) en un envase cerrado a 120
C y 1 atmsfera de presin. Puesto
que la temperatura del sistema est sobre el punto de ebullicin del agua, no hay razn para que el vapor condense
para formar un lquido. Nada sucede hasta que comprimimos lentamente el envase de tal modo que se eleva la presin
del gas hasta que la presin alcanza 2 atmsferas. En este punto, el sistema est en el punto de ebullicin en el que
hierve el agua y algo del gas se condensar para formar un lquido. Tan pronto como la presin en el gas exceda 2
atmsferas, la presin del vapor del agua a 120
C no es lo bastante grande para que el lquido hierva. El gas por lo
tanto condensa para formar un lquido, como se indica en la gura 20.
Figure 20: Mezcla saturada lquido-vapor
En teora, deberamos poder predecir la presin a la cual un gas condensa a una temperatura dada consultando un
diagrama de presin del vapor contra temperatura . En la prctica, cada compuesto tiene una temperatura crtica
(T
c
). Si la temperatura del gas est sobre la temperatura crtica, el gas no se puede condensar, sin importar la presin
aplicada.
La existencia de una temperatura crtica fue descubierta por Thomas Andrews en 1869 mientras que estudiaba
el efecto de la temperatura y de la presin en el comportamiento del bixido de carbono. Andrews encontr que l
podra condensar el gas del CO
2
en un lquido elevando la presin en el gas, mientras l mantuvo la temperatura por
debajo de 31.0
C. A esta temperatura se requiere de una presin de 72.85 atmsferas para licuefacer el gas de CO
2
.
Andrews encontr que era imposible convertir gas de CO
2
en lquido por encima de esta temperatura, no importaba
que tanta presin se aplicara.
Los gases no se pueden licuefacer a temperaturas por encima de la temperatura crtica porque en este punto las
caractersticas de los gases y de los lquidos son las mismas, y no hay base sobre la cual distinguir entre los gases y los
lquidos. La presin del vapor de un lquido a la temperatura crtica se llama la presin crtica (P
c
). La presin del
vapor de un lquido nunca es ms grande que esta presin crtica.
Las temperaturas crticas, las presiones crticas, y los puntos ebullicin de varios gases se escriben en la tabla 1.
Hay una correlacin obvia entre la temperatura crtica y el punto de ebullicin de estos gases. Estas propiedades estn
relacionadas porque ambas son medidas indirectas de la fuerza de atraccin entre las partculas en la fase gaseosa.
Los valores experimentales de la temperatura y de la presin crticas de una sustancia se pueden calcular al utilizar
las constantes de a y de b en la ecuacin de van der Waals.
P +
an
2
V
2
(V nb) = nRT (123)
donde las constantes a y b se pueden calcular a partir de sus puntos crticos de temperatura y presin (ver problema
32
Gas T
c
(
C) P
c
(
atm) P. de Ebullicin (
C)
He -267.96 2.261 -268.94
H
2
-240.17 12.77 -252.76
Ne -228.71 26.86 -246.1
N
2
-146.89 33.54 -195.81
CO -140.23 34.53 -191.49
Ar -122.44 48.00 -185.87
O
2
-118.38 50.14 -182.96
CH
4
-82.6 45.44 -161.49
CO
2
31.04 72.85 -78.44
NH
3
132.4 111.3 -33.42
Cl
2
144.0 78.1 -34.03
Table 1: Temperatura y presin crtica y punto de ebullici de gases comunes.
2):
a =
27R
2
T
2
c
64P
c
(124)
b =
RT
c
8P
c
(125)
2.8 Diagramas de fase
La gura 21 muestra un ejemplo de un diagrama de fase, que resume el efecto de la temperatura y de la presin
en una sustancia en un recipiente cerrado. Cada punto en este diagrama representa una combinacin posible de la
temperatura y de la presin para el sistema. El diagrama se divide en tres reas, que representan los estados slidos,
lquidos, y gaseosos de la sustancia.
Figure 21: Diagrama de fase
La mejor manera de recordar qu rea corresponde a cada uno de estos estados es recordar las condiciones de
temperatura y de presin que son ms probables de ser asociados a un slido, a un lquido, y a un gas. Las bajas
temperaturas y las altas presiones favorecen la formacin de un slido. Los gases, por otra parte, son ms probable
de ser encontrados a altas temperaturas y presiones bajas. Los lquidos se mienten entre estos extremos.
Podemos por lo tanto probar si se ha etiquetado correctamente un diagrama de fase dibujando una lnea de izquierda
a derecha a travs de la parte ms alta del diagrama, que corresponde a un aumento en la temperatura del sistema
33
a presin constante. Cuando un slido se calienta a presin constante, se derrite para formar un lquido, que hierve
eventualmente para formar un gas.
Los diagramas de fase se pueden utilizar en varias maneras. Podemos centrarnos en las regiones separadas por
las lneas en estos diagramas, y conseguimos una cierta idea de las condiciones de temperatura y de presin que son
ms probables para producir un gas, un lquido, o un slido. Podemos tambin centrarnos en las lneas que dividen el
diagrama en los estados, que representan las combinaciones de la temperatura y de la presin en las culaes se tienen
estados en equilibrio.
Los puntos a lo largo de la lnea que conecta A y B en el diagrama de fase en la gura 21 representan todas las
combinaciones de temperatura y de presin a las culaes el slido est en equilibrio con el gas. A estas temperaturas y
presiones, la tasa a la cual el slido sublima para formar un gas es igual a la tasa a la cual el gas condensa para formar
un slido.
A lo largo de lnea AB: Razn a la que el slido sublima para formar un gas = razn a la que un gas se
condensa para formar un slido.
La lnea entre los puntos B y C es idntica con el diagrama de la dependencia de la temperatura a la presin del
vapor del lquido. Contiene todas las combinaciones de temperatura y de presin a las culaes el lquido hierve. En
cada punto a lo largo de esta lnea, el lquido hierve para formar un gas y el gas condensa para formar un lquido.
A lo largo de la lnea BC: Razn a la cual un lquido hierve para formar un gas = razn a la cual un gas
condensa para formar un lquido
La lnea entre los puntos B y D contiene las combinaciones de temperatura y de presin a las culaes el slido y el
lquido estn en equilibrio. En cada punto a lo largo de esta lnea, el slido se derrite en la misma razn con la cual
el lquido se congela.
A lo largo de lnea de BD: Razn en la cual un slido se funde para formar un lquido = razn a la cual un
lquido se congela para formar un slido.
La lnea de BD es casi vertical porque el punto de fusin de un slido no es muy sensible a los cambios en la
presin. Para la mayora de los compuestos, esta lnea presenta una pendiente positiva pequea, segn lo muestra la
gura 21. Debe tenerse en mente que la pendiente de esta lnea es levemente negativa para el caso particular del agua.
Consecuentemente, el agua se puede derretir a temperaturas cercanas a su punto de congelacin cuando est sujetada
a presin. La facilidad con la cual los patinadores del hielo se deslizan a travs de una lago congelado se puede explicar
por el hecho de que la presin ejercida por sus patines derrite una porcin pequea del hielo y se forma una supercie
lquida entre el hielo y sus patines.
El punto B en este diagrama de fase representa la nica combinacin de temperatura y de presin a la cual una
sustancia pura puede existir simultneamente como un slido, un lquido, y gas. Por lo tanto se llama el punto triple
de la sustancia, y se representa por un nico punto en el diagrama de fase en el cual los tres estados estn en equilibrio.
El punto C es el punto crtico de la sustancia, que es la temperatura y la presin ms altas a la cual un gas y un
lquido pueden coexistir en el equilibrio.
La gura 22 muestra que sucede cuando dibujamos una lnea horizontal a travs de un diagrama de fase a una
presin de exactamente de 1 atmsfera. Esta lnea cruza la lnea entre los puntos B y D en el punto de fusin de la
sustancia porque los slidos derriten normalmente a la temperatura a la cual el slido y el lquido estn en equilibrio
a la presin de una atmsfera. La lnea cruza la lnea entre los puntos B y C en el punto de ebullicin de la sustancia
porque en este punto el lquido y el gas estn en equilibrio.
3 La primera ley aplicada a los ciclos en ingeniera termodinmica
En los siguintes secciones nos dedicamos a describir los fundamentos de varias mquinas trmicas. Una mquina
trmica es un dispositivo que utiliza calor para producir trabajo, o bien , utiliza trabajo para remover calor de un
espacio a otro. Los refrigeradores, los motores de combustin interna (los de automvil), y los motores de jet son todos
mquinas.trmicas Modelaremos estos muinas trmicas como ciclos termodinmicos y aplicaremos la primera ley de
la termodinmica para estimar la eciencia trmicas y el trabajo realizado en funcin de las presiones y temperaturas
en diferentes puntos del ciclo. A esto se le denomina anlisis del ciclo ideal. Las estimaciones que obtenemos de dicho
anlisis representan el mejor funcionamiento realizable y que se puede obtener de una mquina trmica. En mquinas
reales el funcionamiento sermenor que las estimaciones obtenidas bajo el anlisis del ciclo ideal..
34
Figure 22: Diagrama de fase a una atmosfera de presin.
Nuestros anlisis utilizarn el ciclo aire-estndar, que es una aproximacin al comportamiento real del ciclo.
Especcamente, hacemos las simplicaciones siguientes:
El aire es el uido de funcionamiento (la presencia de los productos de la combustin y el combustible son despre-
sibles)
La combustin se representa por la transferencia de calor de una fuente de calor externa
El ciclo se completa por la transfeencia de calor hacia los alrededores
Todos los procesos son internamente reversibles (descrito ms adelante en captulos posteriores)
El aire es un gas perfecto con caor especco constante.
3.1 Algunas propiedades de los ciclos en ingeniera; trabajo y eciencia
Como preparacin para nuestra discusin de ciclos (y como breve intruduccin de la segunda ley), examinamos dos
tipos de procesos que se reeren a interacciones entre el calor y el trabajo. El primer de stos representa la conversin
del trabajo en calor. El segundo, que es mucho ms til, se reere a la conversin del calor en trabajo. La pregunta
es qu tan eciente pueden ser la conversin de energa para los dos casos antedichos?.
Figure 23: Ejemplos de connversin de trabajo a calor.
En la gura (23) se musetran tres ejemplos del primer proceso, transformacin de trabajo en calor. El primer caso
muestra un bloque es que arrastrado sobre una supercie horizontal spera por una fuerza y esta hace que se mueve
el bloque una cierta distancia. Es claro que la friccin se opone a la fuerza que lo arrastra. Despus de que la fuerza
que jala el bloque desaparece, la friccin tambin desaparece. Entonces no exitste energa cintica y se tiene la misma
energa potencial que se tena al comeinzo. Si midiramos la temperatura del bloque y de la supercie encontraramos
que la temapertatura se incremento debido al arastre del bloque sobre la superce rugosa. El trabajo trabajo realizado
para mover el bloque se ha convertido totalmente al calor.
35
El segundo ejemplo se reere a agitar un lquido viscoso. Hay trabajo asociado con el torque trasnferido por la
rotacin del eje Cunado la agitacin se detiene, el uido llega al reposo y no hay cambio en la energa cintica o
potencial con respecto al estdo inicial Sin embargo, el uido y las paletas de agitacin se encuentran con mayor
temperatura que al inicio.
El ejemplo nal es el paso de una corriente por una resistencia. ste es el caso de trabajo elctrico que se transform
en calor, como ocurre en la operacin de un calentador elctrico.
Todos los ejemplos anteriores tienen una conversin del 100% de trabajo en calor. Esta conversin del 100% pude
llevarse a cabo sin lmite mientras se provea de trabajo al sistema, pero Esto tembin ocurre para la conversin del
calor en trabajo?, es decir, Es posible transformar el 100% del calor en trabajo?
Para contestar la pregunta anterior, necesitamos tener cierta base para juzgar si el trabajo se realiz en un proceso
dado. Una forma para hacer esto es preguntar si podemos construir o hecer, de alguna manera, que el proceso pueda
permitirnos levantar un peso en un campo gravitacional. Si es as, podemos decir que se ha rrealizado trabajo. A
veces puede ser difcil hacer el acoplamiento entre un proceso termodinmico complicado y levantar simplemente un
peso, pero esto es una prueba rigurosa para la existencia de trabajo.
Un ejemplo de un proceso en el cual el calor se transforma en trabajo es la expansin isotrmica (a temperatura
constante) de un gas ideal, como se muestra en la gura (24) . El sistema es un gas dentro dentro de una cmara.
Mientras que el gas se expande, el pistn realiza trabajo en algn dispositivo externo. Para un gas ideal, la energa
interna es nicamente funcin de la temperatura, de modo que si la temperatura es constante para un cierto proceso el
cambio de la energa interna ser cero. Para mantener la temperatura constante durante la extensin, se debe proveer
calor ya que U = 0 la primera ley toma la forma Q = W Este es un proceso que tiene conversin 100% del
calor en trabajo.
Figure 24: Expansin Isotrmica
El trabajo realizado por el sistema est dado por
W =
Z
2
1
PdV (126)
donde 1 y 2 representan los dos estados, al principio y al nal del proceso. A partir de la ecuacin de estado para un
gas ideal, que esta dada por
P =
NRT
V
(127)
donde N es el nmero de moles del gas contenido en la cmara, podemos escribir una expresin para el trabajo de
expansin isotrmica
W = NRT
Z
2
1
DV
V
= NRT
V
2
V
1
(128)
Para un proceso isotrmico, PV = cte, as que P
1
/P
2
= V
2
/V
1
. El trabajo se puede reescribir en terminos de las
presiones inical y nal como
W = NRT
P
1
P
2
(129)
La presin ms baja a la cual llegar la expancin y recibir an trabajo del sistema es la presin atmosfrica. Debajo
de sta, tendramos que realizar trabajo sobre el sistema para continuar el desplazamiento del pistn. Existe un lmite
en la cantidad de trabajo que se puede obtener de la extensin isotrmica; no podemos continuar indenidamente. Para
un sistema de potencia o un sistema de la propulsin, sin embargo, quisiramos una fuente de potencia continua, es
decir un dispositivo que entrege potencia o propulsin mientras se grega energa ya sea como algn tipo de combustible
o bien energa solar. Para hacer esto, necesitamos una serie de procesos donde el sistema no recorre una transicin
unidireccional de un estado inicial a un estado nal, sino que se completa un ciclo para llegar de nuevo al estado inicial.
Que es de hecho lo que se busca en un ciclo termodinmico para el sistema.
36
Denimos varias cantidades para un ciclo:
Q
A
es el calor absorbido por el sistema.
Q
R
es el calor expelido o menado desde el sistema.
W es el trabajo neto realizado por el sistema.
El ciclo vuelve a su estado inicial, as que el cambio total de la energa U, es cero. El trabajo neto hecho por el
sistema se relaciona con las magnitudes del calor absorbido y expelido, tal que
W
net
= Q
A
Q
R
(130)
La ecacia trmica del ciclo se dene como el cociente del trabajo neto realizadocon respecto al calor absorbido.
(La manara coloquila de ver una eciencia es a menudo "qu obtienes" en relacin con "qu inviertes o que pagas.
Aqu lo que conseguimos es trabajo y pagamos con calor). La eciencia trmica en trminos del trabajo neto y el calor
absorbido es entonces:
th
=
Trabajo neto
Calor absorbido
=
Q
A
Q
R
Q
A
= 1
Q
R
Q
A
(131)
Debe quedar claro que la eciencia trmica solamente puede ser 100% (conversin completa de calor) si Q
R
= 0.
Surge entonces la pregunta bsica en la termodinmica Cul es la eciencia mxima pra cualquier ciclo arbitrario?
Exminaremos esto pra varios casos, incluyendo desde luego los ciclos de Carnot y el de Brayton (o Joule).
3.2 Representacin generalizada de ciclos termodinmicos
Antes de que examinemos las mquinas trmicas individuales, observamos que todas las mquinas trmicas se pueden
representar generalmente como la transferencia del calor desde un depsito de alta temperatura hacia un dispositivo
que realiza trabajo sobre los alrededores, seguido por una expelidad o emanacin de calor del dispositivo hacia un
depsito de baja temperatura como se indica en la gura
Figure 25: Generalizacin de una mquina trmica
3.3 El ciclo de Carnot
Un ciclo de Carnot semuestra en gura (26). ste presenta cuatro procesos. Hay dos ramas reversibles adibticas y
dos ramas reversibles isotrmicas. Podemos construir un ciclo de Carnot con diversos sistemas, pero los conceptos se
pueden demostrar usando un uido de trabajo familiar, el gas ideal. El sistema se puede considerar como una camara
cerrada por un pistn que est llena de este gas ideal.
Los cuatro procesos en el ciclo de Carnot son:
1. El sistema est en la temperatura T
2
en el estado a ste est en contacto con un depsito del calor, que es justo
una masa lo bastante grande tal que su temperatura no cambia apreciablemente cuando una cierta cantidad de calor
se transere hacia el sistema. Es decir el depsito del calor es una fuente constante de la temperatura o recervorio del
calor. El sistema entonces experimenta una extensin isotrmica de a a b, con una cantidad de calor absorbido Q
2
.
2. En el estado b, el sistema se asla termicamante (y se remueve del contacto con el reservorio de calor) y entonces
se expande hasta c.. Durante esta expansin la temperatura disminuye a T
1
. El itercammbio de calor durante esta
parte del ciclo es Q
bc
= 0.
37
Figure 26: Ciclo de Carnot
3. En el estado c el sistema se pone en contacto con un reservorio de calor a temperatura T
1
Entonces el gas se
comprime hasta el estado d, expeliendo calos Q
1
en el proceso.
4. Finalmente, el sistema se comprime adibticamente de nuevo hasta el estado inicial a El intercambio de calor
Q
da
= 0.
La ecacia termica del ciclo est dada por la denicin
th
= 1
Q
R
Q
A
= 1 +
Q
1
Q
2
(132)
En esta ecuacin, hay una convencin de signos implicada. Las cantidades Q
A
y Q
R
son denidas como las
magnitudes del calor absorbido y expelido, respectivamante. Mientras que por otro lado, las cantidades Q
1
y Q
2
se
denen con referencia al calor recibido por el sistema. En este ejemplo, Q
1
es negativo y Q
2
es positivo. El calor
absorbido y rechazado por el sistema ocurre durante procesos isotrmicos y con base en sus valores descritos en las
secciones anteriores escribimos:
Q
2
= W
ab
= NRT
2
[ln
V
b
V
a
] (133)
y
Q
1
= W
cd
= NRT
1
[ln
V
d
V
c
] (134)
donde Q
1
es negativo a partir de que ln(V
d
/V
c
) = ln(V
c
/V
d
) .
Entonces la eciencia se peude escribir en trminos de los volumenes a diferentes estados
= 1 +
T
1
ln(V
d
/V
c
)
T
2
ln(V
b
/V
a
)
(135)
La trayectoria de el estados b hasta c y desde a hasta d es reversible y adibtica. Para un proceso adibtico
reversible sabemos que PV
= cte. Utilizando la ecuacin de estado del gas ideal, tenemos TV
1
= cte. A lo largo
de curva b c, por lo tanto, T
2
V
1
b
= T
1
V
1
c
. Mientras que a lo largo de la curva d a, T
2
V
1
a
= T
1
V
1
d
. As,
V
d
V
c
1
=
(T
2
/T
1
)
(T
2
/T
1
)
V
a
V
b
V
d
V
c
1
=
V
a
V
b
1
V
d
V
c
=
V
a
V
b
(136)
Al comparar la expresin para la eciencia trmica con esta ltima relacin muestra dos consecuencias. Primero,
el calor recibido y expelido estn relacionados con las temperaturas de las partes isotrmicas del ciclo por
Q
1
T
1
+
Q
2
T
2
= 0 (137)
lo que implica que
Q
1
Q
2
=
T
1
T
2
(138)
38
Segundo, la eciencia de del ciclo de Carnot est dada de manera compacta entonces por
= 1
T
1
T
2
(139)
La eciencia puede ser 100% para un ciclo solamente si la temperatura en la cual se expele el calor es cero.
Las transferencias del calor y la produccin de trabajo en un sistema se muestran esquemticamente en la gura
ACTIVIDADES
Figure 27: Trabajo y trasferencia de calor en un ciclo de Carnot entre dos reservorios decalor donde T
2
> T
1
.
1. Ya que = 1 T
1
/T
2
, si observamos el diagrama P V, signica que apartar las isotrmas T
1
y T
2
incremeta
la eciencia, mientras que acercarlas implica reducir la eciencia. Es verdad estos dos argumentos?
2. En el ciclo de Carnot, por qu slo se considera los cambios en el volumen y no en la presin en las adiabticas
y en las isotrmicas?
3. Existe alguna aplicacin fsica real para el ciclo de Carnot? es decir, Se podra disear una mquina trmica
real?
4. Cmo determinamos cuales ciclos utilizar como modelos para procesos reales?
3.4 Refrigeradores y bombas de calor
Hemos analizado el ciclo de Carnot aplicado a la obtencin de trabajo, pero podemos tambin hacer que ste funcione
al revs. As, si ahora hay trabajo neto sobre el sistema se tendr calor neto saliendo del sistema. Habr una cantidad
de calor Q
2
expelida en el reservorio de calor de la temperatura ms alta y una cantidad de calor Q
1
absorbida en el
reservorio de calor de la temperatura ms baja. El primero de estos es negativo segn nuestra convencin de signos
y el ltimo es entonces positivo. El resultado es que el trabajo neto realizado en el sistema, permite al calor que se
extrae de la fuente de baja temperatura sea expelido por el sistema a un reservorio de alta temperatura. El ciclo y
las transferencias de calor y de trabajo se indican en la gura (). En este modo de operacin el ciclo trabaja como
un refrigerador o bomba de calor. Ya que pagamos con el trabajo, y conseguimos una cantidad de calor extrada,
.una mtrica para los dispositivos de este tipo es el coeciente de funcionamiento (coecient of performance, cop),
denido como
COP =
Q
1
W
=
Q
1
(Q
1
+Q
2
)
(140)
Para un ciclo de Carnot conocemos los cocientes entre calor que entra y el calor que sale cuando el ciclo est
operando y ya que el ciclo es reversibles, estos cocientes son iguales cuando el ciclo funciona al revs El coeciente de
funcionamiento se da as en trminos de temperaturas absolutas como
COP =
T
1
T
2
T
1
y este pude ser ms grande que la unidad.
Los ciclos de Carnot que han sido expuestos se basan en el comportamiento del gas ideal. La eciencia del ciclo de
Carnot es independiente del tipo de uido de operacin como veremos posteriormente.
39
Figure 28: Operacin de un refrigerador de Carnot
3.5 El motor de combustin interna (ciclo de Otto)
El ciclo de Otto es un conjunto de procesos usado por los motores de combustin interna (2-tiempos o 4-tiempos).
Estos motores a) admiten una mezcla de combustible y aire, b) que es comprimida c) para que esta pueda reaccionar
con ecacia a la adicin de calor, as que la energa qumica de la mezcla se pueda transformar en energa trmica,
d) y mediante la expansin de los productos de la combustin se produzca movimiento, y posteriormente e) los gases
exhaustos de la combustin se expulsan y posteriormente se substituyen por una nueva mezcla de combustible y aire.
Los diversos procesos se demuestran en la gura ()
Otto.gif
Figure 29: Ciclo idel de Otto
1. Admisin de la mezcla vapor de la gasolina y aire dentro del motor ( 5 1).
2. Compresin de la mezcla, P y T se incrementan ( 1 2).
3. Combustin (chispa), tiempo muy corto, esencialmente el volumen permanece constante (2 3). Modelo: el
calor absorbido de una serie de reservorios a temperaturas T
2
a T
3
.
4. Expansin (3 4).
5. Vlvula de escape: la vlvula se abre, los gases escapan.
6. (4 1) Modelo: calor expelido como una serie de reservorios a temperaturas T
4
a T
1
.
7.Los gases exhaustos productos de la combustin son expulsados (1 5).
En la gura (30) se presenta esquemticamente un ciclo Otto real donde se observa como se desvirtan las trayec-
torias en los diferentes procesos.
Modelamos los procesos como todos actuando con una masa ja de aire contenida por el cilindro y el pistn como
se muestra en la gura ()
40
Otto.gif
Figure 30: Esquema del ciclo Otto real
Figure 31: Pistn y valvulas en una mquina de combustin de cuatro tiempos
3.5.1 Eciencia de un ciclo de Otto ideal
El punto de partida es la expresin general para la eciencia trmica de un ciclo:
=
trabajo
calor de entrada
=
Q
H
+Q
L
Q
H
= 1 +
Q
L
Q
H
(141)
La convencin, previamente establecida, es que el intercambio de calor es positivo si el calor uye hacia el sistema o la
mquina, as que Q
L
es negativo por obvias razones. El calor absorbido ocurre durante la combustin cuando ocurre
la chispa, rigurosamente a volumen constante. El calor absorbido se puede relacionar con el cambio de temperatura
desde el estado 2 hasta el estado 3como:
Q
H
= Q
23
= U
23
(W
23
= 0) (142)
o bien en trminos de la capacidad calorca a volumen constante
Q
23
=
Z
T
3
T
2
C
v
dT = C
v
(T
3
T
2
) (143)
El calor expelido est dado por (para un gas perfecto con calor especco constante)
Q
L
= Q
41
= U
41
= C
v
(T
1
T
4
) (144)
41
Al sustituir la expresin para el calor absorbido y expelido en la expresin para la eciencia trmica se obtiene
= 1
T
4
T
1
T
3
T
2
(145)
Ms an, podemos simplicar dicha expresin usando el hecho que los procesos de 1 a 2 y de 3 a 4 son procesos
isentrpicos (se ver ms adelante en lo relacionado con la Segunda Ley de la Termodinmica)
T
4
V
1
1
= T
3
V
1
2
T
1
V
1
1
= T
2
V
1
2
(146)
y
(T
4
T
1
) V
1
1
= (T
3
T
2
) V
1
2
(147)
tal que
T
4
T
1
T
3
T
2
=
V
2
V
1
1
(148)
la cantidad V
1
/V
2
= r se denomina relacin de compresin. La eciencia del ciclo Otto ideal se puede escribir entonces
como
Otto
= 1
1
(V
2
/V
1
)
1
= 1
1
r
(1)
(149)
En la gura (32) se muestra la eciencia del ciclo Otto ideal como funcin de la relacin de compresin
Figure 32: Eciencia thermica del ciclo Otto ideal
Si la relacin de compresin r aumenta, se incrementa la eciencia
Otto
del ciclo, por ende el incremento de T
2
.
Si T
2
es demasiado grande se presenta un encendido prematuro del combustible, denominado autoencendido, el cul
produce un ruido audible, que recibe el nombre de golpeteo de la mquina. Cabe sealar que el encendido de las
mquinas de chispa no debe tolerarse ya que perjudica el desempeo del ciclo y pude daar los componentes de la
mquina. Por lo anterior existe un lmite superior jado por la razn de compresin para las mquinas de combustin
interna activadas por encendido de chispa debido al autoencendido.
3.5.2 Trabajo de una mquina, ndice o razn de trabajo por unidad de ujo de entalpa
El cociente adimensional del trabajo realizado por unidad de tiempo (potencia) y el ujo de entalpa a travs de la
mquina est dado por
Potencia
Flujo de entalpa
=
mC
p
T
1
=
Q
23
Otto
mC
p
T
1
(150)
Comnmente se desea aumentar esta cantidad, porque signica una mquina ms pequea para la misma energa.
El calor de entrada est dado por
Q
23
=
m
fuel
h
fuel
(151)
donde h
fuel
es el calor de reaccin, es decir, la energa liberada por unidad de masa del combustible y
m
fuel
es razn
del ujo de combustible.
42
La potencia adimensional se escribe entonces como
mC
p
T
1
=
m
fuel
h
fuel
mC
p
T
1
1
1
r
(1)
(152)
Las cantidades de est ecuacin, evaluadas en condiciones estequeomtricas son
m
fuel
m
1
15
(153)
h
fuel
C
p
T
1
4 10
7
10
3
288
(154)
as que podemos escribir
mC
p
T
1
9
1
1
r
(1)
(155)
3.6 Ciclo Diesel
En el ciclo Diesel la mquina trmica presenta un encendido por compresin. El combustible se esparce dentro del
cilindro a una presin alta P
2
cuando la compresin se completa, y hay ignicin sin la necesidad de una chispa. Un
ciclo idealizado de la mquina Diesel se muestra en la gura (33)
Figure 33: Ciclo ideal Diesel.
La eciencia trmica de esta mquina est dada por
Diesel
= 1 +
Q
L
Q
H
= 1 +
C
v
(T
1
T
4
)
C
p
(T
3
T
2
)
= 1
T
1
(T
4
/T
1
1)
T
2
(T
3
/T2 1)
(156)
Ahora se dene una nueva cantidad, la relacin de corte de admisin r
c
como la relacin de los volmenes del
cilindro despus y antes del proceso de combustin
r
c
=
V
3
V
2
(157)
Con esta denicin y las relaciones de gas ideal isentrpicas para los procesos 12 y 34, la relacin del eciencia
trmica se puede escribir como
Diesel
= 1
1
r
(1)
"
r
(1)
c
(r
c
1)
#
(158)
Se puede notar que la eciencia del ciclo Diesel diere de la eciencia del ciclo Otto por la cantidad entre parntesis
cuadrados. Esta cantidad siempre es mayor que 1, por tanto
Otto
>
Diesel
(159)
43
cuando ambos ciclos operan en la misma relacin de compresin. Tambin cuando la relacin de corte disminuye
la eciencia del ciclo Diesel aumenta. En el caso lmite cuando r
c
tiende a la unidad, la cantidad entre parntesis
cuadrado es la unidad y las eciencias de los ciclos Otto y Diesel son iguales. Recuerde, sin embargo, que las mquinas
Diesel operan a relaciones de compresin ms altas, por lo que suelen ser ms ecientes que las mquinas encendidas
por chispa (gasolina). Las mquinas Diesel tambin queman el combustible de manera ms completa, porque suelen
operar a menores revoluciones por minuto que las mquinas de encendido por chispa. Las eciencias trmicas de los
motores Diesel van de 35 a 40% mientras que los motores con encendido de chipa varan entre 25 y 30%.
3.7 Ciclo de Brayton: El ciclo ideal para las mquinas de turbina de gas
El ciclo Brayton representa la operacin una turbina de gas El ciclo consiste de cuatro procesos como se indica en la
gura ().
Figure 34: Ciclo ideal Brayton
a b. Compresin adiabtica reversible (comprensin isentrpica) en el compresor.
b c Adicin de calor a presin constante.
c d Expansin adiabtica reversible (expansin isentrpica) en la turbina.
d a Calor expelido a presin constante.
En la prctica los ciclos reales Brayton toman una de las siguientes conguraciones: ciclo abierto como se muestra
en la gura (35) o bien ciclo cerrado como se muestra en la gura (36)
Figure 35: Conguracin de ciclo Brayton abierto
3.7.1 Trabajo y eciencia del ciclo Brayton
Los cuatro procesos del ciclo Brayton se ejecutan en dispositivos de ujo permanente y de esa manera se deben analizar.
Si se ignoran los cambios en la energa potencial y cintica, la ecuacin por Primera Ley de la. Termodinmica para
ujo permanente se puede expresar por unidad de masa como
(q
in
q
out
) + (w
in
w
out
) = h
out
h
in
(160)
44
Figure 36: Conguracin ciclo Brayton cerrado
Por lo tanto, la transferencia de calor hacia y del ujo de trabajo es
q
in
= (h
c
h
b
) = C
p
(T
c
T
b
) (161)
y
q
out
= (h
4
h
a
) = C
p
(T
4
T
a
) (162)
En este caso la eciencia del ciclo Brayton ideal la podemos escribir como
Brayton
=
W
neto
q
in
= 1
q
out
q
in
= 1
C
p
(T
4
T
a
)
C
p
(T
c
T
b
)
=
T
a
(T
4
/T
a
1)
T
b
(T
c
/T
b
1)
(163)
los procesos a b y c d son isentrpicos y P
b
= P
c
y P
d
= P
a
. Por tanto podemos escribir
T
b
T
a
=
P
b
P
a
=
P
c
P
d
=
T
c
T
d
(164)
Si se sustituyen estas relaciones en la ecuacin de la eciencia es fcil mostrar que
Brayton
= 1
1
r
(1)/r
p
(165)
donde
r
p
=
P
b
P
a
(166)
es la relacin de presiones y es la relacin de calores especcos.
Si consideramos la razn de temperatura a travs del compresor T
b
/T
a
= T
R
podemos escribir la eciencia de
manera simple como
Brayton
= 1
T
a
T
b
= 1
1
T
R
(167)
3.7.2 Tecnologa y termodinmica de la turbina de gas
La temperatura de entrada a la turbina T
c
, se jada por la tecnologa de materiales y el costo de stos. Para un dado
nivel de tecnologa en el desarrollo de turbinas (esto es, dada una mxima temperatura) una pregunta de diseo es
Cul debe ser la razn de temperatura a travs del compresor T
R
, Qu criterio se debe seguir para decidir esto?
Mxima eciencia trmica o mxima extraccin de trabajo para la turbina?
El problema se expone en la gura (37) la cual muestra dos ciclos Brayton. Para mxima eciencia se debe tener
T
R
tan grande como sea posible esto signica que la temperatura del compresor se aproxima a la temperatura de
entrada de la turbina El trabajo neto ser menor que el calor recibido, como T
b
T
c
el calor recibido se aproxima
a cero y por tanto el trabajo tambin ser cero.
El trabajo neto del ciclo se puede expresar como
R
Pdv evaluado en el ciclo. Esta es el rea encerrada por las
curvas, la cual se aproxima a cero como T
b
T
c
.
45
Figure 37: Eciencia y trabajo de dos ciclos Brayton.
La conclusin de cualquiera de estos argumentos es que un ciclo diseado para mxima eciencia trmica no resulta
muy til ya que el trabajo que obtengamos del ciclo ser entonces cero.
Un criterio ms til es obtener el mximo trabajo por unidad de masa. Dicho trabajo lo podemos expresar como
Work / unit mass = c
p
[(T
c
T
b
) (T
d
T
a
)] (168)
donde T
c
es la mxima temperatura a la entrada de la turbina (un restriccin de diseo) y T
a
es la temperatura del
ambiente. La variable de diseo es por ende la temperatura de salida del compresor, T
b
, y para encontrar el mximo
recurrimos a las herramientas del clculo diferencial, tal que al diferenciar la expresin del trabajo con respecto a T
b
,
dw
dT
b
= c
p
dT
c
dT
b
1
dT
d
dT
b
+
dT
a
dT
b
(169)
El primer y cuarto trmino del lado derecho son cero (la temperatura de entrada a la turbina y la temperatura del
ambiente son parmetros jos). De esta manera escribimos la ecuacin como
dw
dT
b
= c
p
1
dT
d
dT
b
(170)
y el mximo ocurre cuando la derivada del trabajo respecto a T
b
es cero, tal que
1 +
dT
d
dT
b
= 0 (171)
para que la relacin antedicha pueda tener sentido, relacionamos T
d
y T
b
y sabemos que
T
d
T
a
=
T
c
T
b
T
d
=
T
a
T
c
T
b
(172)
As que
dT
d
dT
b
=
T
a
T
c
(T
b
)
2
(173)
Al sustituir esta expresin que nos permite conocer el mximo, obtenemos la temperatura de salida del compresor
para mximo trabajo como
1
T
a
T
c
(T
b
)
2
= 0
T
b
=
p
T
a
T
c
(174)
46
que en trminos de la razn de temperatura podemos escribir como
T
b
T
a
=
T
a
T
c
T
a
T
a
T
b
T
a
=
r
T
c
T
a
(175)
La condicin para mximo trabajo en un ciclo Brayton es diferente que la de mxima eciencia. El rol del la razn
de temperatura temperatura T
b
/T
a
se puede observar si examinamos el mximo trabajo por unidad de masa debido
a lo antes expuesto
w
max
= c
p
T
c
p
T
a
T
c
T
a
T
c
T
a
T
c
+T
a
(176)
o bien factorizando la temperatura a la entrada T
a
w
max
= c
p
T
a
"
T
c
T
a
2
2
r
T
c
T
a
+ 1
#
(177)
Para encontrar la mxima potencia debemos multiplicar por el ujo msico, tal que
P
max
=
mc
p
T
a
"
T
c
T
a
2
2
r
T
c
T
a
+ 1
#
3.8 Los puntos complicados del captulo 3
1. Cmo podemos idealizar la adicin de combustible como si se tratara de adicin de calor?
Recordemos que la validez de una aproximacin se basa en la utilidad que tiene como respuesta a la situacin fsica
real. Buscamos bsicamente un slo enfoque concerniente con las condiciones de salida e la cmara de combustin,
a saber, la temperatura de salida o la entalpa de salida. El estado nal es independiente de como se agrega al calor
y depende solamente si agregamos calor. Si esta adicin de calor se realiza a travs de una resistencia elctrica o
por combustin, y si despreciamos los cambios en la constitucin del gas debido a los productos de la combustin (la
mayor parte del gas es nitrgeno) la entalpa es la misma no importa cmo se logre el aumento de temperatura.
2. Puesto que para un ciclo termodinmico = 1 T
1
/T
2
y observado un diagrama P V , Podemos concluir
que al alejar o separar las isoterrmas T
1
y T
2
, la eciencia aumenta mientras que al acercarlas demasiado el ciclo sera
muy ineciente?
Esto es correcto. Debemos tener en mente que existe una eciencia realizable mxima. No podemos convertir todo
el calor absorbido Q
A
en 100% trabajo, es decir, una cantidad de calor Q
R
siempre es expelida. Dicha cantidad de
calor es
Q
R
Q
A
=
T
1
T
2
Q
R
= Q
A
T
1
T
2
(178)
As, para valores dados de T
2
y Q
A
, Q
R
depende solamente del reservorio de baja temperatura T
1
.el cul esta
limitado por las condiciones naturales del ambiente o medio. Las temperaturas involucradas estarn siempre por
arriba del cero absoluto y no existe forma de reducir a valores despreciables el valor de Q
R
. Por lo que la eciencia
del ciclo de Carnot no puede ser la unidad. Es claro que = 1 slo si Q
R
= 0 que resulta imposible.
3. En el ciclo de Carnot, por qu nos ocupamos solamente de los cambios de volumen y no de los cambios en la
presin en las adiabticas e isotermas?
No estamos despreciando los trminos de la presin ni dejamos de largo los cambios en la presin. En el proceso
adiabtico sabemos que dq = 0 as que para un proceso reversible podemos escribir para la Primera Ley que du = Pdv
y usando de la entalpa como dh = vdP. Con dh = C
p
dT y du = c
v
dT para un gas ideal, podemos escribir la razn
dh/du como
dh
du
=
c
p
c
v
= =
vdP
Pdv
(179)
que al ordenar trminos obtenemos
dP
P
=
dv
v
(180)
47
como se obtuvo en las secciones anteriores.
Para un proceso podemos integrar desde el estado 1 hasta el estado 2 y obtener que
P
2
v
2
= P
1
v
1
(181)
por lo que
Pv
= constante (182)
Esta relacin muestra como los cambios de presin y volumen se relacionan entre s en un proceso reversible
adiabtico.
Durante un proceso isotrmico, la temperatura permanece constante. Utilizando la ecuacin de estado para un
gas ideal Pv = RT ,se tiene que Pv =constante en una isoterma. De nueva cuenta, esta relacin nos muestra como
los cambios de presin estn relacionados a los cambios de volumen durante el proceso isotrmico. Observe que en el
diagrama P V las ramas adiabticas (Pv
=constante) tienen mayor pendiente que las isotermas (Pv =constante).
4. Hay alguna aplicacin fsica para el ciclo de Carnot? Se podra disear una mquina de Carnot para un
dispositivo de propulsin?
Veremos que el ciclo de Carnot es el mejor en trminos de la eciencia. Es un proceso de transferencia de calor
a temperatura constante, sin embargo, es difcil obtener en la prctica para los dispositivos en los cuales se requieren
potencias grandes. El papel principal de la mquina de Carnot es por lo tanto como estndar de comparacin de otros
ciclos y mostrar la direccin en la que deben ir los diseo de ciclos ecientes.
5. Cmo sabemos cuales ciclos son usados como modelos de procesos reales?
Podemos ver que un ciclo de Carnot no es una buena descripcin de una turbina de gas. Podemos adelantarnos y
decir que el ciclo Brayton o el ciclo Rankine son empleados en mquinas de combustin interna.
6. Cmo se calcula h
combustible
?
Existen modelos que permiten el clculo de este parmetro, y comnmente se tienen valores tabulados obtenido
scomo resultados experimentales.
7. Qu son las condiciones estequeomtricas?
La estequiometria es la parte de la qumica que se ocupa de la investigacin de las proporciones en que se combinan
las sustancias. Por ejemplo, la proporcin de combustible y aire que se deben combinar para que no haya un exceso
de uno o de otro durante la combustin.
8. Cuando y donde se usa c
v
y c
p
?
Recordemos que c
p
es el calor especco a presin constante y para un gas ideal siempre se tiene que dh = c
p
dT.
Mientras que c
v
es el calor especco a volumen constante du = c
v
dT. Si pensamos cmo mediramos el calor especco
c = q/(T
final
T
inicial
) para un cierto cambio de estado conocido podramos hacer los siguientes experimentos.
Para un proceso durante el cual el calor q se transere (reversiblemente) y el volumen permanece constante (v.
g. un contenedor rgido cerrado que es llenado con una sustancia, o el calor transferido in una mquina Otto durante
la combustin - el pistn esta en el punto muerto superior y el volumen es aproximadamente constante durante la
transferencia de calor) la primera ley es du = dq ya que v = cte. Utilizando la denicin de du = c
v
dT obtenemos el
calor especco volumen constante
c
v
=
q
T
(183)
donde se puede medir tanto la transferencia de calor q como la diferencia de temperaturas T.
Similarmente podemos hacer un experimento involucrando un proceso donde la presin se mantiene constante
durante la transferencia de calor reversible q (v. g. un envase o contenedor rgido que est lleno de una sustancia
y dicho contenedor es cerrado con mbolo o tapa con un cierto peso. o la transferencia de calor en una cmara de
combustin de una turbina donde la presin es aproximadamente constante durante la adicin de calor). La primera
ley pude escribirse en trminos de la entalpa como dh vdP = dq ya que P es constante obtenemos que dh = dq.
Utilizando la denicin de dh = c
p
dT obtenemos el calor especco a presin constante
c
p
=
q
T
(184)
9. Se puede operar en reversa el ciclo Brayton y ser usado como refrigerador?
Si. De hecho en criogenia el ciclo Brayton de opera en sentido contrario para enfriar un sistema donde se requieren
temperatura muy bajas. Una diferencia importante entre el ciclo Brayton operado como mquina y operado como
refrigerador es el tipo de uido trmico utilizado.
Temperaturas extremadamente bajas se pueden alcanzar al usar un regenerador un intercambiador de calor que
precalienta el lquido antes de que entre al compresor y enfra el lquido antes de que entre en la turbina.
48
10. Cuando el ujo se acelera en una boquilla o estrangulamiento qu ocurre con la energa interna y la entalpa?
De hecho se reduce tanto la entalpa como la energa interna. La que se mantiene constante es la entalpa de
estancamiento.
11. Por qu decimos que la combustin en una turbina de gas ocurre a presin constante?
Esto es una aproximacin, y una pregunta clave es qu tan exacta es esta aproximacin y cul es su justicacin.
El cambio de la presin en el quemador se puede analizar usando la ecuacin de ujo compresible unidimensional. La
ecuacin de momento es dP = cdc donde c es la velocidad. Al dividir ambos lados por P obtenemos
dP
P
=
c
c
cdc
p
=
c
2
P/
dc
c
=
c
2
a
dc
c
= M
2
dc
c
(185)
donde a e la velocidad del sonido y M es le nmero de Mach
Los cambios en la velocidad son debidos a los cambios en la densidad y el ujo a travs del rea A esta dado por
cA = constante (186)
Por lo tanto
ln + lnc + lnA = cte (187)
diferenciando obtenemos
d
+
dc
c
+
dA
A
= 0
dc
c
=
dA
A
+
d
(188)
Los cambios de velocidad son entonces relacionados con el cambio en el rea (geometra) y los cambios en la
densidad (bsicamente por le adicin de calor). Para un proceso de combustin en la turbina de gas el cambio en
densidad es comparable con (una fraccin signicativa de) la densidad inicial y el cambio del rea que es varias veces
el rea inicial. Esto signica que el cambio en la velocidad dividido por la velocidad inicial es signicativo en un orden
de magnitud. La ecuacin de momento indica que para nmeros de Mach pequeos (digamos 0.1) el cociente dP/P
ser menor que uno, as que la presin se puede considerar como constante. En realidad la presin cae quemador, pero
la cada total de la entrada y la salida es cercana a 3 4%, que resulta pequeo comparado con el valor inicial de la
presin, de modo que la aproximacin de la presin constante resulta muy til y adecuada..
La rapidez del proceso de combustin realmente no tiene que ver con esta aproximacin. Podramos tener un
proceso, tal como un inyector, en el cual existe combustin al mismo tiempo que la presin decae. Como se observa
de la ecuacin de momento, el calor adicionado no afecta directamente la presin ya que los cambios de presin estn
asociados con los cambios en la velocidad.
Parte II
LA SEGUNDA LEY DE LA TERMODINMICA
Hasta ahora nos hemos ocupado en gran parte de las situaciones ideales que implican procesos reversibles (es de-
cir,procesos cuasiestticos como pistones que corren sin friccin). Ahora consideraremos situaciones ms generales.
4 Antecedentes de la segunda ley de la termodinmica
La experiencia nos muestra que algunos procesos naturales siguen cierta "direccionalidad" para que se lleven a cabo.
Por ejemplo, no esperamos que una cascada uya hacia arriba de manera espontnea o que una taza de caf aumente
de manera natural su temperatura en lugar de dismiurla. Es importante caracterizar la "direccin" que sigue un
proceso natural, existe una direccionalidad bsica en la naturaleza.
49
4.1 Reversibilidad e irreversibilidad en procesos naturales
Comenzamos examinando una rueda con paletas en un recinto aislado lleno de algn uido como se muestra en la
gura (38).
Figure 38: Rueda con paletas en el estado inical y nal.
Una pregunta que se podramos hacer es Podemos comenzar con el estado B y despus permitir a los eventos llegar
al estado A? Por qu si o por qu no? La primera Ley no restringe la direccionalidad del evento slo se encargara de
la conservacin de la energa.
Una de las propiedades del estado A es que la energa est organizada de una cierta forma, las molculas en la
rueda con paletas tienen cierto movimiento circular, y podramos extraer un cierto trabajo usando la energa cintica
de la rueda para levantar un peso. En el estado B, en cambio, la energa se asocia al movimiento desorganizado a
escala molecular. La temperatura del uido y la rueda son ms altas que en el estado A, as que podramos obtener
trabajo al utilizar un ciclo de Carnot, pero sera mucho menor que el trabajo que podramos extraer en el estado A.
Hay una diferencia cualitativa entre estos estados, que necesitamos poder describir de manera ms exacta.
Un punto complicado a tratar sera por qu la disponibilidad para realizar trabajo es menor en B? cmo sabemos
que esta armacin es cierta?
Otro ejemplo es un sistema integrado por muchos ladrillos, la mitad de dichos ladrillos tienen una temperatura
alta T
H
en comparacin con la otra mitad de ladrillos que tiene una temperatura baja T
L
como se muestra en la
gura (4.1). Con los ladrillos separados trmicamente, tenemos en principio la capacidad de obtener trabajo a travs
de un ciclo operando entre las dos temperaturas. Supongamos que ponemos dos ladrillos juntos. Usando la primera
ley podemos escribir
CT
H
+CT
L
= 2CT
M
(T
H
+T
L
) /2 = T
M
(189)
donde C = Q/T es la capacidad calorca. (Para slidos las capacidades calorcas a presin o volumen constantes
son esencialmente las mismas). Hemos perdido la capacidad de realizar trabajo de estos dos ladrillos.
Podemos restaurar el sistema al estado original sin contacto con el exterior? La respuesta es NO. Podemos
restaurar el sistema al estado original con el contacto con el exterior? La respuesta es Si. Podramos operar un
refrigerador al tomar calor de un ladrillo y ponerlo en el otro, pero tendramos que realizar trabajo..
Podemos pensar en el proceso total que implica el sistema (los dos ladrillos en un arreglo aislado) y los alrededores
(el resto del universo) como:
El sistema cambi
Los alrededores permanecen sin cambio.
El sistema compuesto, que es el sistema y los alrededores, cambi al poner los ladrillos juntos. El proceso no es
reversible, es decir, es un proceso irreversible ya que no hay manera de deshacer el cambio y de no dejar ninguna marca
o rastro en los alrededores. Cul es la medida de cambio en los alrededores? 1.Es la Energa? Esta se conserva
50
. 2.Disponibilidad del trabajo? Esta decrece. La medida y la caracterizacin de este tipo de cambio, de perder la
capacidad de hacer el trabajo, es el tema de la Segunda Ley de la Termodinmica
4.2 Diferencia entre la expansin libre de un gas y la expansin isotrmica reversible
La diferencia entre los procesos reversibles e irreversibles se puede mostrar bajo el marco de la expansin isotrmica
de un gas ideal. La pregunta obligada sera cul es la diferencia entre la expansin libre de un gas y la expansin
isotrmica contra un pistn? Para contestar esta pregunta en ambos casos llevamos a cabo la expansin del gas y
posteriormente seguimos los pasos que tendramos llevar a cabo para deshacer el proceso o restituir el sistema a su
estado inicial.
Por expansin libre entendemos la expansin no restringida de un gas dentro de un volumen como se muestra
en la gura (39). El volumen total es V
2
que es el volumen V
1
ms el volumen evacuado. En un momento dado
un agujero se abre en la particin o pared, as que el gas pasa a travs de dicho agujero para llenar el resto del
comnamiento. Durante la expansin no hay transferencia de trabajo con los alrededores, porque no hay movimiento
en los lmites o fronteras del sistema. De hecho, una cierta capacidad de realizar trabajo se perdi, porque pudimos
haber puesto un pistn en el volumen y permitir que la extensin del gas realizara el trabajo para levantar un peso
(40). El connamiento est aislado y no hay transferencia de calor. La Primera Ley establece para este caso que la
energa interna permanece constante por lo que el cambio de la energa interna es U = 0. Para un gas ideal la energa
interna es nicamente funcin de la temperatura, as que la temperatura del gas antes y despus de la expansin es
exactamente la misma. Las propiedades de los estados inicial (estado 1) y nal (estado 2):
Estado 1:V = V
1
, T = T
1
Estado 2: V = V
2
, T = T
1
Tambin sabemos que Q = W = 0, as que no hay cambio en los alrededores.
Figure 39: Expansin libre de un gas ideal
Figure 40: Expansin contra un piston
Para restituir el estado original, esto es., para llevar de regreso el volumen original a la misma temperatura
(V
2
V
1
a una temperatura constante T = T
1
) tendramos que comprimir el gas isotrmicamente (usando trabajo
provisto por un dispositivo externo). Podemos hacer esto de manera cuasiesttica, con P
sistema
P
externa
, como se
muestra en la gura (41).
Es claro que el trabajo que necesitamos hacer es
W =
Z
2
1
PdV (190)
51
Figure 41: Restitucin de la expansin libre a su condicin inicial.
En secciones anteriores hemos evaluado la expansin isotrmica y podemos aplicar dichos argumentos al caso de una
compresin isotrmica reversible. El trabajo realizado sobre el sistema que va del estado "2" hasta el estado "1" es
entonces
W = Trabajo realizado sobre el sistema = NRT
1
ln
V
2
V
1
(191)
Con base en la primera ley, esta cantidad de calor debe ser expelida desde el gas hacia los alrededores si la
temperatura del gas se mantiene constante. Una representacin esquemtica del proceso de compresin, en trminos
del trabajo y el calor transferido, se muestra en la gura (??)
Figure 42: Trabajo e intercambio de calor en el proceso isotrmico reversible de compresin.
Al nal del proceso combinado expansin libre ms compresin reversible se tiene que:
1.- El sistema ha regresado a su estado inicial (no hay cambios en el estado del sistema).
2.- Los alrededores hicieron trabajo en el sistema de magnitud W.
3.- Los alrededores reciben una cantidad de calor, Q, la cual es igual a W.
4..-La suma de todos estos eventos es que hemos convertido una cantidad de trabajo W, en una cantidad de calor
Q, con W y Q numricamente iguales en unidades de energa.
El efecto neto es el mismo si dejemos caer un peso y que ste tire de un bloque a lo largo de una supercie spera,
como se muestra en la gura (43). Existe una conversin del 100% del trabajo en calor.
Figure 43: Conversin del 100% de trabajo en calor.
Los resultados de la expansin libre se pueden contrastar con un proceso de expansin isotrmica contra una presin
dP, la cual es ligeramente diferente que el sistema, como se muestra en la gura (44)
52
Figure 44: Trabajo y trasnferecia de calor en la expansin isotrmica reversible.
Durante la expansin, el trabajo realizado en los alrededores es de magnitud W =
R
PdV , donde P se puede
tomar como la presin del sistema. El trabajo realizado por el sistema es NRT
1
ln(V
2
/V
1
). Al nal de la expansin
isotrmica, por tanto
1. Los alrededores han recibido trabajo W
2. Los alrededores han entregado calor, Q, que es numricamente igual que W.
Ahora deseamos restaurar el sistema a su estado inicial, justo como hicimos en la expansin libre. Para hacer esto
necesitamos realizar trabajo sobre el sistema y extraer calor del sistema, al igual que como hicimos en la expansin
libre. De hecho, ya que nosotros estamos haciendo una transicin entre los mismos estados a lo largo de la misma
trayectoria, el trabajo y el intercambio de calor son iguales que aquellos para el proceso de la compresin examinado
anteriormente.
Sin embargo, el resultado total de restaurar el sistema al estado inicial, es absolutamente diferente para la expan-
sin reversible que para la expansin libre. Para la expansin reversible, el trabajo necesario sobre el sistema para
comprimirlo tiene la misma magnitud que el trabajo realizado durante el proceso de expansin. De hecho, podramos
levantar un peso durante la expansin y despus bajarlo durante el proceso de compresin. Similarmente el calor
agregado al sistema por los alrededores durante el proceso de expansin tiene la misma magnitud que el calor recibido
durante el proceso de compresin. El resultado es que, cuando el,sistema ha sido restaurado a su condicin inicial,
tambin ha sido restaurado los alrededores. No existe rastro de todo el proceso tanto en el sistema como en los
alrededores. Esto es otro signicado de la palabra "reversible".
4.3 Caractersticas de procesos reversibles
Los procesos reversibles son idealizaciones de procesos verdaderos. Un ejemplo familiar y ampliamente utilizado es la
ecuacin e Bernoulli que hemos visto para llevar a cabo balances de ujos de entrada y salida Los procesos reversibles
son extremadamente tiles para denir lmites al sistema o del comportamiento de dispositivos, para identicar las
reas en las cuales ocurren las ineciencias y permite dar criterios en el diseo de dispositivos.
Una caracterstica importante de un proceso reversible es que, dependiendo del proceso, este representa el trabajo
mximo que se puede extraer al ir de un estado a otro, o bien el trabajo mnimo que es necesario para crear un cambio
de estado.
Consideremos procesos que realizan trabajo, de modo que demostremos que el proceso reversible produce el mximo
trabajo de todos los procesos posibles entre dos estados. Por ejemplo, supongamos que tenemos un cilindro aislado
trmicamente que contiene un gas ideal, como se muestra en la gura (45). El gas est contenido por un pistn aislado
de masa despreciable con un apilado de varas pesas pequeas encima de l. El sistema est inicialmente en equilibrio
mecnico y trmico.
Consideremos los tres siguientes procesos que son mostrados en la gura ()
1. Todos las pesas se quitan del pistn instantneamente y el gas se expande hasta que su volumen se incrementa
en un factor de cuatro (una extensin libre).
2. La mitad del peso se quita del pistn instantneamente, el sistema llega al doble de su volumen, y entonces la
otra mitad del peso se quita instantneamente del pistn y el gas se expande hasta que su volumen se duplica otra
vez.
3 Cada pesa pequea se quita del pistn una a la vez, de modo que la presin dentro del cilindro est siempre
en equilibrio con el peso sobre el pistn. Cuando se quita la ltima pasa, el volumen ha aumentado en un factor de
cuatro.
53
Figure 45: Un pistn que soporta unas pesas.
Figure 46: Para obtener el mximo de trabajo se requiere que el proceso sea reversible.
El mximo trabajo (proporcional al rea bajo la curva) se obtiene de la expansin cuasiesttica. Es importante
notar que existe un relacin inversa entre la cantidad de trabajo extrada en un determinado proceso y el grado de
irreversibilidad
Reiterando podemos decir que
El trabajo realizado por un sistema durante un proceso reversible es el trabajo mximo que podemos conseguir.
El trabajo realizado sobre un sistema en un proceso reversible es el trabajo mnimo que necesitamos hacer para
lograr un cambio de estado.
Un proceso debe ser cuasiesttico (cuasi-equilibrio) ser reversible. Esto signica que los efectos siguientes deben
ser ausentes o insignicantes:
Pongamos atencin a un punto sobresaliente en nuestra discusin. Todo proceso reversible es cuasiesttico (en
estados cuasi-equilibrados) pero no todos los procesos cuasi-estaticos son reversible. Esto signica que los siguientes
efectos deben estar ausentes o ser insignicantes en el proceso reversible
1. Friccin: Si la P
externa
6= P
sistema
tendramos que realizar trabajo neto para llevar el sistema de un volumen a
otro volumen y para volverlo a la condicin inicial
2. Expansin (no restringida) libre.
3. Transferencia de calor a travs de un diferencia nita de temperatura.
Figure 47: Transferencia de calor en una diferencia nita
Supongamos que tenemos transferencia de calor de una temperatura alta a una temperatura ms baja como se
indica en la gura (??) Cmo restauraramos el sistema a sus condiciones iniciales? Uno podra pensar hacer funcionar
un refrigerador de Carnot para conseguir una cantidad de calor Q, desde el depsito de temperatura ms baja hacia
54
el depsito de temperatura ms ms alta. Podramos hacer esto, pero los alrededores necesitaran proporcionar una
cierta cantidad de trabajo El resultado neto y nico resultado al nal del proceso sera una conversin de trabajo en
calor. Para la transferencia trmica reversible de un reservorio de calor a un sistema, las temperaturas del sistema y
del reservorio deben ser
T
resevorio de calor
= T
sistema
dT (192)
Es decir la diferencia entre las temperaturas de las dos entidades implicadas en el proceso de transferencia trmica
slo puede diferir una cantidad innitesimal dT.
Todos los procesos naturales son irreversibles hasta cierto punto por lo que no se puede generalizar la modelacin
de procesos como reversibles ya que esto no sera una buena aproximacin de la realidad. Cabe sealar que un cierto
nmero de situaciones en la ingeniera donde el efecto de la irreversibilidad puede ser omitido o ignorado si se puede
suponer un proceso reversible y que resulta una aproximacin excelente.
La segunda ley, que es el asunto siguiente nos dirigimos, permitimos que a hagamos una declaracin cuantitativa
referente a la irrevrsibilidad de un proceso fsico dado.
La Segunda Ley de la Termodinmica nos permite hacer una cuanticar de la irreversibilidad de un proceso fsico
dado.
4.4 Los puntos complicados del captulo 4
1. Por que la disponibilidad de realizar trabajo en la rueda con paletas en un recinto aislado lleno de algn uido
(como se muestra en la gura (38)) decrece en el caso B? Cmo sabemos esto?.
Figure 48: Rueda con paletas en el estado inical y nal.
En el estado A, la energa est en forma organizada y las molculas se mueven a lo largo de las trayectorias circulares
alrededor de la rueda que girara. Podramos obtener trabajo de este sistema usando toda la energa cintica de la
rueda y por ejemplo levantar un peso. La energa del sistema en el estado B (rueda volante que no gira) se asocia al
movimiento desorganizado de las partculas (en la escala molecular). La temperatura en el estado B es ms alta que en
el estado A. Podramos tambin extraer trabajo del estado B operando por ejemplo un ciclo ideal de Carnot entre T
B
y un reservorio de calor en una temperatura ms baja. No obstante el trabajo que conseguiramos de este ciclo ideal
de Carnot es menor que el trabajo que obtenemos del estado A (toda la energa cintica), porque debemos expeler
un cierto calor cuando convertimos calor en el trabajo (no podemos convertir el calor en 100% trabajo). Aunque la
energa del sistema en el estado A est igual que en el estado B (sabemos que esto a partir de la Primera Ley) la
organizacin de la energa es diferente, y as la capacidad de hacer el trabajo es diferente.
2. En la expansin isotrmica reversible, P
externa
=
constante. Si es as, cmo podemos tener que P
externa
P
sistema
Para un proceso reversible, si la presin externa fuera constante, necesitara ser una fuerza que empuja sobre el
pistn y el proceso se podra considerar cuasiesttico. Esta fuerza podramos hacerla nosotros, podra ser obtenida
de un sistema de pesos, o podra provenir de cualquier otro fuente de trabajo. Bajo estas condiciones la presin del
sistema no estara necesariamente cerca de la presin externa pero tendramos
P
sistema
= P
externa
+F
Trabajo recibido
/A
pistn
Podemos por supuesto pensar en una situacin en la cual la presin externa vari y que estuvo siempre cerca a la
presin de sistema.
3. Porqu en la expansin libre el trabajo realizado es igual a cero?
En este problema, todo el sistema est dentro del envase rgido. No hay cambio en el volumen, ningn dV , as
que no hay ningn trabajo realizado en los alrededores. Los componentes del gas pudieron expandirse, empujar a otras
55
componentes del gas y hacer trabajo local dentro del envase (y de otros componentes se comprimieron y recibir as
el trabajo tambin de manera local). Durante el proceso de expansin libre consideramos el sistema en su totalidad
por lo que no hay trabajo neto realizado
4. La irreversibilidad se dene por dejar o no una marca en el medio exterior?
Un proceso es irreversible cuando no hay manera de deshacer el cambio sin dejar una marca en los alrededores o el
resto del universo. En el ejemplo con los ladrillos, podramos deshacer el cambio poniendo un refrigerador de Carnot
entre los ladrillos Para hacer esto tenemos que proveer trabajo al refrigerador y tambin expeler un cierto calor a los
alrededores. As dejamos una marca en el ambiente y el proceso es irreversible.
5. Es la transferencia de calor a travs de una diferencia nita de temperaturas solamente irreversible si no hay
dispositivo presente entre los dos para transformar la diferencia de potencial?
Si tenemos dos depsitos del calor a diferentes temperaturas, la irreversibilidad asociada con la transferencia del
calor de uno al otro es de hecho dependiente de que se encuentra entre ellos. Si hay una barra de cobre entre ellos,
todo el calor que sale del depsito de alta temperatura entra el depsito de la baja temperatura. Si hubiera un ciclo
de Carnot entre ellos, parte del calor (pero no todo) del depsito de alta temperatura sera transferido reservorio o
sumidero de baja temperatura, el proceso sera reversible, y el trabajo se habra realizado. El grado de irreversibilidad
del proceso para cualquier dispositivo puede ser determinado calculando el cambio total de la entropa (dispositivo
ms alrededores) asociado al traspaso trmico.
5 La segunda ley de la termodinmica
Nicols Lonard Sadi Carnot (1796 - 1832) fue hijo de Lazare Carnot, conocido como el Gran Carnot, y to de Marie
Franois Sadi Carnot, que lleg a ser Presidente de la Repblica Francesa. Sadi Carnot fue un ingeniero y ocial de
la milicia francesa y es el pionero y fundador en el estudio de la Termodinmica.
Hay quienes conceden a Sadi Carnot ser el padre de la Termodinmica, pero su condicin de ingeniero indigna a
algunos fsicos quienes dan la paternidad de la Termodinmica a William Thomson (Lord Kelvin) y a Plank, inclusive
se menciona que el concepto de Ciclo Carnot quiz viene de la inuencia de Emile Clapeyron quien en 1934 analiz y
realiz grcos del ensayo de Sadi Carnot.
Licenciado en la Escuela Politcnica, en 1824 public Reexiones sobre la potencia motriz del fuego y sobre las
mquinas adecuadas para desarrollar esta potencia, en donde expuso los dos primeros principios de la termodinmica.
Estos trabajos, poco comprendidos, inclusive despreciados por la comunidad cientca (algunos fsicos prominentes) de
la poca, fueron ms tarde conocidos en Alemania por Rudolf Clausius, que fue quien los difundi y William Thomson
(lord Kelvin) quien hizo lo propio en el Reino Unido. Cabe mencionar que el ensayo de Carnot fue recogido por
Clausius y Thompson para formular de una manera matemtica, las bases de la termodinmica.
Como reconocimiento a las aportaciones pioneras, el principio de Carnot se rebautiz como principio de Carnot-
Clausius. Este principio permite determinar el mximo rendimiento de una mquina trmica en funcin de las tem-
peraturas de su fuente caliente y de su fuente fra. Cuando Luis XVIII envi a Carnot a Inglaterra para investigar el
elevado rendimiento de sus mquinas de vapor, se dio cuenta que la creencia generalizada de elevar la temperatura lo
ms posible para obtener el vapor mejoraba el funcionamiento de las mquinas. Poco despus descubri una relacin
entre las temperaturas del foco caliente y fro y el rendimiento de la mquina. Como corolario se obtiene que ninguna
mquina real alcanza el rendimiento terico de Carnot (obtenido siguiendo el ciclo de Carnot), que es el mximo
posible para ese intervalo de temperaturas. Toda mquina que sigue este ciclo de Carnot es conocida como mquina
de Carnot.
Sadi Carnot no public nada despus de 1824 y es probable que l mismo creyera haber fracasado. Su pensamiento
es original, nico en la historia de la ciencia moderna, pues a diferencia de lo que le sucede a muchos otros cientcos,
no se apoya en nada anterior y abre un amplio campo a la investigacin.
5.1 Concepto y enunciados de La Segunda Ley de la Termodinmica (porqu necesi-
tamos la segunda ley?)
La expansin no restringida o el equilibrio de temperaturas de dos bloques o ladrillos, son procesos familiares. Supong-
amos que nos preguntan si hemos visto estos procesos que ocurran al revs, es decir que ocurran en sentido contrario.
Es posible que dos bloques, ambos con temperatura media, vayan a estados donde uno tiene mayor temperatura que
el otro?. La experiencia nos indica que no es posible. Aunque es tal proceso no viola o se contrapone a la Primera
Ley de la Termodinmica. En otras palabras, la primera ley no prohibe que el proceso antedicho ocurra. Es claro que
debe haber otro "gran principio" que describe la direccin en la que ocurre el proceso natural, y que debe estar en
56
Figure 49: Nicolas Sadi Carnot (1796-1832), ingeniero y ocial en el ejrcito francs. El trabajo de Carnot es ms
notable porque fue hecho sin la ventaja de la primera ley, que no fue descubierta hasta 30 aos ms tarde
acuerdo con la Primera Ley. Este gran principio est contenido en La Segunda Ley de la Termodinmica". Al igual
que la primera ley, esta es una generalizacin de una enorme cantidad de observaciones.
Existen varias maneras en que la Segunda Ley de la Termodinmica puede ser establecida o indicada. A contin-
uacin se lista tres de las ms empleadas. Si bien estas tres parecen no tener conexin entre ellas, todas son equivalentes
entre si.
1. Es imposible para cualquier dispositivo que funcione en un ciclo recibir calor de un solo depsito o reservorio
y producir una cantidad neta de trabajo [enunciado de Kelvin-Plank para la Segunda Ley].
Figure 50: Mquina trmica que viola la Segunda Ley [Kelvin-Plank]
2. Es imposible construir un dispositivo que funcione en un ciclo y cuyo nico efecto sea producir la transferencia
de calor de un cuerpo de temperatura ms baja a un cuerpo de temperatura ms alta.
3. Existe para cada sistema en equilibrio una propiedad llamada entropa, S, la cual es una propiedad termodinmica
del sistema. Para procesos reversibles, los cambios en esta propiedad estn dados por
dS = (dQ
reversible
) /T (193)
57
Figure 51: Para T
1
< T
2
, esto resulta imposible (Clausius).
El cambio de la entropa de cualquier sistema y sus alrededores, considerados juntos, es positivo y se aproxima a
cero para cualquier proceso que tiende o se acerca ser reversible.
S
total
0 (194)
Para un sistema aislado, es decir, un sistema que no tiene ninguna interaccin con los alrededores, los cambios
en el sistema no tiene ningn efecto en los alrededores. En este caso, necesitamos considerar el sistema solamente, y
la primera ley y segunda ley son:
E
sistema
= 0 (195)
S
total
0 (196)
Para sistemas aislados la energa total (E
T
= U + E
k
+ E
p
+ ... + ...) es constante. La entropa puede aumentar
o en el lmite de un proceso reversible, permanecer constante. Cabe sealar que el lmite S
total
= 0 o S
total
= 0,
representa un limite superior para la mejor manera en la que se puede realizar un proceso. En termodinmica, en
sistemas de propulsin o sistemas de generacin de potencia, es muy comn comparar el funcionamiento de mquinas
reales con este lmite y que tan cerca se est de un proceso ideal.
Estos tres enunciados son equivalentes pero el enunciado 3 describe una manera directa de medir cuantitativamente
que tan lejos se est de la reversibilidad.
La entropa no es un concepto familiar, como puede ser la energa, por lo que profundizamos un poco ms al
respecto. Si consideramos la Primera Ley
dU = dQdW (197)
el trmino de la izquierda es una funcin de estado, mientras que los dos trminos de la derecha no lo son. Sin embargo,
para una sustancia compresible podemos escribir el trabajo realizado para un proceso reversible como dW = PdV , as
que
dU = dQPdV (198)
Dos de los tres trminos de esta ecuacin se expresan en funcin de variables de estado. Parece razonable expresar
tambin el trmino faltante usando variables de estado, pero, Cules son las variables apropiadas?. Si consideramos
que el trmino dW = (P) [dV ], tendramos de manera anloga que dQ = (_) [_], donde los parntesis denotan una
variable es estado intensiva y los corchetes (parntesis cuadrados) una variable de estado intensiva. La segunda ley
nos dice que la variable intensiva es la temperatura, T, y la variable extensiva es la entropa, S. La Primera Ley para
una sustancia simple compresible en trminos de estas variables es
dU = TdS PdV (199)
Ya que esta ecuacin incluye la formulacin de la Segunda Ley, esta es conocida como la Primera y Segunda Leyes
combinadas. Observe que esta ecuacin esta escrita en trminos de variables de estado, y es valida para todos los
procesos, no slo para aquellos que son reversibles.
A continuacin se resumen algunos cualidades de la entropa.
58
1.La entropa es una propiedad termodinmica. La entropa es una funcin de estado del sistema y se puede
determinar si se conocen dos propiedades del sistema, s = s(p, T) o s = s(T, v) o s = (P, v).
2. La entropa es una variable extensiva. Se puede expresar la entropa por unidad de masa, o entropa especca,
s.
3. Las unidades de la entropa son Joule sobre Kelvin [J / K] .Para la entropa especca
J K
1
kg
1
.
4. Para un sistema,dS = dQ
rev
/T, donde el numerador es el calor dado al sistema y el denominador es la
temperatura del sistema donde se recibe el calor.
5. dS = 0 para la transferencia nicamente de trabajo.
ACTIVIDADES
Por qu dU = TdS PdV siempre es valida?
Qu diferencia existe entre dQ
reversible
y dQ?
5.2 Axiomas de las leyes de la termodinmica
5.2.1 Introduccin
Con la idea de formalizar el conocimiento de La Segunda Ley y de la Entropa, llevamos a cabo ciertas analogas de lo
que hemos visto hasta ahora con respecto a la experiencia En particular, presentamos una vez ms la Ley Cero y La
Primera Ley de la Termodinmica y usamos el mismo marco para La Segunda Ley. As, haremos explcitos en esta
formulacin axiomtica los paralelos entre la Cero, Primera y Segunda Leyes de la Termodinmica.
5.2.2 Ley de Cero
Ley Cero: Existe para cada sistema termodinmico en equilibrio una propiedad llamada Temperatura. La igualdad
de temperatura es condicin necesaria y suciente para el equilibrio trmico.
5.2.3 Primera ley
Las observaciones y experimentos muestran que para cualquier sistema existe una propiedad llamada Energa. La
Primera Ley arma que se debe asociar tal propiedad con cada sistema.
Primera Ley: Existe para cada sistema termodinmico una propiedad llamada energa. El cambio de energa de
un sistema es igual al trabajo mecnico realizado en el sistema en un proceso adiabtico. En un proceso no adiabtico,
el cambio en la energa es igual al calor agregado al sistema menos el trabajo mecnico realizado por el sistema.
Con base en resultados experimentales, por lo tanto, se puede armar la existencia de dos nuevas propiedades, la
temperatura y la energa interna, que no se presentan en mecnicos ordinarios. En una manera similar, otra relacin
notable entre el calor y la temperatura ser establecida, y una nueva propiedad llamada entropa ser denida.
Aunque esto es una propiedad mucho menos familiar, debe quedar claro que la formulacin general es absolutamente
como se uso para establecer La ley Cero y La Primera Ley. Un principio general y una propiedad asociadas a cualquier
sistema se obtienen de resultados experimentales. Visto de esta manera, la entropa debe aparecer ms mstica que la
energa interna. El aumento de la entropa en un proceso natural no es menos real que la conservacin de la energa.
5.2.4 Segunda ley
Aunque todos los procesos naturales deben ocurrir de acuerdo con la Primera Ley, que es el principio de la conser-
vacin de la energa es por s mismo inadecuado para una descripcin inequvoca del comportamiento de un sistema.
Especcamente, en la Primera Ley no se incluye la observacin de que cada proceso natural tiene en un cierto sentido,
una direccin preferente de accin. Por ejemplo, la transferencia de calor ocurre naturalmente del cuerpo ms caliente
al cuerpo ms fro, en ausencia de otras inuencias, pero si ocurriera lo contrario no existira ciertamente una violacin
de la Primera Ley.
La Segunda Ley es esencialmente diferente de la Primera Ley; los dos principios son independientes y no se pueden
en ningn sentido deducir uno partir del. As, el concepto de la energa no es suciente, y debe aparecer una nueva
propiedad. Esta nueva propiedad se puede esclarecer y entonces se puede presentar La Segunda Ley ms o menos de la
misma manera como se hizo con la Ley Cero y La primera Ley. Al examinar ciertos resultados de la observacin, uno
procura extraer por experiencia una ley que se suponga ser general; esta ser posicionada como un axioma fundamental
que se probar o refutar con base en la experimentacin subsecuente. Es importante tener en mente que dentro de
la estructura de la termodinmica clsica, no hay prueba ms fundamental que las observaciones.
Un enunciado que se puede adoptar como La Segunda Ley de la termodinmica es:
59
Segunda Ley: Existe para cada sistema termodinmico en equilibrio una propiedad escalar extensiva llamada
entropa, S, tale que en un cambio de estado reversible innitesimal del sistema, dS = dQ/T, donde T es la temperatura
absoluta y dQ es la cantidad de calor recibida por el sistema. La entropa de un sistema aislado trmicamente no
puede disminuir y la entropa es constante si y solamente si todos los procesos son reversibles.
Cabe sealar que nadie, absolutamente nadie, ha logrado extender la denicin termodinmica de entropa para
sistemas que se encuentran en estados fuera de equilibrio, excepto en lo que se conoce como equilibrio local y, en este
caso, no es ms que el concepto de equilibrio global extrapolado para regir en pequeos subsistemas que componen al
sistema total.
5.2.5 Procesos reversibles
En este desarrollo, la idea de un proceso totalmente reversible es central, y podemos recordar la denicin, un proceso
se llama totalmente reversible si, despus de que haya ocurrido el proceso, tanto el sistema como sus alrededores se
puede restaurar completamente por cualquier medio a sus estados iniciales respectivos Especialmente, se debe notar
que esta denicin no especica que la trayectoria de reversa debe ser idntica con la trayectoria de ida del proceso.
Si el estado inicial se pueden restaurar por cualesquiera medios, el proceso es por denicin completamente reversible.
Si las trayectorias son idnticas, entonces comnmente llamamos al proceso del sistema reversible, o uno puede decir
que el estado del sistema sigue una trayectoria reversible. En esta trayectoria, entre dos estados de equilibrio 1 y 2,
el sistema pasa a travs de la trayectoria seguida de estos de equilibrio solamente, y el sistema tomar la trayectoria
en reversa e 2 a 1 por una simple realizacin de trabajo y una simple adicin de calor.(en reversa a lo ocurrido
anteriormente)
Los procesos reversibles son idealizaciones y no se encuentran realmente. Sin embargo, son claramente idealizaciones
tiles. Para que un proceso pueda ser totalmente reversible, es necesario que sea cuasiesttico y que no haya disipacin
de la energa como friccin y difusin.
El criterio si un proceso es totalmente reversible se debe basar en los estados iniciales y nales. En la forma en que
se present anteriormente, La Segunda Ley, suministra una relacin entre las propiedades que denen los dos estados,
de tal modo que muestra si es posible un proceso natural que conecta los estados.
5.3 Combinado la Primera Ley y la Segunda Ley de la termodinmica
La primera ley escrita en una forma que siempre es verdadera
dU = dQdW (200)
Slo para procesos reversibles, el trabajo y el calor se pueden escribir como:
dW = PdV (201)
dQ = TdS (202)
La sustitucin de estos trminos nos dirige a encontrar otras formas de la Primera Ley valida nicamente para
procesos reversibles.
dU = dQPdV (203)
donde se ha sustituido dW por la condicin reversible PdV
dU = TdS dW (204)
donde se ha sustituido dQ por la condicin reversible TdS.
(Cabe indicar que si la sustancia tiene otros formas de trabajo, podemos escribir
dU = dQPdV XdY (205)
donde X es la fuerza generalizada, (una cantidad semejante a la presin) y Y es el desplazamiento generalizado (una
cantidad semejante al volumen)).
Sustituyendo tanto dW como dQ en trminos de las variables de estado
dU = TdS PdV (206)
que es siempre valida, ya que esta es una relacin entre propiedades y ahora es independiente del proceso.
60
En trminos de cantidades especcas
du = Tds Pdv (207)
que es la ecuacin de Gibbs o la Primera y Segunda Leyes combinadas.
La expresin de la Primera y Segunda Leyes combinadas es a veces ms til escribirla en trminos de la entalpa,
o entalpa especca, h = u +Pv, tal que
dh = (du) +Pdv +vdP
dh = (Tds Pdv) +Pdv +vdP
dh = Tds +vdP (208)
O bien, considerando v = 1/
dh = Tds +
dP
(209)
que es otro representacin de la ecuacin de Gibbs o la Primera y Segunda Leyes combinadas en trminos de la
entalpa especca o bien en trminos de la entalpa
dH = TdS +V dP (210)
5.4 Relaciones de Maxwell
Las ecuaciones que relacionan las derivadas parciales de las propiedades P, v, T y s de un sistema compresible simple
entre s se conocen como relaciones de Maxwell . Se obtienen a partir de las cuatro ecuaciones de Gibbs y se basan en
las propiedades de la diferenciales exactas. Son de mucha utilidad ya que permiten obtener de manera indirecta, es
decir sin la necesidad de medir experimentalmente, algunas propiedades termodinmicas.
De las relaciones de Gibbs se tiene
du = Tds Pdv (211)
dh = Tds +vdP (212)
Las otras relaciones de Gibss se basan en dos nuevas combinaciones de propiedades: la funcin del Helmholtz
a y la funcin de Gibbs g, denidas como:
a = u Ts (213)
g = h Ts (214)
Al diferenciar se obtiene
da = du Tds sdT
dg = dh Tds sdT
Si se simplican las relaciones anteriores con las ecuaciones (211) y (212) se obtienen las otras relaciones de Gibbs
para sistemas compresibles simples.
da = sdT Pdv (215)
da = sdT +vdP (216)
Un examen cuidadoso de las cuatro relaciones de Gibbs muestra que tienen la forma de la ecuacin
dz = Mdx +Ndy
con
M
y
x
=
N
x
y
puesto que u, h, a y g son propiedades y en consecuencia, tienen diferenciales exactas. De tal suerte que podemos
escribir:
T
v
s
=
P
s
v
(217)
T
P
s
=
v
s
P
(218)
61
s
v
T
=
P
T
v
(219)
s
P
T
=
v
T
p
(220)
stas se llaman las relaciones de Maxwell . Son de gran valor en la termodinmica por que brindan un medio para
determinar el cambio de entalpa que no es posible medir directamente, a partir de la medicin de los cambios en las
propiedades P, v y T. Note que las relaciones de Maxwell presentadas se limitan a sistemas compresibles simples. Sin
embargo, otras relaciones similares se describen con la misma facilidad para sistemas no simples como los que incluyen
efectos electrolticos, magnticos y otro tipo.
5.5 Cambios de la entropa en un gas ideal
Muchas aplicaciones en la ingeniera involucran ujo de gases (como aire). Enseguida examinamos las relaciones de la
entropa para el comportamiento de un gas ideal. Para comenzar con este punto utilizamos la ecuacin de Gibbs de
la forma
du = Tds Pdv (221)
Para un gas ideal, sabemos que du = c
v
dT, tal que podemos escribir
Tds = c
v
dT +Pdv
ds = c
v
dT
T
+
P
T
dv (222)
Utilizando la ecuacin de estado para un gas ideal (Pv = RT), podemos escribir el cambio de entropa como una
expresin con slo diferenciales exactas,
ds = c
v
dT
T
+R
dv
v
(223)
Esta relacin la podemos ver como la fraccin del cambio de temperatura a la fraccin del cambio de volumen, con
factores de escala c
v
y R ; si el volumen se incrementa sin un decaimiento proporcional de la temperatura (como en
el caso de una expansin libre adiabtica), entonces s se incrementa. Al integrar esta ecuacin entre los estados 1 y 2
tenemos
s = s
s
s
1
=
Z
T2
T
1
c
v
dT
T
+R
Z
v2
v
1
dv
v
(224)
Para un gas perfecto con calores especcos constantes
s = s
s
s
1
= c
v
ln
T
2
T
1
+Rln
v
2
v
1
(225)
En forma adimensional, usando R/c
v
= ( 1)
s
c
v
= ln
T
2
T
1
+ ( 1) ln
v
2
v
1
(226)
que es una ecuacin en trminos de cantidades especcas.
Para N moles de gas se tiene que
S
C
v
= N
ln
T
2
T
1
+ ( 1) ln
V
2
V
1
(227)
y esta expresin permite calcular el cambio de entropa en trminos de la temperatura y el volumen. Podemos
desarrollar un forma alternativa en trminos de la presin y del volumen. La ecuacin de estado del gas ideal puede
escribirse como
lnP + lnv = lnR+ lnT (228)
Tomando las diferenciales a ambos lados de la ecuacin obtenemos
dP
P
+
dv
v
=
dT
T
(229)
62
y al utilizar esta ecuacin en ds = c
v
(dT/T) + R(dv/v) y considerando que c
p
= c
v
+ R; y c
p
/c
v
= , encontramos
que
ds = c
v
dP
P
+
dv
v
+R
dv
v
(230)
o
ds
c
v
=
dP
P
+
dv
v
(231)
al integrar entre los estados 1 y 2
s
c
v
= ln
P
2
P
1
+ ln
v
2
v
1
= ln
P
2
P
1
v
2
v
1
(232)
y simplicando llegamos a
P
2
v
2
P
1
v
1
= exp
s
c
v
(233)
Esta ecuacin describe un proceso general. Para la situacin particular en la cual s = 0, es decir, la entropa es
constante, recuperamos la expresin Pv
= constante Se indico que esta expresin se aplica a un proceso reversible
adiabtico. Ahora vemos, con el uso de la Segunda Ley, un signicado ms profundo de la expresin, y al concepto de
un proceso adiabtico reversible, con una entropa constante, es decir un proceso isentrpico.
5.6 La ecuacin de Clausius-Clapeyron
Las relaciones de Maxwell tienen implicaciones de largo alcance para la investigacin termodinmica y con frecuencia
se utilizan para derivar relaciones termodinmicas tiles. La ecuacin de Clapeyron es una de estas relaciones y
permite determinar el cambio de entalpa asociado con un cambio de fase (como la entalpa de vaporizacin h
fg
) a
partir del conocimiento nico de P, v y T.
Consideremos la relacin de Maxwell, ecuacin (219),
s
v
T
=
P
T
v
Durante un proceso de cambio e fase, la presin es la de saturacin, que depende slo de la temperatura y es
independiente del volumen especco,.es decir,
P
sat
= f (T
sat
)
Por otro lado, la derivada parcial
P
T
v
puede expresarse como la derivada total
dP
dT
sat
que es la pendiente de la curva de saturacin sobre un diagrama P T en el estado de saturacin especco. Esta
pendiente no depende del volumen especco de la ecuacin (219) entre los dos estados de saturacin a la misma
temperatura. Un proceso isotrmico. de cambio de fase lquido-vapor, por ejemplo, la integracin produce
s
g
s
f
=
dP
dT
sat
(v
g
v
f
) (234)
o bien
dP
dT
sat
=
s
fg
v
fg
(235)
Durante este proceso la presin tambin permanece constante. En consencuencia, de la ecuacin (212) podemos
escribir
dh = Tds +vdP
%
0
Z
g
f
dh =
Z
g
f
Tds h
fg
= Ts
fg
63
Si se sustituye este resultado en la ecuacin (235) se obtiene
dP
dT
sat
=
h
fg
Tv
fg
(236)
que recibe el nombre de ecuacin de Clapeyron en honor al ingeniero y fsico francs E. Clapeyron (1799-1864). sta
es una importante relacin termodinmica pues permite determinar la entalpa de vaporizacin h
fg
a una temperatura
determinada midiendo simplemente la pendiente de la curva de saturacin en un diagrama PT y el volumen especco
del lquido saturado y el vapor saturado a la temperatura dada.
La ecuacin de Clapeyron es aplicable a cualquier proceso de cambio de fase que suceda a temperatura y presin
constante. Se expresa en una forma general como
dP
dT
sat
=
h
12
Tv
12
(237)
donde los subndices 1 y 2 indican las faces.
La ecuacin de Clapeyron puede simplicarse para cambios de fase lquida-vapor y slido-vapor con algunas aprox-
imaciones. A bajas presiones v
g
v
f
, por lo que v
fg
= v
g
y si se considera el vapor como un gas ideal, se tiene
que
v
g
=
RT
P
Al sustituir estas aproximaciones en la ecuacin (236), se encuentra que
dP
dT
sat
=
Ph
fg
RT
2
o bien
dP
P
sat
=
h
fg
R
dT
T
2
sat
En pequeos intervalos de temperatura, h
fg
puede considerarse como una constante en algn lugar promedio.
Entonces, al integrar esta ecuacin entre los dos estados de saturacin se obtiene
ln
P
2
P
1
=
h
fg
R
1
T
1
1
T
2
sat
(238)
Esta ltima ecuacin se llama ecuacin de Clapeyron-Clasius, y puede emplearse para determinar la variacin
de la presin de saturacin con la temperatura. Tambin se utiliza en la regin slido-vapor si se sustituye h
fg
por
h
ig
(la entalpa de sublimacin) de la sustancia.
5.7 Clculo del cambio de la entropa en algunos procesos bsicos
1. Transferencia de calor desde o hacia un reservorio de calor
Un reservorio de calor (gura (52)) est a una temperatura constante como fuente o sumidero de calor. Ya que la
temperatura es uniforme, no hay transferencia de calor a travs de un diferencia nita de temperaturas y el intercambio
de calor es reversible. De la denicin de entropa (dS = dQ
rev
/T)
S =
Q
T
(239)
donde Q es el calor en el reservorio (denido aqu como positivo si el calor uye en el reservorio.
Figure 52: Calor transferido desde/hacia el recervorio de calor
64
2. Transferencia de calor entre dos reservorios de calor
El cambio de entropa de los dos reservorios en la gura () es la suma del cambio de entropa de cada uno. Si el
reservorio de alta temperatura est aT
H
y el reservorio de baja temperatura esta a T
L
, el cambio total de entropa es
S =
Q
T
H
+
Q
T
L
=
Q
T
H
T
L
(T
H
T
L
) (240)
Figure 53: Transferencia de calor entre dos reservorios
La Segunda Ley dice que el cambio de la entropa debe ser igual a o mayor que cero. Esto corresponde al enunciado
que el calor debe uir de la fuente con temperatura ms alta hacia la fuente con temperatura ms baja. ste es una
de las declaraciones de la Segunda Ley dada en las secciones anteriores.
3. Posibilidad de tener trabajo cclico desde un reservorio de calor.
Podemos ver el proceso propuesto en la gura (54) como la absorcin del calor Q, por un dispositivo o un sistema,
funcionando en un ciclo, sin expeler ningn calor y realizando trabajo. El cambio total de la entropa es la suma
del cambio en el reservorio, el sistema o dispositivo, y los alrededores. El cambio de la entropa del depsito es
S = Q/T
H
El cambio de la entropa del dispositivo es cero, porque suponemos un ciclo completo (de regreso al
estado inicial) y la entropa es una funcin de estado. Los alrededores reciben solamente trabajo as que el cambio de
la entropa de los alrededores es cero. El cambio total de la entropa es
S
Total
= S
reservorio
+S
dispositivo
+S
alrededores
= Q/T
H
+ 0 + 0 (241)
Figure 54: Trabajo de un solo depsito del calor.
Observemos que el cambio total de la entropa en el proceso propuesto es menor que cero,
S
Total
< 0 (242)
que es imposible pues viola la Segunda Ley, as esto nos dice que es imposible obtener trabajo de un solo depsito
nicamente si el dispositivo opera cclicamente. En este caso la palabra nicamente signica que no ocurra ningn
otro cambio.
4. Cambio de entropa en el problema del ladrillo o bloque caliente.
La temperatura de los ladrillos o bloques se iguala y los reservorios usados en las trasfromaciones reversibles de
estado.
65
Figure 55: Los bloques igualan su temeperatura.
Figure 56: Los reservorios usados para restablecer el estado inicial
Podemos examinar de una manera ms cuantitativa los cambios que ocurren cuando ponemos dos ladrillos juntos,
como se muestra en la gura (55). El proceso por el cual los dos ladrillos llegan a la misma temperatura no es
un proceso reversible, as que necesitamos idear una trayectoria reversible. Para hacer esto imaginemos un nmero
grande de reservorios de calor que varan su temperatura en un pequesimo rango tal como se muestra en la gura
(56) T
H
dT, ..., T
L
+dT. Los ladrillos se ponen e contacto con ellos sucesivamente para incrementar la temperatura
de uno con ms baja temperatura a otro de manera reversible. La transferencia de calor de cualquiera de estos pasos
est dada por dQ = CdT. Para el ladrillo de alta temperatura, el cambio de la entropa es
S
hot brick
=
Z
TM
T
H
CdT
T
= C ln
T
M
T
H
(243)
donde C
J kg
1
es la capacidad calorca. Se puede observar que esta cantidad es menor que cero.
Para el ladrillo a baja temperatura es entonces
S
cold brick
=
Z
T
M
T
L
CdT
T
= C ln
T
M
T
L
(244)
As, el cambio de entropa de los dos ladrillos es
S
bricks
= C
ln
T
M
T
H
+ ln
T
M
T
L
= C ln
T
2
M
T
H
T
L
> 0 (245)
Queda demostrado que el proceso no es reversible.
5. Diferencia entre la expansin libre y la expansin isotrmica reversible de un gas ideal
La diferencia esencial entre una expansin libre en un connamiento aislado y la expansin isotrmica reversible
de un gas ideal se puede ver claramente en trminos de los cambios de entropa. Para un cambio de estado de un
volumen inicial y temperatura inicial V
1
y T
1
a uno nal con volumen V
2
y misma temperatura T
1
el cambio en la
entropa es
S =
Z
2
1
ds =
Z
2
1
dU
T
+
Z
2
1
PdV
T
(246)
y haciendo uso la ecuacin estado y el hecho que dU = 0 para un proceso isotrmico.
S = NRln
V
2
V
1
(247)
Este es el cambio de entropa que ocurre para la expansin libre as como para el proceso de expansin isotrmica
reversible, es importante mantener en mente que los cambios de entropa son cambios de estado y en este caso para
los dos sistemas el estado nal son iguales para ambos procesos.
66
Para la expansin libre
S
sistema
= NRln
V
2
V
1
(248)
S
alrededores
= 0 (249)
No hay cambio en la entropa de los alrededores porque no hay interaccin entre el sistema y los alrededores. El
cambio total de la entropa est por lo tanto,
S
Total
= S
sistema
+S
alrededores
= NRln
V
2
V
1
> 0 (250)
Hay varios puntos que notar en este resultado:
1 S
Total
> 0 as que el proceso es irreversible.
2. S
Total
>
R
2
1
dQ/T = 0, la igualdad entre S y dQ es slo para un proceso reversible.
3. Hay una conexin directa entre el trabajo necesitado para restaurar el sistema al estado original y al cambio de
la entropa:
W = NRln
V
2
V
1
= TS
21
(251)
La cantidad TS tiene un signicado fsico como trabajo perdido en el sentido del trabajo que perdimos la opor-
tunidad de utilizar.
Para la extensin isotrmica reversible
La entropa es una variable del estado as que el cambio de la entropa del sistema es igual que antes. En este caso,
sin embargo, se transere calor al sistema desde los alrededores, (Q
alrededores
< 0) as que
S
alrededores
=
Q
alrededores
T
< 0 (252)
El calor transferido de los alrededores, sin embargo, es igual al calor recibido por el sistema:Q
alrededores
=
Q
sistema
= W
S
alrededores
=
Q
alrededores
T
=
W
T
= NRln
V
2
V
1
(253)
El cambio total en la entropa (sistema ms alrededores) est por lo tanto
S
Total
= S
sistema
+S
alrededores
=
Q
T
Q
T
= 0 (254)
El proceso es reversible ya que el cambio total de entropa es cero.
5.8 Los puntos complicados del captulo 5
1. Por qu la relacin dU = TdS PdV siempre es verdad?
Esto es una relacin entre variables del estado. Como tal no es dependiente de la trayectoria, slo depende de los
estados inicial y nal, y sin importar su transicin del estado inicial al estado nal
2. Qu hace diferente dQ
rev
de dQ?
El trmino dQ
rev
denota el intercambio de calor durante un proceso reversible. Utilizamos la notacin dQ para
denotar intercambio de calor durante cualquier proceso, no no necesariamente reversible.
3.Qu sucede cuando toda la energa en el universo se difunde o se dispersa uniformemente, es decir, se tiene la
mxima entropa?
El siguiente prrafo has sido tomado del libro The Refrigerator and the Universe, by Goldstein and Goldstein:
"The entropy of the universe is not yet at its maximum possible value and it seems to be increasing all the time.
Looking forward to the future, Kelvin and Clausius foresaw a time when the maximum possible entropy would be reached
and the universe would be at equilibrium forever afterward; at this point, a state called the heat death of the universe,
nothing would happen forever after"
Claro est que habra que denir que es universo ya que todo este anlisis ser valido si consideramos que el
universo es un ente aislado y por lo tanto todo lo que contiene est connado. No s si la palabra universo empleada
en la acepcin termodinmica sea el mismo caso aplicable a lo que llamamos universo como todo el cosmos, es decir
al espacio-tiempo donde se encuentran billones de galaxias.
67
Para que ocurriera la mxima entropa (o muerte del universo), lo que llamamos universo tendra que ser ahora
nuestro sistema y este ltimo est entonces aislado y todo lo que contiene est connado.
4 Porqu reescribir el cambio de la entropa en trminos de Pv
?
Comnmente se hace la representacin de cambios termodinmicos en diagramas con coordenadas P v y se utiliza
la ventaja de que la relacin Pv
siempre es constante.
5 Cul es la diferencia entre isentropico y adiabtico?
Isentropico signica sin ningn cambio en entropa (dS = 0). Un proceso adiabtico es un proceso sin transferencia
de calor (dQ = 0). Denimos para los procesos reversibles que TdS = dQ. Es muy importante notar que en general
un proceso adiabtico nos es necesariamente isentropico, slo si el proceso es reversible y adiabtico lo podemos llamar
isentropico. Por ejemplo, un compresor se puede suponer adiabtico pero si est operando con prdidas como friccin
el proceso es irreversible. Inclusive podra operar en estados cuasiestaticos, pero debido a las prdidas no pude ser un
proceso isentropico y es irreversible.
6 En un solo depsito de calor, por qu puede la entropa disminuir?
Cuando observamos un slo reservorio, nuestro sistema es el reservorio en si mismo. El calor que expele el reservorio
es negativo. As el cambio de entropa del reservorio es tambin negativo. La Segunda Ley garantiza que existe un
cambio positivo en la entropa en alguna otra parte en los alrededores que es tan grande, o ms grande, que el valor
absoluto de esta disminucin de entropa del reservorio.
7. Porqu la entropa de un reservorio de calor cambia y la temperatura permanece sin cambio?
Un reservorio de calor en una idealizacin (como un gas ideal, un cuerpo rgido, un uido no viscoso, entre otros).
La idea bsica es que la capacidad calorca del reservorio es lo sucientemente grande as que la transferencia de calor
en cualquier problema no representa un cambio apreciable de alterar la temperatura.
Supongamos que consideramos la atmsfera terrestre como reservorio de calor. La masa del la atmsfera es alrededor
de 10
19
kg (expresado simplemente en orden de magnitud). Calculemos el incremento de temperatura debido al calor
de una turbina de avin durante un vuelo intercontinental de 6 horas. Una turbina produce alrededor de 100 MW
de calor, as que la transferencia de calor es de alrededor de 6 3600 10
8
J que representa un incremento de la
temperatura cercano a 10
10
K Como una muy buena aproximacin podemos decir que la temperatura del resevorio
es constante y podemos calcular la entropa como Q/T.
8. Cmo puede la transferencia de calor desde o hacia un reservorio del calor ser reversible?
Hicimos la suposicin que el reservorio del calor es muy grande, y por lo tanto es una fuente o un sumidero de
calor a temperatura constante. Puesto que la temperatura es uniforme no hay transferencia de calor a travs de una
diferencia nita de temperatura y este intercambio de calor es reversible.
9. Cmo puede S ser menor que cero en cualquier proceso? La entropa no aumenta siempre?
La Segunda Ley dice que la Entropa Total (sistema ms alrededores) aumenta siempre. (Vase la seccin 5.1).
Esto signica que ya sea el sistema o los alrededores puede tener disminucin de la entropa si hay transferencia de
calor entre estos, aunque la suma de todos los cambios de la entropa debe ser positiva. Para un sistema aislado, sin
transferencia de calor hacia los alrededores, la entropa debe aumentar siempre.
10. Si Q/T = S para un reservorio, podramos agregar calor Q al reservorio de cualquier tamao y conseguir
que S permanezca igual.
La respuesta es SI. Esto es verdadero si mientras el sistema que agregabas el calor satisface las condiciones para
ser considerado reservorio
11. Es posible transformar 100% calor en 100% trabajo?
La respuesta es en un caso Si y en otro caso NO.
Para una expansin isotrmica los cambios son:
1. El reservorio cede calor Q.
2. El sistema hace trabajo W (de la misma magnitud de Q)
3. El sistema cambia su volumen y su presin.
4. El sistema cambia su entropa (se incrementa en Q/T).
Como puede verse el calor se tranasfrom en 100% trabajo.
Lo que NO es posible es hacer que el calor se transforme 100% en trabajo en un CICLO donde el sistema regresa
a sus condiciones iniciales.
En el enunciado de Kelvin-Plank nos dice que es imposible para cualquier dispositivo que funcione en un ciclo
recibir calor de un solo depsito o reservorio y producir una cantidad neta de trabajo. Es decir se requiere de un
reservorio ms para completar el ciclo y restaurar el sistema a sus condiciones iniciales. De tal forma que no todo el
calor que sale de un reservorio es transformado en trabajo ya que se requiere de otra transformacin para completar
el ciclo.
13. Por qu en un ciclo S = 0? A caso no es la entropa lo que se trata de minimizar en el diseo en ingeniera?
68
El cambio de la entropa durante un ciclo es CERO por que se considera un ciclo completo donde las condiciones
iniciales y nales del sistema son iguales y la entropa es una funcin de estado.
La entropa que se reere el diseo en ingeniera est referido a la entropa que se genera en los componentes de
un ciclo no ideal. Por ejemplo en un motor de jet verdadero tenemos un compresor no ideal, un combustin no ideal
y tambin una turbina no ideal. Todos estos componentes funcionan con una cierta prdida y generan entropa, que
es la entropa que los diseadores intentan reducir al mnimo. Aunque el cambio en entropa durante un ciclo no ideal
es CERO, el cambio total de la entropa (ciclo y los reservorios de calor) es Stotal > 0.
Se deja al lector investigar los siguientes conceptos:
1. Entropa como propiedad termodinmica.
2. Generacin de entropa (que no es una funcin de estado)
3. Flujo de entropa en sistemas abiertos.
6 Usos de la segunda ley
6.1 Limitaciones en el trabajo que puede proveer una mquina trmica
La segunda ley nos permite hacer un enunciado poderoso y general concerniente al mximo trabajo que se puede
obtener de una mquina trmica que opera en un ciclo. Para ilustrar estas ideas, usemos el Ciclo de Carnot en una
Mquina de Carnot como se muestra en la gura (57)
Figure 57: Mquina de Carnot
La mquina opera entre dos reservorios de calor, transriendo calor tanto Q
H
en el reservorio de alta temperatura
a T
H
con Q
L
en el reservorio T
L
de baja temperatura. Los cambios de entropa en los reservorios son
S
H
=
Q
H
T
H
, Q
H
< 0 (255)
y
S
L
=
Q
L
T
L
, Q
L
> 0 (256)
Los mismos intercambios de calor se aplican al sistema pero con signos contrarios. Denotando el calor transferido
hacia la mquina por le subndice e
Q
He
= Q
H
(257)
Q
Le
= Q
L
(258)
El cambio total de entropa durante la operacin de la mquina es
S
Total
= S
H
+S
L
=
Q
H
T
H
+
Q
L
T
L
(259)
Para la mquina se opera en un ciclo podemos escribir por Primera Ley
U
e
= 0
0 = Q
He
+Q
Le
W
e
(260)
69
o bien
W
e
= Q
H
e
+Q
Le
= Q
H
Q
L
(261)
As podemos escribir
W
e
= Q
H
T
L
S
Total
+Q
H
T
L
T
H
= Q
H
T
L
T
H
T
L
S
Total
(262)
El trabajo de la mquina trmica se puede expresar en trminos del calor recibido tal que,
W
e
= Q
He
T
L
T
H
T
L
S
Total
(263)
El lmite superior de trabajo que se puede realizar ocurre en un ciclo reversible. para el cual el cambio de entropa
(S
Total
) es cero. En tal situacin el mximo trabajo extraible entre T
H
y T
L
es
W
e
= Q
He
T
L
T
H
(264)
Tambin para un ciclo reversible se tiene que
Q
H
T
H
+
Q
L
T
L
= 0 (265)
Estas restricciones o lmites se aplican a todas las mquinas reversible operando cclicamente en dos temperaturas
jas. La eciencia trmica est dada por
th
=
Trabajo realizado
Calor recibido
=
W
e
Q
He
(266)
y se conoce como la eciencia de Carnot a la de un ciclo reversible tal que
Carnot
= 1
T
L
T
H
(267)
La eciencia de Carnot en as la eciencia mxima que puede ocurrir en una mquina trmica operando entre dos
temperaturas.
Este ltimo punto lo podemos analizar de otra manera. El trabajo de la mquina esta dado por
W
e
= Q
H
T
L
S
Total
+Q
H
T
L
T
H
(268)
es decir
T
L
S
Total
= Q
H
+Q
H
T
L
T
H
W
e
(269)
El cambio total de entropa se puede escribir en trminos de la eciencia del Ciclo de Carnot y la razn del trabajo
realizado y el calor absorbido por la mquina trmica, esta ltima es la eciencia de cualquier ciclo pueda realizar
S
Total
=
Q
H
e
T
L
1
T
L
T
H
W
e
Q
H
e
=
Q
H
e
T
L
[
Carnot
cualquier otro ciclo
] (270)
La segunda ley dice que el cambio total de la entropa es igual o mayor qua o cero. Esto signica que la eciencia
del ciclo de Carnot es igual o mayor que la eciencia para cualquier otro ciclo. Para que la eciencia de cualquier otro
ciclo sea igual a la de Carnot S
Total
= 0.
70
6.2 La escala termodinmica de la temperatura
En las consideraciones que hemos tomado para un Ciclo de Carnot no hemos tomado en cuenta las propiedades de
uido de trabajo. Este no est limitado al uso de un gas ideal y puede ser cualquier medio. Si bien en las primeras
secciones obtuvimos la eciencia de Carnot considerando en un gas ideal, as como la denicin de temperatura usando
la ecuacin del gas ideal estas no son esencialmente un fomalismo termodinmico. Ms especcamente, podemos
denir una escala de temperatura termodinmica que es independiente del uido de trabajo. Para llevar a cabo esto,
consideremos la situacin que se muestra en la gura (58) que incluye tres ciclos reversibles. Se tiene un reservorio de
calor de alta temperatura a T
1
y un reservorio de calor a baja temperatura T
3
. Para cualesquiera dos temperaturas
T
1
y T
2
la razn de las magnitudes de calor absorbido y expelido en el ciclo de Carnot tienen el mismo valor para todo
el sistema
Figure 58: Arreglo de mquinas trmicas para mostrar la escala termodinmica de temperatura.
La transferencia de calor Q
1
es la misma en los ciclos A y C, tambin Q
3
es el mismo para los ciclos B y C. Para
un ciclo de Carnot tenemos
= 1 +
Q
L
Q
H
= F (T
L
, T
H
) (271)
tal que es slo funcin de la temperatura.
Del mismo modo podemos escribir
Q
1
Q
2
= F (T
1
, T
2
) (272)
Q
2
Q
3
= F (T
2
, T
3
) (273)
Q
1
Q
3
= F (T
1
, T
3
) (274)
y tambin podemos escribir la relacin
Q
1
Q
3
=
Q
1
Q
2
Q
2
Q
3
(275)
tal que, al comparar esta ltima con las funciones de temperatura antedichas se tiene que
F (T
1
, T
3
)
| {z }
No es funcin de T
2
= [F (T
1
, T
2
)] [F (T
2
, T
3
)]
| {z }
No puede ser una funcin de T
2
(276)
De esta manera concluimos que F (T
1
, T
2
) debe ser de la forma f (T
1
) /f (T
2
), anlogamente se tiene F (T
2
, T
3
) =
f (T
2
) /f (T
3
). La razn del intercambio de calor es por tanto
Q
1
Q
3
= F (T
1
, T
3
) =
f (T
1
)
f (T
3
)
(277)
En general
Q
H
Q
L
= F (T
H
, T
L
) =
f (T
H
)
f (T
L
)
(278)
71
de modo que el cociente de la transferencia calor es una funcin de la temperatura. Podramos elegir cualquier
funcin que sea monotnica, y la opcin ms simple es: f(T) = T . sta es la escala termodinmica de la temperatura
Q
H
/Q
L
= T
H
/T
L
. La temperatura denida de esta manera es la misma que la de un gas ideal; la escala de temperatura
termodinmica y la escala del gas ideal son equivalentes.
6.3 Representacin de procesos termodinmicos en coordenadas T s
En termodinmica resulta muy til gracar la transicin de los estados y los ciclos en trminos de la temperatura
(o entalpa) y la entropaT S as como diagramas P V . La mxima temperatura es en ocasiones una restriccin
del proceso y los cambios en la entalpa los son en el trabajo realizado o el calor recibido directamente, as que
gracando en trminos de estas variables se provee un herramienta que permite escudriar dentro del proceso. En
la gura (59) se muestra un ciclo de Carnot en coordenas T s, y se dibuja entonces un rectngulo, con dos ramas
horizontales a temperatura constante y las otras dos ramas son verticales es decir reversibles adiabticas, ( isentrpicas
dS = dQ
rev
/T = 0)
Figure 59: Ciclo de Carnot en coordenadas T s.
Si el ciclo se sigue en sentido de las manecillas del reloj, el calor que es agrega es
Q
H
=
Z
b
a
TdS = T
H
(S
b
S
a
) = T
H
S (279)
El calor expelido (desde c a d) tiene magnitud |Q
L
| = T
L
S
El trabajo realizado por el ciclo se puede encontrar utilizando la Primera Ley para un proceso reversible
dU = dQdW
= TdS dW (280)
valido nicamente para un proceso reversible. Podemos integrar esta expresin alrededor del trayectoria cerrada en el
ciclo tal que
I
du =
I
TdS
I
dW (281)
donde du es una diferencial exacta y su integral alrededor de un supercie cerrada es cero,
0 =
I
TdS
I
dW (282)
es decir que el trabajo realizado por el ciclo representado por el trmino
I
dW es igual con
I
TdS que es el rea
delimitada por el contorno cerrado en el plano T S. Esta rea representa la diferencia entre el calor absorbido
(
R
TdS a alta temperatura) y el calor expelido (
R
TdS a baja temperatura). Encontrar el trabajo realizado a travs de
la evaluacin de
I
TdS es una alternativa para calcular el trabajo en ciclo reversible de
I
PdV. Finalmente, aunque
hemos realizado la discusin en trminos de entropa S, todas los argumentos anteriores son validos para la entropa
especca s, el trabajo del ciclo reversible por unidad masa
I
Tds.
72
6.4 El ciclo Brayton en coordenadas T s
El ciclo Brayton tiene dos ramas reversibles adiabticas (esto es, isentrpicas) y dos ramas reversibles con transferencia
de calor a presin constante. Para un gas ideal, los cambios en la entalpa especca estn relacionados a los cambios
en la temperatura por dh = c
p
dT, as que la forma del ciclo en el diagrama h s es la misma que el plano T s con
un factor de escala de c
p
entre estas. Al combinar la Primera Ley y la Segunda Ley, que relaciona los cambios de
entalpa, entropa y presin tal que
dh = TdS +
dP
(283)
En la curva de presin constante dP = 0 y dh = TdS. La cantidad requerida es la derivada de la temperatura
T con respecto a s a presin constante (T/s)
p
. Con base en las dos leyes combinadas, Primera y Segunda) y la
relacin dh y dT, esto es
T
s
p
=
T
c
p
(284)
La derivada es la pendiente de la rama a presin constante del ciclo Brayton en el diagrama T s. Para un gas ideal
la pendiente es positiva y directamente proporcional a T
Podemos gracar el ciclo Brayton el un diagrama h s. Esto tiene ventajas ya que los cambios en la entalpa
mustran directamente el trabajo del compresor y la turbina y la entrada y salida de calor. La pendiente de la rama a
presin constante esn el plano h-s es (h/s)
p
= T
Observamos que la semejanza en las formas de los planos de los ciclos T s y hs es verdad para los gases ideales
solamente. Mientras que en ciclos bifsicos, las formas parecen absolutamente diferentes en estos dos planos cuando
el medio no es un gas ideal.
Figure 60: El ciclo ideal de Brayton
Trazando el ciclo Brayton en coordenadas T s permite evaluar su eciencia y da pie a las relaciones entre la
eciencia del ciclo de Carnot y la eciencia de otros ciclos. Como se muestra en al gura (60), uno puede descomponer
el ciclo Brayton en pequeos ciclos de Carnot. La i-sima eciencia del ciclo de Carnot
Ci
= 1
T
low,i
T
high,i
(285)
donde la temperatura indicada como baja es la temperatura a la que se expele calor para un elemento del ciclo y la
temperatura indicada como alta es la absorcin de calor del elemento del ciclo. La parte ms alta y la parte ms baja
de las curvas del ciclo Brayton son a presin constante. Por lo tanto todos los elementos del ciclo de Carnot presentan
el misma razn de presin, esto es
P (T
hihg
)
P (T
low
)
= PR = cosntante (286)
Con base en las relaciones isentrpicas para un gas ideal, sabemos que la razn de presin PR y la razn de temperaturas
TR est relacionado por
PR
(1)/
= TR (287)
73
Las razones de temperatura (T
low,i
/T
high,i
) para el elemento de ciclo i son por tanto las misma y cada elemento de
ciclo tiene la misma eciencia trmica. Slo necesitamos encontrar la razn de temperatura a travs de los ciclos
para determinar la eciencia. Sabemos que la razn de temperatura del primer elemento de ciclo es la razn de
la temperatura de salida del compresor y la temperatura a al entrada de la mquina, T2/T0 en la gura (60). Si
la eciencia de cada elemento del ciclo tiene este valor, la eciencia de todo el ciclo Brayton (compuesto por ciclos
elementales) debe tener este valor
Brayton
= 1
T
inlet
T
compresor exit
(288)
Esta discusin grca demuestra que la eciencia de cualquier otro ciclo termodinmico que funciona entre estas
temperaturas mximas y mnimas tiene una eciencia menor que la de un ciclo de Carnot.
6.5 La irreversibilidad, el cambio de la entropa y la prdida de trabajo
Consideremos un sistema en contacto con un reservorio de calor durante un proceso reversible. Si hay calor absorbido
Q por el resevorio a temperatura T, el cambio en el reservorio est dado por S = Q/T. En general, el proceso
reversible est acompaado por intercambio de calor que ocurre a diferentes temperaturas. Para analizar esto, podemos
visualizar un esquema de reservorios de calor a diferentes temperatura, as que durante un porcin innitesimal del
ciclo no existir ninguna transferencia sobre una diferencia nita de temperatura.
Durante cualquier porcin diferencias, el calor dQ
rev
ser transferido entre el sistema y uno de los reservorios el
cual est a una temperatura. Si dQ
rev
es absorbido por el sistema, el cambio de la entropa del sistema es
dS
sistema
=
dQ
rev
T
(289)
mientras que el cambio de entropa del reservorio est dada por
dS
reservorio
=
dQ
rev
T
(290)
El cambio total de entropa del sistema y los alrededores
dS
Total
= dS
sistema
+dS
reservorio
= 0 (291)
Esto es cierto si existe una cantidad de calor expelida por el sistema.
La conclusin es que para un proceso reversible, no ocurren cambios en la entropa total producida o generada,
esto es, la entropa del sistema ms la entropa de los alrededores es
S
Total
= 0 (292)
Ahora hagamos el mismo anlisis pero para un proceso irreversible que considera al sistema en los mismos estados
propuestos para el proceso reversible. Esto se muestra esquemticamente en la gura (61), con R denotando la
trayectoria reversible y con I para la trayectoria irreversible entre los estados A y B. En el proceso reversible, el
sistema recibe calor dQ y realiza trabajo dW.
Figure 61: Cambio reversible (R) y cambio irreversible (I) entre los estados A y B
El cambio en la energa interna para el proceso irreversible est dada por
dU = dQdW (293)
que es siempre valida con base en la Primera Ley.
74
Para el proceso reversible es
dU = TdS dW
rev
(294)
Tratndose de un ciclo termodinmico, el cambio de la energa interna entre los dos procesos es el mismo. Igualando
las ecuaciones anteriores escribimos
dQ
real
dW
real
= TdS dW
rev
(295)
donde el subndice real se reere al proceso real que es irreversible. El cambio de entropa asociado con el cambio de
estado es
dS =
dQ
real
T
+
1
T
[dW
rev
dW
real
] (296)
Es claro que si el proceso es irreversible, obtenemos menos trabajo que para un proceso reversible, tal que dW
real
<
dW
rev
, as que para un proceso irreversible
dS >
dQ
real
T
(297)
Note que no existe el signo de igualdad entre el cambio de entropa dS y la cantidad dQ/T para un proceso irreversible.
La igualdad slo se aplica para procesos reversibles.
El cambio en la entropa para cualquier proceso que incluye la transformacin entre el estado inicial a y el estado
inicial b es por tanto
S = S
b
S
a
Z
b
a
dQ
real
T
(298)
donde dQ
real
es el intercambio de calor real del proceso. La igualdad slo aplica para un proceso reversible
La diferencia entre dW
rev
dW
real
representa el trabajo que se pudo haber obtenido,pero que no fue as. ste
reere comnmente como trabajo perdido y se denota mediante
dW
lost
= [dW
rev
dW
real
] (299)
De esta manera podemos escribir
dS =
dQ
real
T
+
dW
lost
T
(300)
Esta ecuacin muestra que la entropa de un sistema se puede alterar de dos maneras: (i) a travs del intercambio
de calor y (ii) a travs de las irreversibilidades
Para aplicar la Segunda Ley de la Termodinmica consideramos el cambio total de entropa (sistema ms alrede-
dores). Si los alrededores son un reservorio a temperatura T con el que el sistema intercambia calor,
dS
reservorio
(= dS
alrededores
) =
dQ
real
T
(301)
El cambio total de entropa es por tanto
dS
total
= dS
sistema
+dS
alrededores
=
dQ
real
T
+
dW
lost
T
dQ
real
T
(302)
as
dS
total
=
dW
lost
T
0 (303)
donde la cantidad dW
lost
/T es la entropa generada por la irreversibilidad.
Ms an, podemos indicar para el sistema
dS
sistema
= dS
transferencia de calor
+dS
generada debido a las irreversibilidades
dS
sistema
= dS
TC
+dS
Gen
(304)
El trabajo perdido tambin se llama disipacin y se denota por d. Utilizando esta notacin, el cambio de entropa
innitesimal del sistama es entonces
dS
sistema
= dS
TC
+
d
T
(305)
o bien
TdS
sistema
= dQ+d (306)
75
Podemos escribir la razn de entropa por unidad de tiempo
dS
dt
=
S =
S
TC
+
S
Gen
(307)
La entropa del sistema S se afecta por dos factores, el ujo de calor Q y la adicin de entropa que entra al sistema
dS
Gen
debido a la irreversibilidad. Esta adicin de entropa es cero cuando el proceso es reversible y siempre es positivo
cuando el proceso es irreversible. As, uno puede decir que el sistema desarrolla fuentes que generan entropa durante
un proceso irreversible. La Segunda Ley arma que los sumideros de entropa son imposibles en la naturaleza, que
es una manera grca de decir que dS
Gen
y
S
Gen
son positivas denidas (siempre mayores que cero) y cero es el caso
especial para un proceso reversible.
El trmino
S
TC
=
1
T
dQ
dt
=
Q
T
(308)
el cul se asocia con la transferencia de calor hacia el sistema, se puede interpretar como ujo de entropa. La frontera
es traspasada por el calor y el cociente de este ujo del calor con la temperatura se puede denir como ujo de la
entropa.
Para el ujo de entropa no hay restricciones en el signo asociado a esta cantidad, podemos decir que este ujo
entra y contribuye al aumento de entropa del sistema, mientras que si sale disminuye la entropa del sistema.
Durante un proceso reversible, nicamente este ujo es el que afecta la entropa del sistema.
6.6 Entropa y energa no disponible (disponibilidad)
Consideremos un sistema que consiste de un reservorio de calor a temperatura T
2
en los alrededores (que es la atmsfera)
a temperatura T
0
. Los alrededores son equivalentes al segundo reservorio a la temperatura T
0
. Para una cantidad de
calor Q transferido desde el reservorio, el mximo trabajo W
max
que se puede realizar es Q veces la eciencia trmica
del ciclo de Carnot que opera entre estas dos temperaturas tal que
W
max
= Q
1
T
0
T
2
(309)
Recordando la Segunda Ley de la Termodinmica, en un ciclo slo una parte de la transferencia de calor se
transforma en trabajo, en otras palabras slo parte de la energa calorca esta disponible para transformarse en
trabajo.
Supongamos que transferimos la misma cantidad de calor desde un reservorio directamente a otro reservorio a la
temperaturas T
1
< T
2
. La mxima cantidad de trabajo disponible a partir de la cantidad de calor Q, antes de la
transferencia de calor hacia el reservorio a temperatura T
1
est dada por
W
max,T2,T0
= Q
1
T
0
T
2
(310)
que es el mximo trabajo entre T
2
y T
0
.
La mxima cantidad de trabajo disponible despus de la transferencia de calor del reservorio a T
1
es
W
max,T
1
,T
0
= Q
1
T
0
T
1
(311)
que es el mximo trabajo entre T
1
y T
0
.
Existe una cantidad de energa E
0
que se pudo haber convertido en trabajo antes del proceso de transferencia de
calor irreversible
E
0
= Q
1
T
0
T
2
1
T
0
T
1
= Q
T
0
T
1
T
0
T
2
(312)
o bien
E
0
= T
0
Q
T
1
Q
T
2
(313)
76
Sin embargo, Q/T
1
es la entropa ganada en el reservorio a T
1
, mientras que (Q/T
2
) es la disminucin de entropa
en el reservorio a T
2
. La cantidad de energa E
0
que se pudo haber convertido en trabajo (pero que ahora no pude
ser) se puede escribir en trminos del cambio de entropa y la temperatura de los alrededores como
E
0
= T
0
(S
reservorio a T1
+S
reservorio a T2
)
= T
0
S
proceso de transferencia de calor irreversible
(314)
donde E
0
es el trabajo perdido o energa que no esta disponible para realizar trabajo.
Esta situacin descrita es un caso especial de un principio importante concenrniente al cambio de entropa, la
irreversibilidad y la prdida de capacidad de realizar trabajo.
Ahora lo desarrollaremos esta idea de manera ms general. Consideremos un sistema arbitrario que experimenta
un cambio de estado irreversible, que transere calor a los alrededores (por ejemplo a la atmsfera) y que se pueden
asumir a temperatura constante T
0
.El cambio en la energa interna del sistema durante el cambio de estado es
U = QW (315)
El cambio de entropa de los alrededores es (con Q la transferencia de calor hacia el sistema)
S
alrededores
=
Q
T
0
(316)
Ahora consideremos restaurar el sistema al estado inicial mediante un proceso reversible. Para hacer esto, nece-
sitamos hacer trabajo W
rev
sobre el sistema y extraer desde el sistema la cantidad de calor Q
rev
. El cambio en la
energa interna es,
U = Q
rev
+W
rev
(317)
En este proceso reversible, la entropa de los alrededores cambia una cantidad
S
alrededores
=
Q
rev
T
(318)
Para los cambios combinados (el cambio de estado irreversible y el cambio reversible para regresar al estado inicial),
el cambio de la energa interna es cero porque la energa es una funcin de estado
U
rev
+U = 0 = QW + (Q
rev
+W
rev
) (319)
as que
Q
rev
Q = W
rev
W (320)
Para el sistema, el cambio total de la entropa para el proceso combinado es cero, porque la entropa es una funcin
del estado,
S
sistema, proceso combinado
= S
Proceso irreversible
+S
Proceso reversible
S
sistema, proceso combinado
= 0 (321)
El cambio total de entropa se reeja solamente en el cambio de la entropa de los alrededores:
S
total
=
Q
rev
Q
T
0
(322)
Pero sabemos que el cambio de entropa total, para el sistema ms los alrededores esta dado por
S
total
=
S
Proceso irreversible
+
%0
S
Proceso reversible
Sistema y alrededores
(323)
El cambio total de la entropa se asocia solamente al proceso irreversible y se relaciona con el trabajo en los dos
procesos
S
total
=
W
rev
W
T
0
(324)
77
La cantidad W
rev
W representa el trabajo extra requerido para restablecer el sistema a su estado original.
Es claro que si el proceso fuera reversible, no necesitaramos un trabajo extra para realizar esto. Dicha cantidad
representa de trabajo no disponible debido a la irreversibilidad. La cantidad W
rev
tambin se puede interpretar como
el trabajo que el sistema debera realizar si el proceso original fuera reversible. Desde cualesquiera estas perspectivas.,
podemos identicar la cantidad (W
rev
W) como la cantidad denotada anteriormente como E
0
, representando el
trabajo perdido. El trabajo perdido en un proceso irreversible se puede relacionar al cambio total de entropa (sistema
ms alrededores) con respecto al al temperatura de los alrededores mediante
Trabajo perdido = W
rev
W = T
0
S
total
(325)
Para resumir los resultados de los argumentos antedichos para los procesos en donde el calor se puede transferir
con los alrededores temperatura T
0
,:
1. W
rev
W representa la diferencia entre el trabajo que obtuvimos realmente y el trabajo que sera realizado
durante un cambio reversible de estado. Es el trabajo adicional que sera necesario restaurar el sistema a su estado
inicial.
2. Para un proceso reversible W
rev
= W ; S
total
= 0
3. Para un proceso irreversible W
rev
> W; S
total
> 0
4. (W
rev
W) = E
0
= T
0
S
total
es la energa no disponible para realizar trabajo durante un proceso reversible.
6.7 Algunos comentarios sobre entropa y procesos reversibles e irreversibles
6.7.1 Entropa
1. La entropa es una propiedad termodinmica que mide el grado de restricciones que se han removido de un sistema
y comnmente se asocia al grado de orden que se ha perdido entre un estado y otro. La entropa es una propiedad
extensiva, es decir, la entropa de un sistema complejo es la suma de las entropas de las partes. Nos referimos al
cambio de entropa entre dos estados como
S
2
S
1
=
Z
2
1
dQ
rev
T
(326)
2. La transferencia de entropa Considerando un ciclo (1 2 1) donde uno de los procesos es irreversible
(1 2)y el otro es reversible podemos escribir (2 1)
I
Q
T
0
Z
2
1
Q
T
+
Z
1
2
dQ
rev
T
0 (327)
e identicando el cambio de entropa escribimos
Z
2
1
Q
T
| {z }
Transferencia de
Entropa
(No es una propiedad
Termodinmica)
S
2
S
1
| {z }
Cambio de
entropa
(Propiedad
Termodinmica)
(328)
La transferencia de entropa depende de la trayectoria y no es una propiedad termodinmica.
3. Generacin de entropa. La Segunda Ley de la Termodinmica para un proceso como lo indica la ecuacin
anterior, establece que -algebricamente- la entropa nunca excede el cambio de entropa. El peso que indica el signo
de desigualdad en dicha ecuacin es que la generacin de entropa o produccin de entropa es una cantidad que nunca
es negativa
S
gen
= S
2
S
1
Z
2
1
Q
T
0 (329)
78
6.7.2 Procesos reversibles e irreversibles
Los procesos se pueden clasicar en reversibles e irreversibles. El concepto de proceso reversible nos permite reconocer,
evaluar y reducir las irreversibilidades en procesos reales en la ingeniera.
Consideremos un sistema aislado. La Segunda Ley nos dice que cualquier proceso que redujera la entropa del
sistema aislado es imposible. Supongamos que un proceso ocurre dentro del sistema aislado y que llamaremos en
direccin hacia adelante. Si el cambio en el estado del sistema es tal que la entropa aumenta para el proceso que
llamamos hacia adelante, entonces para el proceso hacia atrs (es decir, para el cambio en reversa hacia el estado
inicial) la entropa disminuira. Este proceso en reversa es imposible para el sistema aislado, y por lo tanto decimos
que el proceso hacia adelante es irreversible.
Si ocurre un proceso, sin embargo, en el cual la entropa no cambia (proceso isentrpico) por el proceso hacia
adelante, entonces tambin el proceso hacia atrs permanece sin cambios. Tal proceso puede ir en cualquier direccin
sin violar La Segunda Ley. Los procesos de este tipo se llaman reversibles. La idea fundamental de un proceso
reversible es que no produce entropa.
La entropa se produce en procesos irreversibles. Todos los procesos verdaderos (con la posible excepcin de ujo
de corriente en superconductores) presentan cierta medida irreversible, aunque muchos procesos se pueden analizar
adecuadamente si se asume que son reversibles. Algunos procesos que son claramente irreversibles son: la mezcla de
dos gases, la combustin espontnea, la friccin, y de la transferencia de la energa como calor de un cuerpo con mayor
temperatura hacia un cuerpo con menor temperatura.
El reconocimiento de las irreversibilidades en un proceso verdadero es especialmente importante en la ingeniera.
La irreversibilidad, o alejarse de la condicin ideal de la reversibilidad, reeja un aumento en la cantidad de energa no
organizada a expensas de energa mejor organizada. La energa organizada (tal como el de un peso levantado) se pone
fcilmente en uso prctico; la energa desorganizada (tal como los movimientos al azar de las molculas en un gas)
requiere forzar o restringir antes de que pueda ser utilizada con ecacia. El ingeniero se esfuerza constantemente en
reducir la irreversibilidades de los sistemas para obtener un funcionamiento mejor de estos.
6.7.3 Ejemplos de procesos reversibles e irreversibles
Los procesos que se idealizan generalmente como reversibles incluyen:
Movimiento sin friccin
Compresin o expansin restringida.
Transferencia de energa como calor debido diferencia innitesimal de la temperatura
Corriente elctrica a travs de una resistencia cero
Reaccin qumica restringida
Mezcla de dos muestras de la misma sustancia en el mismo estado.
Los procesos que son irreversibles incluyen:
Movimiento con friccin
Expansin libre
Transferencia de energa como calor debido la diferencia signicativa de temperatura.
Corriente elctrica a travs de una resistencia diferente a cero
Reaccin qumica espontnea
Mezcla de materia de diversa composicin o estado.
79
6.8 La Segunda Ley para sistemas abiertos
La entropa generada en un volumen de control para un sistema abierto desde un tiempo t hasta un tiempo t la
podemos representar como
S
gen
= S
(t+t)
S
(t)
Q
i
T
i
t +
ms
salida
t
ms
entrada
t (330)
donde S
(t)
y S
(t+t)
es la entropa del sistema en el tiempo t y t respectivamente,
Q
i
/T
i
es la transferencia de
entropa debido a la transferencia de calor del i-simo reservorio de calor,
ms
salida
y
ms
entrada
son los ujos
msicos de entrada y salida acompaados con su razn de entropa.
Tomando el lmite t 0, y considerando la existencia de cualquier nmero de reservorios con transferencia de
calor (i) y ujos msicos de entrada y salida sobre la supercie de control, podemos escribir
S
gen
|{z}
Razn de
generacin
de entropa
=
dS
dt
|{z}
Razn de
acumulacin de
entropa en el
volumen de control
X
i
Q
i
T
i
| {z }
Razn de
transferencia de
entropa por la
transferencia de
calor
+
X
salida
ms
X
entrada
ms
| {z }
Flujo neto de entropa
del volumen de control
debido al ujo msico
0 (331)
Observemos que la transferencia de trabajo es la interaccin de energa que no est acompaada de la transferencia
de entropa.
Otro manera de escribir la ecuacin antedicha es
S
gen
=
Z
V
(s)
t
dV+
Z
A
1
T
q ndA+
Z
A
sv ndA 0 (332)
donde V es el volumen de control ocupado por el sistema abierto, A es el rea de la supercie de control, q es vector
del ujo de calor, v es el vector de velocidad, n es el vector unitario normal y local a la supercie A.
Con base en el teorema de la divergencia
Z
V
FdV =
Z
A
F ndA
y considerando la ecuacin de continuidad para un uido incompresible podemos escribir
s
000
gen
=
Ds
Dt
+
1
T
q
0 (333)
donde aparece la derivada temporal total de la entropa y la divergencia del ujo de calor.
Recordemos que el operador D/Dt () representa toda la variacin por unidad de tiempo de una determinada
propiedad del uido siguiendo a la partcula uida, tal que
D
Dt
()
()
t
+v ()
El primer trmino del lado derecho representa la variacin de la propiedad en un punto jo del espacio y por ello
se la denomina derivada local, mientras que el segundo trmino de la derecha representa la variacin de la propiedad
asociado al cambio de posicin de la partcula uida, y se la denomina derivada convectiva.
Adems, recordemos que la divergencia de un campo mide la tendencia de dicho campo vectorial a originarse en o
a converger hacia ciertos puntos. La divergencia de un campo vectorial es un campo escalar, y se dene como el ujo
del campo vectorial por unidad de volumen:
divF = F = lim
V0
I
A
F dA
donde A representa una supercie cerrada que se reduce a un punto en el lmite V 0.
80
6.9 Efecto del desvo del comportamiento ideal, (comportamiento real del ciclo)
Para concluir este captulo, ahora mejoraremos nuestras estimaciones del funcionamiento del ciclo incluyendo los efectos
de la irreversibilidad. Utilizaremos el ciclo de Brayton como ejemplo. Cules son las fuentes de irreversibilidad?
Prdidas (produccin de la entropa) en el compresor y la turbina.
Disminucin de la presin de estancamiento de la cmara de combustin.
Transferencia de calor.
Consideramos aqu solamente irreversibilidad en el compresor y en la turbina. Debido a estas irreversibilidades,
necesitamos ms trabajo, h
compresor
(los cambios en la energa cintica desde la entrada hasta la salida del compresor
se desprecian), para operar el compresor en la situacin ideal. Tambin conseguimos menos trabajo h
turbina
de la
turbina. Cmo se puede deducir de la gura (62) que el trabajo neto de la mquina trmica es menor que en el ciclo
con componentes ideales.
Figure 62: Ciclo de turbina de gas (Brayton) que muestra el efecto del alejamiento del comportamiento ideal en el
compresor y la turbina
Para desarrollar una descripcin cuantitativa del efecto de este alejamiento del comportamiento reversible, con-
sideramos un gas perfecto con calor especco constante y despreciamos la energa cintica a la entrada y a la salida
tanto en la turbina como en el compresor. Denimos la eciencia adiabtica de la turbina como
turbina
=
w
real
turbina
w
ideal
turbiba
=
h
4
h
5
h
4
h
5s
(334)
donde w
real
turbina
y w
ideal
turbiba
presentan la misma relacin de presiones. Anlogamente para el compresor, la eciencia
adiabtica es
compresor
=
w
ideal
compresor
w
real
compresor
=
h
3s
h
0
h
3
h
0
(335)
para la misma relacin de presiones. Observamos que para la turbina que el cociente es el trabajo real entregado
dividi por el trabajo ideal, mientras que para el compresor el cociente es el trabajo ideal demandado dividi por el
trabajo real requerido. stas no son eciencias trmicas, sino miden el grado con el cual la compresin y la expansin
se acercan a los procesos ideales.
Ahora deseamos encontrar el trabajo neto realizado en el ciclo y la eciencia. El trabajo neto es dado por la
diferencia entre el calor recibido y el expelido o bien por el trabajo del compresor y la turbina, donde tomamos en
cuneta la convencin que el calor recibido es positivo y calor expelido es negativo y el trabajo realizado es positivo y
el trabajo absorbido es negativo.
Trabajo neto =
q
A
|{z}
Calor entrando
q
R
|{z}
Calor saliendo
= (h
4
h
3
) (h
5
h
0
)
w
turbina
w
compresor
= (h
4
h
5
) (h
3
h
0
)
La eciencia trmica es
th
=
Trabajo neto
Calor de entrada
(336)
81
Necesitamos calcular T
3
y T
5
De la denicin de
compresor
T
3
T
0
=
(T
3s
T
0
)
compresor
= T
0
(T
3s
/T
0
1)
compresor
(337)
con
T
3s
/T
0
= Razn de temperatura isentrpica
T
3s
/T
0
=
P
salida
P
entrada
compresor
=
1
compresor
(338)
T
3
= T
0
compresor
1
compresor
+T
0
(339)
Similarmente, por la denicin
turbina
=
w
real
turbina
w
ideal
turbiba
podemos encontrar T
5
T
4
T
5
=
turbina
(T
4
T
5s
) =
turbina
T
4
1
T
5s
T
4
=
turbina
T
4
1
1
turbina
(340)
T
5
= T
4
1
turbina
1
1
turbina
(341)
La eciencia trmica se obtiene mediante
th
= 1 +
Q
L
Q
H
= 1
T
5
T
0
T
4
T
3
(342)
Considerando
compresor
=
1
turbina
= (343)
y
s
=
1
(344)
la razn de temperatura del ciclo isentrpico, podemos escribir
th
= 1
T
4
h
1
turbina
1
1
s
i
T
0
T
4
T
0
h
1
compresor
(
s
1)
i
+ 1
(345)
o bien
th
=
h
1
1
s
i
T
4
h
compresor
turbina
T
4
T
0
s
i
1 +
compresor
h
T4
T0
1
i
s
(346)
Existen varios parmetros no-dimensionales que aparecen en esta expresin para la eciencia trmica.
6.9.1 Parmetros que reejan eleccin en el diseo
s
=
1
relacin de presiones del ciclo
T
4
T
0
mxima temperatura de entrada en la turbina
82
6.9.2 Parmetros que reejan la capacidad de disear y llevar a cabo componentes ecientes
compresor
la eciencia adiabtica del compresor
turbina
la eciencia adiabtica del la turbina.
Adems de la eciencia, necesitamos examinar la cantidad de razn de trabajo neto
W
neto
=
W
turbina
W
compresor
rescribiendo en forma adimensional
W
neto
mc
p
T
0
= (
s
1)
"
turbina
T
4
T0
s
1
compresor
#
En la gura se muestra el comportamiento de la potencia y la eciencia adimensionales para una turbina no-ideal
de gas.
Figure 63: Potencia y eciencia adimensionales para una turbina no-ideal de gas
Para cualesquiera
compresor
,
turbina
6= 1, la ptima relacin de compresin () para la mxima eciencia trmica
th
no es la ms alta que se pueda lograr, como en el ciclo ideal de Brayton. El anlisis es demasiado idealizado en
este sentido. La eciencia ms alta tambin ocurre ms cerca al cociente de la relacin de presin para la mxima
potencia que en el caso de un ciclo ideal. Escoger esto como un criterio de diseo por lo tanto no conducir a deducir
la disminucin de la eciencia comparada con el ciclo ideal.
Existe una alta sensibilidad en la eciencia de los componentes. Por ejemplo para
compresor
,
turbina
= 0.85, la
eciencia del ciclo es dos tercios de la del valor ideal.
La potencia mxima ocurre a un valor de
s
o relacin de presin menor que para el mximo de .
La mxima potencia y la mxima eciencia dependen fuertemente de la mxima razn de temperaturas T
4
/T
0
.
En las guras () y () se muestra un diagrama, en trminos de h s y P v, de un ciclo Brayton con compresor y
turbina no ideales.
En estos diagramas la relacin de compresin es 40, T
0
= 288 K, T
4
= 1700 K, y las eciencias del compresor y la
turbina son 0.9.
6.10 Eciencia de ciclos por Segunda Ley de la Termodinmica
En las secciones anteriores se deni la eciencia trmica as como el coeciente de funcionamiento (coecient of
performance, cop) como una medida del desempeo de los dispositivos. Ya que estos son denidos con base en la
primera ley se conocen como eciencias por primera ley
I
. Sin embargo esta eciencia no hace referencia al mximo
desempeo posible.
Como ejemplo considere dos mquinas trmicas, ambas con La eciencia trmica
thermal
=
Trabajo neto
Calor de entrada
(347)
83
Figure 64: Diagrama T s de un ciclo idela de Brayton.
Figure 65: Diagrama P v de un ciclo idela de Brayton.
del 30%, pero la mquina trmica A opera con una fuente a 600K, mientras que la B opera a 1000K y ambas ocupan
la temperatura atmosfrica para desechar calor a 300K. A primera vista ambas convierten la misma fraccin de calor
en trabajo. Sin embargo observemos que
rev,A
= 1
300
600
= 50% (348)
rev,B
= 1
300
1000
= 70% (349)
Ahora es evidente que la mquina trmica B tiene un potencial de trabajo ms grande que la mquina A. Es decir
que la mquina B se desempea pobremente ante la mquina, aun cuando ambas tienen la misma eciencia trmica.
Para medir el desempeo de los dispositivos denimos la eciencia de segunda ley
II
como la relacin entre la
eciencia trmica real y la eciencia trmica mxima posible (reversible) tal que,
II
=
th
rev
(350)
Con base en esta denicin, las eciencias por segunda ley de los dos sistemas anteriores estn dados por
II,A
=
30%
50%
= 60% (351)
II,B
=
30%
70%
= 43% (352)
Esto es, la mquina trmica A convierte 60% del potencial del trabajo disponible en trabajo til. Esta proporcin es
de slo el 43% para la mquina trmica B.
84
La eciencia de segunda ley tambin puede expresarse como la relacin entre el trabajo til y la salida de trabajo
mximo posible (reversible), tal que
II
=
W
util
W
rev
(353)
para dispositivos productores de trabajo. Esta ltima denicin es ms general porque puede aplicarse tanto a procesos
(como turbinas) como a ciclos. Es importante notar que la eciencia por segunda ley esta comprendida entre los valores
0 y 1, es decir no puede exceder el 100%.
Tambin es posible denir una eciencia para dispositivos no cclicos (como compresores) y cclicos (como refrig-
eradores o bombas de calor), que trabajan con la entrada de trabajo, as podemos escribir
II
=
W
rev
W
util
(354)
Para dispositivos cclicos como refrigeradores y bombas de calor podemos expresar la eciencia por segunda ley
como
II
=
COP
COP
rev
(355)
Las deniciones anteriores para la eciencia por segunda ley no se aplican a dispositivos que no estn destinados
a producir o consumir trabajo. Por tanto es necesaria una denicin ms general. Sin embargo no hay un acuerdo
en una denicin general de eciencia por segunda ley, por lo que se pueden encontrar diferentes deniciones para el
mismo dispositivo. La eciencia por segunda ley est ideada para servir como medida de aproximacin a la operacin
reversible, por ello su valor debe cambiar de cero en el peor de los casos (destruccin completa de exerga) a la unidad
en el mejor de los casos (sin destruccin de exerga), as podemos denir
II
=
Exerga recuperada
Exerga suministrada
= 1
Exerga destruida
Exerga suministrada
(356)
85
Referencias
[1] Abbott, M.M., Vanness, H.C., (1991): Termodinmica. 2a. ed. Mxico: McGraw-Hill.
[2] Moran M.J., Shapiro H. N. (2003). Fundamentals of Engineering Thermodynamics. Wiley; 5th ed. USA.
[3] Van Ness.H.C,(1983). Understanding Thermodynamics. Dover Publications, 3rd. edition. USA.
[4] Bejan A. (2006). Advanced Engineering Thermodynamics. Adrian . Wiley; 3rd edition USA.
[5] Sonntag R. E., Borgnakke C. and Van Wylen G. J , (2002). Fundamentals of Thermodynamics.Wiley; 6th edition
USA.
[6] Callen, H.B., (1985): Thermodynamics. New York: Wiley & Sons.
86
También podría gustarte
- Monografia Del LimonDocumento42 páginasMonografia Del LimonCarlos Abdías Luis Villanueva83% (6)
- Solucionario Callen TermodinamicaDocumento204 páginasSolucionario Callen Termodinamicalexleo100050% (16)
- Indice de RefraccionDocumento3 páginasIndice de RefraccionCarlos Abdías Luis Villanueva60% (10)
- Efectos de La Inflación en La Evaluación de ProyectosDocumento4 páginasEfectos de La Inflación en La Evaluación de ProyectosCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Ef TermodinamicaDocumento14 páginasEf TermodinamicaDeivi Cruz Burgos100% (1)
- S03.s3 - Poner en Práctica - Actividad 3 Semana 3Documento2 páginasS03.s3 - Poner en Práctica - Actividad 3 Semana 3Marycarmen Miranda Ramos100% (1)
- Doble Rendija de YoungDocumento5 páginasDoble Rendija de YoungCarlos Duran Salazar ✅100% (1)
- Termodinamica para Ingenieros Libro de Problemas El Aprendizaje Significativo de La Carmen Velasco Jose A Turegano Tomas Gomez Amaya MartinezDocumento203 páginasTermodinamica para Ingenieros Libro de Problemas El Aprendizaje Significativo de La Carmen Velasco Jose A Turegano Tomas Gomez Amaya Martinezconsuelo chuquimango hurtadoAún no hay calificaciones
- Flujograma Queso MantecosoDocumento1 páginaFlujograma Queso MantecosoCarlos Abdías Luis Villanueva100% (1)
- Entrega 3 ProduccionDocumento18 páginasEntrega 3 ProduccionFannyAún no hay calificaciones
- Introduccion A La Termodinamica Con Aplicaciones de IngenieriaDocumento100 páginasIntroduccion A La Termodinamica Con Aplicaciones de IngenieriadresdelmineAún no hay calificaciones
- Libro Un Primer Curso en Mecanica EstadisticaDocumento331 páginasLibro Un Primer Curso en Mecanica EstadisticaDavid Holguin GomezAún no hay calificaciones
- Apuntes TermodinamicaDocumento110 páginasApuntes TermodinamicaIsrael Machuca100% (1)
- Sistemas Dinámicos de Lazo Abierto y CerradoDocumento6 páginasSistemas Dinámicos de Lazo Abierto y CerradoAndres PinzonAún no hay calificaciones
- TC ModulosDocumento11 páginasTC ModulosMagaly GallardoAún no hay calificaciones
- Ayudantia 11 ProbaDocumento4 páginasAyudantia 11 ProbaBoris Durandeau UrraAún no hay calificaciones
- Notas de Cinética ElectroquímicaDocumento149 páginasNotas de Cinética ElectroquímicaChristian Salazar100% (1)
- Resumen Reactores QuímicosDocumento20 páginasResumen Reactores QuímicosSara Mesa MedinaAún no hay calificaciones
- TERMODINAMICADocumento94 páginasTERMODINAMICAarchivaldoAún no hay calificaciones
- Quimiometria 2021Documento11 páginasQuimiometria 2021Yeferson VeraAún no hay calificaciones
- Guia de Laboratorio TermodinamicaDocumento36 páginasGuia de Laboratorio TermodinamicaBruno Orlando Castedo BeltranAún no hay calificaciones
- Ecuación Del Gas IdealDocumento6 páginasEcuación Del Gas IdealViviana CampbellAún no hay calificaciones
- 6934Documento129 páginas6934amilcar211071Aún no hay calificaciones
- Gases IdealesDocumento23 páginasGases IdealesEduardo RobleroAún no hay calificaciones
- Introducción A Los ProyectosDocumento152 páginasIntroducción A Los ProyectosJimmy Rios BurgaAún no hay calificaciones
- Lab Simulador Ley de OHM ReporteDocumento5 páginasLab Simulador Ley de OHM ReporteJoshua RosarioAún no hay calificaciones
- TEORÍADocumento9 páginasTEORÍAEduardo CerezoAún no hay calificaciones
- Informe Laboratorio Maquinas Termicas IIDocumento48 páginasInforme Laboratorio Maquinas Termicas IIJorgeNúñezAún no hay calificaciones
- Proyecto Plastico 2.0Documento27 páginasProyecto Plastico 2.0Gabriel LSAún no hay calificaciones
- PRÁCTICO N 2 TermodinámicaDocumento1 páginaPRÁCTICO N 2 TermodinámicaJosué G BarjaAún no hay calificaciones
- TermoDocumento8 páginasTermoRodrigo AndresAún no hay calificaciones
- 1 - Introduccion A La IODocumento11 páginas1 - Introduccion A La IOJorgeAún no hay calificaciones
- TP1 Logística 70% - Siglo 21Documento11 páginasTP1 Logística 70% - Siglo 21DaDe Play100% (1)
- UNAD Modulo Fisicoquimica PDFDocumento249 páginasUNAD Modulo Fisicoquimica PDFDanHiel LiZarazoAún no hay calificaciones
- IQA211 Taller 3 (2021-1) ResoluciónDocumento7 páginasIQA211 Taller 3 (2021-1) ResoluciónGuillermo Córdova CastilloAún no hay calificaciones
- Fisica IDocumento84 páginasFisica IDeysi Calero Romero0% (1)
- Analisis y Evaluacion de CalderasDocumento64 páginasAnalisis y Evaluacion de Calderasfriendlich_595718Aún no hay calificaciones
- Unidad 1 Ecuaciones de Estado, Derivadas Parciales y Leyes de Los GasesDocumento34 páginasUnidad 1 Ecuaciones de Estado, Derivadas Parciales y Leyes de Los GasesLaura SofiaAún no hay calificaciones
- Eficiencia TérmicaDocumento11 páginasEficiencia TérmicaMajo TrejoAún no hay calificaciones
- Tercer Taller de Transferencia de Calor I 2020Documento4 páginasTercer Taller de Transferencia de Calor I 2020felipe taveraAún no hay calificaciones
- Examenes TermodinamicaDocumento58 páginasExamenes TermodinamicaPablo LuisAún no hay calificaciones
- Balance de Energía MecánicaDocumento9 páginasBalance de Energía MecánicaRosely Savin Atencio VilcaranaAún no hay calificaciones
- 6072 6018no 01Documento5 páginas6072 6018no 01Alevj DbAún no hay calificaciones
- Problemas de Transferencia de Calor2015Documento8 páginasProblemas de Transferencia de Calor2015GabrielPestanaAún no hay calificaciones
- 1 Guia para El Analisis y Evaluacion de CalderasDocumento32 páginas1 Guia para El Analisis y Evaluacion de CalderasDaniel FerrerAún no hay calificaciones
- PPTS13-14-AARICA-2020-01 Nearpod PDFDocumento62 páginasPPTS13-14-AARICA-2020-01 Nearpod PDFDeysi Velayarce SanchezAún no hay calificaciones
- Diseño de Un Control de Temperatura Inteligente para Incubadoras de Recién NacidosDocumento8 páginasDiseño de Un Control de Temperatura Inteligente para Incubadoras de Recién NacidosNestor Vazquez VillanuevaAún no hay calificaciones
- MAR User Manual ESDocumento88 páginasMAR User Manual ESyashiro732Aún no hay calificaciones
- 1.6 Cuestionario Libro Brock 14 Ed. Cap 1 2 3 y 5Documento6 páginas1.6 Cuestionario Libro Brock 14 Ed. Cap 1 2 3 y 5Andrit Alvarado BaezAún no hay calificaciones
- Calor Parte2 Clase8Documento11 páginasCalor Parte2 Clase8Rudecindo Araya TerceroAún no hay calificaciones
- Investigar y Dar Ejemplos de Que Es La Integral de Una FunciónDocumento3 páginasInvestigar y Dar Ejemplos de Que Es La Integral de Una FunciónSalud y VidaAún no hay calificaciones
- Balance de Masa y EnergíaDocumento7 páginasBalance de Masa y EnergíaCinthia AlbertoAún no hay calificaciones
- Segundo Principio de La TermodinamicaDocumento26 páginasSegundo Principio de La TermodinamicaJaviera FuentesAún no hay calificaciones
- Cinetica Quimica para Sistemas HomogeneosDocumento132 páginasCinetica Quimica para Sistemas HomogeneosVera Loor José EdwinAún no hay calificaciones
- BIB1 U3 ContenidoDocumento74 páginasBIB1 U3 ContenidoSusana GutiérrezAún no hay calificaciones
- Examen Parcial de Refrigeracion 2014-II UnacDocumento3 páginasExamen Parcial de Refrigeracion 2014-II UnacMarx Jonathan Rojas HilarioAún no hay calificaciones
- Pregunta DeberDocumento7 páginasPregunta DeberMarlon SawAún no hay calificaciones
- Resumen de Termdinamica Curso IntroductorioDocumento132 páginasResumen de Termdinamica Curso Introductoriojorge galindoAún no hay calificaciones
- Taller 2 Termodinamica 2.0Documento10 páginasTaller 2 Termodinamica 2.0Ana Karolina Valeria PalenciaAún no hay calificaciones
- Electrodeposicion de ZN en Medio AlcalinoDocumento8 páginasElectrodeposicion de ZN en Medio AlcalinoNatalia CarranzaAún no hay calificaciones
- Lectura 7 Instrumentacion IndustrialDocumento3 páginasLectura 7 Instrumentacion IndustrialAlfonso Jordan Jaramillo0% (1)
- F I S I C A para PREPOLITECNICO TEORIA YDocumento246 páginasF I S I C A para PREPOLITECNICO TEORIA YRonny EspinalAún no hay calificaciones
- Termodinamica DviDocumento86 páginasTermodinamica DviIgnacio Del ToroAún no hay calificaciones
- Termodinamica DviDocumento86 páginasTermodinamica DviAlejandro Rubio MartinezAún no hay calificaciones
- TermodinámicaDocumento50 páginasTermodinámicaJavier RamaAún no hay calificaciones
- Apuntes Física Teórica 2Documento215 páginasApuntes Física Teórica 2Mario Cureño OrtizAún no hay calificaciones
- Semana 8Documento22 páginasSemana 8Natha GoAún no hay calificaciones
- Manual de Laboratorio Industrias AlimentariasDocumento73 páginasManual de Laboratorio Industrias AlimentariasCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Monografia de La Cebolla.2Documento29 páginasMonografia de La Cebolla.2Carlos Abdías Luis VillanuevaAún no hay calificaciones
- Monografia ColiflorDocumento20 páginasMonografia ColiflorCarlos Abdías Luis VillanuevaAún no hay calificaciones
- El TomateDocumento28 páginasEl TomateCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Monografia AguaymantoDocumento13 páginasMonografia AguaymantoCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Soluciones de Gases en LiquidosDocumento16 páginasSoluciones de Gases en LiquidosCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Informe de Molino de Martillos y DiscosDocumento6 páginasInforme de Molino de Martillos y DiscosCarlos Abdías Luis VillanuevaAún no hay calificaciones
- DENSIDAD de La LecheDocumento3 páginasDENSIDAD de La LecheCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Metodos para Analisis de CarneDocumento15 páginasMetodos para Analisis de CarneCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Cómo Se Obtienen Las Calorías de Los AlimentosDocumento10 páginasCómo Se Obtienen Las Calorías de Los AlimentosCarlos Abdías Luis VillanuevaAún no hay calificaciones
- Determinacion de DensidadDocumento6 páginasDeterminacion de DensidadCarlos Abdías Luis Villanueva100% (1)
- Provincia de CajabambaDocumento27 páginasProvincia de CajabambaCarlos Abdías Luis Villanueva0% (1)
- Caracteristicas Sensoriales de La CarneDocumento7 páginasCaracteristicas Sensoriales de La CarneCarlos Abdías Luis VillanuevaAún no hay calificaciones
- TEMA 1 (Conduccion Multidimensional) y REPASO PREVIODocumento7 páginasTEMA 1 (Conduccion Multidimensional) y REPASO PREVIOaleb4119Aún no hay calificaciones
- Determinacion de La Carga Electrica y Potencial ElectricoDocumento5 páginasDeterminacion de La Carga Electrica y Potencial ElectricoJosé AntonioAún no hay calificaciones
- Guía de Estudio 2019 2020 Ciencias ExperimentalesDocumento95 páginasGuía de Estudio 2019 2020 Ciencias ExperimentalesMelisa TorresAún no hay calificaciones
- Tarea 8 Est. GenralDocumento8 páginasTarea 8 Est. GenralAlejandro castilloAún no hay calificaciones
- Analisis de Fisica Tema 3Documento4 páginasAnalisis de Fisica Tema 3jose jose prieto santanaAún no hay calificaciones
- El Legado de Einstein AstronomíaDocumento4 páginasEl Legado de Einstein AstronomíaLeonardo CruzAún no hay calificaciones
- Laboratorio 10-Solido Rigido-LABFIS1100-EDocumento4 páginasLaboratorio 10-Solido Rigido-LABFIS1100-ECarlos Ayaviri CanazaAún no hay calificaciones
- Matematica DiscretaDocumento2 páginasMatematica DiscretaVictor MartinezAún no hay calificaciones
- DMC-JCD-221-0818 (Diseño Mezclas MR 40 Pavimento Alcantarillado Buenavista, Quindio)Documento10 páginasDMC-JCD-221-0818 (Diseño Mezclas MR 40 Pavimento Alcantarillado Buenavista, Quindio)Julio C Daza TorresAún no hay calificaciones
- Sensor EsDocumento4 páginasSensor EsKattya Rosscelyn Silvera GarciaAún no hay calificaciones
- MOD1Calculo de Tuberías Conducción EsmeraldaDocumento186 páginasMOD1Calculo de Tuberías Conducción Esmeraldama GálcaAún no hay calificaciones
- Probabilidad IDocumento3 páginasProbabilidad InoriegamendezvictormanuelAún no hay calificaciones
- Susceptibilidad MagneticaDocumento9 páginasSusceptibilidad MagneticaLIZDELGADO87100% (1)
- Magnitudes Físicas - VfuDocumento6 páginasMagnitudes Físicas - VfuCLAUDIA MARIA PERALTA ZAPATAAún no hay calificaciones
- Movimiento de Electrones en Un Campo MagneticoDocumento6 páginasMovimiento de Electrones en Un Campo MagneticoCristhianAlvarezAún no hay calificaciones
- Guia 61021068 2023Documento10 páginasGuia 61021068 2023angel revillaAún no hay calificaciones
- Semana 04 - GeometríaDocumento3 páginasSemana 04 - GeometríaURRIBURU DE LA CRUZ VALENTINA AISHA SUSELAún no hay calificaciones
- 2a EvaluaciónDocumento2 páginas2a EvaluaciónLa cocina de FaizaAún no hay calificaciones
- FTOOL (Tesis Software Estructural)Documento174 páginasFTOOL (Tesis Software Estructural)Janqui100% (1)
- Registro y Documentación de Bienes CerámicosDocumento8 páginasRegistro y Documentación de Bienes CerámicosjjpduwupcAún no hay calificaciones
- Test Omnibus Nº 10Documento6 páginasTest Omnibus Nº 10wxzc6k9w4yAún no hay calificaciones
- Ficha de Analisis de Puesto de TrabajoDocumento6 páginasFicha de Analisis de Puesto de TrabajoMaria Elena Salas GalindoAún no hay calificaciones
- L09 EST200 Función Lineal.2Documento3 páginasL09 EST200 Función Lineal.2eduardo garinAún no hay calificaciones
- Bender - KoppitzDocumento5 páginasBender - KoppitzAndreah SantacruzAún no hay calificaciones
- Guía No. 6 Matematicas PDFDocumento10 páginasGuía No. 6 Matematicas PDFpaul garciacastroAún no hay calificaciones
- Balance Energia-ProblemasDocumento12 páginasBalance Energia-ProblemasCesar HVAún no hay calificaciones
- Curvas Cerradas No CircularesDocumento22 páginasCurvas Cerradas No Circularesilayaly MatheusAún no hay calificaciones