Documentos de Académico
Documentos de Profesional
Documentos de Cultura
5-Equilibrio Químico
5-Equilibrio Químico
Cargado por
pedroplaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
5-Equilibrio Químico
5-Equilibrio Químico
Cargado por
pedroplaCopyright:
Formatos disponibles
1
QUMICA. 2 BACHILLERATO.
EQUILIBRIO QUMICO
Contenidos:
1) Equilibrio qumico.
2) Constantes de equilibrio.
2.1- Equilibrios homogneos. Constante Kc.
2.2- Clculos en equilibrios homogneos en fase gaseosa. Grado de disociacin.
2.3- Cociente de reaccin.
2.4- La constante de equilibrio Kp. Relacin con Kc.
2.5- Equilibrios heterogneos.
3) Factores que afectan al equilibro qumico. Principio de Le Chatelier.
1) EQUILIBRIO QUMICO
Las reacciones qumicas que slo suceden en un sentido reciben el nombre de irreversibles o
completas. Son reacciones que se inician con unos reactivos y finalizan cuando alguno o todos los
reactivos se consumen por completo. Por ejemplo:
Fe (s) + H2SO4(aq) FeSO4(aq) + H2(g)
A este tipo de reacciones no est dedicado este tema.
Las reacciones reversibles son aquellas en las que los reactivos no se transforman totalmente
en productos, ya que stos vuelven a formar los reactivos, dando lugar as a un proceso de doble
sentido que desemboca en el equilibrio qumico. Por ejemplo:
La reaccin de formacin del trixido de azufre a partir del dixido es reversible, es decir, de la misma
forma que se est formando SO3 (reaccin directa), se est descomponiendo en SO2 y O2 (reaccin
inversa).
Las reacciones reversibles se indican con una doble flecha como la que aparece en el ejemplo
anterior, o tambin: . Un equilibro qumico en general se pude representar de la siguiente
manera:
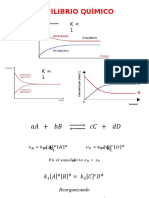
Velocidad de reaccin directa e inversa. Si se hace un estudio de cmo
vara la velocidad de reaccin directa e inversa en una reaccin
reversible se obtendran unas curvas como las que aparecen en la figura
adjunta, que representa esta circunstancia para el equilibro que se
establece entre la formacin y la descomposicin del HI.
Variacin de concentracin de productos y reactivos en una reaccin
reversible. Tambin se puede representar cmo varan las
concentraciones de reactivos y productos en una reaccin reversible (se
2
suelen considerar reactivos a los que corresponden en la reaccin
directa). Por ejemplo, en el equilibro general, las representaciones
podran ser como las que se muestran en la figura adjunta.
En estas representaciones se parte de una cierta cantidad de
reactivos y nada de productos. Pero dado que el equilibrio se
establece entre reaccin directa e inversa, tambin es posible
partir de cantidades de los considerados productos del equilibrio y
nada de los reactivos, establecindose de cualquier modo el
equilibrio. Por ejemplo, en el equilibrio de formacin del SO3, si se
partiera solamente de una cantidad de SO3 como de 0,4 moles en
un recipiente de 1 litro de capacidad, la representacin sera:
El estado de equilibrio dinmico de una reaccin reversible es el estado final del sistema en el
que las velocidades de reaccin directa e inversa son iguales y las concentraciones de las sustancias
que intervienen permanecen constantes.
Hay que imaginar el equilibrio como una incesante transformacin qumica de las sustancias
en los dos sentidos de la reaccin reversible, a pesar de que las concentraciones de reactivos y
productos se mantengan constantes.
2.- CONSTANTES DE EQUILIBRIO
2.1.- Equilibrios homogneos. Constante de equilibrio Kc
Veamos un anlisis experimental del equilibrio
Se realizarn una serie de experiencias en las que:
1) Se partir de una misma cantidad de reactivos y nada de producto (experiencias 1 y 2).
2) Se partir de cantidades no nulas de reactivos y de producto (experiencia 5).
3) Slo se partir de una cierta cantidad de producto, nada de reactivos (experiencias 3 y 4).
Se realizan las medidas correspondientes y se obtiene la tabla siguiente:
Los nmeros en s no dicen nada pero se puede observar que estn relacionados. As, si
hacemos con las concentraciones en el equilibrio de cada experiencia la operacin siguiente:
3
Donde m y n son los coeficientes estequiomtricos de la reaccin ajustada, es decir, para el ejemplo
seguido la operacin sera:
Obtenemos los siguientes resultados:
Las unidades de estos valores son mol
-1
L
Como se puede ver,
El cociente entre las multiplicatorias de las concentraciones de productos y reactivos en el
equilibrio (elevados a sus respectivos coeficientes estequiomtricos), a una temperatura dada, es
constante e independiente de las concentraciones iniciales de reactivos o productos. A este valor se le
denomina constante de equilibrio, Kc,
Lo que ocurre en el equilibrio analizado es generalizable a todos los equilibrios, es decir, para
el equilibrio general
la expresin de la constante de equilibrio, conocida tambin como ley de accin de masas es:
Las unidades de Kc son las que se obtienen de sustituir las concentraciones en molL
-1
. Sus
unidades dependern, por tanto, del equilibrio considerado.
Los equilibrios analizados hasta ahora han sido homogneos, es decir, todas las especies
qumicas presentes se encuentran en la misma fase. Los equilibrios homogneos ms usuales son
aquellos en los que todas las especies estn en estado gaseoso o en disolucin. Ms adelante se analiza
la constante de equilibrio en el caso de equilibrios heterogneos.
Ejemplo de equilibrio homogneo:
N2(g) + 3H2(g) 2NH3(g)
4
Significado del valor de Kc. El valor numrico de Kc es importante ya que aporta informacin
acerca del progreso de la reaccin y de su rendimiento en funcin de las cantidades de productos y
reactivos presentes en el equilibrio. As,
- Si Kc >>> 1, el equilibrio est muy desplazado hacia la derecha, es decir, hacia la formacin
de productos (el rendimiento es grande en la formacin de productos). Ejemplo:
2NO2(g) N2O4(g), Kc (25 :C) = 216 mol
-1
L
- Si Kc <<< 1, el equilibrio est muy desplazado hacia la izquierda, es decir, el rendimiento es
pequeo respecto de la formacin de productos ya que los reactivos prcticamente no
reaccionan. Ejemplo:
I2(g) 2I(g), Kc(727 :C) = 3,810
-5
molL
-1
- Si K = 1, en el equilibrio se cumple que
Como vemos, y tal como se ha dicho, la constante de equilibrio suele venir indicada a una
temperatura determinada ya que su valor depende precisamente de la temperatura.
Relacin entre Kc y la reaccin ajustada. El valor que se da de Kc lo es para un equilibrio
determinado en cuanto a los coeficientes estequiomtricos se refiere. As, por ejemplo:
H2(g) + I2(g) 2HI(g)
H2(g) + I2(g) HI(g)
Reaccin inversa
2HI(g) 2H2(g) + 2I2(g)
Por tanto, todo valor de Kc debe venir acompaado del equilibrio correspondiente ajustado.
2.2.- Clculos en equilibrios homogneos en fase gas. Grado de disociacin
Se trata aqu de realizar una serie de ejercicios-tipo
1
que utilicen la ley de accin de masas.
En el ejercicio n 3 se introduce el concepto de grado de disociacin.
1
Tomados del texto Qumica, Varios autores, Ed. Guadiel (2003)
5
Ejemplo 1.
En un recipiente vaco de 5,00 L se ha colocado una mezcla de nitrgeno e hidrgeno a 500 :C. Al
alcanzarse el equilibrio, se ha comprobado la presencia de 84,28 g de N2, 4,20 g de H2 y 9,61 g de
amoniaco. Calcula el valor de la constante de equilibrio Kc para la reaccin siguiente a la temperatura
dada.
N2(g) + 3H2(g) 2NH3(g)
Datos:
V = 5L,
T = 500 :C
Mm(N2) = 28 g/mol
Mm(H2) = 2 g/mol
Mm(NH3) = 17 g/mol
N2(g) + 3H2(g)
2NH3
Cantidades
iniciales
? ? ?
Cantidades
en equilibrio
(g)
84,28 4,20 9,61
Moles en
equilibrio
[ ] en
equilibrio
Para el equilibrio dado, el valor de Kc ser:
6
Ejemplo 2
La constante de equilibrio Kc para la reaccin H2(g) + I2(g) 2HI(g) vale 46,00 a 490 :C. Sabiendo
que en el equilibrio las concentraciones molares de yodo y de yoduro de hidrgeno son,
respectivamente, 0,0031 molL
-1
y 0,0027 molL
-1
, calcula el valor de la concentracin de hidrgeno en
el equilibrio.
Datos:
Kc = 46,00
[I2] = 0,0031 molL
-1
[HI] = 0,0027 molL
-1
I2(g) + H2(g)
2HI
Cantidades
iniciales
? ? ?
[ ] en
equilibrio
(molL
-1
)
0,0031 ? 0,0027
Despejando la concentracin de hidrgeno tenemos:
7
Ejemplo 3
Se ha introducido en un recipiente vaco de 4,00 L 15,63 g de amoniaco y 9,80 g de nitrgeno. El
equilibrio se alcanza a cierta temperatura cuando el recipiente contiene 0,70 moles de amoniaco.
Calcula el valor de Kc a la temperatura de la experiencia para el equilibrio de disociacin del amoniaco
siguiente:
2NH3(g) N2(g) + 3H2(g)
Datos:
V = 4L,
Masa inicial de nitrgeno = 9,80 g
Masa inicial de amoniaco = 15,64 g
Masa inicial de hidrgeno = 0
Moles de amoniaco en el equilibrio = 0,70 mol
Mm(N2) = 28 g/mol
Mm(H2) = 2 g/mol
Mm(NH3) = 17 g/mol
2NH3
N2(g) + 3H2(g)
Cantidades
iniciales (g)
15,64 9,80 0
Moles
iniciales
0
Supongamos que se forman x moles de N2 hasta llegar al equilibrio. Segn la estequiometra del equilibrio
Moles en
equilibrio(*)
0,70 = 0,92 2x x + 0,35 3x
0,11 + 0,35 = 0,46 moles 30,11 = 0,33 moles
[ ] en
equilibrio
(molL
-1
)
0,70/4 = 0,175
0,46/4 = 0,115 0,33/4 = 0,083
(*)En la tabla anterior x representa el nmero de moles de N2 que se han formado. Segn la estequiometra de la reaccin:
- Por cada mol de nitrgeno que se forma, tambin se forman 3 moles de hidrgeno. Por tanto, si se forman hasta
alcanzar el equilibrio x moles de hidrgeno, tambin se formarn 3x moles de hidrgeno. Los x moles de nitrgeno
formados se sumarn a los 0,35 moles que haba desde el principio.
- Por cada mol de nitrgeno que se forma, se disocian 2 moles de amoniaco. Por tanto, si se forman hasta alcanzar el
equilibrio x moles de hidrgeno, tambin se habrn disociado 2x moles de amoniaco, siendo la cantidad de
amoniaco en equilibrio (0,70 moles) la inicial menos la disociada = 0,92-x.
Por tanto,
Se define el grado de disociacin, , como el tanto por uno de sustancia que se disocia en un equilibrio qumico. Se
determina mediante la razn entre el nmero de moles de la sustancia que se disocia en el equilibrio y el nmero de moles
iniciales de dicha sustancia:
Es evidente que se habla de grado de disociacin en equilibrios qumicos en los que se parte de una sustancia
reactiva que se divide en dos o ms sustancias ms simples, es decir, para equilibrios generales del tipo:
aA bB + cC
En el ejemplo seguido aqu, el grado de disociacin ser:
Es decir, el amoniaco se disocia a la temperatura dada un 23,9%.
8
Ejemplo 4
En un recipiente de 0,50 L se introdujeron 2 moles de bromo y tres moles de hidrgeno. Al alcanzarse
el equilibrio a cierta temperatura, el valor de Kc es 0,50. Calcula las concentraciones de las tres
sustancias presentes en el equilibrio:
Br2(g) + H2(g) 2HBr(g)
Datos:
V = 0,5 L,
Cantidad inicial de Br2 = 2 moles
Cantidad inicial de H2 = 3 moles
Cantidad inicial de HBr = 0
Kc = 0,50
Br2(g) + H2(g)
2HBr
Cantidades
iniciales
(moles)
2 3 0
Supongamos que reaccionan x moles de Br2 hasta alcanzar el equilibrio. Segn la estequiometra del equilibrio:
Moles en
equilibrio
2 x 3 x 2x
[ ] en
equilibrio
(molL
-1
)
La expresin de Kc es:
Realizando operaciones se obtiene una ecuacin de segundo grado:
Cuyas soluciones son:
x1 = 0,64 moles
x2 = -1,35
Es evidente que la segunda solucin no tiene sentido, por tanto, x = 0,64 moles.
Las concentraciones de las tres sustancias en el equilibrio sern:
[Br2] = 2,72 molL
-1
[H2] = 4,72 molL
-1
[HBr] = 2,56 molL
-1
9
Ejemplo 5
Se coloca cierta cantidad de trixido de azufre en un matraz de 0,80 L. A cierta temperatura, se
establece el equilibrio de disociacin siguiente:
2SO3 2SO2 + O2
Se comprueba que en el equilibrio haba dos moles de oxgeno. Si la constante Kc es igual a 0,22 molL
-1
a la temperatura de la experiencia, calcula las concentraciones de las tres sustancias en el equilibrio y
el grado de disociacin.
Datos:
V = 0,80 L,
Kc = 0,22 molL
-1
Moles de oxgeno en el equilibrio = 2
2SO3
2SO2(g) + O2(g)
Moles
iniciales
? = a 0 0
Supongamos que se forman x moles de O2 hasta llegar al equilibrio. Segn la estequiometra del equilibrio
Moles en
equilibrio
a 2x 2x x = 2 (dato)
a - 4 2x = 4 moles
[ ] en
equilibrio
(molL
-1
)
Por tanto,
Operando se obtiene una ecuacin de segundo grado:
0,22a
2
1,76a 36,48 = 0
Cuyas soluciones son:
a1 = 17,48 moles
a2 = - 4,17
Es evidente que la segunda solucin no tiene sentido, por tanto, a = 17,48 moles. Por tanto, las concentraciones de las especies
en el equilibrio son:
[SO3] = 16,85 molL
-1
[SO2] = 5 molL
-1
[O2] = 2,5 molL
-1
En cuanto al grado de disociacin, por definicin (dada en el ejemplo 3):
Es decir, a la temperatura de estudio el trixido de azufre est disociado un 23%.
10
Ejemplo 6
En un recipiente de 0,5 L se colocan 0,075 moles de PCl5 y se establece, a cierta temperatura, el
equilibrio:
PCl5(g) PCl3(g) + Cl2(g)
Calcula la constante de equilibrio sabiendo que PCl5 se encuentra disociado un 62,5%.
Datos:
V = 0,50 L,
Cantidad inicial de PCl5 = 0,075 moles
= 0,625
PCl5
PCl3(g) + Cl2(g)
Moles
iniciales
0,075 0 0
Supongamos que se forman x moles de PCl3 hasta llegar al equilibrio. Segn la estequiometra del equilibrio
Moles en
equilibrio
0,075 x x x
[ ] en
equilibrio
(molL
-1
)
El valor de Kc ser:
El valor de x se puede calcular a partir del dato del grado de disociacin:
De donde, x = 0,047 moles. Por tanto,
11
2.3.- Cociente de reaccin
Idea inicial: El cociente definido por la ley de accin de masas tambin se puede aplicar cuando
no se ha alcanzado el equilibrio.
Veamos el ejemplo general:
aA + bB cC + dD
La reaccin anterior an no est en equilibrio. El cociente definido por la ley de accin de
masas cuando no se ha alcanzado el equilibrio se denomina cociente de reaccin, Qc.
donde los subndices o indican que se trata de concentraciones iniciales, no concentraciones en
equilibrio.
Qc sirve para establecer si una mezcla concreta inicial de reaccin est o no en equilibrio y, si
no lo est, en qu sentido debe evolucionar para alcanzar el equilibrio. Veamos tres posibles
situaciones:
Si Qc > Kc. El sistema no est en equilibrio, cumplindose que:
Para que los dos valores sean iguales debe ocurrir que:
- debe disminuir
- debe aumentar
Por tanto, el sistema se desplaza hacia la izquierda.
Si Qc = Kc, el sistema se encuentra en equilibrio y no se desplaza en sentido alguno.
Si Qc < Kc. El sistema no est en equilibrio, cumplindose que:
Para que los dos valores sean iguales debe ocurrir que:
- debe aumentar
- debe disminuir
Por tanto, el sistema se desplaza hacia la derecha.
Ejemplo
En la reaccin 2HF(g) H2(g) + F2(g), a una temperatura a la que Kc = 1,010
-13
, se analiz la mezcla
de reaccin y se hallaron estos valores (todos ellos en molL
-1
):
[HF] = 0,45
[H2] = 1,010
-3
[F2] = 3,010
-3
12
Predice si el sistema est en equilibrio o bien progresar en un sentido determinado para llegar a l.
2HF(g)
F2 (g) + H2(g)
[ ] (molL
-1
)
en
equilibrio?
0,45 3,010
-3
1,010
-3
Luego, como Qc Kc, el sistema no est en equilibrio. Adems, como Qc > Kc, el sistema se desplazar de manera que la
concentracin de productos disminuya y aumente la de reactivo, es decir, hacia la izquierda.
2.4.- La constante de equilibrio Kp. Relacin con Kc.
Conceptos que es necesario conocer:
- Presin parcial de un gas en una mezcla de gases.
- Presin total de un gas en una mezcla de gases.
- Ley de los gases ideales en una mezcla de gases.
- Relacin entre la presin total de una mezcla de gases y la presin parcial de cada uno de ellos: PA = XAPT, donde
PA es la presin parcial del gas A, XA es la fraccin molar del gas A en la mezcla y PT es la presin total de la mezcla
de gases.
La constante de equilibrio Kc se puede expresar, en el caso de que intervengan gases en el
equilibrio, en funcin de las presiones parciales de cada una de las especies. Veamos:
Sea el equilibrio general
donde todas las especies en equilibrio se encuentran en fase gaseosa. La expresin de Kc ser:
Si n es el nmero de moles y V el volumen del recipiente:
Teniendo en cuenta que cada especie cumple la ley de los gases ideales:
PV = nRT
Por tanto,
donde
13
es la constante de equilibrio en funcin de presiones parciales.
Las unidades de Kp dependern de cada equilibrio y vendrn dadas segn las unidades de las
presiones parciales de las especies presentes en equilibrio. Normalmente las presiones suelen venir en
atmsferas y, por tanto, la constante de los gases que se utilice valdr 0,082 atmL/molK.
Se suele utilizar mucho ms Kp que Kc ya que cuando se trabaja con gases es ms fcil
determinar presiones que concentraciones. Veremos seis ejemplos tpicos de aplicacin (en el ejemplo
n 6 se introduce el grado de disociacin, , en la expresin de Kc).
Ejemplo 1
En un recipiente de 2,0 L se mezcla una cierta cantidad de N2 (g) y de H2 (g) y se eleva la temperatura a
1000 K hasta que el sistema alcance el equilibrio:
N2(g) + 3H2(g) 2NH3(g)
A esta temperatura, el valor de Kc es 2,3710
-3
L
2
mol
-2
. Calcula el valor de Kp.
Ejemplo 2.
Para el equilibrio PCl5(g) PCl3(g) + Cl2(g), la constante Kp vale 1,05 atm a 250 :C. Sabiendo que
en el equilibrio las presiones parciales del PCl5 y del PCl3 son, respectivamente, 0,875 atm y 0,463 atm,
calcula la presin parcial del Cl2 en el equilibrio a dicha temperatura.
PCl5
PCl3(g) + Cl2(g)
Presiones en
equilibrio
(atm)
0,875 0,463
De donde se obtiene que
14
Ejemplo 3.
En un recipiente se han introducido 2 moles de N2O4 y se ha alcanzado el equilibrio
N2O4 (g) 2NO2 (g)
cuando la presin total es de 0,1 atm. Si Kp vale 0,17 atm, calcula el grado de disociacin del N2O4 y las
presiones parciales en el equilibrio.
Datos:
PT = 0,1 atm
Kp = 0,17 atm
N2O4
2NO2(g)
Moles
iniciales
2 0
Supongamos que se disocian x moles de N2O4 hasta llegar al equilibrio. Segn la estequiometra del equilibrio
Moles en
equilibrio
2 x 2x
[ ] en
equilibrio
(molL
-1
)
No se puede conocer pues no conocemos el volumen del recipiente
Planteamos Kp y la desarrollamos en funcin de las fracciones molares (ya que los datos que se dan son moles y conocemos la
presin total).
Donde las fracciones molares son las del equilibrio, es decir:
Sustituyendo estos valores en la expresin de Kp, as como los valores conocidos:
Operando:
De donde resulta una ecuacin de segundo grado cuyas soluciones son:
x1 = - 1,09 (sin sentido)
x2 = 1,09 moles
El grado de disociacin ser:
Las presiones parciales en el equilibrio sern:
O bien,
15
Ejemplo 4
Se han introducido 0,1 moles de PCl5 en un recipiente de 2 L y se alcanz el equilibrio a 250 :C.
PCl5(g) PCl3(g) + Cl2(g)
Si Kp = 1,80 atm, calcula el valor de Kc a la misma temperatura y el grado de disociacin de PCl5.
Datos:
V = 2 L
Moles iniciales de PCl5 = 0,1
Kp 0 1,80 atm
T = 250 :C = 523 K
PCl5
PCl3(g) + Cl2(g)
Moles
iniciales
0,1 0 0
Supongamos que se forman x moles de PCl3 hasta llegar al equilibrio. Segn la estequiometra del equilibrio
Moles en
equilibrio
0,1 x x x
[ ] en
equilibrio
(molL
-1
)
Solucin: x = 0,059 moles.
El grado de disociacin ser:
16
Ejemplo 5.
Para el equilibrio N2O4 (g) 2NO2 (g), a 25 :C, el valor de Kp es 0,143 atm. Sabiendo que la presin
inicial del N2O4 en un matraz de 1 L es 0,05 atm, calcula las presiones parciales de los dos gases y la
presin total en el equilibrio.
Datos:
P = 0,05 atm (presin inicial de tetrxido de dinitrgeno)
Kp = 0,143 atm
T = 25 :C = 298 K
V = 1 L
N2O4
2NO2(g)
Moles
iniciales
a 0
Supongamos que se disocian x moles de N2O4 hasta llegar al equilibrio. Segn la estequiometra del equilibrio
Moles en
equilibrio
a x 2x
[ ] en
equilibrio
(molL
-1
)
a x 2x
Para calcular a utilizamos el dato de la presin inicial de N2O4 y la ecuacin de los gases ideales:
Calculamos tambin Kc:
Ahora podemos calcular x
Resolviendo la ecuacin de segundo grado resultante, la solucin es x = 1,14710
-3
moles.
Por tanto:
- Moles de N2O4 en equilibrio = 2,046210
-3
- 1,14710
-3
= 8,99310
-4
moles
- Moles de NO2 en equilibrio = 21,14710
-3
= 2,29410
-3
moles
Falta calcular las presiones parciales en el equilibrio y la presin total:
17
Antes de ver el ejemplo 6: INTRODUCCIN DEL GRADO DE DISOCIACIN EN LA EXPRESIN DE Kc
Veremos ejemplos concretos con objeto de poder obtener una regla al respecto.
A
2B
Moles
iniciales
a 0
Moles en
equilibrio
a x 2x
[ ] inicial c = a/V 0
= x/a ; x = a , por tanto,
Moles en
equilibrio
a a =
= a(1-)
2a
[ ] en
equilibrio
(molL
-1
)
c(1-) 2c
Por tanto,
Y el nmero total de moles/L en el equilibrio ser = c(1- ) + 2c = c(1+ )
A
B + C
Moles
iniciales
a 0 0
Moles en
equilibrio
a x x x
[ ] inicial c = a/V 0 0
= x/a ; x = a , por tanto,
Moles en
equilibrio
a a =
= a(1-)
a
a
[ ] en
equilibrio
(molL
-1
)
c(1-) c c
Por tanto,
Y el nmero total de moles/L en el equilibrio ser = c(1- ) + c + c = c(1+ )
18
2A
B + 3C
Moles
iniciales
a 0 0
Moles en
equilibrio
a 2x x 3x
[ ] inicial c = a/V 0 0
= 2x/a ; 2x = a ; x = a/2 , por tanto,
Moles en
equilibrio
a a =
= a(1-)
a/2
3a/2
[ ] en
equilibrio
(molL
-1
)
c(1-) c/2 3c/2
[ ] en
equilibrio
(molL
-1
)
2c(1-)
c
3c
Por tanto,
Y el nmero total de moles/L en el equilibrio ser = 2c(1- ) + c + 3c = 2c - 2c + c + 3c = 2c + 2c = 2c(1+)
EN GENERAL
wA
yB + zC
[ ] inicial c 0 0
[ ] en
equilibrio
(molL
-1
)
wc(1-) yc zc
19
Ejemplo 6.
El amoniaco se disocia un 30 % a la temperatura de 423 K y a la presin de 200 atm. Halla los valores
de las constantes Kc y Kp para el equilibrio de disociacin
2NH3(g) N2(g) + 3H2(g)
Datos:
= 0,3
T = 423 K
PT = 200 atm
2NH3
N2(g) + 3H2(g)
[ ] iniciales c 0 0
[ ] en
equilibrio
(molL
-1
)
2c(1-) c 3c
Para calcular Kc es necesario conocer la concentracin inicial de amoniaco, c. Se puede conocer a partir del valor de la presin
total y del nmero total de moles/L en el equilibrio:
Igualando ambas expresiones obtenemos que c = 2,218 molL
-1
. Sustituyendo este valor y el de en la expresin de Kc
obtenemos que:
Kc = 0,55 mol
2
L
-2
En cuanto a Kp,
OTRA FORMA
Se puede empezar por calcular las fracciones molares para determinar primero Kp. Tomando el nmero total de molL
-1
en el
equilibrio determinado anteriormente:
Finalmente,
20
2.5.- Equilibrios heterogneos
Supongamos que podemos calentar carbonato de calcio en un recipiente cerrado. El
carbonato de calcio se descompone en xido de calcio y dixido de carbono. Pero pasado un tiempo se
puede observar que el carbonato de calcio deja de descomponerse, aunque en realidad esto no es as
sino que se establece el siguiente equilibrio:
CaCO3(s) CaO(s) + CO2(g)
Si el mismo proceso se hubiera realizado en un recipiente abierto s que se habra podido
transformar todo el carbonato pues el equilibrio se estara desplazando hacia la derecha (tal como se
analizar ms adelante). Pero en recipiente cerrado se ha establecido un equilibrio heterogneo, que es
aquel en el que las sustancias que forman parte del equilibrio no se encuentran en la misma fase.
Constante de equilibrio. Si planteamos la expresin de la constante de equilibrio para el
ejemplo anterior, que en un principio llamaremos Kc
En esta expresin, las concentraciones de CaO y CaCO3 con constantes pues son sustancias slidas. Esta
circunstancia es aplicable a las concentraciones de slidos y lquidos puros (ver cuadro adjunto). Por
tanto, las concentraciones de sustancias slidas o
lquidas puras en la expresin de la constante de
equilibrio pueden pasar a formar parte de la propia
constante de equilibrio. As, en este equilibrio, la
constante queda:
La constante de un equilibrio heterogneo slo
depende de la concentracin de las especies en
estado gaseoso (o en disolucin) en el equilibrio.
De la misma manera, podemos establecer
que la constante de equilibrio en funcin de las
presiones parciales slo depender de las
correspondientes a aquellas especies en estado
gaseoso. As, en este ejemplo concreto:
El significado de este valor, como se puede ver en la figura
adjunta, es la presin total de las especies gaseosas en el equilibrio
que, en este caso, es slo el dixido de carbono.
Se vern a continuacin tres ejemplos de utilizacin de
constantes de equilibrio en equilibrios heterogneos.
Cul es la concentracin molar del agua pura a 0C si a
esta temperatura su densidad es de 0,92 gcm
3
?
Un litro de agua pura en estas condiciones tiene una
masa de 920 g. Por tanto, su concentracin molar ser:
Esta concentracin es siempre la misma en cualquier
cantidad de agua pura a 0C.
Cul es la concentracin molar del Cu(s) si su densidad
es de 8,94 gcm
3
a 25C?
Un dm
3
de cobre (1 L) en estas condiciones tiene una
masa de 8940 g. Por tanto su concentracin molar ser:
21
Ejemplo 1.
Se introdujo una cierta cantidad de NaHCO3 en un recipiente vaco. A 120 :C se estableci el equilibrio
2NaHCO3 (s) CaCO3(s) + CO2(g) + H2O(g)
cuando la presin en el recipiente era de 1720 mmHg. Calcula las presiones parciales de dixido de
carbono y agua en el equilibrio y los valores de Kp y Kc.
Datos:
PT = 1720 mmHg = 2,26 atm
T = 120 :C = 393 K
Se puede observar que las especies gaseosas en el equilibrio son dos, el CO2 y el H2O. Tambin se puede ver que de
ambas especies se obtiene el mismo nmero de moles, que segn la estequiometra del equilibrio es uno. Si la presin total en
el equilibrio es resultado de la suma
Y las presiones parciales dependen del nmero de moles de CO2 y de H2O, y el nmero de moles de CO2 y el H2O es el mismo
en el equilibrio, entonces:
En cuanto a Kp
En cuanto a Kc
Ejemplo 2.
Dadas las reacciones reversibles siguientes y sus constantes a 1000 :C:
C(s) + CO2(g) 2CO(g) Kp1 = 121,5 atm
CO2(g) + H2(g) CO(g) + H2O(g) Kp2 = 1,59
Calcula el valor de Kp, a la misma temperature, para la reaccin
C(s) + H2O(g) CO(g) + H2(g)
Para obtener el equilibrio requerido debemos dejar el primero como est e invertir el segundo equilibrio:
C(s) + CO2(g) 2CO(g) Kp1 = 121,5 atm =
CO(g) + H2O(g) CO2(g) + H2(g) Kp3 = 1/Kp2 = 0,629=
Como vemos, el valor de Kp ha cambiado en el segundo equilibrio pues al invertir la forma de expresar el equilibrio, tambin
se invierte el valor de Kp (ver pg. 4).
Si sumamos ahora los dos equilibrios anteriores obtenemos el equilibrio demandado cuya Kp es:
C(s) + H2O(g) CO(g) + H2(g)
Si bien se ha obtenido el equilibrio sumando los dos de partida, para obtener Kp a partir de Kp1 y Kp3, vemos que estas
constantes deben ser multiplicadas:
22
Ejemplo 3.
A 700 :C, la presin total del sistema en equilibrio
C(s) + CO2(g) 2CO(g)
Vale 4,50 atm y Kp = 1,52 atm. Calcula las presiones parciales de CO2 y CO en el equilibrio.
Datos:
T = 700 :C = 973 K
PT = 4,50 atm
Kp = 1,52 atm
De la expresin de Kp tenemos una ecuacin:
Como tenemos dos incgnitas debemos encontrar otra ecuacin. A partir del dato de presin total podemos afirmar que:
Que sera una segunda ecuacin que nos permitira resolver el sistema de ecuaciones:
La solucin del sistema es
Nota
Un error comn es considerar que la presin total en el equilibrio
Se reparte equitativamente entre las especies en equilibrio, es decir, para este caso como en el equilibrio ajustado hay dos
moles de CO y un mol de CO2, la presin del CO debe ser el doble que la de CO2. Esto es un error pues solamente se puede
decir que la presin total se reparte entre las especies en equilibrio de acuerdo con la estequiometra del mismo cuando
dichas especies se encuentran bien sea en reactivos, bien sea en productos, pero no repartidas entre reactivos y productos.
Por tanto el ejemplo 1 (pag. 21) s entra dentro de este supuesto.
3) Factores que afectan al equilibro qumico. Principio de Le Chatelier.
3.1.- Energa libre y constante de equilibrio
La siguiente expresin (no vista en la unidad dedicada a Termoqumica) permite calcular la
variacin de energa libre de un proceso qumico a cualquier temperatura (no en condiciones
estndar)
Donde R = 8,31 Jmol/K
Q = el cociente de reaccin (pg. 11)
T = temperatura en grados K
G
0
= variacin de energa libre en condiciones estndar del proceso
G = variacin de energa libre del proceso a la temperatura T.
Ahora bien, si el sistema se encuentra en equilibrio, el cociente de reaccin pasa a ser la
constante de equilibrio K, adems de que la variacin de energa libre en un sistema en equilibrio es
cero:
23
Esta expresin, en la prctica, se suele utilizar para calcular G
0
pues la constante de equilibrio
se puede conocer por otros medios. As, en condiciones estndar:
Qu constante aparece en esta expresin?
- Kp si el equilibrio es homogneo en fase gaseosa, o heterogneo con sustancias en fase
gaseosa.
- Kc si el equilibrio es de sustancias en disolucin.
Atendiendo al valor de la variacin de energa libre estndar de un proceso podemos afirmar
que:
- Si G
0
< 0, entonces K > 1, el equilibrio est desplazado hacia la derecha, hacia la formacin
de productos.
- Si G
0
> 0, entonces K < 1, el equilibrio est desplazado hacia la izquierda, hacia la
formacin de reactivos.
3.2.- Principio de Le Chatelier
Una vez alcanzado un equilibrio qumico, hay una serie de factores que pueden alterarlo,
haciendo que se desplace en un sentido u otro hasta alcanzar un nuevo equilibrio. Estos factores son:
- Un cambio en la concentracin de productos o de reactivos.
- Un cambio en la presin (por cambio del volumen del recipiente, por ejemplo).
- Un cambio en la temperatura.
El objetivo es predecir cmo se ver afectado el equilibrio qumico si cambia alguno de estos
factores, indicando si el equilibrio evolucionar hacia la formacin de productos o de reactivos.
Antes de analizar cmo predecir cmo evoluciona un equilibrio qumico si cambia alguno de
los factores anteriores es conveniente analizar cmo afecta la presencia de un catalizador al
equilibrio qumico:
Como se ha visto en la unidad dedicada a la cintica qumica, la presencia de un
catalizador puede aumentar en el caso de catalizador negativo (o disminuir si el
catalizador es positivo) la energa de activacin que permite alcanzar el complejo
activado. Pero esta circunstancia no afecta al valor de la constante de equilibrio, es
decir, no hace que el equilibrio se desplace en un sentido u otro pues slo afecta a la
rapidez con que se alcanza el equilibrio. Se debe esto a que el catalizador afecta tanto a
la velocidad de la reaccin directa como a la velocidad de la reaccin inversa. Como
ambas velocidades intervienen en el valor de K, ambos efectos se compensan y el valor de
la constante no se ve afectado.
El anlisis cualitativo de la evolucin de un equilibrio qumico si algn factor lo altera se puede
hacer de dos maneras:
- Analizando el cociente de reaccin
- Aplicando el principio de Le Chatelier
24
El principio de Le Chatelier se debe a Henry L. Le Chatelier (1850-1936), enunciado en 1884:
Una alteracin externa de los factores (temperatura, presin o concentraciones) que
intervienen en un equilibrio induce un reajuste del sistema para reducir el efecto de
dicha alteracin y establecer un nuevo estado de equilibrio.
Para analizar cmo afectan los diferentes factores mencionados al equilibrio qumico
utilizaremos como ejemplo el correspondiente a la formacin del amoniaco:
N2(g) + 3H2(g) 2NH3(g)
donde
y
3.2.1.- Influencia del cambio de concentracin de reactivos o productos al equilibrio qumico.
a) Aplicando el principio de Le Chatelier (en general y con dos ejemplos).
-Si aumenta la concentracin de una sustancia el equilibrio de desplaza hacia
donde se consuma dicha sustancia (as se reduce el efecto del aumento de la
concentracin). Por ejemplo, si aumenta la concentracin de amoniaco, el
equilibrio se desplazar hacia la izquierda.
-Si disminuye la concentracin de una sustancia el equilibrio se desplazar
hacia donde se produzca dicha sustancia (as se reduce el efecto de la
disminucin de la concentracin). Por ejemplo, si disminuye la concentracin
de hidrgeno, el equilibrio se desplazar hacia la izquierda.
b) Analizando el cociente de reaccin (para un caso concreto).
-Inicialmente Qc = Kc (el sistema se encuentra en equilibrio).
-Supongamos que aumentamos la concentracin de H2. Entonces el cociente de
reaccin cambia
disminuye respecto al valor de Kc pues la concentracin de hidrgeno se
encuentra en el denominador y sta ha aumentado.
Por tanto, . Para alcanzar de nuevo el equilibrio el cociente de reaccin
debe aumentar, bien aumentando el numerador o disminuyendo el
denominador, es decir, aumentando la concentracin de amoniaco y
25
disminuyendo la concentracin de nitrgeno e hidrgeno. Por tanto, el
equilibrio se desplaza hacia la derecha.
3.2.2.- Influencia del cambio de presin al equilibrio qumico.
En general, un cambio de presin supondr un cambio en el volumen del recipiente. Este factor
afecta mucho a los gases y poco a slidos y lquidos. Cmo afecta a un gas?
si n, R y T son constantes, la presin aumenta si el volumen disminuye para mantener la igualdad
establecida por la ley de los gases ideales (ley de Boyle). Hay que tener en cuenta que si cambia el
volumen, cambia la concentracin de las especies en equilibrio y ste debe desplazarse.
a) Aplicando el principio de Le Chatelier (en general y con dos ejemplos).
-Si la presin aumenta, el volumen disminuye. El nmero de molculas por unidad de
volumen (concentracin) aumenta. Segn el principio de Le Chatelier el sistema se
desplaza de manera que se contrarreste esta circunstancia, se desplaza hacia donde
menor nmero de molculas haya, es decir, hacia donde sea menor el nmero de moles
de sustancias gaseosas. En nuestro ejemplo, si aumenta la presin el equilibrio se
desplaza hacia la derecha pues hay dos moles de sustancias gaseosas en productos y 4
moles de sustancias gaseosas en reactivos.
-Si la presin disminuye, el volumen aumenta. El nmero de molculas por unidad de
volumen disminuye. Segn el principio de Le Chatelier el sistema se desplaza de
manera que contrarreste esta circunstancia, se desplaza hacia donde ms molculas
por unidad de volumen haya, es decir, en nuestro ejemplo, hacia la izquierda.
b) Analizando el cociente de reaccin (para un ejemplo concreto).
-Inicialmente Qc = Kc (el sistema se encuentra en equilibrio).
-Supongamos que aumentamos la presin (disminuyendo el volumen). Entonces el
valor del cociente de reaccin cambia
Si la presin aumenta, el volumen disminuye. Por tanto el cociente de reaccin
disminuye respecto del valor de Kc. Para alcanzar de nuevo el equilibrio cociente de
reaccin debe aumentar, bien aumentando el numerador o disminuyendo el
denominador, es decir, aumentando la concentracin de amoniaco y disminuyendo la
concentracin de nitrgeno e hidrgeno. Por tanto, el equilibrio se desplaza hacia la
derecha.
Es conveniente analizar aqu cmo afectara la adicin de un gas inerte al equilibrio:
Al aadir un gas inerte la presin total en el equilibrio aumenta, pero la fraccin molar
de las especies en equilibrio disminuye. Como la presin parcial de una especie es P =
XPT, uno de los trminos disminuye y el otro aumenta, es decir, la presin parcial se
mantiene y, por tanto Kp no cambia. Como consecuencia de esto, el equilibrio no se ve
afectado por la adicin de un gas inerte.
26
3.2.3.- Influencia de un cambio de temperatura al equilibrio qumico.
Como hemos visto, los cambios anteriores (de presin o concentracin) no afectan al valor de
Kc y Kp, pues slo afectan a cmo se desplaza el equilibrio para mantener constantes los valores de Kc
y Kp.
Pero, un cambio de temperatura afecta al valor de Kp y Kc. En este caso el sistema se
desplazar segn sea el cambio de valor de Kc y Kp.
Para analizar correctamente cmo afecta un cambio de temperatura es necesario conocen qu
sentido la reaccin es exotrmica o endotrmica. As, en nuestro ejemplo:
N2(g) + 3H2(g) 2NH3(g)
la reaccin directa es exotrmica (H
0
= -92,6 kJ), mientras que la reaccin inversa es endotrmica.
Para este factor slo analizaremos cmo se aplica el principio de Le Chatelier (en general y con
dos ejemplos).
-Si aumenta la temperatura se est proporcionando calor al sistema. ste restablece el
equilibrio desplazndose hacia donde se absorbe calor, favorecindose el proceso
endotrmico. En nuestro ejemplo se desplazara hacia la izquierda.
-Si disminuye la temperatura se est quitando calor al sistema, que restablece el
equilibrio desplazndose hacia donde se desprenda calor, es decir, favorecindose el
proceso exotrmico. En nuestro ejemplo se desplazara hacia la derecha.
Veamos otro ejemplo:
Dado el sistema en equilibrio
N2O4(g) 2NO2(g) H
0
= 58,0 kJ
predice el sentido del desplazamiento del sistema al realizar cada una de estas variaciones: a) se aade
algo de dixido de nitrgeno a la mezcla, a temperatura y volumen constantes; b) disminuye la presin
sobre el sistema aumentando el volumen del recipiente, a temperatura constante; c) se calienta la
mezcla a volumen constante; d) se agrega una cierta cantidad de helio.
El valor del cociente de reaccin es
este valor coincide con el de Kc si el sistema se encuentra en equilibrio.
a) Al aumentar la concentracin de NO2, el sistema se desplaza en el sentido que consume NO2, es decir, hacia la izquierda.
Si aumenta la [NO2], ser Qc > Kc. Para que Qc sea igual a Kc debe aumentar el denominador, la [N2O4], es decir, el sistema se
desplaza hacia la izquierda.
b) Una disminucin de la presin supone una disminucin del nmero de molculas por unidad de volumen. El sistema
contrarresta este efecto aumentando el nmero de molculas, para lo cual se desplaza hacia la derecha.
Si disminuye la presin, y al aumentar el volumen, el cociente de reaccin
disminuye, siendo Qc < Kc. Para que llegue a ser igual a Kc debe aumentar el nmero de moles de dixido de nitrgeno, es
decir, se desplaza hacia la derecha.
c) Al aumentar la temperatura, el sistema contrarresta este efecto absorbiendo calor, es decir, haciendo la reaccin
endotrmica, por lo que el sistema se desplaza hacia la derecha, formndose dixido de nitrgeno.
d) La adicin de un gas inerte a la mezcla de reaccin aumenta la presin total del sistema y disminuye la fraccin molar de
N2O4 y de NO2, pero no modifica la concentracin molar ni la presin parcial de los gases. En consecuencia no queda alterado
el equilibrio.
27
Estos apuntes se finalizaron el 12 de abril de 2010
en Villanueva del Arzobispo, Jan (Espaa).
Realizados por: Felipe Moreno Romero
fresenius1@gmail.com
http://www.escritoscientificos.es
También podría gustarte
- Lab. 7 (Conservación de Masa)Documento7 páginasLab. 7 (Conservación de Masa)jayleneAún no hay calificaciones
- Taller Termo 1Documento10 páginasTaller Termo 1AndreitaMmtAún no hay calificaciones
- Equilibrioquimico (Guia Clase)Documento9 páginasEquilibrioquimico (Guia Clase)Edwin MedinaAún no hay calificaciones
- UD 6 Equilibrio Químico COMPLETODocumento66 páginasUD 6 Equilibrio Químico COMPLETOEmmaAún no hay calificaciones
- Tema 7 (22-23)Documento66 páginasTema 7 (22-23)ekaitzibanezriveraAún no hay calificaciones
- Equilibrio QuímicoDocumento18 páginasEquilibrio QuímicoPaloma Padilla GraciaAún no hay calificaciones
- Equilibrio Quimico 12Documento30 páginasEquilibrio Quimico 12zoeAún no hay calificaciones
- Introducción Al Equilibrio QuímicoDocumento15 páginasIntroducción Al Equilibrio QuímicoOsvaldo GonzalezAún no hay calificaciones
- UNIDAD IV Semana 13 - EQUILIBRIO QUIMICODocumento10 páginasUNIDAD IV Semana 13 - EQUILIBRIO QUIMICOOmar Isaac Villaverde LopezAún no hay calificaciones
- Sesion 14 - Equilibrio QuímicoDocumento36 páginasSesion 14 - Equilibrio QuímicoYaquelin ocasAún no hay calificaciones
- Equilibrio QuimicoDocumento12 páginasEquilibrio Quimicojoaquin gomenzoroAún no hay calificaciones
- Definición de Equilibrio QuímicoDocumento15 páginasDefinición de Equilibrio QuímicoSergio SuarezAún no hay calificaciones
- Equilibrio QuímicoDocumento4 páginasEquilibrio Químicojdiazgall9395Aún no hay calificaciones
- Capitulo V. - Aplicaciones Del Equilibrio Químico IDocumento24 páginasCapitulo V. - Aplicaciones Del Equilibrio Químico IytkogAún no hay calificaciones
- Equilibrio QuímicoDocumento9 páginasEquilibrio QuímicoKevin Ortega100% (1)
- Equilibrio Quimico 2014Documento6 páginasEquilibrio Quimico 2014Candelaria PrendesAún no hay calificaciones
- Investigación de Equilibrio QuímicoDocumento13 páginasInvestigación de Equilibrio QuímicoPatty CamposecoAún no hay calificaciones
- Equilibrio Quimico 1Documento8 páginasEquilibrio Quimico 1Manuel MoraisAún no hay calificaciones
- Equilibrio QuimicoDocumento30 páginasEquilibrio QuimicoAMY FERNANDA FERNANDEZ DIAZAún no hay calificaciones
- Equilibrio Químico, Constante y Cociente de Reacción 2024-1Documento19 páginasEquilibrio Químico, Constante y Cociente de Reacción 2024-1Karen PaoAún no hay calificaciones
- Equilibrio QuimicoDocumento10 páginasEquilibrio QuimicoEstela Castrejón JoséAún no hay calificaciones
- Equilibrio QuímicoDocumento29 páginasEquilibrio QuímicofelipeAún no hay calificaciones
- Apuntes Equilibrio Quimico y Acidos y BasesDocumento10 páginasApuntes Equilibrio Quimico y Acidos y BasesAndrea HernandezAún no hay calificaciones
- INTRODUCCIÓNDocumento5 páginasINTRODUCCIÓNmaritza loyoAún no hay calificaciones
- Guía 2 - Equilibrio QuímicoDocumento4 páginasGuía 2 - Equilibrio QuímicoMauricio ahumadaAún no hay calificaciones
- Ud6-Equilibrio QuímicoDocumento18 páginasUd6-Equilibrio Químicosarawilma06Aún no hay calificaciones
- QUÍMICA II Equilibrio Químico Parte 1Documento55 páginasQUÍMICA II Equilibrio Químico Parte 1Jhofran HidalgoAún no hay calificaciones
- 12.equilibrio QuimicoDocumento50 páginas12.equilibrio Quimicodelacruztifanny2Aún no hay calificaciones
- Tema 5: Departamento de Física y Química Tema 5.equilibrio QuímicoDocumento14 páginasTema 5: Departamento de Física y Química Tema 5.equilibrio QuímicoANTONIO CASTAÑO LÓPEZAún no hay calificaciones
- Clase Equilibrio Quimico Aspectos CualitativosDocumento27 páginasClase Equilibrio Quimico Aspectos CualitativosDaniela EscobarAún no hay calificaciones
- Equilibrio QuímicoDocumento9 páginasEquilibrio QuímicoRicardo RodríguezAún no hay calificaciones
- Equilibrio QuimicoDocumento39 páginasEquilibrio QuimicoBrayan Rivera ArgumedoAún no hay calificaciones
- Equilibrio QuimicoDocumento26 páginasEquilibrio Quimicogacv0925Aún no hay calificaciones
- TALLER 6-Equilibrio QuimicoDocumento8 páginasTALLER 6-Equilibrio QuimicoAlejandra Garcia RuizAún no hay calificaciones
- Unidad 9 EquilibrioDocumento69 páginasUnidad 9 EquilibrioXelo VásquezAún no hay calificaciones
- ppt.S05 - VFDocumento25 páginasppt.S05 - VFKokaAún no hay calificaciones
- Equilibrio QuímicoDocumento36 páginasEquilibrio QuímicoLuis MuñozAún no hay calificaciones
- Unidad I Cinetica y Reactores QuimicosDocumento17 páginasUnidad I Cinetica y Reactores QuimicosJosé Juan RamírezAún no hay calificaciones
- Diapositivas Tema. Equilibrio QuímicoDocumento24 páginasDiapositivas Tema. Equilibrio QuímicoEnrique PinazoAún no hay calificaciones
- Equilibrio QuímicoDocumento14 páginasEquilibrio QuímicoCarlos Portilla ArciniegasAún no hay calificaciones
- EJERCICIOS DE EQUILIBRIO QUIMICO Modificado VirtualDocumento20 páginasEJERCICIOS DE EQUILIBRIO QUIMICO Modificado Virtualkaneki kenAún no hay calificaciones
- Guía Síntesis Equilibrio QuímicoDocumento10 páginasGuía Síntesis Equilibrio QuímicoPame HunterAún no hay calificaciones
- Tema 3 Equilibrio Químico PDFDocumento17 páginasTema 3 Equilibrio Químico PDFdavid morochoAún no hay calificaciones
- Guia EquilibrioDocumento6 páginasGuia EquilibrioDaniela Cardenas HigueraAún no hay calificaciones
- Taller EquilibrioDocumento9 páginasTaller Equilibriolaura0% (1)
- S05.s1 - Material - Equilibrio QuímicoDocumento34 páginasS05.s1 - Material - Equilibrio QuímicoOlger Aragon BerlangaAún no hay calificaciones
- Tema 2. Reacciones QuímicasDocumento38 páginasTema 2. Reacciones QuímicasJuan PuertasAún no hay calificaciones
- Pre-Informe: 1. ObjetivoDocumento5 páginasPre-Informe: 1. ObjetivoWilson JosueAún no hay calificaciones
- Apuntes de Equilibrio QuímicoDocumento6 páginasApuntes de Equilibrio QuímicoAlexander UrbinaAún no hay calificaciones
- Equilibrio QuímicoDocumento82 páginasEquilibrio QuímicoErika GimenezAún no hay calificaciones
- s8 Equilibrio Qco TMDocumento24 páginass8 Equilibrio Qco TMMartin GarridoAún no hay calificaciones
- Cinetica de La ReaccionDocumento30 páginasCinetica de La Reaccionnerak quelali100% (5)
- GUIA TP 2da Parte 2017Documento74 páginasGUIA TP 2da Parte 2017gian perazzoAún no hay calificaciones
- Presentaciónpq EquilibrioDocumento43 páginasPresentaciónpq EquilibrioCentzon TotochtinAún no hay calificaciones
- ppt.S05 - VFDocumento25 páginasppt.S05 - VFLeonardo Jesus Fajardo AlbertisAún no hay calificaciones
- Guía de Equilibrio Químico FinalDocumento13 páginasGuía de Equilibrio Químico FinalAzortsoni SiulAún no hay calificaciones
- Contenidos - Activadores (Unidad 3 Parte 1)Documento27 páginasContenidos - Activadores (Unidad 3 Parte 1)Constanza Baquedano GonzálezAún no hay calificaciones
- EQUILIBRIODocumento5 páginasEQUILIBRIOVanessa JimenezAún no hay calificaciones
- Experiencias sobre la propiedad temperaturaDe EverandExperiencias sobre la propiedad temperaturaAún no hay calificaciones
- Programa QU0200 I-2024Documento10 páginasPrograma QU0200 I-2024Valeska RomeroAún no hay calificaciones
- Tecnologias de PoliestirenoDocumento19 páginasTecnologias de PoliestirenoYean1010Aún no hay calificaciones
- Balance Térmico de Los Generadores de VaporDocumento10 páginasBalance Térmico de Los Generadores de VaporSofía RoblesAún no hay calificaciones
- Caudal Í MetroDocumento47 páginasCaudal Í Metrowilliams floresAún no hay calificaciones
- Práctica 4 Movimiento y Energía en Un Plano InclinadoDocumento12 páginasPráctica 4 Movimiento y Energía en Un Plano InclinadoLópez González AlejandroAún no hay calificaciones
- Tabla Periodica ModernaDocumento22 páginasTabla Periodica ModernaAndriy Aldair Macalupu RamirezAún no hay calificaciones
- DCDocumento3 páginasDCRuth Montserrat D. TorresAún no hay calificaciones
- Guía #4 SUSTANCIAS PURAS Y MEZCLAS 7°Documento2 páginasGuía #4 SUSTANCIAS PURAS Y MEZCLAS 7°Kassandra PortillaAún no hay calificaciones
- Secme 7214 PDFDocumento42 páginasSecme 7214 PDFrafael hernandezAún no hay calificaciones
- Marie Curie TripticoDocumento2 páginasMarie Curie TripticolaprincesairiasimonAún no hay calificaciones
- METODOLOGIADocumento1 páginaMETODOLOGIAjpmkirandaloyaga01Aún no hay calificaciones
- Presentacion ViscosidadDocumento4 páginasPresentacion ViscosidadLuis CarreraAún no hay calificaciones
- A3 008 1810557Documento6 páginasA3 008 1810557Fake ProbarAún no hay calificaciones
- Informe de Laboratorio - Practica de DensidadesDocumento9 páginasInforme de Laboratorio - Practica de DensidadesDehivis ZamdelAún no hay calificaciones
- FT Hi Remove SP P074 AlimentariaDocumento1 páginaFT Hi Remove SP P074 AlimentariadulcebeAún no hay calificaciones
- CATALAZADocumento7 páginasCATALAZAerika jimenaAún no hay calificaciones
- Mikhail Tswett (1872-1919)Documento21 páginasMikhail Tswett (1872-1919)AstripAún no hay calificaciones
- Enlaces Quimicos Estructura de LewisDocumento42 páginasEnlaces Quimicos Estructura de LewisPablo Leopoldo Núñez VassalloAún no hay calificaciones
- Calculo y Medida de Infiltraciones de AireDocumento58 páginasCalculo y Medida de Infiltraciones de AireJosé Antonio Cruz BorregoAún no hay calificaciones
- Preguntas de CCNN 1º EsoDocumento3 páginasPreguntas de CCNN 1º EsoJosé Luis Moreiras FernándezAún no hay calificaciones
- Guia Estequiometria 11Documento7 páginasGuia Estequiometria 11Anne AnneAún no hay calificaciones
- Segsa-Pc-028 Procedimiento para Instalacion de QuemadoresDocumento8 páginasSegsa-Pc-028 Procedimiento para Instalacion de QuemadoresAriel Omar Morales VieyraAún no hay calificaciones
- Taller Capacitancia Electrica Maria Veronica PalmaDocumento9 páginasTaller Capacitancia Electrica Maria Veronica PalmaWalter ForeroAún no hay calificaciones
- RESUMEN Del Cosmos Eli.Documento2 páginasRESUMEN Del Cosmos Eli.ELIANA ANDREA GUERRERO SALAZARAún no hay calificaciones
- Alquimia No. 1 La Ciendia Del CambioDocumento29 páginasAlquimia No. 1 La Ciendia Del CambioJaimes JesúsAún no hay calificaciones
- ActividadDocumento8 páginasActividadLucas ProetoAún no hay calificaciones
- Evolucion de Los Materiales en La AviacionDocumento80 páginasEvolucion de Los Materiales en La Aviacionveroni-k-andrea0% (1)
- Anexo 1 Guías de Laboratorio de ElectromagnetismoDocumento28 páginasAnexo 1 Guías de Laboratorio de ElectromagnetismoJuan AponteAún no hay calificaciones