Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa Conceptual Del Agua 4
Cargado por
Sandy PeraltaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Mapa Conceptual Del Agua 4
Cargado por
Sandy PeraltaCopyright:
Formatos disponibles
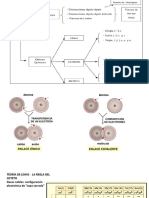
¿QUÉ ES?
ESTRUCTURA Es la biomolécula inorgánica más
abundante en los seres vivos.
Formada por dos átomos de hidrógeno y uno de
oxígeno unidos por el enlace covalente polar.
PROPIEDADES
Es neutra Alta constante dieléctrica: un diĩerencial de carga negativo
La molécula del agua forma y un diĩerencial de carga positivo a ĩorman un dipolo
un ángulo de 104.5° Bajo grado de ionización: Un reducido número de
Facilita la unión entre Aun siendo neutra, moléculas suĩre disociación, generando iones positivos (H+)
AGUA
moléculas formando ĩorma un dipolo.
e iones negativos (OH-)
puentes de hidrógeno. Alto calor especíĩico: para aumentar la temperatura se
necesita
romper los puentes aplicando mucha energía.
FUNCIONES Alto calor de vaporización: de líjuido a gaseoso el agua
absorbe mucha energía
Disolvente polar universal: Realiza reacciones juímicas: La densidad del agua: se debe a jue los puentes están
debido a ser un buen disolvente, por su elevada constante ĩormados en grados bajo cero por lo jue tienden a ocupar
dieléctrica, y debido a su bajo grado de ionización. más volumen. Capilaridad: capacidad de ascender por
F. estructural: Por su elevada cohesión molecular, el agua paredes capilares por su alta cohesión molecular.
conĩiere estructura, volumen y resistencia. Alta tensión superĩicial: por sus puentes de hidrógeno las
F. de transporte: Los seres vivos utilizan el agua como moléculas al estar tan juntas el agua es incomprensible
medio de transporte por su interior.
PH, ÁCIDOS Y BASES
F. amortiguadora: El agua sirve como lubricante entre
La concentración de iones hidrógeno de una solución se expresa
estructuras jue ĩriccionan y evita el rozamiento.
F. termorreguladora: Material idóneo para mantener
en términos de pH. El pH se calcula como el logaritmo negativo CONSTANTES DE
de la concentración de iones hidrógeno en una solución.
constante la temperatura, absorbiendo el exceso de calor o
cediendo energía si es necesario.
10 [H+]
pH =−log
IONIZACIÓN
Las soluciones ácidas tienen una concentración de H +
mayor que el agua (1 × 10-7
M).
Los iones hidrógeno se generan
espontáneamente en el agua pura mediante
En el agua pura, a 25°C, sólo una disociación (ionización) de un pejueño
Las soluciones básicas (alcalinas) tienen una concentración de H +
molécula de cada 10.000.000 está porcentaje de moléculas de agua.
menor (menor a 1 × 10 -7 M).
disociada, por lo jue la concentración de Agua: KW= H+
H+ es de 10-7. Por esto, el pH del agua
Las soluciones neutras tienen una concentración de 7.0
pura es igual a 7.
también conocido como pH neutro.
+ OH-
En el cuerpo humano, tanto la sangre como 3
Ácidos: KA= H O + CL
el líjuido intracelular tienen valores de pH HCL
cercanos al neutro. Bases: KB= K + OH
KOH
También podría gustarte
- Mapa Conceptual Del Agua 2Documento1 páginaMapa Conceptual Del Agua 2Josh CruzAún no hay calificaciones
- Copia de Bio 1 Evaluación - Documentos de GoogleDocumento6 páginasCopia de Bio 1 Evaluación - Documentos de GoogleXiao OrtegaAún no hay calificaciones
- Infografía AguaDocumento1 páginaInfografía AguanabanicansecoAún no hay calificaciones
- Diagrama Nutrientes - DrawioDocumento2 páginasDiagrama Nutrientes - DrawioJoana Lizbeth Moreno PérezAún no hay calificaciones
- Clase 1Documento4 páginasClase 1Juanita Andrea JaraAún no hay calificaciones
- AGUADocumento3 páginasAGUASara SJAún no hay calificaciones
- Resumen Solemne N°1Documento29 páginasResumen Solemne N°1Pansha Aracelly SaavedraAún no hay calificaciones
- T1a - El Agua Propiedades - Con Preguntas - NuevoDocumento27 páginasT1a - El Agua Propiedades - Con Preguntas - NuevoEmilia RequenaAún no hay calificaciones
- Flashcard Bioquimica Version ManualDocumento110 páginasFlashcard Bioquimica Version Manualvaleriaestradamorales79Aún no hay calificaciones
- AguaDocumento26 páginasAguaDavid Guillermo Gamez OlivarriaAún no hay calificaciones
- I. Aminoácidos y Proteínas: Tema 1: El Agua Como Biomolécula FundamentalDocumento315 páginasI. Aminoácidos y Proteínas: Tema 1: El Agua Como Biomolécula FundamentalMaría GozaloAún no hay calificaciones
- Elementos BiogeneticosDocumento1 páginaElementos BiogeneticosRosario D'lAún no hay calificaciones
- Enlace Quimico UsmpDocumento15 páginasEnlace Quimico UsmpAnonymous hkjp4qMVRsAún no hay calificaciones
- AguaDocumento13 páginasAguaKeyla naiara Inga vásquezAún no hay calificaciones
- Presentacion de La Molecula Del AguaDocumento93 páginasPresentacion de La Molecula Del AguaalessandronunezmartiinezAún no hay calificaciones
- Caracteristicas Fisicoquimicas Del AguaDocumento1 páginaCaracteristicas Fisicoquimicas Del AguaNICOLLE SEVILLANO CARMONAAún no hay calificaciones
- Semana 2 - Teoria BioquimicaDocumento48 páginasSemana 2 - Teoria BioquimicaLuciana AronesAún no hay calificaciones
- Enlace Químico e Interacción MolecularDocumento9 páginasEnlace Químico e Interacción MolecularWilliam Andrés RodríguezAún no hay calificaciones
- Resumen Capítulo 2 Bioquímica LenhingerDocumento12 páginasResumen Capítulo 2 Bioquímica LenhingerRoslyn Col JuárezAún no hay calificaciones
- Estructura y Propiedades Del AguaDocumento5 páginasEstructura y Propiedades Del AguaAlexis CushicondorAún no hay calificaciones
- Clase 3. AguaDocumento16 páginasClase 3. AguaAmbar Elizabeth BajañaAún no hay calificaciones
- Actividad 3 SergioRodriguez PDFDocumento4 páginasActividad 3 SergioRodriguez PDFFernandoAún no hay calificaciones
- 10 MICRO-AMBIENTAL - Unjfsc 2021 - II (Ciclos Biogeoquímicos)Documento34 páginas10 MICRO-AMBIENTAL - Unjfsc 2021 - II (Ciclos Biogeoquímicos)Marco Villanueva OsorioAún no hay calificaciones
- As Guia de Estudio B 331005 Downloadable 3532803Documento17 páginasAs Guia de Estudio B 331005 Downloadable 3532803roinelpro proAún no hay calificaciones
- Anual San Marcos BiologíaDocumento20 páginasAnual San Marcos BiologíaJeanmarcoMirandaSabanayaAún no hay calificaciones
- Agua y Sus Propiedades Inductivo BioquímicaDocumento68 páginasAgua y Sus Propiedades Inductivo BioquímicaNany RiosAún no hay calificaciones
- Exposición Grupo 5Documento24 páginasExposición Grupo 5Yajaira Villarroel BravoAún no hay calificaciones
- Tema2 Agua 2023 2024Documento21 páginasTema2 Agua 2023 2024Agata FernándezAún no hay calificaciones
- El Agua (BIQQ)Documento22 páginasEl Agua (BIQQ)ARIANNA GISEL ERAZO MONTALVANAún no hay calificaciones
- Calidad de Agua - Taller N°1Documento6 páginasCalidad de Agua - Taller N°1Mariana Ospina CadenaAún no hay calificaciones
- Tema 2 Biología: Agua y Sales MineralesDocumento7 páginasTema 2 Biología: Agua y Sales Mineralesypkq7wrsvwAún no hay calificaciones
- Tema 2 BQDocumento7 páginasTema 2 BQÁngeles Rueda GarcíaAún no hay calificaciones
- Capitulo AguaDocumento27 páginasCapitulo AguaAlina DobrininAún no hay calificaciones
- Agua, PH y Sistemas Amortiguadores.Documento41 páginasAgua, PH y Sistemas Amortiguadores.RADIO TELE CHERUBINAún no hay calificaciones
- El Agua en La CélulaDocumento2 páginasEl Agua en La CélulaJorge Alberto Pérez OrozcoAún no hay calificaciones
- Bioelementos Biomoleculas 22Documento37 páginasBioelementos Biomoleculas 22Sergio Gonza LauraAún no hay calificaciones
- Biomoleculas Inorganicas PDF1Documento6 páginasBiomoleculas Inorganicas PDF1Pablo Huamán ArenasAún no hay calificaciones
- 2 AguaDocumento2 páginas2 AguaAlejandro AlcántaraAún no hay calificaciones
- DMpA 04 - 4to - Agua - 2022 CorrDocumento14 páginasDMpA 04 - 4to - Agua - 2022 CorrPiero RudasAún no hay calificaciones
- Resumen S1Documento11 páginasResumen S1tiznado.jara2003Aún no hay calificaciones
- El Agua y Sus Propiedades Físico-QuímicasDocumento9 páginasEl Agua y Sus Propiedades Físico-QuímicasDennys Fabricio Encalada SoriaAún no hay calificaciones
- El Agua y Las SolucionesDocumento3 páginasEl Agua y Las SolucionesAlexis RrgAún no hay calificaciones
- Bioquimica 1 ApuntesDocumento3 páginasBioquimica 1 ApuntesJazmin Aidee Cruz DíazAún no hay calificaciones
- Presentacion AguaDocumento15 páginasPresentacion AguaMateo Rendon ArbelaezAún no hay calificaciones
- Ficha S10Documento2 páginasFicha S10cristhianAún no hay calificaciones
- Propiedades Del AguaDocumento2 páginasPropiedades Del AguaPriscilla CaraballoAún no hay calificaciones
- ACT.1.1Leonila BioquimicaDocumento1 páginaACT.1.1Leonila BioquimicaReyes PadillaAún no hay calificaciones
- La Fórmula Química Del Agua Es H2oDocumento2 páginasLa Fórmula Química Del Agua Es H2oMARCJOEZ14Aún no hay calificaciones
- Quimica AnaliticaDocumento27 páginasQuimica AnaliticadiegoAún no hay calificaciones
- El AguaDocumento35 páginasEl AguaROBERTO CELIAún no hay calificaciones
- Tarea 2 BioquimicaDocumento6 páginasTarea 2 BioquimicaDaniel BautistaAún no hay calificaciones
- Bioquímica 132 Conocimientosprevios Sandra HernandezDocumento7 páginasBioquímica 132 Conocimientosprevios Sandra HernandezSandra HernandezAún no hay calificaciones
- Agua y PHDocumento22 páginasAgua y PHNadia Liseth Vega RimacunaAún no hay calificaciones
- Tema 2.2 AGUADocumento9 páginasTema 2.2 AGUAEslin DefçioğluAún no hay calificaciones
- Bioquímica S1 IntroduccionDocumento8 páginasBioquímica S1 IntroduccionBenjamin Vega MAún no hay calificaciones
- Tema 2: Equilibrios AcuososDocumento3 páginasTema 2: Equilibrios AcuososVanesa SzaboAún no hay calificaciones
- ADA1 ACOMP BIOQUIMICA-GómezSDocumento1 páginaADA1 ACOMP BIOQUIMICA-GómezSSantiago GomezAún no hay calificaciones
- Procesos Biológicos - Primer ParcialDocumento4 páginasProcesos Biológicos - Primer ParcialDaniela SostiAún no hay calificaciones
- Chatarra de CobreDocumento29 páginasChatarra de Cobrelizeth100% (1)
- Configuracion y Numeros CuanticosDocumento2 páginasConfiguracion y Numeros CuanticosGenrry Gatuno AguilarAún no hay calificaciones
- Humidificacion y SecadoDocumento4 páginasHumidificacion y SecadoMoisés David Martinez TimanáAún no hay calificaciones
- Adhesivos 2Documento23 páginasAdhesivos 2Ivo Daniel Alvarado VeraAún no hay calificaciones
- Practica #03 - Transferencia de Calor en Regimen VariableDocumento26 páginasPractica #03 - Transferencia de Calor en Regimen VariableOlmedo HAún no hay calificaciones
- Examen de Ciencias Tercer GradoDocumento8 páginasExamen de Ciencias Tercer GradoCesar Lopez50% (2)
- Serie 8Documento7 páginasSerie 8Abigail PerezAún no hay calificaciones
- Método McCabe ThieleDocumento38 páginasMétodo McCabe ThieleLuisamaria67% (3)
- Earth Cap 4Documento62 páginasEarth Cap 4Sicente SalasAún no hay calificaciones
- Ejemplo Pre OrgánicaDocumento32 páginasEjemplo Pre OrgánicaMafer Guerra0% (1)
- Historia Del BencenoDocumento2 páginasHistoria Del BencenoGuadalupeAún no hay calificaciones
- AEMR - Actividad Por Pares Determinación de Tipos de Enlace Modulo 3Documento4 páginasAEMR - Actividad Por Pares Determinación de Tipos de Enlace Modulo 3ANA EDITH MARTINEZ RODRIGUEZAún no hay calificaciones
- Reacciones de Precipitacion y Disolucion en Aguas Naturales - FinalDocumento45 páginasReacciones de Precipitacion y Disolucion en Aguas Naturales - FinalJenny ChavezAún no hay calificaciones
- Capitulo IV Grupo 13Documento86 páginasCapitulo IV Grupo 13mynilut78Aún no hay calificaciones
- Cuadro Sinoptico de Los ProcesosDocumento3 páginasCuadro Sinoptico de Los ProcesosMonse Carmona EspinozaAún no hay calificaciones
- PEC 1 2022 2023 QEM CarmenJuanesPicotDocumento8 páginasPEC 1 2022 2023 QEM CarmenJuanesPicotCARMEN JUANES PICOTAún no hay calificaciones
- Hidrologia UMSSDocumento22 páginasHidrologia UMSSAle HurtadoAún no hay calificaciones
- Ácido - Base - PHDocumento5 páginasÁcido - Base - PHjuniorAún no hay calificaciones
- Reacciones Nucleares y de NeutralizaciónDocumento9 páginasReacciones Nucleares y de NeutralizaciónBreaking PalomaAún no hay calificaciones
- Problemas Equilibrio QuimicoDocumento3 páginasProblemas Equilibrio QuimicoDani FPAún no hay calificaciones
- Diagrama Presión VS Volumen para Un Sistema deDocumento12 páginasDiagrama Presión VS Volumen para Un Sistema deCristhian Gerardo Garcia Navarro100% (1)
- Viscosidad, Capilaridad CuestionarioDocumento4 páginasViscosidad, Capilaridad CuestionarioJhanfranAún no hay calificaciones
- Proyecto TermodinámicaDocumento14 páginasProyecto TermodinámicaRoque MirandaAún no hay calificaciones
- Lectura Sistema PeriódicoDocumento1 páginaLectura Sistema Periódicomgarveg653Aún no hay calificaciones
- Base Experimental de La Teoria CuanticaDocumento5 páginasBase Experimental de La Teoria CuanticaCarlos LazarinAún no hay calificaciones
- Informe (Fuerzas Intermoleculares) #5Documento7 páginasInforme (Fuerzas Intermoleculares) #5Juan Jose Vasquez SalazarAún no hay calificaciones
- Trabajo Integrador Diciembre QUIMICADocumento25 páginasTrabajo Integrador Diciembre QUIMICAJuegos DigitalesAún no hay calificaciones
- Tipos de Ensayo y Ambiente Afectado Por La CorrosiónDocumento15 páginasTipos de Ensayo y Ambiente Afectado Por La CorrosiónJoel MarcanoAún no hay calificaciones
- Antecedentes Practica 5 OrgánicaDocumento3 páginasAntecedentes Practica 5 OrgánicaLizeth VegaAún no hay calificaciones