Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Clase 4 Propiedades Coligativas
Cargado por
Daniel Joe0 calificaciones0% encontró este documento útil (0 votos)
29 vistas4 páginasTítulo original
Clase 4 Propiedades Coligativas (1)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
29 vistas4 páginasClase 4 Propiedades Coligativas
Cargado por
Daniel JoeCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 4
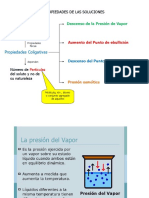
CLASE 4: SOLUCIONES
PROPIEDADES COLIGATIVAS
“COMPARAR PROPIEDADES DE LA SOLUCIÓN CON RESPECTO A LAS DEL SOLVENTE PURO”
1. DISMINUCIÓN DE LA PRESIÓN DE VAPOR
(Ley Roult)
“ La presión de vapor de vapor de una solución
es menor que la presión de vapor del solvente
puro a la misma temperatura” (soluto no volátil)
Pvsolución=Pvsolvente puro*xste (sto no volátil)
Pvsolución=Pvste1*xste1+Pvste2*xste2 (solución
de 2 solventes volátiles)
PRESIÓN DE VAPOR: “Presión parcial que
ejercen las moléculas de vapor(gaseosas) sobre
la superficie del líquido a una temperatura”
2. AUMENTO DEL PUNTO DE EBULLICIÓN (∆T)
“Una solución hierve (punto de ebullición) a más temperatura
que el solvente puro a la misma presión atmosférica”
∆T=Ke*mll; ∆T= Te solución-Te solvente puro; ∆T>0
Ke: constante de ebullición del solvente puro
Ke agua= 0.52°C/mll
3. DISMINUCIÓN DEL PUNTO DE CONGELAMIENTO (∆T)
“Una solución se congela (punto de congelamiento) a menor
temperatura que el solvente puro”
∆T=Kc*mll; ∆T=Tc solución-Tc solvente puro; ∆T<0
Kc: constante de congelamiento del solvente puro
Kc agua= -1.86°C/mll
4. PRESIÓN OSMÓTICA (π)
“Es la presión espontánea que permite el paso (espontáneo) de
solvente de una solución menos concentrada hasta una de
mayor concentración a través de una membrana semipermeable”
π= Mo*R*T
π=Presión osmótica (atm)
R=Constante de los gases; 0.082 atm*L/mol°K
T=Temperatura °K; Mo= Molaridad
ÓSMOSIS INVERSA
“Por medio de una presión externa(mayor a
la presión osmótica) se hace pasar (no
espontáneo) el solvente a través de una
membrana semipermeable desde una
solución concentrada hacia una solución
diluida o solvente puro”
REFLECCIONES
1. La presión de vapor del agua pura a 30°C es 31.8 mmHg. Se tiene una
solución al 10% de NaCl en agua a 30°C. Cuál es su presión de vapor?
2. Cual tiene mayor o menor presión de vapor: una solución 2 molar de NaCl
o una solución 2 molar de KCl? Ambas están a la misma temperatura.
3. Cuál tiene mayor presión de vapor: Una solución 2 Normal de NaCl a 20°C
o una solución 2 Normal de NaCl a 30°C?
4. Una solución de AgCl hierve a 103°C y otra de NaCl hierve a 104°C, cuál
tiene menor concentración?
5. Una solución en agua congela a -3°C y otra solución en etanol de la misma
concentración congela a -4°C. La Konstante del etanol es menor que la del
agua?
6. A qué temperaturas congelan las siguientes soluciones en agua: 2molal,
X=0.2 soluto
7. En un proceso osmótico espontáneo, la solución hipertónica se
concentra?
8. En la ósmosis inversa, la solución hipotónica se diluye?
También podría gustarte
- ElectroculturaDocumento15 páginasElectroculturaYOSOYEXITOSO100% (1)
- Ley de Henry Ejercicio 3Documento10 páginasLey de Henry Ejercicio 3willignton100% (2)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Clase 5 Propiedades ColigativasDocumento39 páginasClase 5 Propiedades ColigativascristianAún no hay calificaciones
- Procedimiento para Espacios ConfinadosDocumento15 páginasProcedimiento para Espacios ConfinadosMAGDA CARVAJALAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Constante CrioscopicaDocumento7 páginasConstante Crioscopicavanesa nonsoqueAún no hay calificaciones
- Diapositivas - Unidad 4 - FisicoquímicaDocumento22 páginasDiapositivas - Unidad 4 - FisicoquímicaJuan SalazarAún no hay calificaciones
- Preguntas de Comunicaciones SatelitalesDocumento7 páginasPreguntas de Comunicaciones SatelitalesJorge MartinezAún no hay calificaciones
- Propiedades ColigativasDocumento11 páginasPropiedades ColigativasAbath Vlandimir100% (1)
- Propiedades ColigativasDocumento14 páginasPropiedades ColigativasAndres Felipe Martinez OrozcoAún no hay calificaciones
- II Propiedades ColigativasDocumento20 páginasII Propiedades ColigativasNorth Cloths Paños del NorteAún no hay calificaciones
- Propiedades ColigativasDocumento23 páginasPropiedades ColigativasAngélica Tommaso AcevedoAún no hay calificaciones
- 4 Propiedades ColigativasDocumento5 páginas4 Propiedades ColigativasJuan Paulo Delgado OrtizAún no hay calificaciones
- 1.1 Propiedades Coligativas de Las Disoluciones (Temperatura de Ebullición, Temperatura de Fusión, Presión de Vapor, Presión Osmótica)Documento13 páginas1.1 Propiedades Coligativas de Las Disoluciones (Temperatura de Ebullición, Temperatura de Fusión, Presión de Vapor, Presión Osmótica)July AguilaAún no hay calificaciones
- Propiedades ColigativasDocumento20 páginasPropiedades ColigativasSebastían MartínezAún no hay calificaciones
- Propiedades ColigativasDocumento29 páginasPropiedades ColigativasjorgeAún no hay calificaciones
- 1 Propiedades ColigativasDocumento4 páginas1 Propiedades Coligativasyerri lalolitoAún no hay calificaciones
- Aplicaciones ColigativasDocumento9 páginasAplicaciones ColigativasMiriam Guerra RodríguezAún no hay calificaciones
- Soluciones IIDocumento15 páginasSoluciones IIjvierAún no hay calificaciones
- Propiedades Coligativas de Las Soluciones y EjemplosDocumento13 páginasPropiedades Coligativas de Las Soluciones y EjemplosHarryArcher90% (20)
- Propiedades Coligativas de Las DisolucionesDocumento31 páginasPropiedades Coligativas de Las DisolucionesMarianet ZereneAún no hay calificaciones
- Propiedades Coligativas de DisolucionesDocumento5 páginasPropiedades Coligativas de DisolucionesCarl AcuñaAún no hay calificaciones
- Propiedades Coligativas PDFDocumento19 páginasPropiedades Coligativas PDFGabriel ArboledaAún no hay calificaciones
- Aumento Del Punto de Ebullicion .Descenso Del Punto de Ebullicion - Presion OsmoticaDocumento18 páginasAumento Del Punto de Ebullicion .Descenso Del Punto de Ebullicion - Presion OsmoticaJesús NavarroAún no hay calificaciones
- 4to. Introducción - Propiedades Coligativas de Solutos No ElectrolíticosDocumento43 páginas4to. Introducción - Propiedades Coligativas de Solutos No Electrolíticosdarwins pintoAún no hay calificaciones
- Material Academico A1Documento26 páginasMaterial Academico A1Vania CastilloAún no hay calificaciones
- Guia 4. Prop. ColigativasDocumento6 páginasGuia 4. Prop. ColigativasLaura Rivera100% (1)
- Previo PROPIEDADES COLIGATIVASDocumento6 páginasPrevio PROPIEDADES COLIGATIVASIván Gerardo López VenturaAún no hay calificaciones
- Propiedades ColigativasDocumento8 páginasPropiedades ColigativasCahuaya VCAún no hay calificaciones
- P3 - Propiedades ColigativasDocumento23 páginasP3 - Propiedades ColigativasLuis PérezAún no hay calificaciones
- Ejercicios de Primera Ley de TermodinamicaDocumento10 páginasEjercicios de Primera Ley de TermodinamicaJohan RicardoAún no hay calificaciones
- 4COLIGATIVASDocumento43 páginas4COLIGATIVAScristianAún no hay calificaciones
- Propiedades ColigativasDocumento8 páginasPropiedades ColigativasSabas QuispeAún no hay calificaciones
- Metodo de Rast 2Documento6 páginasMetodo de Rast 2Mendoza EiraAún no hay calificaciones
- Propiedades Coligativas de Las Soluciones 2021Documento22 páginasPropiedades Coligativas de Las Soluciones 2021Secrets UncleAún no hay calificaciones
- Propiedades ColigativasDocumento3 páginasPropiedades ColigativascristianAún no hay calificaciones
- Propiedades ColigativasDocumento3 páginasPropiedades ColigativascristianAún no hay calificaciones
- Propiedades ColigativasDocumento21 páginasPropiedades ColigativasMike RodriguezAún no hay calificaciones
- 13.-Propiedades ColigativasDocumento3 páginas13.-Propiedades ColigativasgigigelpAún no hay calificaciones
- Guia de Propiedades ColigativasDocumento6 páginasGuia de Propiedades ColigativasMiriam Arriagada100% (1)
- GUIA Labo 6 Propiedades ColigatDocumento8 páginasGUIA Labo 6 Propiedades ColigatLuis angelAún no hay calificaciones
- Variación de La Presión de VaporDocumento13 páginasVariación de La Presión de VaporFannyEspinozaGiraldezAún no hay calificaciones
- Ejercicios Propiedades ColaigativasDocumento13 páginasEjercicios Propiedades ColaigativasPtRck Crbjl50% (2)
- Unidad 5Documento28 páginasUnidad 5Geozac Gamboa HoyosAún no hay calificaciones
- Informe 2 Quimca 2Documento14 páginasInforme 2 Quimca 2Nerit Paucarcaja BuitrónAún no hay calificaciones
- Diapos No ElectroliticasDocumento50 páginasDiapos No ElectroliticasNéstor Bazán ArribasplataAún no hay calificaciones
- Las Propiedades ColigativasDocumento12 páginasLas Propiedades ColigativasBetzy Valery Poma PerezAún no hay calificaciones
- Propiedades Coligativas Wagner Nicolas Ramirez PaezDocumento3 páginasPropiedades Coligativas Wagner Nicolas Ramirez PaezWagner Nicolas Ramirez PaezAún no hay calificaciones
- Propiedades Coligativas PDFDocumento9 páginasPropiedades Coligativas PDFIsaias Quispe CondoriAún no hay calificaciones
- Propiedades ColigativasDocumento10 páginasPropiedades ColigativasIvan ViteAún no hay calificaciones
- 7 - Propiedades ColigativasDocumento18 páginas7 - Propiedades ColigativasEmma SarliAún no hay calificaciones
- Eje Tematico N 4 Propiedades Fisicoquimicas de LaDocumento9 páginasEje Tematico N 4 Propiedades Fisicoquimicas de LaJuan El PerezAún no hay calificaciones
- Ley de HenryDocumento33 páginasLey de HenryQkriiz ArriolaAún no hay calificaciones
- Disminución Del Punto de CongelaciónDocumento11 páginasDisminución Del Punto de CongelaciónJuan Alonso Villanueva AlejosAún no hay calificaciones
- Propiedades Coligativas de Una SoluciónDocumento2 páginasPropiedades Coligativas de Una SoluciónMay TcAún no hay calificaciones
- Propiedades Coligativas de Las SolucionesDocumento6 páginasPropiedades Coligativas de Las SolucionesXerman Prieto DezaAún no hay calificaciones
- S07.s1 - Material FQDocumento41 páginasS07.s1 - Material FQJanira DominguezAún no hay calificaciones
- PREVIO 07 Chimal RamírezDocumento10 páginasPREVIO 07 Chimal RamírezIsaac ChimalAún no hay calificaciones
- Propiedades ColigativasDocumento12 páginasPropiedades ColigativasGisselle AranibarAún no hay calificaciones
- Unidad 7-PT2Documento41 páginasUnidad 7-PT2Alvaro GuerreroAún no hay calificaciones
- GUIA No. 3 - Propiedades Coligativas de Las SolucionesDocumento4 páginasGUIA No. 3 - Propiedades Coligativas de Las SolucionesMARI MIERAún no hay calificaciones
- Practica 1 SolubilidadDocumento12 páginasPractica 1 SolubilidadDaniel JoeAún no hay calificaciones
- Universidad Central Del EcuadorDocumento4 páginasUniversidad Central Del EcuadorDaniel JoeAún no hay calificaciones
- TEORIAESTRUCTURALDocumento74 páginasTEORIAESTRUCTURALDaniel JoeAún no hay calificaciones
- Al Can Os Completo 1Documento59 páginasAl Can Os Completo 1Daniel JoeAún no hay calificaciones
- Universidad Central Del EcuadorDocumento2 páginasUniversidad Central Del EcuadorDaniel JoeAún no hay calificaciones
- Sistema Frenet-Serret - Grupo 5Documento6 páginasSistema Frenet-Serret - Grupo 5Daniel JoeAún no hay calificaciones
- Clase 3 Cálculos EstequiométricosDocumento4 páginasClase 3 Cálculos EstequiométricosDaniel JoeAún no hay calificaciones
- Grupo Nº10 Trabajo Grupal 2Documento11 páginasGrupo Nº10 Trabajo Grupal 2Daniel JoeAún no hay calificaciones
- PsicrometriaDocumento39 páginasPsicrometriaDaniel GodoyAún no hay calificaciones
- Practica4 QOI 2016 2018Documento6 páginasPractica4 QOI 2016 2018macuilignacio0Aún no hay calificaciones
- Balance HidricoDocumento7 páginasBalance HidricoKarla CorreaAún no hay calificaciones
- Tabloide Medio Ambiente2Documento67 páginasTabloide Medio Ambiente2rosa1955Aún no hay calificaciones
- Hidrología para Ingenieros CivilesDocumento1 páginaHidrología para Ingenieros CivilesAntonia BouvierAún no hay calificaciones
- Informe de Impacto AmbientalDocumento15 páginasInforme de Impacto AmbientalYaleniih Vigo MendozaAún no hay calificaciones
- PP-412 Digrama de Fases - Tipos de YacimientosDocumento34 páginasPP-412 Digrama de Fases - Tipos de YacimientosMario HuasasquicheAún no hay calificaciones
- FM-200 EsDocumento6 páginasFM-200 EsfblequettAún no hay calificaciones
- La Formación de La Tierra ResumenDocumento3 páginasLa Formación de La Tierra ResumenErika Pariona ColosAún no hay calificaciones
- Resumen Climas-ClimogramasDocumento2 páginasResumen Climas-ClimogramaslupilapiAún no hay calificaciones
- Sexta Semana - Estabilidad Atmosferica - 2022 ADocumento24 páginasSexta Semana - Estabilidad Atmosferica - 2022 ALUNA ROJAS JESSICA SOFIAAún no hay calificaciones
- La Industria y Su Impacto en VenezuelaDocumento29 páginasLa Industria y Su Impacto en VenezuelaTruxy WorldAún no hay calificaciones
- Efecto InvernaderoDocumento11 páginasEfecto InvernaderochupalonohayusernameAún no hay calificaciones
- Puerto SamancoDocumento78 páginasPuerto SamancoNathalie OrdayaAún no hay calificaciones
- 6 AireadoresDocumento29 páginas6 AireadoresArtero96Aún no hay calificaciones
- Anuario MeteorologicoDocumento67 páginasAnuario MeteorologicoJORDAN RENE MANZABA CARVAJALAún no hay calificaciones
- TallerDocumento3 páginasTallerOSCAR DANIEL BOLAÑOS TOROAún no hay calificaciones
- Plan de Mejoramiento Tec e Info Setipmo 2pDocumento3 páginasPlan de Mejoramiento Tec e Info Setipmo 2pArley santiago Trujillo tamayoAún no hay calificaciones
- Meteoros Clasi2Documento9 páginasMeteoros Clasi2Frida Ariadna FloresAún no hay calificaciones
- Industrias y Sectores Que Producen Mayor Contaminación Ambiental A Nivel MundialDocumento28 páginasIndustrias y Sectores Que Producen Mayor Contaminación Ambiental A Nivel Mundialdivar quijanoAún no hay calificaciones
- El Hombre y El Medio AmbienteDocumento16 páginasEl Hombre y El Medio AmbienteEddy AriasAún no hay calificaciones
- Que Es La Capa de Ozono - Google SearchDocumento1 páginaQue Es La Capa de Ozono - Google Searchluisadel0987Aún no hay calificaciones
- TALLER No. 1Documento2 páginasTALLER No. 1Jean HernándezAún no hay calificaciones
- Unidad 2 EjerciciosDocumento8 páginasUnidad 2 EjerciciosRoxana VelascoAún no hay calificaciones
- Lab2 IWQ221 2S2016Documento8 páginasLab2 IWQ221 2S2016Catalina villagranAún no hay calificaciones
- Guía Variación Del Volumen, Temperatura y Presión de Los GasesDocumento4 páginasGuía Variación Del Volumen, Temperatura y Presión de Los GasesDennis TulcanazoAún no hay calificaciones
- El Efecto InvernaderoDocumento5 páginasEl Efecto InvernaderoFIORELLLAAún no hay calificaciones