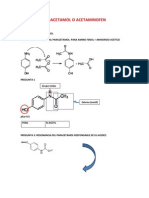
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Form
Cargado por
Rolando Quintana HuaycaniTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Form
Cargado por
Rolando Quintana HuaycaniCopyright:
Formatos disponibles
Farmacodinámica[editar]
Durante mucho tiempo se ha creído que el mecanismo de acción del paracetamol es casi
igual al del ácido acetilsalicílico (AAS). Es decir, que actúa reduciendo la síntesis
de prostaglandinas, compuestos relacionados con los procesos febriles y el dolor,
inhibiendo la ciclooxigenasa (COX).
Pero, hay diferencias importantes entre los efectos del ácido acetilsalicílico y el
paracetamol. Las prostaglandinas participan en los procesos inflamatorios, pero el
paracetamol no presenta actividad antiinflamatoria apreciable. Además, la COX también
participa en la síntesis de tromboxanos que favorecen la coagulación de la sangre; el AAS
tiene efectos antiagregantes, pero el paracetamol no. Finalmente, el AAS y otros AINE son
perjudiciales para la mucosa gástrica, donde las prostaglandinas desempeñan un papel
protector, pero en este caso el paracetamol es seguro.
De esta forma, mientras el AAS actúa como un inhibidor irreversible de la COX y bloquea
el centro activo de la enzima directamente, el paracetamol la bloquea indirectamente y
este bloqueo es inútil en presencia de peróxidos.37 Esto podría explicar por qué el
paracetamol es eficaz en el sistema nervioso central y en células endoteliales, pero no
en plaquetas y células del sistema inmunitario, las cuales tienen niveles altos de peróxidos.
Swierkosz et al. (2002) encontró evidencias que indican que el paracetamol inhibe una
variante de la enzima COX que es diferente a las variantes COX-1 y COX-2, denominada
ahora COX-3.38 Su mecanismo de acción exacto no es bien comprendido aún, pero futuras
investigaciones pueden esclarecerlo.
Estudios recientes indican que el paracetamol podría aparentemente modular el
sistema cannabinoide endógeno en el cerebro a través de su metabolito, AM404 (N-
arachidonoylaminophenol), que parece inhibir la recaptación de
la anandamida endógena por lo que está más disponible para reducir el dolor, así como
posiblemente activar directamente el TRPV1 que también inhibe las señales de dolor en el
cerebro.39
Farmacocinética[editar]
Modelo tridimensional de la molécula de paracetamol: negro
- carbono; blanco - hidrógeno; rojo - oxígeno; azul - nitrógeno
El paracetamol se absorbe rápida y completamente por vía oral, y bastante bien por vía
rectal, teniendo la ventaja de evitar el primer paso hepático. Existen también preparaciones
intravenosas. Las concentraciones plasmáticas máximas se alcanzan en función de la
forma farmacéutica, con un tiempo, hasta la concentración máxima, de 0,5-2 horas. El
paracetamol se distribuye rápidamente por todos los tejidos. Las concentraciones son
similares en la sangre, la saliva y el plasma. La tasa de unión a las proteínas plasmáticas
es baja. La biodisponibilidad es muy elevada (cercana al 100%), siendo la biodisponibilidad
por vía oral del 75-85 %. El paracetamol se metaboliza principalmente a nivel del hígado.
Las dos principales rutas metabólicas son la glucuro y sulfuroconjugación. Esta última vía
se satura rápidamente con dosis superiores a las terapéuticas. Solamente una pequeña
proporción se metaboliza mediante el sistema enzimático del citocromo P-450 en el
hígado, por acción de las oxidasas mixtas, generando un intermedio reactivo, N-
acetilbenzoquinoneimida que en condiciones normales es inactivado (se detoxifica) por
reacción con los grupos sulfhidrilo del glutatión y eliminado en la orina conjugado con
cisteína y ácido mercaptúrico. Por el contrario, durante las intoxicaciones graves aumenta
la cantidad de este metabolito tóxico. Dosis elevadas de paracetamol, saturan sus otras
dos vías metabólicas y se crea un exceso de N-acetilbenzoquinoneimida que agota los
niveles hepáticos de glutatión. Entonces el metabolito puede reaccionar covalentemente
con aminoácidos de las enzimas y proteínas hepáticas, a las que inactiva y llega a
provocar necrosis hepática aguda. Los niños tienen una menor capacidad de
glucuronidación, lo que los hace más susceptibles a sufrir este trastorno. La eliminación es
principalmente urinaria. El 90 % de la dosis ingerida la elimina el riñón en 24 horas,
principalmente como glucurónidos (60 a 80 %) y sulfoconjugados (20 a 30 %). Menos del
5 % se elimina sin modificar.. La semi-vida de eliminación del paracetamol es de 2-4 horas
en los pacientes con la función hepática normal, siendo prácticamente indetectable en el
plasma 8 horas después de su administración. En los pacientes con disfunción hepática la
semi-vida aumenta sustancialmente, lo que puede ocasionar el desarrollo de una necrosis
hepática.40
Farmacodinámica[editar]
Durante mucho tiempo se ha creído que el mecanismo de acción del paracetamol es casi
igual al del ácido acetilsalicílico (AAS). Es decir, que actúa reduciendo la síntesis
de prostaglandinas, compuestos relacionados con los procesos febriles y el dolor,
inhibiendo la ciclooxigenasa (COX).
Pero, hay diferencias importantes entre los efectos del ácido acetilsalicílico y el
paracetamol. Las prostaglandinas participan en los procesos inflamatorios, pero el
paracetamol no presenta actividad antiinflamatoria apreciable. Además, la COX también
participa en la síntesis de tromboxanos que favorecen la coagulación de la sangre; el AAS
tiene efectos antiagregantes, pero el paracetamol no. Finalmente, el AAS y otros AINE son
perjudiciales para la mucosa gástrica, donde las prostaglandinas desempeñan un papel
protector, pero en este caso el paracetamol es seguro.
De esta forma, mientras el AAS actúa como un inhibidor irreversible de la COX y bloquea
el centro activo de la enzima directamente, el paracetamol la bloquea indirectamente y
este bloqueo es inútil en presencia de peróxidos.37 Esto podría explicar por qué el
paracetamol es eficaz en el sistema nervioso central y en células endoteliales, pero no
en plaquetas y células del sistema inmunitario, las cuales tienen niveles altos de peróxidos.
Swierkosz et al. (2002) encontró evidencias que indican que el paracetamol inhibe una
variante de la enzima COX que es diferente a las variantes COX-1 y COX-2, denominada
ahora COX-3.38 Su mecanismo de acción exacto no es bien comprendido aún, pero futuras
investigaciones pueden esclarecerlo.
Estudios recientes indican que el paracetamol podría aparentemente modular el
sistema cannabinoide endógeno en el cerebro a través de su metabolito, AM404 (N-
arachidonoylaminophenol), que parece inhibir la recaptación de
la anandamida endógena por lo que está más disponible para reducir el dolor, así como
posiblemente activar directamente el TRPV1 que también inhibe las señales de dolor en el
cerebro.39
Farmacocinética[editar]
Modelo tridimensional de la molécula de paracetamol: negro
- carbono; blanco - hidrógeno; rojo - oxígeno; azul - nitrógeno
El paracetamol se absorbe rápida y completamente por vía oral, y bastante bien por vía
rectal, teniendo la ventaja de evitar el primer paso hepático. Existen también preparaciones
intravenosas. Las concentraciones plasmáticas máximas se alcanzan en función de la
forma farmacéutica, con un tiempo, hasta la concentración máxima, de 0,5-2 horas. El
paracetamol se distribuye rápidamente por todos los tejidos. Las concentraciones son
similares en la sangre, la saliva y el plasma. La tasa de unión a las proteínas plasmáticas
es baja. La biodisponibilidad es muy elevada (cercana al 100%), siendo la biodisponibilidad
por vía oral del 75-85 %. El paracetamol se metaboliza principalmente a nivel del hígado.
Las dos principales rutas metabólicas son la glucuro y sulfuroconjugación. Esta última vía
se satura rápidamente con dosis superiores a las terapéuticas. Solamente una pequeña
proporción se metaboliza mediante el sistema enzimático del citocromo P-450 en el
hígado, por acción de las oxidasas mixtas, generando un intermedio reactivo, N-
acetilbenzoquinoneimida que en condiciones normales es inactivado (se detoxifica) por
reacción con los grupos sulfhidrilo del glutatión y eliminado en la orina conjugado con
cisteína y ácido mercaptúrico. Por el contrario, durante las intoxicaciones graves aumenta
la cantidad de este metabolito tóxico. Dosis elevadas de paracetamol, saturan sus otras
dos vías metabólicas y se crea un exceso de N-acetilbenzoquinoneimida que agota los
niveles hepáticos de glutatión. Entonces el metabolito puede reaccionar covalentemente
con aminoácidos de las enzimas y proteínas hepáticas, a las que inactiva y llega a
provocar necrosis hepática aguda. Los niños tienen una menor capacidad de
glucuronidación, lo que los hace más susceptibles a sufrir este trastorno. La eliminación es
principalmente urinaria. El 90 % de la dosis ingerida la elimina el riñón en 24 horas,
principalmente como glucurónidos (60 a 80 %) y sulfoconjugados (20 a 30 %). Menos del
5 % se elimina sin modificar.. La semi-vida de eliminación del paracetamol es de 2-4 horas
en los pacientes con la función hepática normal, siendo prácticamente indetectable en el
plasma 8 horas después de su administración. En los pacientes con disfunción hepática la
semi-vida aumenta sustancialmente, lo que puede ocasionar el desarrollo de una necrosis
hepática.40
Farmacodinámica[editar]
Durante mucho tiempo se ha creído que el mecanismo de acción del paracetamol es casi
igual al del ácido acetilsalicílico (AAS). Es decir, que actúa reduciendo la síntesis
de prostaglandinas, compuestos relacionados con los procesos febriles y el dolor,
inhibiendo la ciclooxigenasa (COX).
Pero, hay diferencias importantes entre los efectos del ácido acetilsalicílico y el
paracetamol. Las prostaglandinas participan en los procesos inflamatorios, pero el
paracetamol no presenta actividad antiinflamatoria apreciable. Además, la COX también
participa en la síntesis de tromboxanos que favorecen la coagulación de la sangre; el AAS
tiene efectos antiagregantes, pero el paracetamol no. Finalmente, el AAS y otros AINE son
perjudiciales para la mucosa gástrica, donde las prostaglandinas desempeñan un papel
protector, pero en este caso el paracetamol es seguro.
De esta forma, mientras el AAS actúa como un inhibidor irreversible de la COX y bloquea
el centro activo de la enzima directamente, el paracetamol la bloquea indirectamente y
este bloqueo es inútil en presencia de peróxidos.37 Esto podría explicar por qué el
paracetamol es eficaz en el sistema nervioso central y en células endoteliales, pero no
en plaquetas y células del sistema inmunitario, las cuales tienen niveles altos de peróxidos.
Swierkosz et al. (2002) encontró evidencias que indican que el paracetamol inhibe una
variante de la enzima COX que es diferente a las variantes COX-1 y COX-2, denominada
ahora COX-3.38 Su mecanismo de acción exacto no es bien comprendido aún, pero futuras
investigaciones pueden esclarecerlo.
Estudios recientes indican que el paracetamol podría aparentemente modular el
sistema cannabinoide endógeno en el cerebro a través de su metabolito, AM404 (N-
arachidonoylaminophenol), que parece inhibir la recaptación de
la anandamida endógena por lo que está más disponible para reducir el dolor, así como
posiblemente activar directamente el TRPV1 que también inhibe las señales de dolor en el
cerebro.39
Farmacocinética[editar]
Modelo tridimensional de la molécula de paracetamol: negro
- carbono; blanco - hidrógeno; rojo - oxígeno; azul - nitrógeno
El paracetamol se absorbe rápida y completamente por vía oral, y bastante bien por vía
rectal, teniendo la ventaja de evitar el primer paso hepático. Existen también preparaciones
intravenosas. Las concentraciones plasmáticas máximas se alcanzan en función de la
forma farmacéutica, con un tiempo, hasta la concentración máxima, de 0,5-2 horas. El
paracetamol se distribuye rápidamente por todos los tejidos. Las concentraciones son
similares en la sangre, la saliva y el plasma. La tasa de unión a las proteínas plasmáticas
es baja. La biodisponibilidad es muy elevada (cercana al 100%), siendo la biodisponibilidad
por vía oral del 75-85 %. El paracetamol se metaboliza principalmente a nivel del hígado.
Las dos principales rutas metabólicas son la glucuro y sulfuroconjugación. Esta última vía
se satura rápidamente con dosis superiores a las terapéuticas. Solamente una pequeña
proporción se metaboliza mediante el sistema enzimático del citocromo P-450 en el
hígado, por acción de las oxidasas mixtas, generando un intermedio reactivo, N-
acetilbenzoquinoneimida que en condiciones normales es inactivado (se detoxifica) por
reacción con los grupos sulfhidrilo del glutatión y eliminado en la orina conjugado con
cisteína y ácido mercaptúrico. Por el contrario, durante las intoxicaciones graves aumenta
la cantidad de este metabolito tóxico. Dosis elevadas de paracetamol, saturan sus otras
dos vías metabólicas y se crea un exceso de N-acetilbenzoquinoneimida que agota los
niveles hepáticos de glutatión. Entonces el metabolito puede reaccionar covalentemente
con aminoácidos de las enzimas y proteínas hepáticas, a las que inactiva y llega a
provocar necrosis hepática aguda. Los niños tienen una menor capacidad de
glucuronidación, lo que los hace más susceptibles a sufrir este trastorno. La eliminación es
principalmente urinaria. El 90 % de la dosis ingerida la elimina el riñón en 24 horas,
principalmente como glucurónidos (60 a 80 %) y sulfoconjugados (20 a 30 %). Menos del
5 % se elimina sin modificar.. La semi-vida de eliminación del paracetamol es de 2-4 horas
en los pacientes con la función hepática normal, siendo prácticamente indetectable en el
plasma 8 horas después de su administración. En los pacientes con disfunción hepática la
semi-vida aumenta sustancialmente, lo que puede ocasionar el desarrollo de una necrosis
hepática.40
Farmacodinámica[editar]
Durante mucho tiempo se ha creído que el mecanismo de acción del paracetamol es casi
igual al del ácido acetilsalicílico (AAS). Es decir, que actúa reduciendo la síntesis
de prostaglandinas, compuestos relacionados con los procesos febriles y el dolor,
inhibiendo la ciclooxigenasa (COX).
Pero, hay diferencias importantes entre los efectos del ácido acetilsalicílico y el
paracetamol. Las prostaglandinas participan en los procesos inflamatorios, pero el
paracetamol no presenta actividad antiinflamatoria apreciable. Además, la COX también
participa en la síntesis de tromboxanos que favorecen la coagulación de la sangre; el AAS
tiene efectos antiagregantes, pero el paracetamol no. Finalmente, el AAS y otros AINE son
perjudiciales para la mucosa gástrica, donde las prostaglandinas desempeñan un papel
protector, pero en este caso el paracetamol es seguro.
De esta forma, mientras el AAS actúa como un inhibidor irreversible de la COX y bloquea
el centro activo de la enzima directamente, el paracetamol la bloquea indirectamente y
este bloqueo es inútil en presencia de peróxidos.37 Esto podría explicar por qué el
paracetamol es eficaz en el sistema nervioso central y en células endoteliales, pero no
en plaquetas y células del sistema inmunitario, las cuales tienen niveles altos de peróxidos.
Swierkosz et al. (2002) encontró evidencias que indican que el paracetamol inhibe una
variante de la enzima COX que es diferente a las variantes COX-1 y COX-2, denominada
ahora COX-3.38 Su mecanismo de acción exacto no es bien comprendido aún, pero futuras
investigaciones pueden esclarecerlo.
Estudios recientes indican que el paracetamol podría aparentemente modular el
sistema cannabinoide endógeno en el cerebro a través de su metabolito, AM404 (N-
arachidonoylaminophenol), que parece inhibir la recaptación de
la anandamida endógena por lo que está más disponible para reducir el dolor, así como
posiblemente activar directamente el TRPV1 que también inhibe las señales de dolor en el
cerebro.39
Farmacocinética[editar]
Modelo tridimensional de la molécula de paracetamol: negro
- carbono; blanco - hidrógeno; rojo - oxígeno; azul - nitrógeno
El paracetamol se absorbe rápida y completamente por vía oral, y bastante bien por vía
rectal, teniendo la ventaja de evitar el primer paso hepático. Existen también preparaciones
intravenosas. Las concentraciones plasmáticas máximas se alcanzan en función de la
forma farmacéutica, con un tiempo, hasta la concentración máxima, de 0,5-2 horas. El
paracetamol se distribuye rápidamente por todos los tejidos. Las concentraciones son
similares en la sangre, la saliva y el plasma. La tasa de unión a las proteínas plasmáticas
es baja. La biodisponibilidad es muy elevada (cercana al 100%), siendo la biodisponibilidad
por vía oral del 75-85 %. El paracetamol se metaboliza principalmente a nivel del hígado.
Las dos principales rutas metabólicas son la glucuro y sulfuroconjugación. Esta última vía
se satura rápidamente con dosis superiores a las terapéuticas. Solamente una pequeña
proporción se metaboliza mediante el sistema enzimático del citocromo P-450 en el
hígado, por acción de las oxidasas mixtas, generando un intermedio reactivo, N-
acetilbenzoquinoneimida que en condiciones normales es inactivado (se detoxifica) por
reacción con los grupos sulfhidrilo del glutatión y eliminado en la orina conjugado con
cisteína y ácido mercaptúrico. Por el contrario, durante las intoxicaciones graves aumenta
la cantidad de este metabolito tóxico. Dosis elevadas de paracetamol, saturan sus otras
dos vías metabólicas y se crea un exceso de N-acetilbenzoquinoneimida que agota los
niveles hepáticos de glutatión. Entonces el metabolito puede reaccionar covalentemente
con aminoácidos de las enzimas y proteínas hepáticas, a las que inactiva y llega a
provocar necrosis hepática aguda. Los niños tienen una menor capacidad de
glucuronidación, lo que los hace más susceptibles a sufrir este trastorno. La eliminación es
principalmente urinaria. El 90 % de la dosis ingerida la elimina el riñón en 24 horas,
principalmente como glucurónidos (60 a 80 %) y sulfoconjugados (20 a 30 %). Menos del
5 % se elimina sin modificar.. La semi-vida de eliminación del paracetamol es de 2-4 horas
en los pacientes con la función hepática normal, siendo prácticamente indetectable en el
plasma 8 horas después de su administración. En los pacientes con disfunción hepática la
semi-vida aumenta sustancialmente, lo que puede ocasionar el desarrollo de una necrosis
hepática.40
Farmacodinámica[editar]
Durante mucho tiempo se ha creído que el mecanismo de acción del paracetamol es casi
igual al del ácido acetilsalicílico (AAS). Es decir, que actúa reduciendo la síntesis
de prostaglandinas, compuestos relacionados con los procesos febriles y el dolor,
inhibiendo la ciclooxigenasa (COX).
Pero, hay diferencias importantes entre los efectos del ácido acetilsalicílico y el
paracetamol. Las prostaglandinas participan en los procesos inflamatorios, pero el
paracetamol no presenta actividad antiinflamatoria apreciable. Además, la COX también
participa en la síntesis de tromboxanos que favorecen la coagulación de la sangre; el AAS
tiene efectos antiagregantes, pero el paracetamol no. Finalmente, el AAS y otros AINE son
perjudiciales para la mucosa gástrica, donde las prostaglandinas desempeñan un papel
protector, pero en este caso el paracetamol es seguro.
De esta forma, mientras el AAS actúa como un inhibidor irreversible de la COX y bloquea
el centro activo de la enzima directamente, el paracetamol la bloquea indirectamente y
este bloqueo es inútil en presencia de peróxidos.37 Esto podría explicar por qué el
paracetamol es eficaz en el sistema nervioso central y en células endoteliales, pero no
en plaquetas y células del sistema inmunitario, las cuales tienen niveles altos de peróxidos.
Swierkosz et al. (2002) encontró evidencias que indican que el paracetamol inhibe una
variante de la enzima COX que es diferente a las variantes COX-1 y COX-2, denominada
ahora COX-3.38 Su mecanismo de acción exacto no es bien comprendido aún, pero futuras
investigaciones pueden esclarecerlo.
Estudios recientes indican que el paracetamol podría aparentemente modular el
sistema cannabinoide endógeno en el cerebro a través de su metabolito, AM404 (N-
arachidonoylaminophenol), que parece inhibir la recaptación de
la anandamida endógena por lo que está más disponible para reducir el dolor, así como
posiblemente activar directamente el TRPV1 que también inhibe las señales de dolor en el
cerebro.39
Farmacocinética[editar]
Modelo tridimensional de la molécula de paracetamol: negro
- carbono; blanco - hidrógeno; rojo - oxígeno; azul - nitrógeno
El paracetamol se absorbe rápida y completamente por vía oral, y bastante bien por vía
rectal, teniendo la ventaja de evitar el primer paso hepático. Existen también preparaciones
intravenosas. Las concentraciones plasmáticas máximas se alcanzan en función de la
forma farmacéutica, con un tiempo, hasta la concentración máxima, de 0,5-2 horas. El
paracetamol se distribuye rápidamente por todos los tejidos. Las concentraciones son
similares en la sangre, la saliva y el plasma. La tasa de unión a las proteínas plasmáticas
es baja. La biodisponibilidad es muy elevada (cercana al 100%), siendo la biodisponibilidad
por vía oral del 75-85 %. El paracetamol se metaboliza principalmente a nivel del hígado.
Las dos principales rutas metabólicas son la glucuro y sulfuroconjugación. Esta última vía
se satura rápidamente con dosis superiores a las terapéuticas. Solamente una pequeña
proporción se metaboliza mediante el sistema enzimático del citocromo P-450 en el
hígado, por acción de las oxidasas mixtas, generando un intermedio reactivo, N-
acetilbenzoquinoneimida que en condiciones normales es inactivado (se detoxifica) por
reacción con los grupos sulfhidrilo del glutatión y eliminado en la orina conjugado con
cisteína y ácido mercaptúrico. Por el contrario, durante las intoxicaciones graves aumenta
la cantidad de este metabolito tóxico. Dosis elevadas de paracetamol, saturan sus otras
dos vías metabólicas y se crea un exceso de N-acetilbenzoquinoneimida que agota los
niveles hepáticos de glutatión. Entonces el metabolito puede reaccionar covalentemente
con aminoácidos de las enzimas y proteínas hepáticas, a las que inactiva y llega a
provocar necrosis hepática aguda. Los niños tienen una menor capacidad de
glucuronidación, lo que los hace más susceptibles a sufrir este trastorno. La eliminación es
principalmente urinaria. El 90 % de la dosis ingerida la elimina el riñón en 24 horas,
principalmente como glucurónidos (60 a 80 %) y sulfoconjugados (20 a 30 %). Menos del
5 % se elimina sin modificar.. La semi-vida de eliminación del paracetamol es de 2-4 horas
en los pacientes con la función hepática normal, siendo prácticamente indetectable en el
plasma 8 horas después de su administración. En los pacientes con disfunción hepática la
semi-vida aumenta sustancialmente, lo que puede ocasionar el desarrollo de una necrosis
hepática.40
También podría gustarte
- ParacetamolDocumento3 páginasParacetamolcharalneto7677100% (6)
- Ayuno Intermitente Contra El Higado Graso: Basado En Las Enseñanzas De Frank SuarezDe EverandAyuno Intermitente Contra El Higado Graso: Basado En Las Enseñanzas De Frank SuarezAún no hay calificaciones
- Biodisponibilidad Del ParacetamolDocumento8 páginasBiodisponibilidad Del ParacetamolMarco Antonio GallardoAún no hay calificaciones
- ParacetamolDocumento7 páginasParacetamolNicoAún no hay calificaciones
- Fisiología renal y metabolismo hidrosalino: Segunda ediciónDe EverandFisiología renal y metabolismo hidrosalino: Segunda ediciónAún no hay calificaciones
- Farmacocinética y Farmacodinamia Del ParacetamolDocumento2 páginasFarmacocinética y Farmacodinamia Del ParacetamolBrigitte Gutierrez80% (5)
- PARACETAMOLDocumento7 páginasPARACETAMOLSilvi TaAún no hay calificaciones
- Cuest FarmacoDocumento2 páginasCuest FarmacoAnonymous q3hUTAAún no hay calificaciones
- PARACETAMOLDocumento8 páginasPARACETAMOLkelyttasAún no hay calificaciones
- Farmacocinética Del ParacetamolDocumento2 páginasFarmacocinética Del ParacetamolYaritza Anzaldo Pérez100% (1)
- Propiedades Farmacológicas Del ParacetamolDocumento3 páginasPropiedades Farmacológicas Del ParacetamolJorge MoscosoAún no hay calificaciones
- ParacetamolDocumento14 páginasParacetamolGerardo HernandezAún no hay calificaciones
- Acetaminofen o ParacetamolDocumento6 páginasAcetaminofen o Paracetamolgaby2045Aún no hay calificaciones
- Paracetamol en VademecumDocumento4 páginasParacetamol en VademecumSantiago ParraAún no hay calificaciones
- Aines ClasificaciónDocumento4 páginasAines ClasificaciónjesusAún no hay calificaciones
- Nombre Del Principio ActivoDocumento10 páginasNombre Del Principio Activodelcarmenscarlet1Aún no hay calificaciones
- Farmacocinetica y Farmacodinamia SalbutamolDocumento9 páginasFarmacocinetica y Farmacodinamia SalbutamolLore Pilla100% (1)
- Farmacología - AINESDocumento4 páginasFarmacología - AINESLuisfer LoeroAún no hay calificaciones
- Mecanismo de Acción OmeprazolDocumento4 páginasMecanismo de Acción OmeprazolRoberto AguilarAún no hay calificaciones
- Tema - 4 - MEDICAMENTOS ANÁLGESICOS - PROCESO (LADME) PDFDocumento28 páginasTema - 4 - MEDICAMENTOS ANÁLGESICOS - PROCESO (LADME) PDFMaAuxiliadoraCarrión50% (2)
- Intoxicacion Por Aspirina y AcetaminofenDocumento3 páginasIntoxicacion Por Aspirina y AcetaminofenJeferson Grandas FrancoAún no hay calificaciones
- Trabajo FarmacoDocumento44 páginasTrabajo FarmacoStella Maria LirianoAún no hay calificaciones
- Toxicidad Acetaminofen - ParacetamolDocumento6 páginasToxicidad Acetaminofen - ParacetamolLuzzi NickelAún no hay calificaciones
- Caries Segun Su UbicacionDocumento6 páginasCaries Segun Su Ubicacionemiligallos2004Aún no hay calificaciones
- Aines y Embarazo OkDocumento8 páginasAines y Embarazo OkdorisrraelAún no hay calificaciones
- Articulo - Uso de Omeprazol en Estudiantes de La UgDocumento9 páginasArticulo - Uso de Omeprazol en Estudiantes de La UgTony PilliguaAún no hay calificaciones
- Farmacologia OmeprazolDocumento5 páginasFarmacologia OmeprazolRicardo juarezAún no hay calificaciones
- AtorvastatinaDocumento6 páginasAtorvastatinaCasandra AlanisAún no hay calificaciones
- Intoxicacion y Picadura de AlacranDocumento8 páginasIntoxicacion y Picadura de AlacranIvan Felix ZarateAún no hay calificaciones
- Importancia Clínica de Los Inhibidores e Inductores EnzimáticosDocumento8 páginasImportancia Clínica de Los Inhibidores e Inductores EnzimáticosJeanpierre CórdovaAún no hay calificaciones
- Actividad - BiofarDocumento13 páginasActividad - BiofarJESSICA QUISPE HUASCOAún no hay calificaciones
- ParacetamolDocumento19 páginasParacetamolFridaCobosAún no hay calificaciones
- ToxicidadDocumento22 páginasToxicidadRolando Quintana HuaycaniAún no hay calificaciones
- Intoxicacion Por ParacetamolDocumento4 páginasIntoxicacion Por ParacetamolJonathan Mercado HuancaAún no hay calificaciones
- CEFALEXINA 250 MLDocumento4 páginasCEFALEXINA 250 MLKaren Melissa Castro NolascoAún no hay calificaciones
- AINES2 NNMMDocumento4 páginasAINES2 NNMMYubel FlorianAún no hay calificaciones
- EDROFONIODocumento4 páginasEDROFONIOANA SOFÍA BECERRILAún no hay calificaciones
- ENSAYO Intoxicación-Por-Aspirina-Y-ParacetamolDocumento14 páginasENSAYO Intoxicación-Por-Aspirina-Y-ParacetamolAnonymous I9NdLEAún no hay calificaciones
- Acetilcisteina en VademecumDocumento8 páginasAcetilcisteina en VademecumLiliana LopezAún no hay calificaciones
- Intoxicación Por ParacetamolDocumento5 páginasIntoxicación Por ParacetamolGuillermo LeonardoAún no hay calificaciones
- Paracetamol o AcetaminofenDocumento11 páginasParacetamol o AcetaminofenZuriel MartinezAún no hay calificaciones
- Farmacocinética y FarmacodinamiaDocumento4 páginasFarmacocinética y FarmacodinamiaCarlos Paul Bazo QuesquenAún no hay calificaciones
- FarmacocineticaDocumento4 páginasFarmacocineticaYazmin RuizAún no hay calificaciones
- Aines AcidosDocumento2 páginasAines AcidosSandia LuisAún no hay calificaciones
- Inhibidores de La Bomba de ProtonesDocumento7 páginasInhibidores de La Bomba de ProtonesElsy Christian Dolly Crow'Aún no hay calificaciones
- PARACETAMOLDocumento3 páginasPARACETAMOLHeidi A FloresAún no hay calificaciones
- DFP02 TareaDocumento8 páginasDFP02 TareaAzucena González RoblesAún no hay calificaciones
- Keto Rola CoDocumento16 páginasKeto Rola CoTate HerediaAún no hay calificaciones
- Practica de Venta de Medicamento (Recuperado Automáticamente)Documento30 páginasPractica de Venta de Medicamento (Recuperado Automáticamente)yolaymi peraltaAún no hay calificaciones
- AlprazolamDocumento7 páginasAlprazolamCristhian Vilchez RamosAún no hay calificaciones
- Aines Derivados Del Paraaminofenol (Paracetamol)Documento3 páginasAines Derivados Del Paraaminofenol (Paracetamol)Ana CervantesAún no hay calificaciones
- Farmacocinetica y Dinamia.Documento6 páginasFarmacocinetica y Dinamia.Adrian RodolfoAún no hay calificaciones
- Paracetamol 1Documento18 páginasParacetamol 1kristy mendoza chumbeAún no hay calificaciones
- DERIVADOSDocumento2 páginasDERIVADOSjuan perez100% (1)
- AspirinaDocumento8 páginasAspirinajuan gabriel flores rochaAún no hay calificaciones
- Ácido para Amino SalicílicoDocumento5 páginasÁcido para Amino SalicílicoJorge SaucedoAún no hay calificaciones
- Escuela Superior Politécnica de Chimborazo FarmacoDocumento9 páginasEscuela Superior Politécnica de Chimborazo FarmacoLore PillaAún no hay calificaciones
- Tarea Farmaco 2Documento11 páginasTarea Farmaco 2Aldair CobainkAún no hay calificaciones
- SobredosificacionDocumento10 páginasSobredosificacionRolando Quintana HuaycaniAún no hay calificaciones
- Word 06Documento496 páginasWord 06Rolando Quintana HuaycaniAún no hay calificaciones
- Word 03Documento41 páginasWord 03Rolando Quintana HuaycaniAún no hay calificaciones
- Word 04Documento196 páginasWord 04Rolando Quintana HuaycaniAún no hay calificaciones
- Word 02Documento130 páginasWord 02Rolando Quintana HuaycaniAún no hay calificaciones
- Dua Lipa BiografiaDocumento4 páginasDua Lipa BiografiaRolando Quintana HuaycaniAún no hay calificaciones
- Trabajo Con Normas Apa de ForenseDocumento17 páginasTrabajo Con Normas Apa de ForenseRolando Quintana HuaycaniAún no hay calificaciones
- Analisis de La Casacion Grupo 7 Borrador RolandoDocumento1 páginaAnalisis de La Casacion Grupo 7 Borrador RolandoRolando Quintana HuaycaniAún no hay calificaciones
- Cta3-u1-Sesion 06 (4) 30 de AbrilDocumento8 páginasCta3-u1-Sesion 06 (4) 30 de AbrilMelvins CalderonAún no hay calificaciones
- Origen de La Papaina y Sus Usos en La IndustriaDocumento14 páginasOrigen de La Papaina y Sus Usos en La IndustriaMau ContrerasAún no hay calificaciones
- Farmacologia - Vias de Administracion PDFDocumento8 páginasFarmacologia - Vias de Administracion PDFDeborita RamosAún no hay calificaciones
- Tratamiento Con MTA en Molar Temporal Con Perforación en Furca y Reabsorción RadicularDocumento4 páginasTratamiento Con MTA en Molar Temporal Con Perforación en Furca y Reabsorción RadicularJavier Farias VeraAún no hay calificaciones
- Guía de Prácticas de Biotecnología 2023Documento32 páginasGuía de Prácticas de Biotecnología 2023Lina MurgasAún no hay calificaciones
- Plan de Clase CarbohidratosDocumento9 páginasPlan de Clase Carbohidratosnicolas100% (1)
- 5 Antitrombticos 1216286328501938 9Documento41 páginas5 Antitrombticos 1216286328501938 9Jose Antonio Marrasquin LujanoAún no hay calificaciones
- Leyes de La Conservación, Ebullicion, Fusion, Ley de Conservacion de EnergiaDocumento4 páginasLeyes de La Conservación, Ebullicion, Fusion, Ley de Conservacion de EnergiaJuanAlbertoEnriqueCaalBoAún no hay calificaciones
- Alimentos FuncionalesDocumento13 páginasAlimentos Funcionalesmarc0scp100% (1)
- Estado GaseosoDocumento12 páginasEstado GaseosoandreaAún no hay calificaciones
- Extracion de Cera de AbejaDocumento11 páginasExtracion de Cera de AbejaKaren Aymara ArteagaAún no hay calificaciones
- Marie CurieDocumento3 páginasMarie CuriemirianAún no hay calificaciones
- Composición y Estructura de Los HuesosDocumento1 páginaComposición y Estructura de Los Huesosyony muñozAún no hay calificaciones
- Universidad Peruana de Ciencias Aplicadas: Facultad de Ingeniería Programa Académico de Ingeniería CivilDocumento59 páginasUniversidad Peruana de Ciencias Aplicadas: Facultad de Ingeniería Programa Académico de Ingeniería CivilJhon AndersonAún no hay calificaciones
- Medios Dirigidos: CablesDocumento21 páginasMedios Dirigidos: CablesJaime Ulises RicoAún no hay calificaciones
- Identificación de Carbohidratos, Lípidos y Proteínas (Trabajo Experimental #1)Documento9 páginasIdentificación de Carbohidratos, Lípidos y Proteínas (Trabajo Experimental #1)Olga ArreazaAún no hay calificaciones
- Ficha Técnica Candado AlemánDocumento2 páginasFicha Técnica Candado AlemánGissette Ivonne Cortés AlarcónAún no hay calificaciones
- Practica Estadistica 2Documento5 páginasPractica Estadistica 2MARIA MARTHA VALERO YAHUITA0% (1)
- IndexDocumento9 páginasIndexDante SupertallarinAún no hay calificaciones
- Informe DesinfectantesDocumento8 páginasInforme DesinfectantesYarlein JulioAún no hay calificaciones
- ACA 3. Propano MetanoDocumento9 páginasACA 3. Propano MetanoRAFAEL MARIA GARCIA PUERTAAún no hay calificaciones
- Niveles de Organización de La MateriaDocumento3 páginasNiveles de Organización de La MateriaCristina CalderonAún no hay calificaciones
- Unidad 8 Fenómenos Termodinámicos en El IncendioDocumento18 páginasUnidad 8 Fenómenos Termodinámicos en El IncendioMauricio Germán Velloso Colombres100% (1)
- Programa de Proteccion RespiratoriaDocumento20 páginasPrograma de Proteccion RespiratoriaMilexa Maribel CarrilloAún no hay calificaciones
- A Cril AmidaDocumento6 páginasA Cril AmidaNancy Emeledith CTafurAún no hay calificaciones
- Trmodinamica 2017 Practica N°3Documento3 páginasTrmodinamica 2017 Practica N°3kaesar66Aún no hay calificaciones
- GENÉTICADocumento1 páginaGENÉTICACrystal RangelAún no hay calificaciones
- Ecuaciones CuadráticasDocumento17 páginasEcuaciones Cuadráticastigres1212Aún no hay calificaciones
- Hoja Calculo Pdcaas MezclasDocumento8 páginasHoja Calculo Pdcaas MezclasAaron Quispe ChambiAún no hay calificaciones
- Tabla Periodica:)Documento1 páginaTabla Periodica:)Alejandra Keila Quispe RamosAún no hay calificaciones
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Nuestra mente nos engaña: Sesgos y errores cognitivos que todos cometemosDe EverandNuestra mente nos engaña: Sesgos y errores cognitivos que todos cometemosCalificación: 3.5 de 5 estrellas3.5/5 (6)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- 200 tareas en terapia breve: 2ª ediciónDe Everand200 tareas en terapia breve: 2ª ediciónCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Neuropsicología: Los fundamentos de la materiaDe EverandNeuropsicología: Los fundamentos de la materiaCalificación: 5 de 5 estrellas5/5 (1)
- La belleza tiene su ciencia: Mitos y verdades sobre los cosméticos, el cuidado de la piel y el cabelloDe EverandLa belleza tiene su ciencia: Mitos y verdades sobre los cosméticos, el cuidado de la piel y el cabelloCalificación: 5 de 5 estrellas5/5 (2)
- La biología no miente: Revolución en salud. Basada en las cinco leyes biológicas descubiertas por el Dr. HamerDe EverandLa biología no miente: Revolución en salud. Basada en las cinco leyes biológicas descubiertas por el Dr. HamerCalificación: 4 de 5 estrellas4/5 (4)
- Sacale partido a tu cerebro: Todo lo que necesitas saber para mejorar tu memoria, tomar decisiones y aprovechar todo tu potencialDe EverandSacale partido a tu cerebro: Todo lo que necesitas saber para mejorar tu memoria, tomar decisiones y aprovechar todo tu potencialCalificación: 3 de 5 estrellas3/5 (1)
- Inteligencia artificial: Una exploración filosófica sobre el futuro de la mente y la concienciaDe EverandInteligencia artificial: Una exploración filosófica sobre el futuro de la mente y la concienciaAna Isabel Sánchez DíezCalificación: 4 de 5 estrellas4/5 (3)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- El cerebro del triunfador: 8 estrategias de las grandes mentes para alcanzar el éxitoDe EverandEl cerebro del triunfador: 8 estrategias de las grandes mentes para alcanzar el éxitoCalificación: 5 de 5 estrellas5/5 (1)
- Terapia de vidas pasadas: Un camino hacia la luz del alma. Técnica y prácticaDe EverandTerapia de vidas pasadas: Un camino hacia la luz del alma. Técnica y prácticaCalificación: 4.5 de 5 estrellas4.5/5 (11)
- El autismo: Reflexiones y pautas para comprenderlo y abordarloDe EverandEl autismo: Reflexiones y pautas para comprenderlo y abordarloCalificación: 4 de 5 estrellas4/5 (7)
- Despeja Tu Mente: Como Dejar De Pensar Demasiado, Vencer A Tu Crítico Interno, Y Replantear Tus Pensamientos Negativos Con Hábitos SaludablesDe EverandDespeja Tu Mente: Como Dejar De Pensar Demasiado, Vencer A Tu Crítico Interno, Y Replantear Tus Pensamientos Negativos Con Hábitos SaludablesAún no hay calificaciones
- Cómo dormir bien: Cómo reconocer, prevenir y tratar las dificultades para dormir bienDe EverandCómo dormir bien: Cómo reconocer, prevenir y tratar las dificultades para dormir bienCalificación: 5 de 5 estrellas5/5 (1)
- Los cinco ritos tibetanos de la eterna juventud: El ojo de la revelaciónDe EverandLos cinco ritos tibetanos de la eterna juventud: El ojo de la revelaciónCalificación: 4.5 de 5 estrellas4.5/5 (12)
- La increíble conexión intestino cerebro: Descubre la relación entre las emociones y el equilibrio intestinalDe EverandLa increíble conexión intestino cerebro: Descubre la relación entre las emociones y el equilibrio intestinalCalificación: 4.5 de 5 estrellas4.5/5 (103)