Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Docsity Los Balances de Materia y Energia Son Una Herramienta Importante para El Ingeniero en Alim 3
Cargado por
Lucero OrtizTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Docsity Los Balances de Materia y Energia Son Una Herramienta Importante para El Ingeniero en Alim 3
Cargado por
Lucero OrtizCopyright:
Formatos disponibles
Los balances de materia y energía
son una herramienta importante
para el ingeniero en Alim
Química
Unarte
88 pag.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
BALANCE DE MATERIA Y ENERGIA
UNIDAD II
ING. WILBERT M. BLANCO CARRILLO
Contenido
BALANCE DE MATERIA Y ENERGIA ............................................................................... 1
ING. WILBERT M. BLANCO CARRILLO ........................................................................... 1
UNIDAD II .......................................................................................................................... 2
COMPETENCIA GENERAL DE LA UNIDAD ..................................................................... 2
COMPETENCIAS ESPECÍFICAS: ..................................................................................... 2
2.1 Conceptos básicos....................................................................................................... 2
2.2 Reacciones de combustión .......................................................................................... 8
2.3 Balance de materia en sistemas reaccionantes con una sola reacción y en una etapa.
........................................................................................................................................ 11
2.4 Balance de masa con reacción química irreversible de combustión. .......................... 16
2.5 Balance de materia en sistemas reaccionantes en una etapa y con reacción reversible.
........................................................................................................................................ 22
2.6 Balance de materia en sistemas reaccionantes multietapas ...................................... 25
2.7 Balance de materia en sistemas reaccionantes con una sola reacción en varias
etapas. Solución con computadora (cont.). ...................................................................... 30
2.8 Balance materia en procesos de varias etapas con reacción de combustión. ............ 33
2.9 Balance de materia con una sola reacción reversible en varias etapas ...................... 35
2.10 Balance de materia en sistemas con reacciones químicas múltiples ........................ 39
2.11 Balance de materia en sistemas reaccionantes con mas de una reacción en una
etapa................................................................................................................................ 41
2.12 Balance de materia con varias reacciones en una sola etapa. Reacciones de
combustión. ..................................................................................................................... 43
2.13 Balance de materia en sistemas reaccionantes con mas de una reacción y varias
etapas. Reacciones reversibles. ...................................................................................... 67
2.14 Balance de materia en procesos con múltiples reacciones en varias etapas........... 69
2.15 Balance de materia por elemento químico en varias etapas .................................... 75
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
UNIDAD II
COMPETENCIA GENERAL DE LA UNIDAD
Desarrollar balances de materia en sistemas reaccionantes
COMPETENCIAS ESPECÍFICAS:
Emplear adecuadamente los conceptos básicos de la estequiometria de una reacción:
reactivo limitante y en exceso, grado de conversión global y de un solo paso, avance de la
reacción, rendimiento y selectividad.
Elabora un estudio sobre los diferentes tipos de reactores utilizados en la industria de
procesos.
Realizará una investigación bibliográfica sobre los términos especiales utilizados en
reacciones de combustión: aire y oxígeno teórico, por ciento de exceso de aire u oxígeno,
gases de chimenea y análisis Orsat o base seca.
Desarrollará balances de materia en sistemas con una o más reacciones químicas,
reversibles e irreversibles, basados en los componentes químicos.
Elabora balances de materia en sistemas reaccionantes enfocado en los elementos
químicos (balance elemental).
2.1 Conceptos básicos
2.1.1 Reactivo limitante y en exceso
2.1.2 Por ciento de conversión global y de un solo paso
2.1.3 Rendimiento y Selectividad
Estequiometría
Entre los cálculos fundamentales de la estequiometría están las relaciones de
masa y de volumen entre los reactivos y productos de una reacción química. Tal
información se puede obtener a partir de una ecuación de la reacción
correctamente balanceada, junto con los pesos atómicos y moleculares. Por
ejemplo consideremos la siguiente ecuación:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
La estequiometría muestra que un mol de nitrógeno reaccionará exactamente con
tres moles de hidrógeno para producir dos moles de amoniaco o bien que 28 g de
nitrógeno reaccionan exactamente con 6g de hidrógeno para producir 34g de
amoniaco, cumpliéndose la ley de la conservación de la masa (6g +28g = 34 g).
Sin embargo en la industria las cantidades relativas de las masas de los
reactantes alimentados al reactor no se alimentan, por lo general, en la proporción
estequiométrica. Si se alimentaran, por ejemplo, 2 moles de nitrógeno y 7 de
hidrógeno y la reacción se llevara a cabo hasta que se agotara uno de los
reactivos, ¿cuál se agotaría primero?, el nitrógeno. Según la ecuación química
para esto se requieren 6 moles de hidrógeno, quedando un sobrante de 1 mol de
este último reactivo. Al reactivo que se alimenta en menor proporción que la
estequiométrica se le denomina reactivo limitante (en este ejemplo es el
nitrógeno) y el otro que está en mayor proporción que la estequiométrica es el
reactivo en exceso ( el hidrógeno). La cantidad del reactivo en exceso que se
combinaría con todo el reactivo limitante se denomina cantidad teóricamente
necesaria o requerida del reactivo en exceso (en este caso es 6 moles de
hidrógeno) y el sobrante de éste, cantidad en exceso (1 mol). El porcentaje en
exceso es el por ciento de la cantidad en exceso con respecto a la cantidad
teóricamente necesaria, (1/6)(100)=16.666 %. La cantidad obtenida de productos
(4 moles de amoniaco para este ejemplo) depende entonces del reactivo limitante.
En muchos casos, debido a que la reacción alcanza un equilibrio químico o el
tiempo de residencia en el reactor no es lo suficiente como para que se agote el
reactivo limitante, el efluente del reactor contiene, además de los productos de
reacción, las cantidades de los reactivos que no se combinaron. La fracción del
reactivo limitante que se consume se le denomina grado de conversión.
Suponga que el grado de conversión de la reacción es de 0.70, entonces los
moles consumidos del reactivo limitante es 1.4 de 2 alimentados y los consumidos
del reactivo en exceso será 4.2 de 7 alimentados y los moles de amoniaco
producidos será 2.8, de modo que la corriente de salida del reactor contendrá en
moles: 0.6 de nitrógeno, 2.8 de hidrógeno y 2.8 de amoniaco.
NOTAS SOBRE ESTEQUIOMETRÍA
Los coeficientes estequiométricos son los coeficientes de reactivos y
productos que aparecen en una reacción química balanceada. Por
ejemplo en la reacción 4𝑁𝐻3 + 5𝑂2 → 4𝑁𝑂 + 6𝐻2 𝑂 , el coeficiente
estequiométrico del 𝑁𝐻3 es 4, el del 𝑂2 es 5, el del NO es 4 y el de H2O
es 6. La relación estequiométrica entre 𝑁𝐻3 y 𝑂2 es 4 a 5, entre el 𝑁𝐻3 y
el NO es 1 a 1, así entre los demás.
Esto nos indica que 4 moles de NH3 reaccionan exactamente con 5
moles de O2 para producir 4 moles de NO y 6 moles de H2O. También
que 20 moles de NH3 reaccionan con 25 moles de O2 para producir 20
moles de NO y 30 moles de H2O y así en general.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
La relación de alimentación es la relación con la entran los reactivos
al reactor, por ejemplo si la relación de alimentación entre el NH3 y el
O2 es 1a 2 significa que si entran 20 de NH3 entonces entran 40 de O2.
Pero ojo, los reactivos reaccionarán 4 a 5 independientemente de
cómo se alimenten al reactor.
El reactivo limitante es aquel que se consumiría primero si la reacción
se dejara el tiempo suficiente para que se llevara al 100 % de
conversión. Por ejemplo si se alimentan 20 moles de NH3 y 40 de O2 al
reactor, para que se consuman 20 de NH3 se consumirían solo 25 de
los 40 de O2 según la estequiometria de la ecuación química por lo
que el reactivo limitante es el NH3 y el reactivo en exceso es el O2. Se
le llama limitante porque es el que detendría la reacción al consumirse
por completo.
El % de conversión es el porcentaje del reactivo limitante alimentado al
reactor que se consume por la reacción. Por ejemplo, si de los 20
moles de NH3 (reactivo limitante) alimentados solo se consumieran 16,
el % de conversión sería (16/20) 100=80 % ó en fracción de
conversión sería 0.80.
El rendimiento de proceso es la relación entre los moles de producto
obtenido (NO por ejemplo) y los moles de este mismo producto que se
obtendrían si todo el reactivo limitante se consumiera para producir
este producto y que no hubiera otras reacciones indeseables. Para
este ejemplo, los moles producidos de NO, según el grado de
conversión (80 %) es 16, ya que, según la estequiometria (1 a 1), si se
consumen 16 de NH3 se producen 16 de NO. Pero si se consumiera
todo el reactivo limitante (20 moles) se obtendrían 20 moles de NO.
por lo tanto el rendimiento es 16/20=0.80 ó 80 %. En este caso el
grado de conversión dio igual al rendimiento (80 %) pero no
siempre es el caso, además son dos conceptos diferentes.
Cuando en el reactor se lleva a cabo una sola reacción no tiene
sentido hablar de selectividad.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
En un proceso de múltiples etapas es conveniente distinguir entre conversión
global y conversión de un sólo paso.
𝐶𝑜𝑛𝑣𝑒𝑟𝑠𝑖ó𝑛 𝑑𝑒 𝑢𝑛 𝑠𝑜𝑙𝑜 𝑝𝑎𝑠𝑜 (𝛼) =
𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑣𝑜 𝑙𝑖𝑚𝑖𝑡𝑎𝑛𝑡𝑒 𝑎𝑙𝑖𝑚𝑒𝑛𝑡𝑎𝑑𝑜𝑠 𝑎𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 − 𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑠𝑎𝑙𝑖𝑑𝑎 𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑣𝑜 𝑙𝑖𝑚𝑖𝑡𝑎𝑛𝑡𝑒 𝑎𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟
=
𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑣𝑜 𝑙𝑖𝑚𝑖𝑡𝑎𝑛𝑡𝑒 𝑎𝑙𝑖𝑚𝑒𝑛𝑡𝑎𝑑𝑜 𝑎𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟
𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑣𝑜 𝑙𝑖𝑚𝑖𝑡𝑎𝑛𝑡𝑒 𝑎𝑙𝑖𝑚𝑒𝑛𝑡𝑎𝑑𝑜𝑠 𝑎𝑙 𝑝𝑟𝑜𝑐𝑒𝑠𝑜−𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑣𝑜 𝑙𝑖𝑚𝑖𝑡𝑎𝑛𝑡𝑒 𝑎 𝑙𝑎 𝑠𝑎𝑙𝑖𝑑𝑎 𝑑𝑒𝑙 𝑝𝑟𝑜𝑐𝑒𝑠𝑜
𝐶𝑜𝑛𝑣𝑒𝑟𝑠𝑖ó𝑛 𝑔𝑙𝑜𝑏𝑎𝑙(𝛼) =
𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑣𝑜 𝑙𝑖𝑚𝑖𝑡𝑎𝑛𝑡𝑒 𝑎𝑙𝑖𝑚𝑒𝑛𝑡𝑎𝑑𝑜𝑠 𝑎𝑙 𝑝𝑟𝑜𝑐𝑒𝑠𝑜
Rendimiento: Este término, así como el de Selectividad, se emplean para
especificar el grado de predominio que tiene una reacción deseada sobre otras
indeseables que compiten con ella.
Ejemplo:
El óxido de etileno se produce mediante la oxidación catalítica de etileno:
Pero también se desarrolla una reacción indeseable, la combustión del etileno:
Si por cada 3 moles de C2H4 y 4 mol de O2 alimentados al reactor se obtienen 1.5
moles de C2H4O y 1.5 moles de CO2:
a)¿Cuál sería el reactivo limitante?
b) ¿Cuál el rendimiento y la selectividad?
c) ¿Cuál es el grado de conversión del etileno?
d) ¿Cuál sería el avance de la reacción?
Cálculos:
La relación estequiométrica entre el etileno y el O2 es de 1 a 1/2. Para que se
consuman en forma total los 3 moles de etileno se requerirían consumir 1.5 moles
de oxígeno. Por lo tanto, el reactivo limitante es el etileno.
Producto deseable: el óxido de etileno
Producto indeseable: el Bióxido de carbono
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
¿Qué significado tienen valores altos de rendimiento y de selectividad en un
proceso?
Respuesta: Mientras mayor sean estos valores, mayor será la eficiencia del
reactor desde el punto de vista técnico. Para la eficiencia real deberá efectuarse
un estudio de ingeniería de costos.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Foto de un reactor
Ejercicio:
Considera la ecuación
CH4 + 2 O2 ======> CO2 + 2 H2O
Si se alimentaran al reactor 100 kg de metano y 200 kg de oxígeno:
a) ¿Cuál sería el reactivo limitante?
b) Si el grado de conversión es del 80% ¿cuántos moles de metano y de
oxígeno se consumirían y cuántos moles de CO2 y de H2O se
obtendrían como productos?
c) ¿Cuál sería el flujo de salida del reactor en kg?
2.2 Reacciones de combustión
2.1.4.1 Importancia
2.1.4.2 Combustión completa e incompleta
2.1.4.3 Gas de chimenea
2.1.4.4 Composición base húmeda y seca
2.1.4.5 Oxígeno y aire teórico y en exceso
La combustión de materiales combustibles, como un medio para producir calor y potencia,
se emplea con mucha frecuencia en la industria, por ejemplo en una caldera para producir
vapor, en un horno de secado, en metalurgia, etc.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
La potencia total de un combustible es el calor desprendido en su combustión
completa, a presión constante y temperatura de 25 o C, entendiéndose como
combustión completa aquella en la cual los productos de combustión son CO 2
gaseoso, H2O líquida y SO2 gas (si lo hay). La potencia calorífica neta es aquella
en la cual el estado final del agua es vapor a 25 oC.
Calor de combustión del carbono = 14 490 Btu/lb
Coque = carbono amorfo
Los combustibles pueden ser sólidos (carbón), líquidos (gasolina) o
gaseosos(metano).
Ejemplos de ecuaciones de combustión:
Términos especiales empleados en combustión:
1) Gas de chimenea - todos los gases que resultan en un proceso de combustión,
incluyendo el vapor de agua, que algunas veces se denomina análisis en base
húmeda.
2) Análisis Orsat o en base seca - todos los gases que resultan del proceso de
combustión, excluyendo el vapor de agua. (El nombre de Orsat se refiere a un tipo
de aparato para el análisis de gases en el que se miden los volúmenes sobre
agua; por lo tanto cada componente está saturado con vapor de agua. El resultado
neto del análisis es la eliminación del agua como componente de la mezcla
analizada.
3) Aire teórico (u oxígeno teórico) - la cantidad de aire (o de oxígeno) requerida
para una combustión completa. También se le conoce como aire requerido ( u
oxígeno requerido).
4) Exceso de aire (o de oxígeno) -de acuerdo a la definición de exceso de
reactante, el exceso de aire (o de oxígeno) es la cantidad de aire ( o de oxígeno)
que está en demasía con respecto a la que se requiere para una combustión
completa, tal como se describe en el inciso3.
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Ejemplo:
En un horno se quema metano. Calcúlese el análisis del gas que se obtendrá al usar un
aparato Orsat con los gases de combustión, en cada uno de los siguientes casos:
a) con combustión completa usando el aire teóricamente necesario
b) con combustión completa empleando 50% de exceso de aire y
c) usando 50% de exceso de aire, pero con un 10% del metano produciendo únicamente
CO.
Diagrama del quemador:
Ejercicio (Balance por elemento químico)
En la combustión de una mezcla gaseosa que contiene C2H2, CO Y O2 se obtiene un gas de
chimenea con la siguiente composición en % molar:
O2 4.3 %
H2O 8.0 %
CO2 8.0 %
CO 8.6 %
N2 71.1 %
Calcule la composición del combustible y el % de aire en exceso utilizado.
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
2.3 Balance de materia en sistemas reaccionantes con una sola
reacción y en una etapa.
En este ejemplo se describe el procedimiento para desarrollar el balance de
materia en un sistema reaccionante en una sola etapa. El análisis es similar para
cualquier sistema en el cual se realicen cambios químicos y es una parte integral
de los balances en diagramas de procesos, como se verá en la sección 2.2.2.2.
También se incluye un ejercicio al término del ejemplo.
Ejemplo: Costo de un tanque de almacenamiento
A un Ingeniero de procesos se le encomendó calcular el costo de un tanque de almacenamiento
esférico para contener acetileno a 40 Kg/cm 2 abs y 25 oC, que sea suficiente para soportar la
producción de 4,300 Kg/h de benceno durante 10 días, empleando dos turnos de 8 horas. El
acetileno se transforma a benceno en la reacción:
3𝐶2 𝐻2 => 𝐶6 𝐻6
con 65 % de conversión. Se consideró un factor de seguridad del 10 % y la ecuación de estado de
Redlich-wong. El tanque se va a construir con acero al carbón de densidad d=7,800 Kg/m3 y costo
de $6.50/Kg y un espesor de 1 pulgada. El costo reportado fue de $5 000,000.00
¿Perderá su trabajo el Ingeniero?
Grado de conversión = 65 %
Solución:
A = acetileno
B = benceno
Reacción:
3𝐶2 𝐻2 => 𝐶6 𝐻6
Balance en el reactor:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Salidas = Entradas - Consumo + Producción
Moles de benceno producidos (FB):
Moles de acetileno alimentados (FA0):
Estos 40710 Kgmol de acetileno es lo que debe contener el tanque de almacenamiento al inicio de
proceso para que el reactor sea alimentado durante 10 días.
Cálculo del volumen molar del acetileno usando la ecuación de Redlich-Kwong:
1 atm = 1.033 kg/cm 2
P = 40 Kg/cm2 = 38.72 atm ; T = 25oC = 298oK
Pc = 60.6 atm ; Tc = 308 oK ;
R = 82.05 cm3atm /gmol oK
La ecuación (4)se resuelve por prueba y error.
Considerando al acetileno como gas ideal para estimar el valor de arranque del volumen Vo, para
la solución de (4):
𝑅𝑇 82.05𝑥298
𝑉0 =
𝑃
= = 631.48 𝑐𝑚3 ⁄𝑔𝑚𝑜𝑙
38.72
3
Resolviendo (4): 𝑉 = 615.6 𝑐𝑚3 ⁄𝑔𝑚𝑜𝑙 = 0.6156 𝑚 ⁄𝑘𝑚𝑜𝑙
Kg de acetileno = 40,710 kgmol x 26 kg/kgmol = 1 058 460 kg
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Volumen interno del tanque con el 10 % de seguridad =
= (1.10)(0.6156 m3/kgmol)(40 710 kgmol)
= 27567.1836 m3
Como es tanque esférico: V = 4/3 r3
Entonces r1= 27.446 m = radio interno de la esfera
Y r2=27.446 m + 1 pulg = 27.472 m = radio externo
Volumen del acero V = 4/3 (r23- r13) = (20733.4146-20674.6029)4/3= 78.4156 m3
Kg de acero = densidad x Volumen = (7,800 Kg/m3)(78.4156 m3)= 611641.55 kg
Costo del tanque = (611641.55 kg)($6.50/kg) = $ 3 975 670.0725
RESPUESTA: El Ingeniero probablemente pierda su trabajo, ya que sus cálculos no son correctos.
El valor calculado $ 3 975 670.0725 y el reportado $5 000,000, no coinciden.
Problema: producción de alcohol etílico
En un experimento a partir de melaza a 10 0brix para la producción de alcohol etílico, utilizando una
cepa de sacaromices cereviceae se cargaron 120 Litros de melaza en un fermentador y un inóculo
de levadura.
Después de un tiempo suficiente, se tomó una muestra y se determinó que contiene 1 % mol de
etanol.
La densidad de la melaza es 1.1 g/ml.
Calcular la conversión de azúcar en alcohol etílico y la composición másica de la mezcla final (deje
fuera del balance a la levadura). La reacción es:
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
AMONÍACO Y SUS PRINCIPALES DERIVADOS
1. PROPIEDADES Y APLICACIONES DEL AMONÍACO
El amoníaco anhidro es un gas incoloro, de olor irritante y tóxico con las siguientes
propiedades físicas:
Temperatura de solidificación (MP) -77,7 ºC
Temperatura normal de ebullición (BP) -33,4 ºC
Presión de vapor a 0 ºC 4,2 ata
Calor latente de vaporización en el BP 327 kcal/kg
Calor latente vaporización a 0ºC 302 kcal/kg
Densidad en el BP 0,682 Tm/m3
Temperatura crítica 132 ºC
Presión crítica 113 ata
Temperatura de inflamación 651 ºC
Por su elevado calor latente de vaporización se utiliza como fluido frigorífico, si
bien es peligroso en caso de que se produzcan fugas, por lo que no siempre es
recomendable. Es muy soluble en agua, se hidrata formando NH4OH que se
ioniza, generando soluciones de fuerte carácter básico. El ión amonio es
fácilmente asimilable por las plantas. Por su importancia como nutriente es el
segundo producto químico que más se produce industrialmente a escala mundial
después del ácido sulfúrico.
Es la materia prima para la fabricación del ácido nítrico, del nitrato amónico y otros
nitratos inorgánicos, así como de la urea, todos ellos de empleo masivo como
fertilizantes. El ácido nítrico es el reactivo imprescindible para la fabricación de
nitrocompuestos que encuentran aplicación en la industria de los plásticos
(isocianatos de los que se derivan los poliuretanos), las pólvoras y los explosivos
(nitroglicol y nitroglicerina para las dinamitas), fármacos, colorantes y otros
muchos productos de química fina.
La producción mundial de amoníaco se estima en 140 MTm/a, en rápido
crecimiento, a partir de gas natural y nitrógeno del aire en plantas de capacidad
por encima de las 650 Tm/d, pero que pueden llegar a los 2.000 Tm/d. El gas
natural se reforma primero en un horno alotérmico y, seguidamente, en otro
autotérmico en el que se introduce el aire que aporta el nitrógeno. Su localización
predominante es en la proximidad a los pozos de petróleo, cuyo gas asociado es
una materia prima barata. Por añadidura, el amoniaco líquido se almacena y
transporta mucho más fácilmente que el gas natural y tiene un mercado muy
amplio y transparente.
Se almacena en grandes tanques criogénicos a la presión atmosférica (a
temperaturas del orden de -33ºC), en esferas semicriogénicas a 4,2 ata (a 0ºC) y
en recipientes a presión que en verano pueden alcanzar presiones del orden de
15-20 ata. Tanto los tanques criogénicos como los semicriogénicos deben contar
con aislamientos térmicos eficaces y sistemas de licuación de emergencia.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
2. PROCESO INDUSTRIAL DE FABRICACIÓN DEL AMONÍACO
El amoníaco anhidro se obtiene industrialmente por reacción catalítica entre el
nitrógeno y el hidrógeno según la reacción reversible:
N2 + 3 H2 ⇄ 2NH3 ∆𝐻𝑟𝑜 = −21.920 kcal/kmol (4.1)
La calidad que se comercializa en la actualidad es de gran pureza, debiendo estar
exento de metanol y otros compuestos oxigenados. Puede estar contaminado con
aceites procedentes del engrase de los compresores. Para evitar la presencia de
metanol en el producto final el gas de síntesis debe ser depurado eliminando los
restos de CO y CO2 que hayan podido escapar de la conversión y de la
descarbonatación del gas de síntesis. La depuración más convencional se realiza
mediante las reacciones de metanización de ambos óxidos de carbono, que son
inversas de las de reformado con vapor (3.1 y 3.2):
CO + 3 H2 -> CH4 + H2O (4.2)
CO2 + 4 H2 -> CH4 + 2 H2O (4.3)
El metano producido no afecta a la pureza del amoniaco, aunque perjudica al
equilibrio y debe ser purgado del circuito de síntesis, como sucede con el argón
que acompaña al aire que se introduce en el reformador secundario.
En su conjunto las plantas modernas de fabricación de amoniaco constan de seis
unidades interconectadas como se indica en el diagrama simplificado de la figura
4.2: el reformado con vapor, con sus dos reformadores (primario y secundario), el
enfriamiento y conversión del gas reformado, la descarbonatación con carbonato
potásico y/o monometilamina (MEA) y finalmente el bucle de síntesis.
El proceso es similar aunque más complejo que el de fabricación de metanol; de
hecho, muchas plantas de amoniaco han sido reconvertidas para fabricar metanol,
cuando han dejado de ser competitivas.
La reacción (4.1), conocida como síntesis de Haber-Bosh, es un buen ejemplo en
el que se comprueba el principio de Le Chatelier, que postula que el equilibrio se
favorece a altas presiones cuando hay una reducción de moles (de 4 a 2 en este
caso) y a bajas temperaturas cuando se desprende calor. Efectivamente las
pequeñas plantas de producción del principio del siglo XX trabajaban a 1.000 ata,
en reactores refrigerados, con graves problemas de materiales.
Paulatinamente, a medida que se aumentaba la capacidad de las plantas de
producción, se redujo la presión y los reactores se diseñaron adiabáticos,
operando con bajos grados de conversión y un importante caudal de gases en
recirculación.
Con reactores adiabáticos pueden alcanzarse temperaturas excesivamente altas
para el acero al carbono. Por encima de 500 ºC la descarburación del acero por
efecto de la difusión a su través y reacción con el carbono para formar metano es
relativamente rápida, de modo que la temperatura límite del circuito de síntesis
está entre 450 - 475 ºC.
La evolución de la síntesis del amoniaco ha estado impulsada por la necesidad de
plantas de mayor capacidad de producción, con dificultades para refrigerar los
reactores y mantener las temperaturas por debajo de las que resisten los aceros al
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
carbono. Por ello se ha ido reduciendo progresivamente la presión de operación y,
en consecuencia, la conversión por paso.
Ejercicio 4.1. La composición molar del gas de entrada al reactor de síntesis de
una planta de amoníaco es la siguiente:
N2 H2 NH3 CH4 + A Total
20,8 62,5 3,7 13,0 100
Expresar: a) las concentraciones molares en función del grado de conversión del
nitrógeno x; b) el grado de conversión del nitrógeno en función de la concentración
molar del amoníaco; c) a partir de la ecuación de Larson que proporciona el valor
de la constante de equilibrio de la reacción:
1 3
𝑁2 + 𝐻2 ⇄ 𝑁𝐻3
2 2
2074.8
𝑙𝑜𝑔𝐾𝑝 = 2.113 +
𝑇
− 2.4943𝑙𝑜𝑔𝑇 − 1.256𝑥10−4 𝑇 + 1.8564𝑥10−7 𝑇 2
(Donde T en 0K), dibujar las curvas de equilibrio a 150 y 80 bares en el diagrama
grado de conversión-temperatura.
Sugerencia: Ver ejemplo 4.1 del anexo en PDF, “cap3_amoniaco.pdf”
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
2.4 Balance de masa con reacción química irreversible de combustión.
La combustión es la combinación de una sustancia combustible con oxígeno. Todos los procesos
de combustión son, sin excepción, exotérmicos, por lo que sus calores de combustión son
negativos. En el análisis de un proceso de combustión es muy importante obtener las respuestas a
las siguientes preguntas:
¿Qué flujo de aire o de oxígeno debiera de usarse para un flujo dado de
combustible?
¿Qué tan eficientemente se está usando el combustible?
¿Cuál es la concentración de cualquier contaminante en los gases de desperdicio
de la combustión?
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Las respuestas a estas preguntas se obtienen con los datos obtenidos con los balances de materia
y energía a partir de los valores de las variables medibles en el sistema de proceso. Entre estas
últimas se puede mencionar a la concentración del combustible, los gases de descarga y/o de
residuos de combustible no quemado.
Ejemplo: Combustión en una caldera
En una enlatadora se requiere vapor para la autoclave. Dicho vapor se va a
obtener mediante una caldera que utilizará gas propano (C3H8, 95%; CO2, 2%;
H2O, 3% en peso), el cual se va a quemar con un 40% de exceso de aire. La
legislación vigente permite hasta 8% en peso de CO2 en el gas de chimenea. La
combustión se efectúa en un 95%. Prediga el análisis masa en el gas de chimenea
y diga si se está violando la ley sobre polución.
Solución:
Cálculo de la composición molar del combustible:
Base de cálculo: 100 Kg de gas
Componente Xi mi Mi ni yi
C3H8 0.95 95 44 2.159 0.9342
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
CO2 0.02 2 44 0.045 0.0195
H2O 0.03 3 18 0.107 0.0463
_______
n= 2.311
Donde Xi, mi, Mi, ni y yi son la fracción masa, la masa, el peso molecular, el número de moles y la
fracción mol del componente i, respectivamente.
𝑪𝟑 𝑯𝟖 + 𝟓𝑶𝟐 = 𝟑𝑪𝑶𝟐 + 𝟒𝑯𝟐 𝑶
Moles de oxígeno requerido = 5/1 x 2.159 = 10.79
Moles de oxígeno en exceso = 10.79 x 0.40 = 4.32
Moles de oxígeno a la entrada = 10.79 + 4.42 = 15.11
Moles de C3H8 quemados = 2.159 x 0.95 = 2.051
Moles de oxígeno consumidos = 2.051 x 5 = 10.255
Balances de materia:
Salidas = entradas - consumo + producción
Moles de O2 de salida = 15.113 - 10.255 = 4.858
Moles de C3H8 de salida = 2.159 - 2.051 = 0.108
Moles de CO2 de salida = 0.045+3/1x2.051= 6.198
Moles de H2O de salida=0.167+ 4/1x2.051 = 8.371
Moles de N2 de salida = 79/21 x 15.113 = 56.840
________
Total de moles de salida = 76.375
Cálculo de la composición en peso del gas de chimenea:
Componente ni Mi mi Xi
CO2 6.198 44 272.712 0.1254
H2O 8.371 18 150.678 0.0693
O2 4.858 32 155.456 0.0715
N2 56.840 28 1591.520 0.7317
C3H8 0.108 44 4.752 0.0022
________ ______
2175.118 1.0001
RESPUESTA: Sí se está violando la ley, ya que el contenido de CO 2 del gas de
chimenea (12.54%) excede a lo permitido por la legislación (8%).
¿Qué recomendaciones le harías a la empresa para resolver este problema
de contaminación?
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
PROBLEMA
En un proceso en el que se intenta generar NO económico, se quema NH 3 con
20% de exceso de oxígeno,
4𝑁𝐻3 + 5𝑂2 → 4𝑁𝑂 + 6𝐻2 𝑂
La reacción se consuma en un 70%. El NO se separa del NH3 sin reaccionar y
éste se recircula como en la figura.
Calcular:
a) Las moles de NO formados por 100 moles de NH3 alimentados al proceso.
b) Los moles de NH3 recirculado por mol de NO formado.
F5 NO
F3 O2
F2 Reactor Separador
α= 70%
F1
NH3 F3 O2
F3 H2O
F8 NH3 Recirculado
Base del cálculo: 100 moles de NH3 alimentados al reactor
5𝑂2
100 𝑁𝐻3 ( ) = 125 𝑂2 𝑡𝑒ó𝑟𝑖𝑐𝑜
4𝑁𝐻3
Moles alimentados en exceso
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
(125)(0,20) + 125 = 150𝑂2
Moles de N2
Por cada 21 de O2 hay 79 de N2
5 X = 18.80 N2
(0.79)(150)
= 564.2857
0.21
𝐹2 = 150 + 564.28 = 764.28 𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑎𝑖𝑟𝑒
EL AIRE ES F3
Balance en el Reactor
𝑂2 𝑋14 𝐹4 = 150 − 5𝑍 (1)
𝑁2 𝑋24 𝐹4 = 564.28 (2)
𝑁𝐻3 𝑋34 𝐹4 = 100 − 4𝑍 (3)
𝐻2 𝑂 𝑋44 𝐹4 = 6𝑍 (4)
𝑁𝑂 𝑋54 𝐹4 = 4𝑍 (5)
𝑋14 + 𝑋24 + 𝑋34 + 𝑋44 + 𝑋54 = 1 (6)
4𝑍
0.7 = (7)
100
(0.7)(100)
𝑍= = 17.5 𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑁𝐻3 𝑐𝑜𝑠𝑢𝑚𝑖𝑑𝑎𝑠
4
𝑋14 𝐹4 = 150 − 5(17.5) = 62.5
𝑋24 𝐹4 = 564.28
𝑋34 𝐹4 = 100 − 4(17.5) = 30
𝑋44 𝐹4 = 6(17.5) = 105
𝑋54 𝐹4 = 4(17.5) = 70
𝐹4 = 62.5 + 564.28 + 30 + 105 + 70 = 831.78
52.5
𝑋14 = = 0.0757
831.78
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
564.28
𝑋24 = = 0.6764
831.78
30
𝑋34 = = 0.0361
831.78
105
𝑋44 = = 0.1262
831.78
70
𝑋54 = = 0.0842
831.78
𝐵𝑎𝑙𝑎𝑛𝑐𝑒 𝑒𝑛 𝑒𝑙 𝑠𝑒𝑝𝑎𝑟𝑎𝑑𝑜 𝐸𝑛𝑡𝑟𝑎𝑑𝑎 = 𝑆𝑎𝑙𝑖𝑑𝑎
𝑂2 𝑋14 𝐹4 = 𝑋36 𝐹6 → 62.5 = 𝑋36 𝐹6
𝑁2 𝑋24 𝐹4 = 𝑋26 𝐹6 → 564.2 = 𝑋26 𝐹6
𝑁𝐻3 𝑋34 𝐹4 = 𝐹8 → 30 = 𝐹8
𝐻2 𝑂 𝑋44 𝐹4 = 𝐹7 → 105 = 𝐹7
𝑁𝑂 𝑋54 𝐹4 = 𝐹5 → 70 = 𝐹5
𝐹6 = 62.5 + 564.2 = 626.7
62.5
𝑋36 = = 0.099
626.27
564.7
𝑋26 = = 0.9
626.27
Balance Total
𝐹1 + 𝐹3 = 𝐹5 + 𝐹6 + 𝐹7 + 𝐹8
Ejercicio
Una mezcla gaseosa que contiene 80 % de metano y 20 % N 2, se quema con 30
% de exceso de aire. Calcule la composición de los gases de chimenea si la
combustión se realiza en un 95 %.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
2.5 Balance de materia en sistemas reaccionantes en una etapa y con reacción reversible.
Los cálculos de balance de materia y energía en procesos de este tipo se
simplifican cuando se integra a las ecuaciones de balance la ecuación de equilibrio
de la reacción como una ecuación adicional. Veamos el siguiente ejemplo.
Ejemplo
Se alimentan a un reactor 4 780 kg/h de una mezcla gaseosa que tiene la
siguiente composición en % masa: CO, 58.58 %; H2O, 41.42 %. En el reactor se
efectúa la siguiente reacción:
CO(g) + H2O(g) ==> CO2(g) + H2(g)
que tiene la siguiente ecuación de equilibrio:
Donde Yi es la fracción mol del componente i.
Calcule los flujos molares a la salida del reactor y el grado de conversión de la reacción si
ésta alcanza el equilibrio.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Solución:
Base de cálculo: 4 780 kg/h de mezcla
Cálculo de los flujos molares en la alimentación:
Según la ecuación química la relación estequiométrica es 1 a 1, por lo tanto, el reactivo
limitante es el CO.
Sea r la velocidad de consumo del CO.
Balances:
salidas = entradas + producción
Fracción molar en el equilibrio:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Resultados:
Flujos a la salida:
FCO = 31.11 mol/h
FCO2 = 68.89 "
FH2 = 68.89 "
FH2O = 41.11 "
Grado de conversión:
𝟑𝟏.𝟏𝟏
∝= 𝒙𝟏𝟎𝟎 = 𝟑𝟏. 𝟏𝟏 %
𝟏𝟎𝟎
Ejercicio
Se alimentan 20 moles/h de una mezcla gaseosa equimolar de nitrógeno y acetileno a un
reactor a 300 0C y 1 atm, en donde reaccionan para formar HCN gaseoso por medio de la
reacción:
que tiene la siguiente ecuación de equilibrio:
Donde [i]n es la fracción molar del componente i y n es el coeficiente estequiométrico de i
en la ecuación química.
Estime la fracción mol en equilibrio del HCN en el producto.
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=====================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
2.6 Balance de materia en sistemas reaccionantes multietapas
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
SOLUCION:
A=Acetaldehído E= Etanol H=Hidrógeno
Base de cálculo: F6= 1000 Kg/h
N6 = 1000/(0.97x44+0.03x46)=22.7 Kmol/h Nij = Kmol/h
NA6= 22.019 NE6=0.681
Balance en la columna de destilación:
Total: 𝑁5 = 𝑁2 + 22.7 (1)
Acetaldehído: 0.55𝑁5= 0.05𝑁2 + 22.019 (2)
Resolviendo (1) y (2): 0.55𝑁2 + 12.485 = 0.05𝑁2 + 22.019
𝑁2 = 19.068 𝑌 𝑁5 = 41.768
Cálculo de las presiones de vapor de los componentes puros:
Componente A B C
ACETALDEHIDO 8.00552 1600.017 291.809
ETANOL 8.11220 1592.864 226.184
De la ecuación de Antoine:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
𝑃𝐴0 = 44.81 𝑚𝑚 𝐻𝑔 𝑦 𝑃𝐸0 = 0.360 𝑚𝑚 𝐻𝑔
Para la corriente 4:
𝑥𝑖5 𝑃𝑖0
𝑦𝑖4 =
𝑃
Donde P= 760 mm Hg
𝑦𝐴4 = 0.0319 𝑦 𝑦𝐸4 = 0.000213 𝑦𝐻4 = 0.9674
Balance global:
Acetaldehído: 22.7x0.97+0.0319xN4=z (3)
Etanol: 22.7x0.03+0.000213N4=N1-z (4)
Hidrógeno: 0.9674N4=z (5)
Resolviendo las 3 ecuaciones anteriores se obtiene:
N1=23.46 kmol N4=23.52 z=22.75
Flujo molar de la alimentación fresca = 23.46 kmol/h
Kmol/h de etanol alimentado al reactor=N1+19.068X0.95= 41.5746
Flujo molar de la recirculación (N2) = 19.068 kmol/h
Flujo molar del H2 en el gas desprendido (corriente 4)= 23.52 x 0.9674 = 22.753248 kmol/h
𝑁7 𝑅𝑇
Cálculo del flujo volumétrico de la alimentación al reactor: 𝑉̇ =
𝑃
N7 = N1+N2=42.668 kmol/h R=0.08206 m3 atm/kmol.K P= 1 atm
T=280+273.15=493.15 K
Flujo volumétrico de la alimentación al reactor 𝑉 =1726.683887852 m3/h
Grado de conversión global=(22.75)/23.46=0.970 = 97.00 %
Etanol alimentado al reactor= 23.46 +18.1146 =41.5746 kmol/h
Balance total en el condensador: N3 = N4+N5 =65.288 kmol/h
Balance de etanol en el condensador (salida del reactor):
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
NE3= (23.52x0.000213)+( 41.768𝑥0.45)= 0.00500976+18.7956 =18.80060976
Grado de conversión en un solo paso (en el reactor)=( 41.5746 -18.80060976)/(41.5746)= 54.77 %
kmol/h de etanol enviado a la torre lavadora=(23.52x0.000213)= 0.00500976
kmol/h de acetaldehido enviado a la torre lavadora=(23.52x0.0319)= 0.750288
Ejemplo 1: para resolver por computadora (Método secuencial iterativo).
PROCESO NAPHTALI*:
En el proceso de Naphtali, de acuerdo al diagrama de proceso, la corriente de
alimentación consiste de 1,000 Kg/h de cloro y 1,000 Kg/h de etileno. Estos
componentes se mezclan con los de la corriente de recirculación, para pasar a un
reactor en el cual el cloro reacciona con el etileno para dar dicloroetileno, con un
90% de conversión. Del reactor los productos pasan a un separador con una
recuperación en el domo de 99.9%, 8.0%y 2.0% de cloro, etileno y dicloroetileno
respectivamente. La corriente del domo se bifurca en dos, una parte recircula para
mezclarse con la alimentación y la otra (un 5% de lo que sale del domo del
separador) se purga. En cada equipo del proceso hay tres componentes: Cl 2, C2H4
y C2H4Cl2. Si se usa Xij para denotar a los flujos molares de estos componentes a
la salida de cada equipo, entonces el subíndice i representa a los componentes.
Cl2(i=1), C2H4(i=2) y C2H4Cl2(i=3). El subíndice j indica el número de corriente.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
* Naphtali, L.M., "Process heat and Material Balances", Chem. Eng. Prog. ,vol.60,
No 9, 1964.
¿Por qué es necesario purgar en alguna zona de un proceso
Solución al problema NAPHTALI:
Conversión de flujo másico a molar de la alimentación:
X11 = 1000/70 =14.286;
X21 =1000/28= 35.714
De acuerdo a la reacción, el reactivo limitante es el cloro.
Estructuración del modelo:
PARA EL MEZCLADOR
𝑋12 = 14.286 + 𝑋16 (1)
𝑋22 = 35.714 + 𝑋26 (2)
𝑋32 = 𝑋36 (3)
PARA EL REACTOR
𝑋13 = 𝑋12 − 0.90𝑋12 (4)
𝑋23 = 𝑋22 − 0.90𝑋12 (5)
𝑋23 = 𝑋22 + 0.90𝑋12 (6)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Para iniciar el cálculo secuencial iterativo se proponen los valores de arranque de las variables de
la recirculación: X16, X26 y X36. Obteniéndose en las primeras 2 iteraciones los siguientes valores:
Para el cloro:
iteración 1 2
Gasto 1.45071 1.4934
Para el etileno:
iteración 1 2
Gasto 1.7447 1.7704
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
========================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
2.7 Balance de materia en sistemas reaccionantes con una sola reacción en varias
etapas. Solución con computadora (cont.).
Ejemplo 2. Método secuencial combinado
Se ha propuesto el siguiente proceso para la obtención de éter etílico:
Y se cuenta con la siguiente información:
1. El grado de conversión del alcohol en el reactor es del 90 %.
2. En la alimentación al reactor, el % masa del alcohol es igual al del ácido.
Desarrolla un balance total del proceso.
Solución:
Método secuencial combinado
Este método consiste en resolver las ecuaciones independientes en forma simultánea. En este
ejemplo se planteará el modelo matemático para resolver el sistema de ecuaciones con ayuda de
la computadora usando el Software MATLAB.
Simbología:
X= fracción masa de alcohol
Y= fracción masa de agua
Z= fracción masa de H2SO4
W= fracción masa de éter
Módulos de balance:
Modulo 1. Mezclador
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Módulo 2. Reactor
Módulo 3. Separador de éter
Módulo 4. Separador de alcohol
Estructuración del sistema para la solución por computadora:
Ecuaciones seleccionadas:
a,1,3,4,5,6,7,8,b,9,10,11,c,13,14,16
Asignación de variables:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Ecuaciones:
Utilizando un Software adecuado se obtiene el siguiente resultado con 300 iteraciones:
X(1) = D = 3513 kg X(9) = XH = 0.047
X(2) = R = 403 kg X(10) = YH = 0.14
X(3) = G = 3985 X(11) = W H = 0.341
X(4) = F = 7901 X(12) = K =5897
X(5) = XF = .471 X(13) = XK = 0.063
X(6) = YF = 0.062 X(14) = YK = 0.21
X(7) = r = 36.29 X(15) = L = 5496
X(8) = H = 7902 X(16) = YL = 0.194
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
==========================================
2.8 Balance materia en procesos de varias etapas con reacción de combustión.
Ya hemos visto anteriormente como se estructura el modelo matemático de un sistema
multietapas integrando los módulos de cada unidad del proceso, así también se han
definido los conceptos básicos sobre combustión y los cálculos relacionados con los
mismos. Veamos ahora un ejemplo de un proceso con combustión de varias etapas.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Ejemplo.
En la fabricación de dióxido de azufre mediante la oxidación directa del azufre con
oxígeno puro, S(l) +| O2 (g) SO2 (g), el dióxido de azufre frío se debe recircular al
quemador, de manera que se mantenga la temperatura de flama debajo de 1000 0K para
evitar daños al quemador. Para lograr lo anterior se recircula un 90 % del efluente del
reactor. Calcule las libramol de SO2 recirculadas por lbmol de SO2 producida.
.
Quemador
de azufre
1000 0K 400 0K
O2
SO2
S(l) 1lbmol
Intercambiador de Divisor
calor
Solución:
Base de cálculo: 1 libramol de SO2 producidas = 454 gmol
Balances de material: salidas = entradas – consumo + producción
Global:
SO2: 454 = 0+ r (1)
S: 0 = F2 – r (2)
O2: 0 = F1 – r (3)
Reactor:
SO2: F3 = R + r (4)
Ec. adicional: R = 0.90 F3 (5)
De (1): r1= 454 gmol
De (2): F2 = 454 gmol
De (3): F1 = 454 gmol
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
De (4) y (5): F3 = 4540 gmol
R = 4086 gramos mol recirculados = 9 lb mol
WMBC
Ejercicio.
Se queman 2 m3 de metano, medidos a 90 0C y 1 atmósfera, con un 20 % de exceso de
aire. Después, los gases de combustión se someten a un sistema de separación en el
cual se elimina el 95 % de su contenido de agua. ¿Cuál será la composición de la mezcla
gaseosa a la salida del separador?
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
2.9 Balance de materia con una sola reacción reversible en varias etapas
Ejemplo
Una mezcla cuya composición en por ciento mol es de 90 % de N 2O4 y el resto de NO2, se
alimenta a un reactor en el que se alcanza el equilibrio:
𝑁2 𝑂4(𝑔) ⇄ 2𝑁𝑂2(𝑔)
El reactor opera a 25 oC y 2 atm y la reacción tiene la siguiente expresión
de equilibrio:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
2
PNO2
P0
KP
0 0.148
PN2O4
P0
donde Pi y Po son las presiones parciales, en torr, de los componentes y la presión normal
(750 torr), respectivamente.
Después del equilibrio, el efluente del reactor se pasa a un separador donde se obtiene
NO2 puro.
¿Cuánto NO2 se produce por 100 gr-mol de mezcla alimentada al proceso si la
recuperación del NO2 en el separador es del 80%?
Solución:
Simbología: 1. NO2 2. N2O4
Reacción: 𝑁2 𝑂4(𝑔) ⇄ 2𝑁𝑂2(𝑔)
Ecuaciones de balance:
Sea r los moles de N2O4 consumidos
En el reactor:
X 11 F1 10 2r (1)
X 21 F1 90 r (2)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Ecuaciones adicionales:
Del equilibrio:
2
PNO2
P0
K P0 0.148
3
PN2O4
P0
además:
X11 X 21 1 (4)
De los gases ideales:
PNO 2 X 11 P (5)
PN 2O 4 X 21 P (6)
Número de ecuaciones = 6
Número de incógnitas = 6
Por lo tanto es un sistema correctamente definido.
Cálculos:
Sumando (1) y (2):
F1 100 r (7)
Entonces las fracciones molares en equilibrio serán :
10 2r
X 11 (8)
100 r
90 r
X 21 (9)
100 r
Sustituyendo en la ecuación (3) y simplificando:
4.073r 2 40.73r 557.24 0 (10)
Resolviendo esta última r 7.720
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
De (8) y (9):
X11 = 0.2362 y X21 = 0.7638
De (7): F1 = 107.72 moles
En el separador:
Ecuación de restricción:
X 12 F2 0.80 X 11 F1 (11)
Respuesta:
Moles obtenidos de NO2 = X12F2 = 20
Ejercicio
Repita los cálculos del ejemplo anterior con la siguiente modificación: la mezcla
alimentada al reactor tiene un contenido equimolar de N 2O4 y NO2.
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
¿Cómo se resuelve un sistema de ecuaciones no lineales?
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
2.10 Balance de materia en sistemas con reacciones químicas múltiples
¿Cuántas velocidades de producción son correctas usar en presencia de
reacciones múltiples?
¿Cómo puede uno incorporar velocidades de producción múltiple en una
ecuación de balance por componente?
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Consideremos un sistema con r reacciones y c componentes y sea R i la velocidad
de producción neta del componente i y R ij la velocidad de producción del
componente i en la reacción j y r j la velocidad de reacción de la reacción j.
Entonces:
Ri ij de j=1 hasta j = r
La ecuación de balance molar del componente i está dado por:
Salidas = entradas + producción
En esta ecuación consideramos la producción negativa para los reactivos y
positiva para los productos de la reacción. Entonces:
Ni = N0i + Ri = N0i + Ri1 + Ri2 + ......+ Rij
ij el coeficiente del componente i en la reacción j (negativo para los reactivos
y positivo para los productos). Así:
Rij ij rj
donde rj designa a la velocidad de reacción en la reacción j.
Cuando ocurren r reacciones, se requiere introducir, por lo general, r variables de
velocidad de reacción en las ecuaciones de balance. Sin embargo, en algunos
casos, habrá ecuaciones de reacción química que son dependientes
(redundantes), es decir, pueden obtenerse sumando o restando múltiplos de las
demás reacciones; por lo que en estos casos se requieren menos de r variables
de velocidades de reacción.
CONVERSIÓN FRACCIONAL DEL COMPONENTE i (𝜶𝒊 ): Moles del
componente i consumidos por mol de i alimentado.
RENDIMIENTO FRACCIONAL (RENDpq) del producto p a partir del reactivo q:
Donde: Rp es la velocidad neta de producción de p
Rp MAX es la velocidad máxima de producción de p si se utilizara la
velocidad total de consumo de q a producir únicamente p.
Un rendimiento del 100 % indica que casi todo el reactivo q está siendo
convertido al producto deseado p.
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
2.11 Balance de materia en sistemas reaccionantes con más de una
reacción en una etapa.
Reacciones de combustión.
Ejemplo
Un gas que contiene sólo CO y N2 se produce pasando una mezcla de
gases de chimenea y aire a través de un lecho de carbón incandescente
(suponga que el carbón es puro). Las dos reacciones que ocurren de
manera completa son:
En un caso particular, el gas de chimenea contiene 12.8 % mol de CO,
3.7 % mol de CO2, 5.4 % mol de O2 y 78.1 % mol de N2. La mezcla gas
de chimenea/aire se alimenta a la cámara de combustión en una relación
de 2 a 1. Calcule la composición del gas producto y los kilogramos de
carbón quemados por cada 100 kgmol de gas de chimenea alimentados.
Solución:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Diagrama de proceso
wmbc
Base de cálculo: F0 = 100 kgmol de gas de chimenea
Sean r1 y r2 las velocidades de producción de cada una de las reacciones,
respectivamente.
Ecuaciones de balance:
Salidas = entradas + mas producción
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Ejercicio
2.12 Balance de materia con varias reacciones en una sola etapa. Reacciones de
combustión.
Se carga un horno vertical con piedra caliza pura, CaCO3, y coque también
puro (carbono), ambos a 25 0C. Por el fondo del horno se introduce aire seco,
que proporciona el calor necesario para la descomposición del carbonato,
mediante la combustión del carbono hasta CO2. Por el fondo del horno se
descarga cal viva, CaO, a 950 0C, que contiene 5 % de carbono y 1 % de
CaCO3. Los gases del horno se descargan por la parte superior a 600 0 F y
contienen únicamente CO2 y N2. Las dos reacciones son
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Calcule:
1. La composición de los gases de combustión.
2. Los kilogramos de cal viva obtenida por
kilogramo de piedra caliza alimentada.
3. Los m3 de aire alimentados a C.N. por kg de
Carbono alimentado.
PROBLEMA
Metano y oxigeno reaccionan en presencia de un catalizador para dar formaldehido. En
una reacción paralela, el metano se oxida a dióxido de carbono y agua.
CH4+ O2 HCHO + H2O
CH4+ O2 CO2 + H2O
La alimentación del reactor contiene cantidades equimolares de metano y oxigeno.
Suponga como base a una alimentación de 100 mol/s.
a) Dibuje y marque el diagrama de flujo. Use el análisis de grados de libertad basado
en el grado de avance de la reacción para determinar cuántas variables de
proceso deben especificarse para calcular el valor de las variables restantes.
b) Use 𝑋𝑖𝑗 como la fracción molar del componente i en la corriente j y 𝐹𝑗 como el flujo
molar de la corriente j para formular los balances de materia.
c) La fracción de conversión del metano es .900 y la fracción de rendimiento del
formaldehido es de .855. Calcule la composición molar de la corriente de salida
del reactor y la selectividad de producción de formaldehido en relación con la
producción de dióxido de carbono.
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Problema 4.75 (FELDER)
SELECTIVIDAD = Producción de CO2 respecto a CO es 10:1
Sea Nij = los kmoles del componente i en la corriente j
De la selectividad: 𝑁23 = 10𝑁13 (1)
a) Cálculo del % de Oxígeno en exceso
Para calcular el oxígeno teórico se supone que todo el carbono se oxida a CO2, el H a H2O y el S a
SO2.
𝐶 + 𝑂2 → 𝐶𝑂2
𝐻2 + 1⁄2 𝑂2 → 𝐻2 𝑂
𝑆 + 𝑂2 → 𝑆𝑂2
Entonces:
(5000)(0.75) (5000)(0.17) 1 (5000)(0.02) 1
𝑶𝟐 𝒕𝒆ó𝒓𝒊𝒄𝒐 = + ( )+ =
12 1 4 32 1
= 312.5 + 212.5 + 3.125 = 𝟓𝟐𝟖. 𝟏𝟐𝟓 𝒌𝒎𝒐𝒍𝒆𝒔/𝒉
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Kmoles de O2 alimentados/h= (50 kmol aire/min)(60 min/1 h)(0.21)= 630
% exceso de O2 = (630-528.125)528.125= 19.29 %
b) Cálculo de la composición de CO y CO2 en el gas de combustión
Como no se conoce la fórmula (s) del combustible, realizaremos un balance elemental:
ENTRADAS DEL ELEMENTO i = SALIDAS DEL ELEMENTO i
Balance de C: (5000 x 0.75)/12 = N13 + 𝑁23 + 0.06 (5000 x 0.75)/12 (2)
De (1) y (2): 312.5 = 11 N13 + 18.75 N13 = 26.7045 kmol y N23 = 267.045
N33 = 3.125 N63 = 425
Kmoles de O2 consumidos = 13.3522 + 267.045 +3.125 + 212.5 = 496.0222
Observe que los moles realmente consumidos de O2 (496.0222) es diferente a los moles teóricos
(528.125).
Entonces N43 = (630-496.0222)= 133.9778 N53 = (79/21)( 630)= 2370
Componente Nij yij
CO 26.7045 0.828
CO2 267.045
SO2 3.125 9.687 x 10-4
O2 133.9778
N2 2370
H2O 425
total 3225.8523
c) Velocidad de formación de ácido sulfúrico (kg/h)
𝑆𝑂2 + 1/2𝑂2 → 𝑆𝑂3
𝑆𝑂3 + 𝐻2 𝑂 → 𝐻2 𝑆𝑂4
𝑘𝑔
𝑑𝑒 𝐻2 𝑆𝑂4 = 3.125𝑥98 = 306.25
ℎ
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Base de cálculo: N3bs = 100 moles de gas seco
Todo el carbono del gas seco proviene del hexano:
Moles de hexano alimentados al reactor N1= (2.1+6.9+6(0.265))(1/6)= 1.765
Moles de hexano consumidos = 1.765 – 0.265 = 1.5
a) % de conversión del hexano = (1.5/1.765)(100)= 84.9858 %
Para obtener el O2 teórico se supone que todo el carbono del combustible se quema a CO2:
𝐶6 𝐻14 + 19/2𝑂2 −> 6𝐶𝑂2 + 7𝐻2 𝑂
Moles de oxígeno teórico = (9.5/1)(1.765)= 16.7675
Moles de O2 alimentados = 16.7675 (1+x), (siendo x la fracción en exceso de O2).
Moles de N2 alimentados =(79/21)( 16.7675 (1+x))= moles de N2 a la salida (a)
Moles de O2 a la salida = 16.7675 (1+x)-(0.5/1)(2.1)-6-9 (b)
Pero (a)+(b) = 90.735 = (79/21)( 16.7675 (1+x))+ 16.7675 (1+x)-(0.5/1)(2.1)-6.9
90.735 = 63.0777+63.0777 x + 16.7675+16.7675 x -1.05-6.9
79.8452 x = 18.8398
De donde se obtiene que x= 0.2359, entonces :
b) % en exceso de O2 es 23.59 % = % de exceso de aire alimentado
Moles de hexano consumidos = 1.5
𝐶6 𝐻14 + 19/2𝑂2 −> 6𝐶𝑂2 + 7𝐻2 𝑂 (c)
𝐶6 𝐻14 + 13/2𝑂2 −> 6𝐶𝑂 + 7𝐻2 𝑂 (d)
En (c) se consumen (1/6)(6.9)= 1.15 moles de Hexano
En (d) se consumen (1/6)(2.1)= 0.35
Moles de agua producidas = 7(1.15+0.35)= 10.5
Moles totales de gas húmedo = 110.5
Fracción molar del agua en el gas húmedo = 10.5/110.5= 0.0950
Presión parcial del agua en el gas húmedo = 0.0950 (101.32) = 9.6277 kPa
La temperatura de rocío del gas húmedo es la temperatura a la cual el gas estuviera saturado de
vapor de agua y en este punto la presión parcial del vapor de agua sería igual a su presión de vapor
como agua pura saturada. Esto es pv = p0= 9.6277 kPa.
Utilizando las tablas de vapor saturado se obtiene la temperatura de saturación del agua o de
rocío del gas húmedo: Tsat=Trocío= 45.5 0C. por lo que si el gas húmedo de combustión se enfriara, el
vapor de agua empezaría a condensar a 45.5 C.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
Problema numero
33.- una mezcla de propano y butano se quema con aire. Un análisis parcial
del gas de emisión proporciona los siguientes porcentajes en volumen en una
base seca.
C3H8 = 0.0527%
C4H10 = 0.0527%
CO = 1.48%
CO2 = 7.12%
La presión absoluta del gas de emisión es de 776mm de Hg y el punto de
rocío del gas es de 46.5 °C, calcula la composición molar del combustible.
Solución
1.- C3H8
2.- C4H10
Aire = 0.21 de O2 Y 0.79 de N2 COMPOSICION DE LA CORRIENTE DE AIRE
F1 =
n11 = mol de propano
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
n21 = mol de butano
F2 =
n12 = 0.21 de O2
n22 = 0.79 de N2
Gas de combustión=
P: 776 mm. De Hg
T de punto de rocio: 46.5°c
100 mol. Corriente de gas
0.000527 mol de C3H8/mol
0.000527 mol de C4H10/mol
0.0148 mol de CO/ mol
0.0712 mol de CO2/mol + O2 y N2 + n3 moles de H2O
C3H8 + 5 O2 3 CO2 + 4 H2O
C4H10 + 13/2 O2 4 CO2 + 5 H2O
Punto de rocío:
A 46.5 °c Y3 p = p3* (46.5) Y3 = 77.6 mm Hg / 776mm Hg = 0.0995 mol de H 2O / mol
Pero Y3 = n3 / 100 + n3 = 0.0995 entonces
n3 = 11.05 mol de H2O
Balance del C = 3n11 + 4 n21 = 100 (0.000527)(3) + (0.000527)(4) + 0.0148 + 0.01712
3n11 + 4n21 = 8.969………………… 1
Balance de H = 8 n11 + 10n21 = 100 (0.000527)(8) + (0.000527)(10) +( 11.05)(2)
8 n11 + 10n21 = 23.047………….. 2
Resolver simultáneamente: n11 = 1.25 mol C3H8 49.0% C3H8
n21 = 1.30 mol C4H10 51.0% C4H10
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
ING. QUIMICA
“BALANCE DE MATERIA Y ENERGIA”
CATEDRATICO: WILBERT MORGAN BLANCO CARRILLO
Ejercicio 4.50
El etanol se clora en un reactor continuo:
C₂H₆ + Cl2 C2H5Cl + HCl
Parte del monocloroetano que se produce se clora aún más por una reacción secundaria
indeseable:
C2H5Cl + Cl2 C2H4Cl2 + HCl
(a) Suponiendo que el objetivo principal sea maximizar la selectividad de producción de
monocloroetano respecto de la producción de dicloroetano, ¿diseñarían el reactor para
que realizara una conversión alta o baja de etano? Explique su respuesta. (Sugerencia: si el
contenido del reactor permaneciera en éste el tiempo suficiente para que se consumiera
la mayor parte de etano en la alimentación, ¿cuál sería el principal constituyente del
producto?) ¿Qué pasos adicionales con seguridad se llevaría a cabo para que el proceso
fuera razonable desde el punto de vista económico?
(b) El reactor está diseñado para dar una conversión de 15% de etano y una selectividad de 14
mol C2H5Cl/ mol C2H4Cl2, con una cantidad insignificante de cloro en el gas producido.
Calcule la proporción de alimentación (mol Cl2/mol C2H6) y la fracción de rendimiento del
monocloroetano.
(c) Suponga que el reactor se construye y arranca, y la conversión es solo de 14%. El análisis
cromatográfico muestra que no hay Cl2 en el producto, sino otra especie de mayor peso
molecular que el del diclorometano. Dé una explicación posible para esos resultados.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Solución
(a) Se diseñaría para conversión baja. Al aumentar el grado de conversión aumentaría la producción
de monocloetano en la reacción A, pero se convertiría más de éste a dicloroetano en la reacción
B, disminuyendo el rendimiento y/o la selectividad y el producto principal sería el dicloroetano.
Una posible solución sería la separación del etano del producto y recircularlo al reactor.
(b) Cálculo de la proporción de alimentación y el rendimiento
(b1): Balance por compuesto químico
Entradas de i - consumo de i + producción de i = salidas de i
C₂H₆ + Cl2 C2H5Cl + HCl (A)
C2H5Cl + Cl2 C2H4Cl2 + HCl (B)
NOTA: Como el cloro en el gas de salida es insignificante nos sugiere que podemos despreciarlo.
Sea ZA y ZB los moles de Cl2 consumidos en las reacciones A y B respectivamente y nij son los moles del
componente i en la corriente j.
Balance de etano: n11 - ZA= n12 (1)
Balance de Cl2: n21- ZA -ZB = 0 (2)
Balance de C2H5Cl: ZA-ZB = 100 (3)
Balance de C2H4Cl2: ZB = n42 (4)
Balance de HCl: ZA +ZB = n52 (5)
Grado de conversión: 0.15=ZA/n11 (6)
Selectividad: 14=100/n42 (7)
7 ecuaciones = 7 incógnitas: el sistema tiene solución única
Solución del sistema:
De (7): n42=7.1429 moles de C2H4Cl2
De (4): ZB = 7.1429
De (3): ZA = 107.1429
De (6): n11 = 714.286
De (1): n12 = 607
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
De (2): n21 = 114.2858
De (5): n52 = 114.2858
Proporción de alimentación:
Moles de Cl2/mol C2H6= n21/n11= 0.16
Rendimiento de C2H5Cl:
Rend = (100/n11) 100= 14 %
(c) Es probable que el dicloroetano se clore más a tricloroetano.
(b2) Balance por elemento químico: entradas = salidas
C₂H₆ + Cl2 C2H5Cl + HCl (A )
C2H5Cl + Cl2 C2H4Cl2 + HCl (B)
Base de cálculo: 100 moles de C2H5Cl
n11= C2H6 n12=C2H6
F1 F2
REACTOR n32=C2H5Cl=100
n21= Cl2 n42= C2H4Cl2
n52=HCl
NOTA: Como el cloro en el gas de salida es insignificante nos sugiere que podemos despreciarlo.
Balance por elemento químico: entradas = salidas
Balance de C: 2n11=2n12+ 2(100) + 2n42 (1)
Balance de H2: 3n11= 3n12+2.5 (100) +2n42 +0.5n52 (2)
Balance de Cl2: n21= n12+ 50+n42+0.5n52 (3)
Ecuaciones adicionales:
Grado de conversión: 0.15=(n11-n12)/n11 (4)
Selectividad: 14=100/n42 (5)
Cinco ecuaciones = 5 incógnitas (todas las nij)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Solución del sistema de ecuaciones:
De (5): n42=7.1429 moles de C2H4Cl2
De (1) y (4) simultáneos: n11= 714.286 n12= 607
De (2): n52= 114.2858
De (3): n21= 114.2858
Proporción de alimentación:
Moles de Cl2/mol C2H6= n21/n11= 0.16
Rendimiento de C2H5Cl: Rend = (100/n11) 100= 14 %
(c) Es probable que el dicloroetano se clore más a tricloroetano.
(d) Suponga que se alimentan los mismos n11= 714.286 moles de etano al reactor y y que el grado de
conversión es del 50 %, ¿cuál sería el rendimiento y la selectividad para la producción de 100 moles de
monocloroetano?
Sea ZA y ZB los moles de Cl2 consumidos en las reacciones A y B respectivamente y nij son los moles del
componente i en la corriente j.
Balance de etano: 714.286 - ZA= n12 (1)
Balance de Cl2: n21- ZA -ZB = 0 (2)
Balance de C2H5Cl: ZA-ZB = 100 (3)
Balance de C2H4Cl2: ZB = n42 (4)
Balance de HCl: ZA +ZB = n52 (5)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Grado de conversión: 0.50=ZA/714.286 (6)
De (6): ZA = 357.143
De (1): n12= 357.143
De (3): ZB = 257.143
De (2): n21= 614.286
De (4): n42 = 257.143
De (5): n52 =614.286
De donde Rend = (100/714.286) 100 = 14 %
Selectividad = 100/257.143 = 0.389
Se tendría que alimentar un mayor flujo de Cl2, (n21), disminuyendo la selectividad, lo cual no es
conveniente para el proceso.
(e) si se recircula el etano no consumido se obtienen los resultados mostrados en la figura.
Observe que la selectividad no disminuyó y que el rendimiento aumentó de 14 % a 93.21 % lo cual es una
mejora del proceso.
Se tendría que efectuar un estudio de costos para saber si el proceso es razonable desde el punto de vista
económico, ya que se incluiría un proceso de separación y recirculación del etano.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE TUXTLA GUTIERREZ
Ing. Wilbert Blanco Carrillo
=======================================
2.2.2.1.2 Balance de materia en sistemas con más de una
reacción en una sola etapa. Reacciones reversibles.
Ejemplo: Proceso Oswald
En el proceso Oswald, el amoníaco, NH3, se oxida a NO2 mediante las
Siguientes reacciones
4 NH 3 5O2 4 NO 6 H 2O
2 NO O2 2 NO2
El NO2 es absorbido posteriormente en agua para formar el HNO3. La reacción se hace a
80 oC y 150 atm. La segunda reacción tiene como expresión de equilibrio:
( x 2 NO2 )
0.005
P ( x 2 NO )( xO2 )
P = en atm x = fracción molar
Se alimenta 4 Kgmol/h de NH3 y la cantidad estequiométrica de oxígeno atmosférico
necesario.
Calcule la composición molar y másica del efluente del reactor.
Solución al problema Oswald:
Base de cálculo= 4 Kmol de NH3
Reactor
4 NH 3 5O2 4 NO 6 H 2O (1)
2 NO O2 2 NO2 (2)
Moles de O2 alimentados = Moles requeridos de O2 = 7
NOTA: Los moles teóricamente necesarios de O2 son los requeridos para que todo el
reactivo limitante (NH3) produzca el producto deseado (NO2).
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Balances de materia: salidas = entradas – consumo + producción
Denominación:
Y = NO Z = NO2 X = O2 W = H2O
Ecuaciones de balance:
NH 3 : 0 4 4 R1 (1)
NO : Y2 F2 4 R1 2 R2 (2)
NO2 : Z 2 F2 2 R2 (3)
O2 : X 2 F2 7 5R1 R2 (4)
H 2O : W2 F2 6 R1 (5)
N2: 26.33=26.33 (6)
__________________________
F2 = 37.33+R1-R2
Ecuación adicional:
En el equilibrio
NO: 4R1-2R2 moles en equilibrio
NO2: 2R2 “
O2: 7-5R1-R2 “
_____________
Sumando: 7-R1-R2
De la ecuación de equilibrio:
4𝑅22
38.33−𝑅2
0.005 = 150(4−2𝑅2)2 (2−𝑅2)
(38.33−𝑅2) (38.33−𝑅2)
2 R2
( )2
7 R1 R2
0.005 (6)
4 R 2 R2 2 7 5R1 R2
150( 1 ) ( )
7 R1 R2 7 R1 R2
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Cálculos:
DE (1): R1 1
DE (6): R23 6R22 36R2 4 0 (7)
Resolviendo la ecuación (7) por el método de Newton-Raphson:
R2 = 0.6108
Salidas del reactor:
DE (2) NO = 2.7784 moles
DE (3) NO2 = 1.2216 "
DE (4) O2 = 1.3892 "
DE (5) H2O = 6.0 "
N2 = 79(7)/21 = 26.333 "
________
SUMA = 37.7222
Composición del efluente del reactor:
ni xi Mi mi wi
NO2 1.2216 0.03238 46 56.1936 0.05459
NO 2.7784 0.07365 30 83.3520 0.08097
02 1.3892 0.03683 32 44.4544 0.04318
H2 O 6.0000 0.15906 18 108.0000 0.1049
N2 26.3333 0.69808 28 737.3324 0.7163
_______ ______ _________ ______
37.7222 0.9999 1029.3324 0.99994
donde:
xi = fracción molar y wi = fracción másica
Problema: Repita los cálculos de ejemplo anterior pero con una conversión del amoniaco
del 55 %.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Ing. Química Balance de materia y energía
Problema 3.125 del Himmelblau decimocuarta edición Ing. Wilbert Morgan Blanco Carrillo
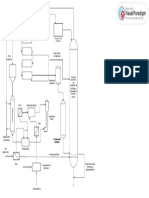
3.125.- Con referencia al diagrama de flujo del proceso, mostrado en la figura de la hoja anexa, que produce
ácido maleico por medio de la oxidación parcial del benceno se tiene lo siguiente: los moles de O2 que
alimental al reactor por mol de benceno puro que se introduce al reactor son 18.0. Todo el ácido maleico
que se produce en el reactor se extrae mediante agua por el flujo inferior del lavador de agua. Todo el C6H6,
O2, CO2 y N2 que sale del reactor se descarga con la corriente de la parte superior del lavador, y dichos
gases están saturados con H2O. Originalmente, el benceno contiene trazas de un contaminante no volátil
que inhibiría la reacción. Este contaminante se elimina mediante destilación por arrastre con vapor de agua
en el alambique correspondiente. Este alambique contiene dos fases líquidas, es decir, la de benceno y la de
agua (el benceno es totalmente inmiscible en agua). La fase de benceno equivale al 80% del peso total de
las dos fases líquidas y la fase de agua equivale a 20% en peso restante. Las demás condiciones del proceso
se muestran en el diagrama de flujo. Utilizar los datos de presión de vapor que se proporcionan más
enseguida.
Datos de presión de vapor
Temperatura, F Benceno lbf/plg2 abs Agua lbf/plg2 abs
110 4.045 1.275
120 5.028 1.692
130 6.195 2.223
140 7.570 2.889
150 9.178 3.718
160 11.047 4.741
170 13.205 5.992
180 15.681 7.510
190 18.508 9.339
200 21.715 11.536
Calcula:
a) Los moles de benceno que participan en la reacción (2) por mol de benceno alimentado al reactor.
b) Las libras de agua eliminadas con la corriente superior del deshidratador por lbmol de benceno
alimentado al reactor.
c) La composición (% mol, en base húmeda) de los gases de descarga que salen por la parte superior
del lavador.
d) Las libras de agua líquida pura que se añaden por la parte superior del lavador, por lbmol de
benceno alimentado al reactor.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Las reacciones son: C6H6 + 9/2 O2 C4H4O4 + 2CO2 + H2O (1)
C6H6 + 15/2 O2 6CO2 + 3H2O (2)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Solución
1 atm = 14.646 psi.
Base de 100 moles C6H6 alimentados al reactor.
1 C6H6 / 18 O2
Moles de O2 alimentados al reactor (corriente 7)=1800
1800 O2 21% O2
8571.4286 100% Aire seco
6771.4286 79% N2
Moles de aire seco en la corriente 6 = 8571.4286
Moles de N2 en la corriente 6 = 6771.4286
HR= 50%
HR=(Pi/P°H2O a 150°F )X100
Pi= (50/100)x P°H2O a 150°F
De la tabla anterior: P°H2O a 150°F = 3.718 psia
Entonces : pi =1.859 (presión parcial del vapor de agua en el aire húmedo de la corriente 6)
pi= yiP yi = Pi/p = 1.859/14.696=0.1265= yH2O
(fracción mol del agua en el aire húmedo).
ya.s.= 1- yH2O = 1- 0.1265= 0.8735 (fracción molar del aire seco en el aire húmedo)
ya.s.= na.s./na.h. Na.h=na.s./ya.s.=8571.4286/0.8735= 9812.7402 (moles de aire
húmedo)
na.h.= na.s. + nH2O
na.h.- na.s. = nH2O
= 9812.7402 – 8570.4280= 1241.3116 moles de H2O en la corriente 6.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Corriente 7:
Base seca: 0.78% C4H4O4, 80.0% N2, xCO2, xO2 y xC6H6
Balance en el reactor.
Moles de N2 en el efluente del reactor(n38) = 6771.4286 (esto es el 80 % del efluente seco)
Efluente seco= 8 464.2858 moles
n58 = 0.76% de 83464.2858 = 64.3286 moles de C 4H4O4
Como Z1= 64.3286 moles producidos de acido maleico en la reacción 1:
Balances en el reactor:
Benceno: n18 = 100 – Z1 – Z2 (1)
O2: n28 = 1800 – 9/2 Z1 – 15/2 Z2 (2)
CO2: n68 = 2 Z1 + 6 Z2 (3)
Ec. Adicionales.
*n18 + n28 + n68 = 8 464.2858-6771.4286- 64.3286 = 1628.5286
Sumando (1), (2) y (3):
*1628.5286 = 100 + 1800 – 7/2 Z1 – 5/2 Z2
= 1900 – 225.1501 – 2.5 Z2
1628.5286 – 1674.8499 =– 2.5 Z2
Z2=-46.3213/-2.5 = 18.5285
De (1): n18= 100 – 64.3286 – 18.5285 = 17.1429 C6H6
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
De (2): n28 = 1800 – 9/2(64.3286) – 5/2(18.5285) = 1371.5575 O2
De (3): n68 = 2(64.3286) + 6(18.5285) = 239.8282 CO2
Balance de agua en el reactor:
n48 = 1241.3116 + Z1 + 3Z2 = 1241.3116 + 64.3286 + 3(18.5285)= 1361.2257 H2O
Balance en el lavador:
Salida inferior.
Entrada: n5,11= n58= 64.3286 12% C4H4O4
n18=17.1429 536.0717 100%
n28=1371.5575 n4,11 = 471.7431 38% H2O
n38=6771.4286
n48=13.61.2257 Salida superior.
n58=64.3286 n1,10 = 17.1429 C6H6
n68 =239.8282 n2,10 = 1371.5575 O2
n3,19 = 239.8282 CO2
8399.9572 Base seca (salida superior del lavador)
Como base seca está saturada. P°H2O a 142°F = 3.0548 psi
Interpolación para obtener p° H2O a 142 F
HR= (pi/ P°H2O a 142°F )X 100 (((142 – 140)(3.7118 – 2.889))/(150-140)) +
2.889= 3.0548 psi
Pi=(100/100)x3.0548= 3.0548
Pi= γi P
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
γi= Pi/P = 3. 0548/14.696 = 0.2079 γH2O
γb.s= 1 - γH2O = 1- 0.2079= 0.7921
*γb.s= nbs/nbh
nb.h= nbs/ γb.s= 8399.9572/0.7921= 10609.6676b.h
nb.h=nbs + nH2O
= nH2O= nb.h – nb.s=10604.6676 – 8399.4572 = 2204.7104 n4,10 (moles de H2O)
n48 + n49= n4,10 + n4,11
1361.2257 + n49 = 2204.7104 + 471.7431
n49= 2204.7104 + 471.7431 – 1361.2257
n49 = 1315.2278 H2O
Balance en el deshidratador.
Entrada:
n4,11 = 471.7431 H2O
n5,11 = 64.3286 C4H4O4
C4H4O4 C4H4O3 + H2O
Z1= n5,11= 64.3286
n4,12= n4,11 + Z1
n7,13= Z1
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
n4,12= 471.7431 + 64.3286 =536.0717 H2O
n7,13= 64.3286 C4H2O3
Problema
Una mezcla que contiene 68.4 % de H2 y 22.6 de N2 y 9 % de CO2
(todas en % mol), reacciona de acuerdo con
N 2 3H 2 2 NH 3
CO2 H 2 CO H 2O
hasta que la mezcla de salida del reactor contiene 15 % de amoniaco,
5% de agua y el resto de N2, H2, CO2 y CO. Calcule, para una
alimentación al reactor de 100 kmol:
a. la composición de los otros componentes de la mezcla de salida
b. el grado de conversión del Hidrógeno en cada una de las
reacciones
c. el rendimiento del amoniaco con respecto al hidrógeno
d. la selectividad entre el amoniaco y el CO.
NOTA:
El valor de esta evaluación es de 0 a 60 % y el 40 % restante
distribuido entre tareas fuera de aula y asistencias al aula.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
INSTITUTO TECNOLOGICO DE
TUXTLA GUTIERREZ
MATERIA: BALANCE DE MATERIA Y ENERGIA
EVALUACION DE LA UNIDAD II. Balance de materia en sistemas reaccionantes
INSTRUCTOR: I.Q. Wilbert Morgan Blanco Carrillo
PROBLEMA
La corriente de alimentación de una planta Claus consta de 75 % de CO 2 y 25 %
de H2S. Un tercio de la corriente se envía a un horno, donde el H 2S se quema por
completo con una cantidad estequiométrica de aire alimentado a 1 atm y 25 oC. La
reacción es
𝐻2 𝑆 + 3⁄2 𝑂2 => 𝑆𝑂2 + 𝐻2 𝑂
Los gases producidos en esta reacción se mezclan después con los dos tercios
restantes de la corriente de alimentación y se mandan a un segundo reactor donde
se realiza la siguiente reacción hasta completarse:
2𝐻2 𝑆 + 𝑆𝑂2 ==> 2𝐻2 𝑂 + 3𝑆
Los gases salen de este último reactor a velocidad de 10 m3/min a 380 0C y 205
kPa absolutas. Suponiendo comportamiento de gas ideal, determine la velocidad
de alimentación de aire en m3/min.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
𝐻2 𝑆 + 3⁄2 𝑂2 => 𝑆𝑂2 + 𝐻2 𝑂 (1)
2𝐻2 𝑆 + 𝑆𝑂2 ==> 2𝐻2 𝑂 + 3𝑆 (2)
Cambio de base de cálculo
Base de cálculo: F1=300 kmol/min
Moles alimentados al horno= 100
De éstos, 25 kmoles de H2S reaccionan en el horno según la reacción (1)
produciendo 25 kmoles de SO2 y 25 de H2O y se consumen 3/2 (25)=37.5 kmoles
de O2. Entonces los kmoles de aire alimentado será: F4=100/21(37.5)=178.57
kmoles de N2 alimentados=79/21(37.5)=141.07
Al reactor se alimentan las otras dos terceras partes de la alimentación fresca (200
kmoles) con el efluente del horno (25 kmoles de SO2, 25 de H2O, 75 de CO2 y
141.07 de N2).
kmoles totales alimentados al reactor=466.07
En el reactor se consumen los 50 kmoles restantes de H2S y los 25 de SO2 según
la reacción (2). Esto quiere decir que no sale SO2 en el efluente del reactor.
Salidas del reactor:
CO2=225 kmoles
N2 =141.07
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
H2O=75
S = 75
Total de kmoles a la salida del reactor = 516.07
Cálculo del volumen ocupado por los 516.07 kmoles del efluente del reactor:
𝑁𝑅𝑇 516.07𝑥8.314𝑥653.15 3
𝑉= = = 13670.289 𝑚 ⁄𝑚𝑖𝑛
𝑃 205
Haciendo referencia con la base original (10 m3/min) se calcula el flujo molar de
aire alimentado real.
Kmoles de aire alimentado=(178.57/13670.289)(10)= 0.13062
Molg de aire alimentados al horno=130.62
2.13 Balance de materia en sistemas reaccionantes con mas de una
reacción y varias etapas. Reacciones reversibles.
Ejemplo.
Se alimentan a un reactor 4 moles de la sustancia A y 6 moles de B, que
reaccionan de acuerdo a las reacciones siguientes:
La segunda reacción tiene la siguiente ecuación de equilibrio:
en donde Xi es fracción molar del componente i. El efluente del reactor
se somete a un proceso flash para separar los gases ligeros (A y C ). Si
la fracción molar máxima permitida de D a la salida del reactor es 0.05,
calcule:
a) el flujo y la composición de la corriente saliente del reactor
b) la composición de las corrientes de salida del equipo flash
en donde Xi es fracción molar del componente i.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Solución: Diagrama
Cálculos:
En el reactor:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
La unidad del reactor está completamente especificado, es decir, tiene 6
incógnitas y 6 ecuaciones independientes, por lo que se puede resolver
su sistema de ecuaciones independientemente del sistema de la unidad
flash. Como se puede observar, no es posible una solución secuencial
para este sistema, de manera que aplicaremos el método de Newton
para sistemas de ecuaciones no lineales. La solución es:
wmbc
En el separador:
Ejercicio
El proceso del ejemplo anterior se modifica purgando un 20 % de la corriente de
gases ligeros del separador y el resto se recircula al reactor. Realice de nuevo
los cálculos y prediga cuál de los dos diagramas considera más eficiente, si el
producto principal es la sustancia D.
2.14 Balance de materia en procesos con múltiples reacciones en varias
etapas. Reacciones irreversibles
Ejemplo1:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
En un proceso de fermentación se lleva a cabo las siguientes reacciones:
C12 H 22 O11 H 2 O 2C6 H12 06 (a )
C6 H12 O6 2C2 H 5 OH 2CO2 (b)
Estas reacciones se realizan una tras otra y de forma cuantitativa. El CO 2
desprendido bajo estas condiciones lleva una cantidad apreciable de agua y de
vapores de alcohol, lográndose un 80 % de saturación.
El alcohol presente en esos vapores se elimina en un absorbedor y se regresa al
alambique en donde se destila el alcohol generado en el fermentador. El
absorbedor produce una disolución al 1.5 % de alcohol en peso y los gases
salientes contienen solamente 0.03 % de alcohol. Tanto el absorbedor como el
fermentador operan a la presión de 1 atmósfera. El fermentador opera a 15 0C y se
puede suponer que las reacciones se completan en un 100 %. El líquido que se
produce en el fermentador contiene 12 % en peso de alcohol. Calcule:
a) La composición molar de los gases que salen del fermentador.
b) La fracción de alcohol recuperado en el absorbedor
c) Los kg de alcohol obtenidos por 1000 kg de azúcar
d) La composición del líquido alimentado al alambique.
Diagrama:
ANALISIS DE GRADO DE LIBERTAD
No. de variables independientes = = +17
No. de variables independientes especificadas =-3
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Base de cálculo= = -1
No. de ecs de balance = = - 11
No. de ecs adicionales= =-1
G. L.=+1
Solución:
Discusión y planteamiento:
Las dos reacciones tienen un 100 % de conversión.
La corriente de alimentación del absorbedor consiste de dos fases: una fase
gaseosa (CO2 y alcohol) y una fase líquida (agua).
El % de saturación se refiere a la concentración de un vapor condensable (el
etanol) en un gas (CO2) y se define como:
pv p ps
% sat. (1)
ps p pv
donde: pv = presión parcial del vapor en la mezcla gaseosa
ps = presión de vapor del líquido puro a 15 0C
p = presión total del sistema = 1 atm
La presión de vapor de una sustancia se obtiene de tablas o bien se calcula con la
ecuación de Antoine como vimos en la unidad I:
B
Ln ps A (2)
C T
Donde A, B y C son las constantes de antoine que se obtienen de la bibliografía y
T es la temperatura en grados absolutos.
Determinada ps de (2), se obtiene pv de (1) con p = 1 atm.
Con estos datos ya se puede calcular la fracción molar (y) del alcohol en la mezcla
gaseosa con la ecuación:
pv y p (3)
y la fracción molar del CO2 será: yCO = 1- yalcohol
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Análisis de la corriente No.3
De las tablas (ec. de Antoine) se obtiene para el C 2H5OH:
A = 16.1952; B = 3423.53; C = - 55.7152
De la ecuación (2): ps = 4.2917 kpa a 150C
De la ecuación (1): pv = 13.53 kpa con p = 101.3 kpa
De la ecuación (3): y33 base seca = 0.13356
Así y43 base seca = 1-0.13356 = 0.8664
a) composición de la corriente 3:
y33 base seca = 0.13356
y43 base seca = 1-0.13356 = 0.8664
Balances de materia:
Base de cálculo: F1 = 1000 kg de azúcar alimentada
Denominación:
1 = azúcar
2 = agua
3 = alcohol
4 = CO2
Cambio de fracción masa a fracción molar (Corriente 7):
Base de cálculo: 100 kg de masa
masa de agua = 88 kg moles de agua = 7.333
masa de etanol = 12 moles de etanol = 0.261
moles totales = 7.594
y37 = 0.0344 y27 = 0.9656
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
En el reactor: balance molar
80% saturación
CO2
Agua
H2O (1)
Reactor (3)
(2)
Agua
(7)
Azúcar =100%
Moles de azúcar = 1000/342 = 2.924
C12 H 22 O11 H 2 O 2C6 H12 06 (a )
C6 H12 O6 2C2 H 5 OH 2CO2 (b)
Salidas = entradas – consumo + producción
Azúcar: 0=2.924 - r1 (4)
Agua: y23F3 + 0.9656 F7= F1-r1 (5)
Alcohol: y33F3 + 0.0344 F7 = 2 r2 (6)
CO2: y43F3 = 2 r2 (7)
C6H12O6: 0 = 0+ 2 r1 – r2 (8)
W 3 = (18)y23F3 + (46)y33F3 + (44)y43F3 (9)
Siendo W 3 la masa de la corriente 3.
En el absorbedor: balance de masa
Total: W3 + W4 = W5 + W 6 (10)
Alcohol: X33W 3 = 0.0003 W 5 + 0.015 W 6 (11)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Agua: X23W 3+ W 4 = 0.985W 6 (12)
De (4): r1 = 2.924 moles
De (8): r2 = 5.848
De (7): moles de CO2 producidos = 2 r2 = 11.696
kg de CO2 producidos = 11.696x44 = 514.624
Moles de CO2 en la corriente 3 = 11.696
Moles de gases en la corriente3 (CO 2 + alcohol) = 11.696/0.8664 = 13.4995
Moles de etanol en la corriente 3 = 13.4995- 11.696 =1.804
Kg de etanol en la corriente 3 = 1.804 x 46 = 82.904
Pero los 514.624 kg de CO2 constituyen el 99.97 % de los gases que salen del
absorbedor, entonces,
W 5 = (514.624/99.97 %) x 100% W5= 514.778 kg.
Kg de etanol en la corriente 5 = 514.778 x .0003 = 0.1544
kg de etanol en la corriente 6 = 82.938 – 0.1544 = 82.7836
Entonces W 6 = 82.7836 / 0.015 W 6 = 5,518.91 kg
b) Fracción de etanol recuperado en el absorbedor=
= 82.7836/82.904 = 0.998547 ó 99.8547 %
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Balance global:
Balance de etanol: 0.0003W 5 / (46)+ W 9/46 =11.696
0.0003(514.7)+W 9=538.016 ………. W 9 = 537.862 kg
0.015W 6+0.12W 7=W 9 ………………. W 7= 3 792.32 Kg
W 6+W 7=W 8……………………………W 8= 9311.23 Kg
W 10 = 8773.368 kg
c) kg etanol obtenidos / 1000 kg de azúcar = 537.862 kg de etanol
d) composición de la alimentación al alambique (corriente 8):
0.015(5,518.91) + 0.12(3792.32) = x38 (9311.23)
𝑥38 = (82.78365 + 455.0784)/(9311.23)
𝒙𝟑𝟖 = 𝟎. 𝟎𝟓𝟕𝟖 ó 5.78 % en peso de etanol
94.22 % en peso de agua
wmbc
Solución con el programa “BME2FERMENTACION” DE MATLAB
ING. WILBERT MORGAN BLANCO CARRILLO
Programa en MATLAB para el problema de fermentación.
Calculo de las fracciones molares en el gas de la corriente 3
Constantes de Antoine del etanol con ln, P en kPa y T en K:
A =16.1952 B =3.4235e+003 C =-55.7152
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
T =15 0C = 288.1500 0K (dato del problema)
La ecuación de Antoine es ln P =A-B/(T+C)
La presión de saturación ps del etanol a T = 288.1500 0K es:
ps = 4.3328 kPa
P = 101.3200 kPa = 1 atm (dato del problema)
La ecuación de saturación es:
f = Inline function:
f(x) = [(x./4.3328).*((101.32-4.3328)./(101.32-x))-0.80]
Donde x=pv
Resolviéndola da la presión parcial del etanol pv: pv = 3.4961 kPa
a) LAS FRACCIONES MOLARES DEL GAS EN LA CORRIENTE 3 SEGUN:
LA TEORIA DE GAS IDEAL SE DA POR pi=yiP, ENTONCES:
y33bs = 0.0345 y y43bs = 0.9655
yijbs = significa la fracción mol del componente i en la corriente j base seca
Base de cálculo: W2 kg de azúcar:
W2 = 1000 Kmoles de azúcar F2 = 2.9240
Se consume todo el azúcar, entonces por la estequiometria:
kmoles de CO2 producidos n4 = 11.6959
Kmoles de etanol producidos n3 = 11.6959
Todos los Kmoles de CO2 producidos están en la corriente 3, n4 = F43bs = 11.6959
Entonces los Kmoles de la fase gas (etanol+CO2) en la corriente 3 es F3bs :
𝑛4
𝐹3𝑏𝑠 = = 12.1139 𝑘𝑚𝑜𝑙𝑒𝑠
𝑦43𝑏𝑠
En estos últimos, la fracción molar del etanol es y33bs = 0.0345
Los kmoles de etanol en la corriente 3 es F33bs =F3bs x y33bs = 0.4180
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Los kg de etanol en la corriente 3 es W33 = 18.3921
Los kg de CO2 en la corriente 3 es W43 = 514.6199
Todo el CO2 de la corriente 3 pasan a la corriente 5 y en esta es el 99.97 % masa.
Entonces W5 = 514.7743 kg
kg de etanol en la corriente 5 es W35 = 0.1544
Un balance de etanol en el absorbedor nos da los kg de etanol en la corriente 6:
W36 = 18.2376 kg
Los W36 kg de etanol en la corriente 6 es el 1.5 x ciento de W6, entonces:
W6 = 1 215.8
b) El x ciento de etanol recuperado en el absorbedor es PCER:
PCER = 99.1603
Un balance global de etanol nos da W9 = 537.8573
Un balance de etanol en el sistema formado por el nodo de unión y el alambique juntos nos da
W7: W7 = 4 330.2
Un balance total en el nodo de unión nos da W8: W8 = 5 546.0
Un balance total en el alambique nos da W10 = 5 008.1 kg
c) Los kg de etanol obtenidos x 1000 kg de azúcar e W9 = 537.8573
d) Composición de la corriente 8 será:
x38 = 0.0970 x28 = 0.9030
Si suponemos que la relación molar de alimentación al fermentador entre el agua y el azúcar es 80
a 1, entonces ya se pueden calcular las otras corrientes.
Los kg de agua en la corriente 1 es W1 = 4 210.5
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Un balance global de agua nos da W4 = 850.2545
Un balance total en el absorbedor nos da W3 = 880.3628
La masa de agua en la corriente 3 es W23 = 347.3509
RESULTADOS:
W1=4210.526316 W2=1000.000000 W3=880.362823 W4=850.254455 W5=514.774315
W6=1215.842962 W7=4330.163493 W8=5546.006455 W9=537.857264 W10=5008.149191
COMPROBACION CON EL BALANCE GLOBAL DE MASA
"ES LA LEY DE LA CONSERVACION DE LA MATERIA"
ENTRADAS = 6 060.8 kg
SALIDAS = 6 060.8 kg
ENTRADAS EN Kg = SALIDAS EN Kg
POR LO TANTO EL PROBLEMA ESTA RESUELTO CORRECTAMENTE.
********************************************************
BRAVOOOOOO CLAP CLAP CLAP
********************************************************
2.15 Balance de materia por elemento
químico en varias etapas
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Este tipo de balances se desarrolla sobre la base de la conservación de la masa o
moles de los elementos que conforman la estructura de los componentes que
participan en la reacción.
¿En qué circunstancias se usaría en lugar de un balance por componente?
En aquellos casos en los que se dispone exclusivamente de los análisis
elementales de los componentes del sistema, o cuando se desconoce la
estequiometría de la reacción o bien ésta es muy compleja. Recuerde que en un
reactor químico, los átomos de un elemento participante no se transforman sino
que únicamente de recombinan conservando su masa, por lo que su balance de
masa sería:
entradas = salidas.
Ejemplo: Producción de formaldehído
El formaldehído se puede producir mediante la oxidación parcial del metanol con
aire sobre un catalizador de plata, suponiendo que se producen alrededor de 2/3
moles de formaldehído por mol de metanol que reacciona, y que también se
produce algo de ácido fórmico, H2, CO y CO2.
Para asegurar un mejor aprovechamiento del reactivo, el gas producto se lava con
agua para separar los gases indeseables, el residuo se destila para producir una
recirculación de metanol puro. Suponiendo que el gas de entrada al reactor
contiene 35 % mol de metanol, calcule las moles de formaldehído que se producen
por mol de metanol alimentado y el grado de conversión del metanol en el reactor.
La composición de los gases indeseables es de 20.2 % de H2; 4.8 % de CO2; 0.2
% de CO; 74.5 % de N2 y 0.3 % de O2.
Gases indeseables
metanol
metanol
Metanol H2O
Aire HCOOH
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
wmbc
Solución:
Se conocen los componentes de cada una de las corrientes, pero no así la o las
reacciones que se desarrollan en el reactor. Esto hace necesario realizar un
balance por elemento en el reactor.
Sea Fij el flujo molar del componente i en la corriente j.
Identificación de componentes:
1. CH3OH 2. HCHO 3. HCOOH 4. H2
5. CO 6. CO2 7. N2 8. O2
9. H2O
Balance en el mezclador: sistema no reaccionante
CH3OH
1 4
CH3OH CH3OH
2
Aire
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Total : F1 F2 F3 F4 (1)
Me tan ol : F1 F3 0.35F4 (2)
Balance por elemento en el reactor:
CH3OH
5
CH3OH 35 % 4 HCHO
Aire HCOOH
H2
CO
C: F14 F15 F25 F35 F55 F65 (3)
H2 : 2 F14 2 F15 F25 F35 F45 F95 (4)
O2 : 1/ 2 F14 F44 1/ 2 F15 1/ 2 F25 F35 1/ 2 F55 F66 F86 1/ 2 F96 (5)
Ec.adicional : F25 2 / 3( F14 F15 ) (6)
wmbc
Balance en el separador:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
H2 20.2%
CO 0.2%
CO2 4.8%
CH3OH
6
HCHO HCHO
5
HCOOH HCOOH
7
H2
3
CO
CH 3OH : F15 F13 (7)
HCHO : F25 F27 (8)
HCOOH : F35 F37 (9)
H2 : F45 F46 (10)
CO : F55 F56 (11)
CO2 : F65 F66 (12)
N2 : F75 F76 (13)
O2 : F85 F86 (14)
H 2O : F95 F97 (15)
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
wmbc
Cálculos:
Base de cálculo: F6 = 100 moles
De (10), (11), (12), (13) y (14):
F45 = 20.2
F55 = 0.20
F65 = 4.80
F75 = 74.50 = F74
F85 = 0.30
Moles de aire alimentados al reactor = (100/79)(74.50) = 94.304
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Moles de CH3OH alimentados al reactor = F14 = (94.304/65)(35) = 50.779
Nitrógeno (N2) en el aire alimentado = F74 =74.5
Oxígeno (O2) en el aire alimentado = F84 = (21/79)(74.5) = 19.804
De (3) : 45.779 F15 F25 F35 (3' )
De (4) : 81.354 2 F15 F25 F35 F95 (4' )
De (5) : 39.999 1/ 2 F15 1/ 2 F25 F35 1/ 2 F95 (5' )
De (6) : F25 2 / 3(50.779 F15 ) (6' )
Resolviendo el sistema formado por las 4 últimas ecuaciones:
F15 = 9.91 moles F25 = 27.213 moles
F35 = 8.656 moles F95 = 25.563 moles
Moles de HCHO producidos = F25 = 27.213
Moles de CH3OH que reaccionan = F14-F15 = 50.779 - 9.91 = 40.869
Moles de CH3OH recirculados = F13 = F3 = 9.91
Moles de CH3OH alimentados al proceso = F1 = 40.869
Respuesta:
Moles de formaldehído producido por mol de metanol alimentado =
= 27.213/40.869 = 0.666
Grado de conversión del metanol = (40.869/50.779) 100
= 80.48 %
PROBLEMA 2
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
La eliminación del dióxido de azufre de los gases de chimenea de las instalaciones
industriales es un tópico que ha traído la atención mundial durante la última
década. La recuperación del dióxido de azufre de los gases de combustión de las
plantas generadoras de energía, reduciría la contaminación del aire y
proporcionaría un importante producto químico industrial. Se están desarrollando
en todo el mundo diversos tipos de procesos, y la selección del método más
adecuado depende del tamaño de la instalación, del mercado disponible para el
producto final obtenido, de los costos de transporte y manejo, del monto de la
inversión y de los costos de operación. En una de las técnicas propuestas, el gas
de chimenea de un aceite combustible de alto contenido de azufre se quema a
SO2, el cual se oxida a SO3 en una serie de convertidores catalíticos y unidades
de absorción. Cada convertidor va seguido de un absorbedor. El gas que entra al
primer convertidor tiene el siguiente análisis (en base a ausencia de CO 2):
SO2 0.80%
O2 2.80%
N2 96.40%
Y el gas que sale del primer absorbedor es:
SO2 0.20%
O2 2.00%
N2 97.80%
Calcúlese el grado de conversión del SO 2 en el primer convertidor. ¿Cuál es el
análisis del gas de salida después que ha ocurrido una conversión y una absorción
completa (en base a ausencia del CO2)?
Ejercicio
Se ha propuesto el siguiente diagrama de proceso para la obtención del producto
P a partir del reactivo R:
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
Donde es el grado de conversión de R en el reactor.
En el reactor se llevan a cabo las siguientes reacciones
2R W P
R 2Q W
La alimentación al reactor contiene 8 % de inertes, I, y la concentración de éstos
en el producto no debe exceder de 1 % y La concentración de Q en el producto es
12 %. Calcule:
1. la composición y el flujo de la corriente de producto
2. la fracción de I recuperado en el separador
3. los moles de P obtenidos por mol de R consumido
4. la composición del efluente del reactor
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
EVALUACION DE BALANCE DE MATERIA
UNIDAD II
El ácido maleico se produce por medio de la oxidación parcial del benceno y se tiene lo siguiente: los moles
de O2 que alimental al reactor por mol de benceno puro que se introduce al reactor son 10. Una corriente
de benceno puro se mezcla con una corriente de aire húmedo y la mezcla resultante se alimenta al reactor.
Las demás condiciones del proceso se muestran en el diagrama de flujo. Utilizar los datos de presión de
vapor que se proporcionan enseguida.
Las reacciones son: C6H6 + 9/2 O2 C4H4O4 + 2CO2 + H2O (1)
C6H6 + 15/2 O2 6CO2 + 3H2O (2)
Temperatura, F Benceno lbf/plg2 abs Agua lbf/plg2 abs
110 4.045 1.275
120 5.028 1.692
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
130 6.195 2.223
140 7.570 2.889
150 9.178 3.718
160 11.047 4.741
170 13.205 5.992
180 15.681 7.510
190 18.508 9.339
200 21.715 11.536
CALCULAR:
a. Los moles de benceno alimentados al reactor
b. El flujo de las corrientes indicadas y el grado de conversión del benceno en el reator.
c. El rendimiento del ácido maleico y la selectividad entre el ácido maleico y el CO2
producidos.
Document shared on https://www.docsity.com/es/los-balances-de-materia-y-energia-son-una-herramienta-importante-para-el-ingeniero-en-alim-3/9090627/
Downloaded by: lucero-ortiz-6 (luceroj519@gmail.com)
También podría gustarte
- Reactivo LimitanteDocumento13 páginasReactivo LimitanteRosa Maria KalanAún no hay calificaciones
- Laboratorio 4 - BalanceDocumento12 páginasLaboratorio 4 - BalanceMarissa100% (2)
- Informe Balance de Materia Helen Andrea Ramos ZuazoDocumento22 páginasInforme Balance de Materia Helen Andrea Ramos ZuazoAxel MonteroAún no hay calificaciones
- P y E I-2 Sesión 3 Estequiometría de Las Racciones Sem 2 2017Documento19 páginasP y E I-2 Sesión 3 Estequiometría de Las Racciones Sem 2 2017Elisabet Alejandra Gutierrez SalinasAún no hay calificaciones
- 20170702220706Documento56 páginas20170702220706AlejandroAún no hay calificaciones
- Balance de Materia en Reactores QuimicosDocumento73 páginasBalance de Materia en Reactores QuimicosAdán Fonseca Hernandez100% (1)
- Conceptos Balances de Masa Con Reacción Química Cap. 2 Rodrigo LondoñoDocumento4 páginasConceptos Balances de Masa Con Reacción Química Cap. 2 Rodrigo LondoñoMaria Vanessa Dominguez AcevedoAún no hay calificaciones
- 5 Balance de Materia Con Reaccion QuimicaDocumento12 páginas5 Balance de Materia Con Reaccion QuimicaAngela QuinteroAún no hay calificaciones
- Introducción Al Balance de Materia en Sistemas ReaccionantesDocumento32 páginasIntroducción Al Balance de Materia en Sistemas ReaccionantesJesusemiliozerpa50% (4)
- Balance de Materia y Energia Como Una Herramienta Fundamental en La IngenieriaDocumento7 páginasBalance de Materia y Energia Como Una Herramienta Fundamental en La IngenieriaDanny Paredes LayzaAún no hay calificaciones
- Guía de Aprendizaje 07Documento11 páginasGuía de Aprendizaje 07Katheryn CobosAún no hay calificaciones
- Balances de Materia Con ReacciónDocumento3 páginasBalances de Materia Con ReacciónBaruk AlonsoAún no hay calificaciones
- Material de Clase Presentacion Sistemas ReaccionantesDocumento33 páginasMaterial de Clase Presentacion Sistemas ReaccionantesBrayam Stalyn Bonifacio AyalaAún no hay calificaciones
- Practica 6Documento14 páginasPractica 6Escarlet Rodriguez perezAún no hay calificaciones
- Estequiometría de Una Reacción QuímicaDocumento10 páginasEstequiometría de Una Reacción QuímicaLina Gonzalez HAún no hay calificaciones
- Balance de Materia. PRODocumento30 páginasBalance de Materia. PROdiegoAún no hay calificaciones
- Informe de Balance de MateriaDocumento13 páginasInforme de Balance de MateriaCeleste CondoriAún no hay calificaciones
- Balance de MasaDocumento36 páginasBalance de MasaAngheliithaLaraAún no hay calificaciones
- FASE 1 MÓDULO QA - Repaso ConceptualDocumento28 páginasFASE 1 MÓDULO QA - Repaso Conceptualjavier monsalveAún no hay calificaciones
- MarioDocumento46 páginasMariofvvvtvvAún no hay calificaciones
- Velocidad de ReacciónDocumento29 páginasVelocidad de ReacciónalexAún no hay calificaciones
- Guia de Prácticas Farmacoquimica IIDocumento92 páginasGuia de Prácticas Farmacoquimica IIAgustin Orlando Llam MillAún no hay calificaciones
- Semana 4. EstequiometríaDocumento5 páginasSemana 4. EstequiometríamiriamAún no hay calificaciones
- Actividades Unidad 4Documento12 páginasActividades Unidad 4Jesus EnriquezAún no hay calificaciones
- SesDocumento22 páginasSesIvette Pebes Cabrera0% (1)
- Balance Materiales Con Reaccion QuimicaDocumento28 páginasBalance Materiales Con Reaccion QuimicaRAQUEL ABIGAIL JERÓNIMO MORALESAún no hay calificaciones
- Informe 3 Estequiometria IDocumento18 páginasInforme 3 Estequiometria Iyauri230100% (1)
- 1-Estequiometria TeoriaDocumento14 páginas1-Estequiometria TeoriaCarlos García GilAún no hay calificaciones
- Cinetica QuimicaDocumento105 páginasCinetica QuimicaRakuen 23Aún no hay calificaciones
- 6 Diap Estequiometría PDFDocumento45 páginas6 Diap Estequiometría PDFAriel Dorian100% (1)
- Balance de Materia Con Reacción Quimica Sem 7Documento35 páginasBalance de Materia Con Reacción Quimica Sem 7Hernán Cambillo CabezasAún no hay calificaciones
- ESTEQUIOMETRIADocumento44 páginasESTEQUIOMETRIAalexAún no hay calificaciones
- Tema N°5 Balances de Materia Con Reacciones QuímicasDocumento3 páginasTema N°5 Balances de Materia Con Reacciones QuímicasMelania Calizaya MendozaAún no hay calificaciones
- Trabajo de Reactores Ideales y CataliticosDocumento31 páginasTrabajo de Reactores Ideales y CataliticosSALUSTRIA CABEZAS SANCHEZAún no hay calificaciones
- Quimica Inorganica - EstequiometríaDocumento25 páginasQuimica Inorganica - EstequiometríaReyes Rodríguez MelanieAún no hay calificaciones
- ReyesFuentesTaniaMontserrat Tarea2Documento5 páginasReyesFuentesTaniaMontserrat Tarea2Montserrat Reyes FuentesAún no hay calificaciones
- INFORME DE LABORATORIO Practica 5 Estequiometria 3 PDFDocumento15 páginasINFORME DE LABORATORIO Practica 5 Estequiometria 3 PDFLeidy CorreaAún no hay calificaciones
- EXPOSICION 3 EQUIPO 5 (qumicaIII)Documento3 páginasEXPOSICION 3 EQUIPO 5 (qumicaIII)Diego RodríguezAún no hay calificaciones
- Práctica 04 Estequiometría Parte 01 Cambios Q y FDocumento3 páginasPráctica 04 Estequiometría Parte 01 Cambios Q y FVianna Del Sol n sAún no hay calificaciones
- Clase Balances de Materia en Sistemas ReaccionantesDocumento24 páginasClase Balances de Materia en Sistemas ReaccionantesSebastian OcampoAún no hay calificaciones
- Resumen y Introduccion de Estequiometria de Una Reaccion SrSO4Documento11 páginasResumen y Introduccion de Estequiometria de Una Reaccion SrSO4Edson Sanchez75% (4)
- EstequiometríaDocumento3 páginasEstequiometríajorge mario durango petroAún no hay calificaciones
- Prácticas de EstequiometríaDocumento4 páginasPrácticas de Estequiometríacamilo Acosta mejiaAún no hay calificaciones
- ReyesFuentesTaniaMontserrat Tarea2Documento6 páginasReyesFuentesTaniaMontserrat Tarea2Montserrat Reyes FuentesAún no hay calificaciones
- ReactoresDocumento5 páginasReactores0231920038 CRISS CAROLINA HERNANDEZ OROZCO ESTUDIANTE ACTIVOAún no hay calificaciones
- Práctica 9 Estequiometría Práctica 9 EstequiometríaDocumento12 páginasPráctica 9 Estequiometría Práctica 9 Estequiometría5IM16 Peña García Luis AngelAún no hay calificaciones
- Pre InformeDocumento7 páginasPre Informegina0% (1)
- Conceptos de Estequiometria-V2Documento9 páginasConceptos de Estequiometria-V2Jose MarioAún no hay calificaciones
- SEMANA 4, Balances Con Reaccion 28.9.21Documento18 páginasSEMANA 4, Balances Con Reaccion 28.9.21Mario Alberto RamosAún no hay calificaciones
- Preinforme Balance de MasaDocumento4 páginasPreinforme Balance de MasaCarolina Botello De La HozAún no hay calificaciones
- Informe 11 - Quimica GeneralDocumento11 páginasInforme 11 - Quimica GeneralGeralAún no hay calificaciones
- L6 - Balance+RQ - I - +PROBLEMAS ResueltosDocumento30 páginasL6 - Balance+RQ - I - +PROBLEMAS ResueltosHernan QuishpeAún no hay calificaciones
- GUIA ESTQUIOMETRIA Grados 11Documento8 páginasGUIA ESTQUIOMETRIA Grados 11Saray GarciaAún no hay calificaciones
- PRACTICA No.8Documento10 páginasPRACTICA No.8Higinio TorresAún no hay calificaciones
- Reacciones Químicas y Estequimetría.Documento8 páginasReacciones Químicas y Estequimetría.Valentina LinaresAún no hay calificaciones
- Informe 04 - QuimicaDocumento9 páginasInforme 04 - QuimicaJosé GonzálezAún no hay calificaciones
- RQ09 10 ConceptsDocumento11 páginasRQ09 10 Conceptsbea19roAún no hay calificaciones
- Taller (Relaciones Estequiometricas) - GNDocumento10 páginasTaller (Relaciones Estequiometricas) - GNDAVID JERONIMO TORRES ANTEAún no hay calificaciones
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Química general para las ciencias ambientalesDe EverandQuímica general para las ciencias ambientalesAún no hay calificaciones
- Untitled VPDDocumento1 páginaUntitled VPDLucero OrtizAún no hay calificaciones
- Planeación EstratégicaDocumento3 páginasPlaneación EstratégicaLucero OrtizAún no hay calificaciones
- Ejercicios CromatografíaDocumento8 páginasEjercicios CromatografíaLucero OrtizAún no hay calificaciones
- Manual Nutricion Kelloggs Capitulo 07Documento10 páginasManual Nutricion Kelloggs Capitulo 07Tina MonroyAún no hay calificaciones
- Sistema de DefensaDocumento31 páginasSistema de DefensaLucero OrtizAún no hay calificaciones
- Hipertensión Arterial y Otras Afecciones ArterialesDocumento16 páginasHipertensión Arterial y Otras Afecciones ArterialesLucero OrtizAún no hay calificaciones
- Desarrollo Humano Linea de TiempoDocumento6 páginasDesarrollo Humano Linea de TiempoLucero OrtizAún no hay calificaciones
- Fitoterapia para La DiabetesDocumento19 páginasFitoterapia para La DiabetesLucero OrtizAún no hay calificaciones
- Formación de Brigadas Contra IncendiosDocumento53 páginasFormación de Brigadas Contra Incendiosynunezcenteno100% (1)
- Cuaderno - Lab. de HidrocarburosDocumento29 páginasCuaderno - Lab. de HidrocarburosCristian Saco CardenasAún no hay calificaciones
- Refinación de PetróleoDocumento11 páginasRefinación de PetróleoDavid Titusunta Arias100% (1)
- OPERACIONES UNITARIAS Deshidratacion Del Gas CespedezDocumento104 páginasOPERACIONES UNITARIAS Deshidratacion Del Gas CespedezBetzaLicyChavezAún no hay calificaciones
- Activantes y DesactivantesDocumento12 páginasActivantes y DesactivantesEvelin ChandiAún no hay calificaciones
- E.E.S.S. LomosDocumento155 páginasE.E.S.S. LomosAndres CrespoAún no hay calificaciones
- Informe 1 - 4° SemestreDocumento7 páginasInforme 1 - 4° SemestreJohan Lf CalderonAún no hay calificaciones
- Abc Del GLPDocumento45 páginasAbc Del GLPGustavo GarateAún no hay calificaciones
- Test Tema 26 SIN RESPUESTASDocumento6 páginasTest Tema 26 SIN RESPUESTASSergio Arribas DiazAún no hay calificaciones
- Tamiz MolecularDocumento16 páginasTamiz MolecularJuan Carlos MicasioAún no hay calificaciones
- CATO Ventilacion, Evacuacion Gases (Autoguardado)Documento173 páginasCATO Ventilacion, Evacuacion Gases (Autoguardado)KennyParedesAún no hay calificaciones
- Estructura de Precios Febrero 2019 MensualDocumento1 páginaEstructura de Precios Febrero 2019 MensualGiovanni AguaisAún no hay calificaciones
- Planta de Separación de Líquidos Gran Chaco ARIELDocumento12 páginasPlanta de Separación de Líquidos Gran Chaco ARIELSaul Veliz100% (1)
- TermoquímicaDocumento23 páginasTermoquímicaAnibal Yarasca0% (1)
- Calores de FormacionDocumento12 páginasCalores de FormacionJose Maria GattoAún no hay calificaciones
- Problema de Orden de ReacciónDocumento10 páginasProblema de Orden de ReacciónAnthony PeredaAún no hay calificaciones
- Destilación FraccionadaDocumento8 páginasDestilación FraccionadaSofia Ayala HuaynatteAún no hay calificaciones
- Práctica 6 InorgánicaDocumento2 páginasPráctica 6 InorgánicaDanielleAún no hay calificaciones
- Practica de Laboratorio FCQ 2019Documento9 páginasPractica de Laboratorio FCQ 2019luis RobertoAún no hay calificaciones
- Problemas de DaltonDocumento4 páginasProblemas de DaltonEduardo MariscalAún no hay calificaciones
- Quimica 7 13Documento7 páginasQuimica 7 13Enrique RuelasAún no hay calificaciones
- Punto 6Documento14 páginasPunto 6nataly condoriAún no hay calificaciones
- Informe Petroleos Practica 1Documento4 páginasInforme Petroleos Practica 1andreaAún no hay calificaciones
- Destilación FraccionadaDocumento18 páginasDestilación FraccionadaLorena VivasAún no hay calificaciones
- Prelaboratorio OrganicaDocumento8 páginasPrelaboratorio OrganicaArturo DiazAún no hay calificaciones
- Refinamiento Del PetroleoDocumento40 páginasRefinamiento Del PetroleoA L E J A N D R AAún no hay calificaciones
- Producción de Carbonato SódicoDocumento5 páginasProducción de Carbonato SódicoDeysi PalaciosAún no hay calificaciones
- Extincion de IncendiosDocumento31 páginasExtincion de IncendiosAlejandro Gardel100% (1)
- Prueba Hidraulica Alcantarillado 08Documento97 páginasPrueba Hidraulica Alcantarillado 08Dallayra Nathalie Moscol Ipanaque86% (7)
- Refinerias y PlantasDocumento52 páginasRefinerias y PlantasAdalid David Quino TiconaAún no hay calificaciones