0% encontró este documento útil (0 votos)
389 vistas5 páginasDensidad y Estructura Cristalina de Metales
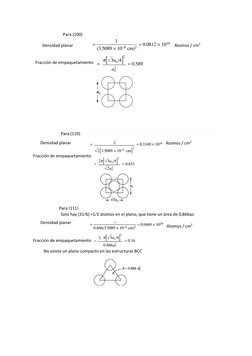
1) El documento presenta varios problemas relacionados con la estructura cristalina cúbica, incluyendo calcular la densidad planar y fracción de empaquetamiento de planos (010) y (020) del polonio cúbico, y determinar los índices de Miller de direcciones dadas en una celda unitaria cúbica.
2) También calcula el volumen ocupado por un mol de boro, esboza planos y direcciones en una celda cúbica, y determina la densidad planar y fracción de empaquetamiento de planos
Cargado por
sergio andres rodriguezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
389 vistas5 páginasDensidad y Estructura Cristalina de Metales
1) El documento presenta varios problemas relacionados con la estructura cristalina cúbica, incluyendo calcular la densidad planar y fracción de empaquetamiento de planos (010) y (020) del polonio cúbico, y determinar los índices de Miller de direcciones dadas en una celda unitaria cúbica.
2) También calcula el volumen ocupado por un mol de boro, esboza planos y direcciones en una celda cúbica, y determina la densidad planar y fracción de empaquetamiento de planos
Cargado por
sergio andres rodriguezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd