Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Práctica 8 Calor de Neutralización
Cargado por
Fernando MuñizTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Práctica 8 Calor de Neutralización
Cargado por
Fernando MuñizCopyright:
Formatos disponibles
CALOR DE NEUTRALIZACIÓN
E. QFB Alba Rocio Bañuelos Francisco 224093
Universidad Autónoma de Ciudad Juárez, Instituto de Ciencias Biomédicas
Departamento de Ciencias Químico-Biológicas, Licenciatura en QFB
Laboratorio de Fisicoquímica I
Resumen
En un calorímetro adiabático y a presión constante, se llevó a cabo una reacción de neutralización
entre el ácido clorhídrico, HCl, e hidróxido de sodio, NaOH, con el fin de determinar el calor o entalpía
de reacción. Finalmente, se determinó que este tipo de reacciones corresponden a un proceso
exotérmico.
Palabras clave: entalpía, reacción de neutralización, base fuerte, ácido fuerte
Introducción desprenden energía calorífica (Reacciones
ácido base, s.f.).
Las reacciones químicas y los cambios físicos
se dan con desprendimiento de calor Hipótesis
(procesos exotérmicos) o absorción de calor
Al combinar ácido clorhídrico, HCl, con
(procesos endotérmicos) en forma simultánea.
hidróxido de sodio, NaOH, se efectuará una
El calor transferido en un proceso suele ser
expresado en Joules o calorías (Whitten et al., reacción exotérmica con un valor de entalpía
2015). negativo.
Objetivos Además, se obtendrán como productos de
reacción; cloruro de sodio, NaCl, y agua, H2O.
• Determinar la variación de entalpía de
neutralización para una mezcla de un Materiales y métodos
ácido fuerte (HCl), con una base fuerte En primer lugar, se procedió a verter 25 mL de
(NaOH). una solución de ácido clorhídrico con una
Fundamento teórico concentración de 1 M en un vaso de
La cantidad de calor que se transfiere a o sale precipitado. Este vaso de precipitado, que
de un sistema cuando está experimentando un contenía la solución ácida, fue colocado junto
cambio químico o físico a presión constante se con un termómetro de alcohol. Se registró la
define como el cambio de entalpía del temperatura inicial del ácido clorhídrico
proceso. Esta magnitud es igual a la entalpía (denominada T1), y se procedió a pesar el
de las sustancias que se producen menos la vaso de precipitados, obteniendo de esta
entalpía de las sustancias que se consumen manera la masa del ácido clorhídrico (mHCl).
(Whitten et al., 2015). Después, se repitió un proceso similar
Las reacciones de neutralización se dan entre utilizando una solución de hidróxido de sodio
un ácido y una base, y forman una sal, y en de 1 M. Se transfirieron 25 mL de esta solución
muchos casos, agua. La sal que se forma al calorímetro, acompañada de un termómetro
contiene al catión característico de la base y al de alcohol. La temperatura inicial del hidróxido
anión característico del ácido. Este tipo de de sodio (T2) se registró, y se pesó el
reacciones reciben el nombre de reacciones calorímetro con la solución de hidróxido de
de neutralización por que se neutralizan las sodio, lo que permitió calcular la masa del
propiedades del ácido y de la base (Whitten et
hidróxido de sodio (mNaOH) por diferencia.
al., 2015).
Tras estas preparaciones, se permitió que
Las reacciones de neutralización
generalmente son exotérmicas, por lo que ambas soluciones reposaran durante 10
minutos hasta que alcanzaron el equilibrio
térmico. Cuando se constató que la
temperatura se mantenía constante, se Figura 1. Calorímetro en el que se llevó a cabo la
procedió a tomar medidas de temperatura reacción entre el HCl y NaOH
cada 30 segundos durante un período de 5
minutos. Una de las temperaturas registradas
corresponde a la temperatura del ácido
clorhídrico (T3) antes de la mezcla, mientras
que la otra es la temperatura del hidróxido de
sodio (T4) antes de la mezcla, y estos datos se
registraron en las tablas 3 y 4,
respectivamente.
En la etapa siguiente, se añadió el ácido
clorhídrico al calorímetro, seguida de una
cuidadosa agitación de la mezcla utilizando el Cuadro III. Datos obtenidos de la reacción entre HCl y
termómetro. Durante un período de 5 minutos, NaOH
se midió la temperatura de la mezcla (Tm)
Mezcla T mezcla, °C
cada minuto y se mantuvo la agitación
V, ml m, g 1´ 2´ 3´ 4´ 5´
constante. Posteriormente, se procedió a 50 52,86 30 30 32 32 32
pesar el calorímetro con la mezcla para
determinar la masa de la mezcla (mm). La reacción química que se efectuó fue la
siguiente:
Considerando que la densidad de la mezcla de
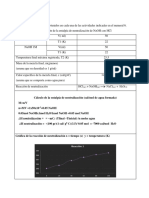
reacción se aproximó a 1 g/ml y que su calor 𝑁𝑎𝑂𝐻 + 𝐻𝐶𝑙 → 𝐻2 𝑂 + 𝑁𝑎𝐶𝑙
específico se aproximó a 1 cal/g·K, se llevó a La entalpía de la reacción fue de -55.9 kJ, lo
cabo el cálculo del calor de neutralización (en que indica que se trató de una reacción
KJ/mol) para la reacción de neutralización exotérmica.
realizada.
Análisis de resultados
Resultados
Brown et al. (2004), menciona que, en las
En los cuadros I y II se muestran los datos reacciones químicas exotérmicas; como la
obtenidos de las soluciones de ácido observada en este experimento, ocurre una
clorhídrico y NaOH individualmente. liberación de calor; el aumento de la
Cuadro I. Datos obtenidos individualmente del ácido temperatura en la reacción entre el hidróxido
clorhídrico, HCl. de sodio y el ácido clorhídrico demuestra este
HCl T3, °C proceso. También se indica que el valor de la
m vaso de precipitado, g V, ml m, g Ti, °C 1´ 1.5´ 2´ 2.5´ 3´ 3.5´ 4´ 4.5´ 5´
111,73 25 136 25 25 25 25 25 25 25 25 25 25 entalpía en este tipo de reacciones tiene
Cuadro II. Datos obtenidos individualmente del
magnitud negativa, en este caso, la entalpía
hidróxido de sodio, NaOH. de la reacción observada fue de -55.9 kJ.
NaOH T4, °C La reacción observada coincide con las
m vaso de precipitado, g V, ml m, g Ti, °C 1´ 1.5´ 2´ 2.5´ 3´ 3.5´ 4´ 4.5´ 5´
3,61 25 27,85 24 24 24 24 24 24 24 25 25 25 características de las reacciones de
neutralización, ya que se obtuvo agua y
Al agregar el ácido clorhídrico al hidróxido de
cloruro de sodio, NaCl; una sal formada por el
sodio que se encontraba en el calorímetro, el
catión del NaOH, Na+, y el anión del HCl, Cl-
cual se observa en la figura 1, la mezcla
(Whitten et al., 2015).
aumentó su temperatura hasta los 32 °C. En el
cuadro III se muestran los resultados de masa Conclusión
y temperatura obtenidos en esta reacción. A través del experimento realizado, se pudo
observar y definir que al efectuar una reacción
de neutralización en la que se mezcla un ácido
fuerte (HCl) y una base fuerte (NaOH), ocurre
un proceso exotérmico, el cual se define por
su valor de entalpía negativo.
Bibliografía
Brown, T., Lemay, H., & Bursten, B. (2004).
Química: La Ciencia Central (9ª ed.).
Editorial Pearson – Prentice Hall.
México.
Whitten, K., Raymond, D., Peck, M., & Stanley,
G. (2015). Química (10ª ed). Cengage
Learning.
Reacciones ácido base. (s. f.). Experimentos
Científicos.
https://www.experimentoscientificos.es/
reacciones-acido-base/
También podría gustarte
- Lab 1 (Termoquimica)Documento6 páginasLab 1 (Termoquimica)Jean Franco Pereira GuerrieroAún no hay calificaciones
- Práctica 7 Termoquímica Calor o Entalpía de ReacciónDocumento3 páginasPráctica 7 Termoquímica Calor o Entalpía de ReacciónFernando MuñizAún no hay calificaciones
- Informe 7Documento11 páginasInforme 7Alvaro Junior Ruelas PonceAún no hay calificaciones
- Informe 3 QG Invierno PDFDocumento15 páginasInforme 3 QG Invierno PDFDiana Rita Pomez QuirozAún no hay calificaciones
- Termodinámica en la práctica de química generalDocumento11 páginasTermodinámica en la práctica de química generalElizabeth HuamaniAún no hay calificaciones
- Calor de Neutralización: Un Estudio TermoquímicoDocumento20 páginasCalor de Neutralización: Un Estudio TermoquímicoYris RosarioAún no hay calificaciones
- Calor de Reacción de NeutralizaciónDocumento1 páginaCalor de Reacción de NeutralizaciónJUAN PABLO DIAZ CATACOLYAún no hay calificaciones
- Laboratorio 4Documento9 páginasLaboratorio 4Maria Isabel Galindo BermeoAún no hay calificaciones
- Informe 4 TermoquimicaDocumento11 páginasInforme 4 TermoquimicaMelany Jazmin Arias GarciaAún no hay calificaciones
- Informe de Fisicoquimica 1Documento10 páginasInforme de Fisicoquimica 1karol Evelyn valerianoAún no hay calificaciones
- Calor Molar de Una Reacción QuímicaDocumento6 páginasCalor Molar de Una Reacción QuímicaSebastian PertuzAún no hay calificaciones
- Termoquímica Laboratorio UNA-La MolinaDocumento17 páginasTermoquímica Laboratorio UNA-La MolinaLourdes LuqueAún no hay calificaciones
- Informe 3 EntalpiaDocumento8 páginasInforme 3 EntalpiaMARINEL SOFIA VARGAS MANOTASAún no hay calificaciones
- Calorimetría: capacidad calorífica de un calorímetro y calor de neutralizaciónDocumento10 páginasCalorimetría: capacidad calorífica de un calorímetro y calor de neutralizaciónNelson Ysmael Chirinos VielmaAún no hay calificaciones
- Determinación de La Entalpía de NeutralizaciónDocumento6 páginasDeterminación de La Entalpía de NeutralizaciónElena Borrego BlancoAún no hay calificaciones
- Entalpia de NautralizacionDocumento6 páginasEntalpia de Nautralizacionantony usecheAún no hay calificaciones
- FQ 3am2 Calixto F Pr7termoquímicaDocumento8 páginasFQ 3am2 Calixto F Pr7termoquímicaOliv CalixtoAún no hay calificaciones
- Termodinámica: Ley de Hess y entalpía de neutralizaciónDocumento17 páginasTermodinámica: Ley de Hess y entalpía de neutralizaciónAny de jesus chima oliveroAún no hay calificaciones
- EXAMENDocumento11 páginasEXAMENCamila ArAún no hay calificaciones
- 17-2019-Laboratorio 5Documento3 páginas17-2019-Laboratorio 5Camila ContrerasAún no hay calificaciones
- Lab. Calor de NeutralizacionDocumento8 páginasLab. Calor de NeutralizacionLeo DonadoAún no hay calificaciones
- Informe N°3 - TermoquímicaDocumento11 páginasInforme N°3 - TermoquímicaStiven LapaAún no hay calificaciones
- Informe 7Documento15 páginasInforme 7Bruno Alberto Ramirez HerreraAún no hay calificaciones
- Entalpía de neutralizaciónDocumento5 páginasEntalpía de neutralizaciónValentinaAún no hay calificaciones
- Informe # 7 FQ1. Demostración de La Ley de HessDocumento5 páginasInforme # 7 FQ1. Demostración de La Ley de HessMONROY RAMIREZ ANDRES FELIPE100% (1)
- Informe Calor de NeutralizacionDocumento5 páginasInforme Calor de NeutralizacionValentina LópezAún no hay calificaciones
- Informe EntalpíaDocumento3 páginasInforme EntalpíainsantamariatAún no hay calificaciones
- Informe Numero 7Documento12 páginasInforme Numero 7Breyner SanchezAún no hay calificaciones
- Informe - TermoquímicaDocumento11 páginasInforme - TermoquímicaAlexander Omar Capcha RiosAún no hay calificaciones
- Determinacion de Entalpias de Reaccion y Aplicacion de La Ley de HessDocumento3 páginasDeterminacion de Entalpias de Reaccion y Aplicacion de La Ley de HessManuel MontañezAún no hay calificaciones
- Ley de Kirchhoff PDFDocumento17 páginasLey de Kirchhoff PDFWendyAún no hay calificaciones
- Construccion y Calibracion de Un Calorimetro y Determinacion de Calor de Una ReaccionDocumento4 páginasConstruccion y Calibracion de Un Calorimetro y Determinacion de Calor de Una ReaccionPedro David Guerreo MoralesAún no hay calificaciones
- Informe de KCDocumento6 páginasInforme de KCFernanda RodriguezAún no hay calificaciones
- Informe 2 FisicoquimicaDocumento16 páginasInforme 2 FisicoquimicaJoZe TorresAún no hay calificaciones
- Determinación Del Calor de NeutralizaciónDocumento11 páginasDeterminación Del Calor de NeutralizaciónLUIS ALBERTO PEREZ GARCIA100% (1)
- Calor de Una DisolucionDocumento6 páginasCalor de Una Disolucionfernanda oviedoAún no hay calificaciones
- Calor de Neutralizaciòn TzaDocumento5 páginasCalor de Neutralizaciòn TzaAlex Santiago100% (3)
- Informe #5 - TermoquímicaDocumento7 páginasInforme #5 - TermoquímicaDevra GomezAún no hay calificaciones
- INFORME-7Documento7 páginasINFORME-7AnaisBriggitJacintoChavezAún no hay calificaciones
- Lab 1 de ErnestoDocumento7 páginasLab 1 de ErnestoPaola AlarconAún no hay calificaciones
- Exposicion NeutralizacionDocumento29 páginasExposicion NeutralizacionJefferson Gutierrez ZorrillaAún no hay calificaciones
- 7 Informe DE QUIMICADocumento22 páginas7 Informe DE QUIMICAAustin de los BackyardigansAún no hay calificaciones
- CALOR DE NEUTRALIZACION Fisicoquimica 1"VISITEN MI BLOG ALLÍ ESTOY SUBIENDO NUEVOS ARCHIVOS Http://quimicofiq - Blogspot.com/"Documento7 páginasCALOR DE NEUTRALIZACION Fisicoquimica 1"VISITEN MI BLOG ALLÍ ESTOY SUBIENDO NUEVOS ARCHIVOS Http://quimicofiq - Blogspot.com/"denis91% (32)
- Informe Fisicoquímica Calor de NeutralizaciónDocumento8 páginasInforme Fisicoquímica Calor de NeutralizaciónNathaly FalconíAún no hay calificaciones
- Calor de ReaccionDocumento6 páginasCalor de ReaccionGonzalo Montes TorresAún no hay calificaciones
- Diapositivas - Calor de Neutralizacion-2014Documento15 páginasDiapositivas - Calor de Neutralizacion-2014Anonymous yEGP9hnAún no hay calificaciones
- Informe N 1 Lab. Fisicoquimica Calor de NeutralizacionDocumento16 páginasInforme N 1 Lab. Fisicoquimica Calor de NeutralizacionNicolás CarmonaAún no hay calificaciones
- Determinacion de Entalpias de Reaccion y Aplicacion de La Ley de HessDocumento3 páginasDeterminacion de Entalpias de Reaccion y Aplicacion de La Ley de HessAngelo VarelaAún no hay calificaciones
- Reporte Practica 9. Calor de Disolucion. Metodo Calorimetrico. 224081Documento6 páginasReporte Practica 9. Calor de Disolucion. Metodo Calorimetrico. 224081Judith RomoAún no hay calificaciones
- Práctica de Laboratorio Virtual N°02 - Calor de Neutralización - 2021-01Documento9 páginasPráctica de Laboratorio Virtual N°02 - Calor de Neutralización - 2021-01Stefani Quijada QuispeAún no hay calificaciones
- Labo 6Documento20 páginasLabo 6Ericka Violeta Prudencio ZaragozaAún no hay calificaciones
- Calor de neutralización de HCl y Ca(OH)2Documento13 páginasCalor de neutralización de HCl y Ca(OH)2Yomer CernaAún no hay calificaciones
- Calor de DisolucionDocumento7 páginasCalor de DisolucionYoelis MontielAún no hay calificaciones
- Química TermoquímicaDocumento9 páginasQuímica TermoquímicaShalAún no hay calificaciones
- Fiqqui 1 TQDocumento8 páginasFiqqui 1 TQDavid Francisco Benites MillanAún no hay calificaciones
- CALOR DE REACCIÓN Luis Esteban Lara, Sebastián Martínez Pabon, Luis Gabriel Pineda, Axel Sanjuan Beltran.Documento8 páginasCALOR DE REACCIÓN Luis Esteban Lara, Sebastián Martínez Pabon, Luis Gabriel Pineda, Axel Sanjuan Beltran.Sebastían MartínezAún no hay calificaciones
- Entalpías de neutralizaciónDocumento6 páginasEntalpías de neutralizaciónjulian realpeAún no hay calificaciones
- Reporte Practica 10. Determinacion Del Calor de Neutralizacion Del Acido Clorhidrico Con Hidroxido de Sodio. 224081Documento6 páginasReporte Practica 10. Determinacion Del Calor de Neutralizacion Del Acido Clorhidrico Con Hidroxido de Sodio. 224081Judith RomoAún no hay calificaciones
- Plan de Clases de Ensayos de Aa y ProteínasDocumento15 páginasPlan de Clases de Ensayos de Aa y ProteínasJavier Yribarren MondejarAún no hay calificaciones
- Informe 5, Determinación de Carbonatos y Bicarbonatos - Docx - RemovedDocumento5 páginasInforme 5, Determinación de Carbonatos y Bicarbonatos - Docx - Removedandreaoc2701Aún no hay calificaciones
- Practica No.6docxDocumento9 páginasPractica No.6docxRonaldo VEAún no hay calificaciones
- EX - Adm - UNI 2022-2 - FyQDocumento10 páginasEX - Adm - UNI 2022-2 - FyQJhordanAún no hay calificaciones
- Informe 2do Control IbuprofenoDocumento11 páginasInforme 2do Control IbuprofenoKarla Quiñones RufinoAún no hay calificaciones
- Riesgo QuimicoDocumento23 páginasRiesgo Quimicomercedes rojasAún no hay calificaciones
- NONILFENOLDocumento6 páginasNONILFENOLAaronHumbertoChapoñanCarrascoAún no hay calificaciones
- Guia QuimicaDocumento17 páginasGuia QuimicaLuisRdz1230% (1)
- Informe JabonDocumento9 páginasInforme JabonEvelyn ArroboAún no hay calificaciones
- Universidad Nacional Mayor de San Marcos: Facultad de Química E Ingeniería QuímicaDocumento36 páginasUniversidad Nacional Mayor de San Marcos: Facultad de Química E Ingeniería QuímicaAnderson MartelAún no hay calificaciones
- Simulación de un reactor semicontinuoDocumento14 páginasSimulación de un reactor semicontinuoLUIS ENRRIQUE SANCHEZ VALLEJOSAún no hay calificaciones
- Practica de Laboratorio 4 - Grupo 2Documento10 páginasPractica de Laboratorio 4 - Grupo 2Liga Distrital DE Los Baños DEL IncaAún no hay calificaciones
- Reacciones químicas y clasificaciónDocumento2 páginasReacciones químicas y clasificaciónYamil KattleAún no hay calificaciones
- Manual de Saponificacion PDFDocumento19 páginasManual de Saponificacion PDFPablo Limachi Gomez100% (1)
- Nomenclatura Quimica de Los Compuestos InorganicosDocumento10 páginasNomenclatura Quimica de Los Compuestos Inorganicoswellinton toribioAún no hay calificaciones
- Practico EstequiometriDocumento4 páginasPractico EstequiometriIvan MP100% (1)
- White Liquor Plant v01 PDFDocumento89 páginasWhite Liquor Plant v01 PDFRuben Fernandez OñateAún no hay calificaciones
- MERCK - Determinación Fibras Alimentarias TotalesDocumento3 páginasMERCK - Determinación Fibras Alimentarias TotalesCarolina GonzálezAún no hay calificaciones
- NCh0281-69 Soda CáusticaDocumento9 páginasNCh0281-69 Soda CáusticajaimeAún no hay calificaciones
- Preguntas PropuestasDocumento10 páginasPreguntas PropuestasDavid SilloAún no hay calificaciones
- Tema 1 ProblemasDocumento4 páginasTema 1 ProblemasSabela FernándezAún no hay calificaciones
- Tinción de ArgenticaDocumento140 páginasTinción de ArgenticaKelly Evelyn100% (1)
- Informe LaboratorioDocumento6 páginasInforme Laboratoriomatias0% (1)
- Clasificación de reacciones químicasDocumento7 páginasClasificación de reacciones químicasEloxin RodriguezAún no hay calificaciones
- SPC Pa21 Act 3 Cierre de ProyectoDocumento2 páginasSPC Pa21 Act 3 Cierre de ProyectoRubi AAún no hay calificaciones
- Intercambiadores Alfa LavalDocumento24 páginasIntercambiadores Alfa LavalLuis Fernando Chura VillcaAún no hay calificaciones
- Practica n6Documento10 páginasPractica n6Arian Gabriel LeónAún no hay calificaciones
- Investigación Prod. LimpiezaDocumento55 páginasInvestigación Prod. LimpiezaV Raul Ruiz Ló75% (4)
- Data Public Archivos Informe Oeramirez 1695524638510 PLHRDocumento21 páginasData Public Archivos Informe Oeramirez 1695524638510 PLHRKathe TasconAún no hay calificaciones
- MODIFICACIÓN DE LA CONCESIÓN DE BENEFICIO PARAÍSODocumento3 páginasMODIFICACIÓN DE LA CONCESIÓN DE BENEFICIO PARAÍSOgonzaloAún no hay calificaciones